Адаптивное ремоделирование сердца и сосудов это
В
Республике Беларусь обычно используют
классификацию ХСН, предложенную Н.Д.
Стражеско и В.Х.Василенко в 1935г.
Стадия
I.
Признаки ХСН (одышка,
сердцебиение, слабость) появляются
только при физической нагрузке и
исчезают в покое.
Стадия
II
А. Основным
признаком является наличие застойных
явлений в одном из кругов кровообращения.
Стадия
II
Б. Имеются
глубокие нарушения гемодинамики.
Выжженные признаки нарушения гемодинамики,
застой по обоим кругам кровообращения.
Симптоматика ХСН возникает в покое.
Стадия
III
– конечная дистрофическая с глубокими
необратимыми нарушениями обмена веществ
и изменениями в органах (цирроз печени,
кахексия, почечная недостаточность).
Для
объективизации стадии ХСН приводится
приложение 1, определяющее понятие
бессимптомной дисфункции, адаптивного
и дезадаптивного ремоделирования
сердца.
Приложение
1. Характеристика функции, дисфункции,
адаптивного и дезадаптивного
ремоделирования сердца.
Определение
ремоделирования сердца (М. Pffefer
в модификации Ю.Н. Беленкова).
Ремоделирование
сердца – структурно-геометрические
изменения левого желудочка, включающие
в себя процессы гипертрофии миокарда
и дилатации сердца, приводящие к изменению
его геометрии и нарушению систолической
и диастолической функции.
Бессимптомная
дисфункция ЛЖ (соответствует I
стадии)
Симптомы
ХСН в покое и при обычных
нагрузках отсутствуют.Систолическая
дисфункция: ФВ ЛЖ<45% и/или
конечно-диастолический размер (КДР)
ЛЖ >5,5 см (индекс конечного диастолического
размера (ИКДР) ЛЖ >3,3 см/м2).Диастолическая
дисфункция: ТМЖП (толщина межжелудочковой
перегородки)
+ ТЗСЛЖ (толщина задней стенки ЛЖ) –
К2 >1,3 см и/или ТЗСЖ >1,2 см и/или
гипертрофический
тип спектра трансмитрального доплеровского
потока (ТМДП) (Е/А< 1,0).При
этом относительная толщина стенок ЛЖ
(ТМЖП+ТЗСЛЖ/КДР) не отличается от нормы
и составляет > 0,45.Индекс
сферичности ЛЖ в систолу (отношение
короткой оси ЛЖ к
длинной оси
ЛЖ)
не отличается от нормы( <0,70).
Адаптивное ремоделирование лж (соответствует iiа стадии)
Симптомы,
соответствующее IIА
стадии.Систолическая
дисфункция (см. в I
стадии) + индекс сферичности ЛЖ в систолу
>
0,70 и/или относительная толщина стенок
ЛЖ >
0,30 и <0,45.Диастолическая
дисфункция (см. в I
стадии) + псевдонормальный тип спектра
ТМДП
>1,1и <2,0.
Дезадаптивное ремоделирование лж (соответствует iiб стадии)
Симптомы
соответствующее II
Б стадии.Систолическая
дисфункция (см. в I
стадии) + индекс сферичности ЛЖ в систолу
>
0,80 и/или относительная толщина стенок
ЛЖ <
0,30.Диастолическая
дисфункция (см. в I
стадии) + рестриктивный тип спектра
ТМДП
>2,0.
По
классификации
Нью-Йорской кардиологической ассоциации
(NYHA),
предложенной в 1964 году, выделяют 4
функциональных класса ХСН.
I
функциональный класс (ФК I)
– бессимптомная
дисфункция левого желудочка сердца.
Обычная физическая нагрузка не вызывает
симптоматики СН.
II
функциональный класс (ФК II).
Легкое
ограничение физической активности.
Обычная физической нагрузка вызывает
утомление, одышку, слабость.
III
функциональный класс (ФК III).
Выраженное
ограничение физической активности:
признаки ХСН возникают при незначительных
(менее обычных) нагрузках.
IV
функциональный класс (ФК IV).
Признаки СН имеются в покое и усиливаются
при нагрузке.
Тест
6-минутной ходьбы
широко
используется в последние годы в
международной практике и позволяет
оценить толерантность пациента к
физическим нагрузкам, используя
минимальные технические
средства. Суть его заключается в том,
что нужно измерить, какую дистанцию в
состоянии
пройти пациент в течение 6 минут. Для
этого требуются лишь часы с секундной
стрелкой
и рулетка. Проще всего заранее разметить
больничный или поликлинический коридор
и попросить пациента двигаться по нему
в течение 6 минут. Если пациент пойдет
слишком быстро и вынужден будет
остановиться, эта пауза, включается в
6 минут. В итоге определяется физическая
толерантность
больного к нагрузкам. Каждому ФК ХСН
соответствует определенная дистанция
6-минутной
ходьбы:
1 ФК – 426 – 550 м;
2 ФК – 300-425 м;
3 ФК – 150 – 300 м;
4 ФК – менее 150 м.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник

Ремоделирование миокарда
Ремоделирование миокарда – это термин, используемый докторами для обозначения структурных изменений сердечной мышцы после перенесенных человеком заболеваний, например, инфаркта. При этом особенности проявления нарушений напрямую зависят от причины, спровоцировавшей их появление.
Например, если говорить про ремоделирование, возникшее на фоне систематического повышения артериального давления, то оно будет проявляться следующим образом:
- повышение числа саркомеров,
- увеличение толщины кардиомиоцитов,
- утолщение стенок,
- образование концентрического ремоделирования ЛЖ.
Используется на практике и такой термин, как эксцентрическое ремоделирование. Он обозначает удлинение кардиомиоцитов, уменьшение толщины стенок. Состояние спровоцировано объемной перегрузкой сердечной мышцы. Что касается функционального ремоделирования ЛЖ, то здесь подразумевается только нарушение его сократительной способности. Геометрия и размеры желудочка не меняются. Если они видоизменены, речь пойдет о структурном варианте патологии.
Концентрическая форма
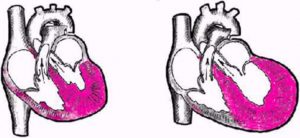
Концентрическое ремоделирование миокарда
Концентрическое ремоделирование миокарда левого желудочка – это достаточно распространенное заключение, которое применяется по отношению к пациентам с гипертензией. Начинается процесс с гипертрофии ЛЖ, которая проявляется увеличением толщины его стенки. Также отмечаются изменения в перегородке. Внутреннее пространство не изменено.
Нужно отметить, что причиной ГЛЖ может стать не только стойкое повышение артериального давления, но и другие факторы, такие как:
- интенсивные физические нагрузки, которым человек постоянно подвергает свой организм,
- малоподвижный образ жизни, часто встречающийся среди офисных работников,
- курение, вне зависимости от количества выкуриваемых сигарет,
- систематическое злоупотребление алкоголем.
Таким образом, сделаем заключение – для предотвращения запуска процесса ремоделирования миокарда необходимо как можно раньше диагностировать гипертоническую болезнь или ГЛЖ и заняться их эффективным лечением. Чтобы это сделать, требуется изучить симптомы, которые могут сказать о наличии подобных заболеваний, это:
- систематическое повышение артериального давления,
- частые головные боли и головокружения,
- периодическая дрожь в конечностях,
- нарушение сердечных ритмов,
- затрудненное дыхание, появление одышки,
- снижение работоспособности,
- болевые ощущения в области сердца.
Если имеют место подобные признаки, необходимо обратиться за медицинской помощью, пройти полноценное обследование, позволяющее получить полную информацию о состоянии собственного здоровья. Важно! Главным методом диагностики остается электрокардиография. Она позволяет определить ремоделирование миокарда по повышенному сегменту ST и сниженному либо полностью отсутствующему зубцу R. Подобные показатели свидетельствуют про концентрический тип патологического состояния, могут указывать на перенесенный инфаркт, что усугубляет положение.
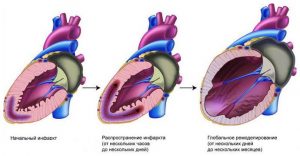
Ремоделирование после ИМ
Главным фактором, способствующим развитию ремоделирования, становится нейрогормональная активация. Она наблюдается после перенесенного человеком инфаркта миокарда. Активность нейрогормонов прямо сопоставима с масштабами поражения сердечной мышцы. Первоначально она способствует нормализации артериального давления и деятельности сердца. Но через некоторое время активность гормонов становится патологической. В результате процесс ремоделирования ускоряется, обретая более значительные масштабы, развивается хроническая сердечная недостаточность, представляющая опасность для здоровья и жизни человека.
Следующий фактор ‒ активизация симпатической нервной системы. Она способствует возрастанию напряжения левого желудочка, вследствие чего увеличивается потребность миокарда в кислороде.
Патофизиология процесса
Если говорить о патофизиологии ремоделирования миокарда, то изменения после инфаркта проявляются так:
- изменение формы ЛЖ. Если до приступа она была эллипсовидной, теперь стала ближе к сферической,
- сердечная мышца истончена. Наблюдается ее растяжение,
- увеличение некрозированной части миокарда. Оно может случаться даже при условии отсутствия повторного приступа.
Следует отметить, что благодаря возможностям современной медицины процент выживаемости после ИМ стал намного выше. Но процесс ремоделирования предотвратить пока не удалось, потому как он является закономерным следствием неразрывной цепочки естественных этапов. Единственное, что зависит от самого человека – это возможность сделать последствия инфаркта минимальными. Для этого достаточно соблюдать рекомендации лечащего врача, касающиеся реабилитационного периода, а также не забывать о правилах профилактики повторного приступа.
Заключение
Повышение артериального давления
Подведем итог. Запускает процесс ремоделирования в большинстве случаев систематическое повышение артериального давления. Как ответная реакция на постоянно повышенное давление в сосудах – утолщение стенки левого желудочка. При этом, чем выше показатели АД, тем больше толщина. Вследствие такого процесса повышается масса миокарда, что запускает цепочку последующих патологических изменений.
Как результат – нарушение работы сердца в целом, ухудшение самочувствия человека, появление многочисленных симптомов, доставляющих существенный дискомфорт.
Тот же самый процесс характерен и для ремоделирования сердечной мышцы, развивающегося на фоне инфаркта миокарда, влекущего появление осложнений в виде сердечной недостаточности, имеющей хронический характер.
Именно поэтому, чтобы избежать серьезных последствий, необходимо внимательно следить за собственным здоровьем. Как только будут замечены признаки сердечно-сосудистых заболеваний, необходимо как можно скорее обратиться к врачу, пройти диагностику и курс эффективного лечения.
Загрузка…
Источник
Октябрь 30, 2017
Нет комментариев
Ремоделирование кровеносных сосудов начинается обычно как адаптивный процесс в ответ на изменение условий гемодинамики или активности тканевых и циркулирующих гуморальных факторов. Длительно существующая адаптация сменяется нарушением структуры сосудов в ответ на прямое повреждение, в том числе токсичными веществами и метаболитами, а также на воздействие атерогенных факторов или изменение гемодинамической нагрузки.
К настоящему времени выявлены различные варианты ремоделирования стенки кровеносных сосудов: увеличение массы кровеносного сосуда за счет утолщения его мышечного слоя (медии) и/или субэндотелиальных слоев интимы вследствие увеличения количества (гиперплазии) гладкомышечных клеток в сосудах крупного и среднего калибра или клеточной массы (гипертрофии) в резистивных сосудах, а также сочетания этих процессов.
Сравнительно недавно появились сведения о ремоделировании эндотелиальной выстилки. Этот процесс был исследован на модели прекапиллярной формы легочной гипертензии, возникающей в условиях хронической гипоксии. Констрикторная реакция сосудов легочного ствола возникает в ответ на снижение парциального давления кислорода в альвеолярном воздухе – это известный защитно-приспособительный рефлекс Эйлера—Лилиестранда: «чем меньше вентилируются альвеолы, тем меньше они перфузируются».
Такая гипертензия нередко возникает у человека при его пребывании в условиях высокогорья (гипобарической гипоксии при горной болезни). В связи с тем что проблема легочной гипертензии пока не решена, несомненный интерес должны представлять сведения не только о клеточно-молекулярных механизмах ее развития, но и о возможности восстановления эндотелиальной выстилки при данной форме патологии.
Ключевую роль в процессе ремоделирования эндотелиальной выстилки в условиях гипоксии играют Rho GTPases — «связывающие белки», т. е. ферменты, продукты клеточных Ras-онкогенов, GTP (гуанинтрифосфат). Эти белки способны:
1) регулировать ремоделирование межклеточных соединений и цитоскелета эндотелия путем индуцирования полимеризации филаментов F -актина и Е-кадерина в линейные волокна или разветвленную сеть (на электронограммах белок F-актин окрашен в красный цвет, а Е-кадерин — основной белок, обеспечивающий клеточную адгезию, — в зеленый);
2) увеличивать проницаемость цитолеммы эндотелиоцитов;
3) активировать HIF-la (гипоксией-индуцируемый фактор la) – это транскрипционный фактор, который был идентифицирован в 1992 г., в настоящее время он оказался одним из объектов самого интенсивного изучения.
Как оказалось, данный фактор обеспечивает формирование адекватного ответа на гипоксию, т. к. он вызывает экспрессию генов, которые детерминируют процессы, улучшающие снабжение тканей кислородом: увеличивает продукцию эритропоэтина, васкулярно-эндотелиального фактора роста (VEGF), стимулирующего ангиогенез, рецепторов к VEGF, трансферрина и других белков, а также активацию синтеза ферментов гликолиза (лактатдегидрогеназы, альдолазы, пиру-ваткиназы, фосфофруктокиназы) и транспорта глюкозы.
При обследовании пациентов с хроническими обструктивными заболеваниями легких было установлено, что основными патогенетическими факторами развивающейся у них прекапиллярной легочной гипертензии является эндотелии I и ангиотензин II, которые вызывают сокращение гладких мыши и гипертрофию сосудистой стенки. Вместе с тем были получены прямые доказательства, что синтез ангиотензина II вызывается экспрессией HIF-Ia, т.е. установлено, что HIF-la играет первостепенную роль в развитии легочной гипертензии. Таким образом, локальное торможение HIF-la в легких может быть терапевтической стратегией лечения и предупреждения развития легочной гипертензии у лиц с высоким фактором риска этой формы патологии (например, для профилактики острого отека легких у альпинистов в условиях высокогорья);
4; активировать NF-kB (ядерный фактор транскрипции каппа В).
В настоящее время установлено, что активация Rho GTPases происходит йе только в условиях гипоксии, но и при дефиците эндотелиального оксида азота.
Установлено, что N0 является важнейшим ангиопротектором. В этом качестве он выступает лишь при условии его синтеза в адекватном, т. е. патогенетически незначимом, количестве.
Неадекватные, т.е. патогенетически значимые изменения — как гиперпродукция, так и дефицит N0 — могут детерминировать развитие эндотелиальной дисфункции и соответствующих заболеваний. Гиперпродукция N0 может быть следствием чрезмерной активации эндотелиальной NO-синтазы. Образующийся при этом N0, взаимодействуя с супероксидным анион-радикалом, может превращаться в весьма токсичные вещества: пероксинитрит и нитротирозин, которые обладают рядом патогенных эффектов: увеличивают окисление белков и липидов, инактивируют ферменты, в тл. митохондриальные, повышают проницаемость мембран, повреждают ДНК, активируют апоптоз.
Нарушение «биодоступности» NO (т.е. его «дефицит», а точнее недостаточность «целевых эффектов» оксида азота) является, по современным представлениям, основной причиной развития эндотелиальной дисфункции при воздействии общеизвестных факторов риска ишемической болезни сердца -артериальной гипертензии, табакокурения, дислипидемий, сахарного диабета и др.
При тяжелом поражении эндотелия может нарушаться его целостность, при этом в интиме появляются участки, лишенные эндотелиальной выстилки. Обнажение субэндотелиальной поверхности — «деэндотелизация» означает выключение «эндотелийобусловленнош» регулирующего влияния на сосуды. Однако при этом сохраняются базальный компонент сосудистого тонуса деэндотелизированного участка артерии, а также дилататорная реакция сосуда на некоторые вазодилататоры. Вместе с тем, реэндотелизация поврежденной интимы артерий может приводить к стойкому снижению выделения эндотелиального NO и исчезновению дилататорных реакций на потоковые нагрузки.
В заключение отметим, что, кроме изложенных эффектов, эндотелиальная активность:
а) влияет на иммунное состояние организма; иммунорегуляторная функция эндотелия детерминирована его способностью продуцировать, прежде всего, 1Ь-1и IL-2, необходимые для развертывания иммунного ответа, а также большой спектр цитокинов, оказывающих на него мо-дулируюшеее влияние;
б) играет большую роль в патогенезе воспаления. Эцдотелиоциты венозных сосудов при действии флогогенных факторов увеличивают свою адгезивность, т.к. способны экспрессировать рецепторы к Fc-фрагменту JgG,C3B; фиксировать хемотаксины (напр., С5а), а также продуцировать адгезивные молекулы и провоспалительные цитокины;
в) неразрывно связана с атерогенезом; эндотелий играет важную роль как в предотвращении, так и в развитии атеросклеротического поражения сосудов, т.к. эцдотелиоциты, с одной стороны, благодаря апо-В, Е-рецепторам способны обеспечивать регулируемый захват атерогенных липопротеинов, и тем самым, предотвращать их накопление в сосудистой стенке, а с другой — способствовать их накоплению в сосудах из-за активизации нерегулируемого захвата таких липопротеидов с помощью «scavenger» (англ, мусорщик) – рецепторов. Кроме того, на процесс атерогенеза оказывают влияние продуцируемые эндотелием биологически активные вещества.
Загрузка…
Источник
… наиболее характерным признаком гипертонической болезни является изменения артериол.
Суть ремоделирования заключается в способности органа изменять структуру и геометрию в ответ на долговременное воздействие патологических стимулов. Ремоделирование с точки зрения патофизиологии означает обретение новой функции биологической структурой. Рассмотрим процесс ремоделирования сосудов в рамках артериальной гипертензии.
Ремоделирование сосудов – это неизменный атрибут артериальной гипертензии, проявляющийся адаптивной модификацией функции и морфологии сосудов, которая (адаптивной модификацией) является с одной стороны, осложнением, с другой – фактором прогрессирования артериальной гипертензии.
Процесс ремоделирования сосудов при артериальной гипертензии включает две стадии: (1) стадию функциональных изменений сосудов, связанную с вазоконстрикторными реакциями в ответ на трасмуральное давление и нейрогуморальную стимуляцию, и (2) морфологическую стадию, характеризующуюся структурным уменьшением просвета сосудов вследствие утолщения их медиального слоя.
Стадия функциональных изменений сосудов в виде вазоконстрикторной реакции в «континууме ремоделирования сосудов» при артериальной гипертензии начинается обычно как адаптивный процесс в ответ на изменение условий гемодинамики или активности тканевых и циркулирующих гуморальных факторов. Длительно существующая адаптация сменяется нарушением структуры сосудов в ответ на изменение гемодинамической нагрузки, а также в ответ на повреждение токсичными веществами, метаболитами и атерогенными факторами. В последующем структурные повреждения сосудов проявляются нарушениями их функций (проводящей и/или демпфирующей), что последовательно ведет к расстройству кровообращения органов и нарушению их функций.
Прежде чем рассматривать «структурное» (морфологическое) ремоделирование сосудов при артериальной гипертензии необходимо рассмотреть строение основной ее «мишени» (точки приложения), то есть строение артериальной стенки.
Артериальная стенка состоит из соединительнотканных структур, разделяющихся на три слоя:
(1) внутренняя оболочка (tunica intima, интима) – является барьером между артериальной стенкой и кровью, состоит из одного слоя эндотелиальных клеток, тонкого субэндотелиального слоя и базальной мембраны;
(2) средняя оболочка (tunica media, медиа) – это наиболее широкий слой артериальной стенки, который состоит из относительно большого количества гладкомышечных клеток и миофибробластов; сокращение и расслабление мышечных элементов меди изменяют просвет сосуда в ответ на действие различных системных и локальных вазоактивных соединений;
(3) внешняя оболочка (tunica adventitia, адвентиция) – состоит из соединительной ткани, содержащей волокна гладкомышечных клеток, фибробласты, мелкие артерии и вены, связанные с периадвентицией и жировой тканью, поддерживающей сосуд.
Следует отметить тот факт, что сосуды большого – аорта, проксимальный отдел аортальных коллатералей и легочная артерия калибра – являются сосудами эластического типа и не обладают функцией сократимости, но эффективно сдерживают давление тока крови. При артериальной гипертензии наиболее значимые патофизиологические изменения происходят в мелких сосудах.
Согласно закону Пуайзеля, детерминантами артериального сопротивления являются вязкость крови, длина и калибр сосуда. Но так как длина сосуда и вязкость крови являются относительно постоянными величинами, размер сосуда может изменяться в результате резких изменений тонуса или вследствие длительного процесса ремоделирования. Свойства стенки сосуда зависят от двух характеристик: (1) растяжимости (прямо пропорциональной давлению и радиусу и обратно пропорциональной толщине стенки) и (2) напряжению сдвига (комплекс сил, действующих на сосудистую стенку в результате тока крови). Изменения радиуса и толщины стенки поддерживают эти две величины в относительно постоянном состоянии. При повышенном токе крови радиус сосуда увеличивается для снижения напряжения сосудистой стенки. При высоком внутрисосудистом давлении компенсаторно увеличивается толщина сосуда и уменьшается диаметр.
Помимо баланса биомеханических сил на структурные (морфологические) элементы артериальной стенки оказывают влияние целый ряд биологически активных веществ, в частности катехоламины, ангиотензин II, эндотелин-1, сосудисто-эндотелиальный фактор роста и некоторые другие факторы.
Катехоламины, обладая трофической функцией, стимулируют гипертрофию гладкомышечных клеток сосудов. Трофический эффект адренергической стимуляции реализуется прямо или опосредованно через увеличение секреции тромбоцитарного ростового фактора. Способность ангиотензина II стимулировать гипертрофию и гиперплазию гладкомышечных клеток сосудов продемонстрированa в культуральных условиях и на примере экспериментальных животных. Кроме того, ангиотензин II может выступать в роли паракринного регулятора продукции ряда пептидных ростовых факторов клетками сосудистой стенки и клетками крови. К таким факторам, уровень которых повышается под влиянием ангиотензина II, относятся тромбоцитарный ростовой фактор и β1-трансформирующий фактор. Последние участвуют в модификации гипертрофического эффекта ангиотензина II на гладкомышечные клетки сосудов.
Различают (1) концентрическое ремоделирование, при котором уменьшается просвет сосуда, и (2) эксцентрическое, при котором просвет увеличивается. Концентрическое сосудистое ремоделирование обычно развивается при повышенном внутрисосудистом давлении или снижении тока крови, в то время как эксцентрическое ремоделирование развивается при повышении тока крови.
Гистологическими характеристиками эксцентрического ремоделирования являются: истончение стенки сосуда, снижение гладкомышечного компонента медиа, уменьшение экстрацеллюлярного матрикса и снижение отношения толщины стенки сосуда и внутреннего диаметра. При этом варианте ремоделирования сосудов выявляют дегенеративные изменения медиа с повышением в ней уровня коллагена, фиброэластическое утолщение интимы, фрагментацию эластической мембраны с вторичным фиброзом и кальцинозом медиа и изменения экстрацеллюлярного матрикса.
В отношении сосудистой массы выделяют эутрофический, гипертрофический и гипотрофический типы ремоделирования в зависимости от снижения, отсутствия изменений или увеличения клеточных компонентов (у больных с артериальной гипертензией чаще выявляются структурные изменения сосуда, преимущественно по гипертрофическому типу):
(1) эутрофическое внутреннее ремоделирование характеризуется уменьшением наружного диаметра и просвета сосуда, с отсутствием изменений толщины медиального слоя; этот вариант ремоделирования характеризуется увеличением отношения толщины медиального слоя к просвету сосуда без повышения жесткости сосудистой стенки и описан в резистивных артериях при мягком течении гипертонической болезни;
(2) эутрофическое наружное ремоделирование характеризуется увеличением просвета резистивных артерий без изменения площади поперечного сечения сосуда, что наблюдается при гипотензивной терапии у больных с эссенциальной гипертензией;
(3) гипертрофическое внутреннее ремоделирование характеризуется увеличением отношения медиа/просвет сосуда за счет утолщения медиального слоя; этот тип ремоделирования выявлен у больных с симптоматическими гипертензиями (а также при экспериментальной дезоксикортикстероновой солевой гипертензии, реноваскулярной гипертензии на модели «одна почка – один зажим»);
(4) гипотрофическое наружное ремоделирование характеризуется увеличением просвета сосуда с уменьшением площади его поперечного сечения (данный вид ремоделирования выявлен у спонтанногипертензивных крыс на фоне гипотензивной терапии).
На сегодняшний день установлено что:
(1) у больных гипертонической болезнью, как правило, закономерным является гипертрофия артериальных сосудов, которая выражается в дилатации артерий эластического типа и утолщении стенки артерий эластического и мышечного типа, причем по мере увеличения степени тяжести артериальной гипертензии наблюдается прогрессирование артериальной гипертрофии.
(2) на гипертрофию артериальной стенки может влиять целый ряд факторов, среди которых основная роль принадлежит локальным гемодинамическим условиям, в частности балансу биомеханических сил, оказывающих влияние на артериальную стенку, а также гуморальным факторам, стимулирующим процессы клеточного роста и гипертрофии.
Источник
