Анестетики действие на сосуды
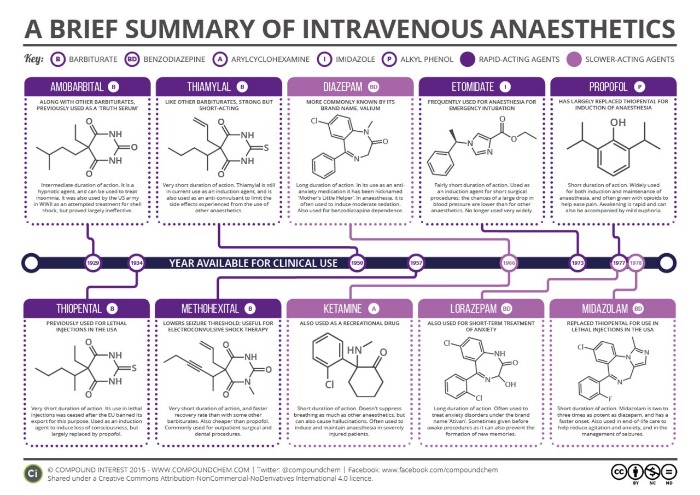
Механизм местной анестезии и эффекты местных анестетиков
Местные анестетики (МА) обратимо ингибируют образование и распространение импульса в нервах. Такое воздействие на чувствительные (афферентные) нервы позволяет безболезненно выполнять хирургические или стоматологические операции.
а) Механизм действия местных анестетиков. Проведение импульса по аксону происходит в форме ПД. Изменение потенциала вызывает открытие (активацию) белковых Na+-каналов, через которые происходит быстрое поступление Na* внутрь клетки. Na+ движется по градиенту концентрации, т.к. концентрация Na+ снаружи клетки равна 150 ммоль/л, а внутри клетки — приблизительно 7 ммоль/л. МА ингибируют этот быстрый приток Na+, вследствие чего блокируется возникновение и распространение возбуждения.
Большинство МА представляет собой катионные амфифильные соединения. Это физико-химическое свойство способствует встраиванию молекул МА между полярными и неполярными доменами мембран. Они находятся в фосфолипидах мембран, а также в белковых ионных каналах. Имеются доказательства, что при присоединении МА к белкам каналов блокируются Na+-кaнaлы. МА действуют в цитозоле. Это означает, что препарат должен сначала проникнуть через клеточную мембрану.
Местноанестезирующими свойствами также обладают и незаряженные вещества. Это позволяет предположить, что такие молекулы связываются с неполярной областью белкового канала или гидрофобной областью липидов мембраны.
Побочные эффекты, обусловленные механизмом действия. Поскольку местные анестетики (МА) блокируют поступление Na+ не только в чувствительные нервы, но и в другие возбудимые ткани, их вводят локально. Угнетение возбуждающих процессов в сердце, хотя оно и нежелательно во время местной анестезии, позволяет использовать местную анестезию (МА) при аритмиях сердца.
б) Виды местной анестезии. Местные анестетики (МА) применяют по-разному, в т. ч. путем пропитывания тканей (инфильтрационная анестезия) или инъекции раствора рядом с ветвью нерва, содержащей волокна, идущие от области, которую необходимо обезболить (проводниковая анестезия, спинальная анестезия сегментарных задних корешков), или аппликации на поверхность кожи либо слизистой оболочки (поверхностная анестезия). В каждом случае местный анестетик (МА) диффундирует к нервам из депо, образовавшегося в ткани или на коже.
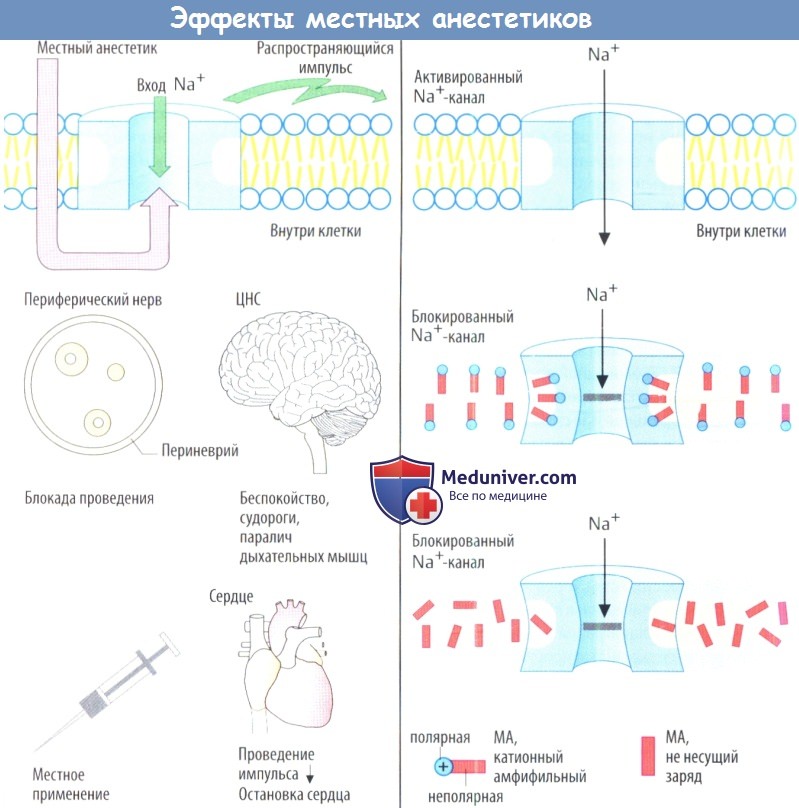
Высокая чувствительность сенсорных нервов низкая чувствительность двигательных нервов. Проведение импульса в сенсорных нервах ингибируется при концентрации ниже той, что необходима для достижения соответствующего эффекта в двигательных волокнах. Это различие может быть связано с более высокой частотой импульсов и более длительной продолжительностью ПД в ноцицептивных волокна по сравнению с двигательными волокнами. С другой стороны, это может быть связано с толщиной чувствительных и двигательных нервов, а также с расстоянием между перехватами Ранвье. При скачкообразном проведении импульса деполяризуется только мембрана в области перехвата Ранвье.
Поскольку деполяризация может происходить даже после блокады 3 или 4 колец узловых перехватов Ранвье концентрация препарата, необходимая для достижения блокады двигательных волокон, должна быть выше.
Это объясняет, почему сенсорные стимулы, которые проводятся с помощью миелинизированных А волокон, блокируются позже и в меньшей стелени чем сигналы, проводимые с помощью немиелинизированных С-волокон. Поскольку вегетативные постганглионарные волокна не имеют миелиновой оболочки, они блокируются местным анестетиком (МА). В результате в области анестезии расширяются кровеносные сосуды, т.к. снижается влияние симпатической нервной системы. Такое локальное расширение сосудов нежелательно.
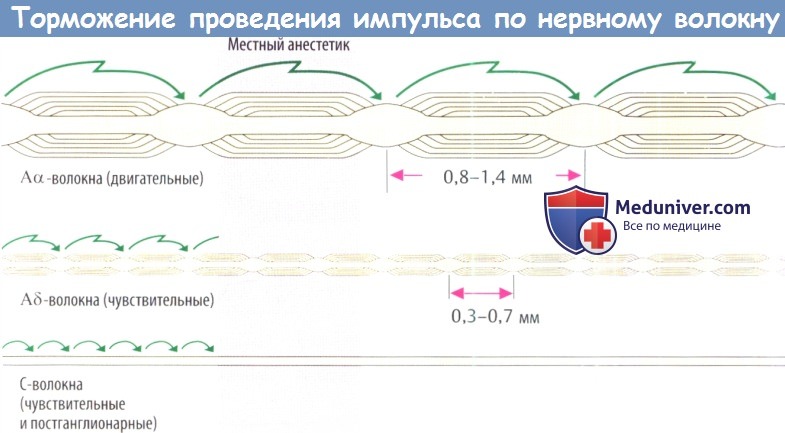
в) Диффузия и эффекты местного анестетика (МА). При диффузии из места инъекции (из интерстициального пространства соединительной ткани) к аксону чувствительного нерва местный анестетик (МА) должен пройти через периневрий. Многослойный периневрий образован клетками соединительной ткани, связанными между собой с помощью плотных контактов и, следовательно, образующими плотный липофильный барьер.
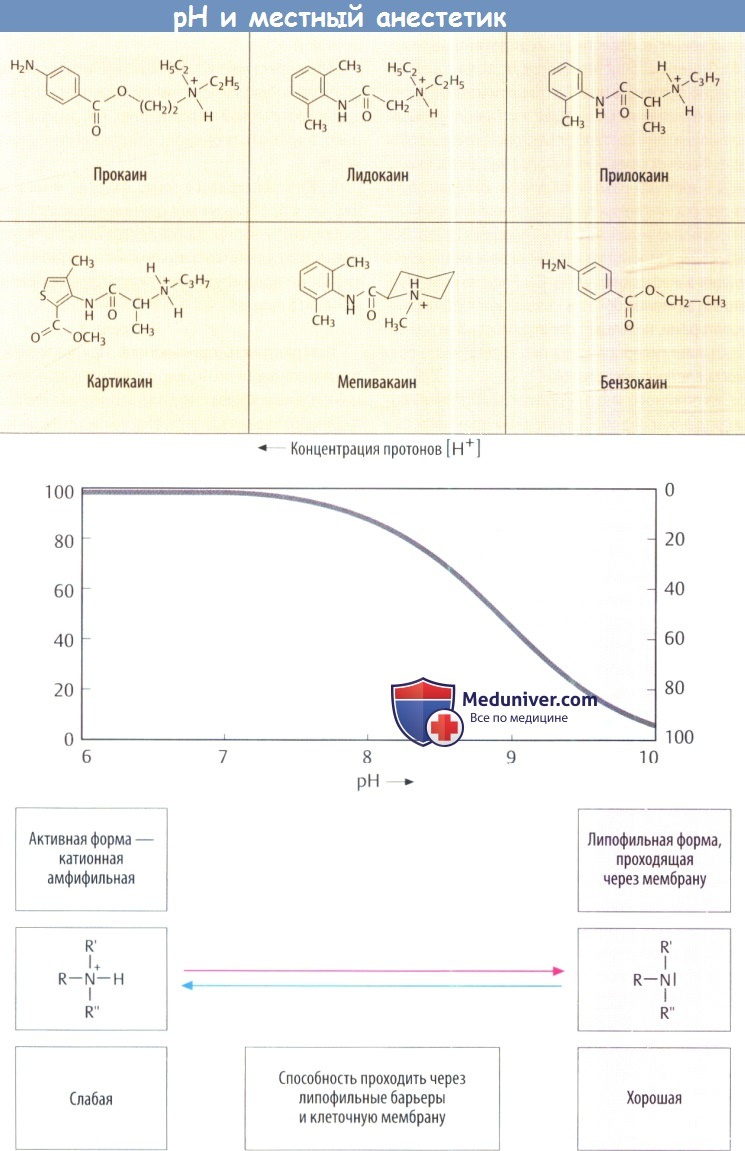
Большинство местных анестетиков (МА), используемых в клинической практике, — третичные амины. При pH интерстициальной жидкости они находятся частично в нейтральной жирорастворимой форме (символически изображается в виде частицы с двумя красными точками) и частичнов протонированной форме, т. е. как амфифильный катион (символически изображается в виде частиц с одной синей и одной красной точками). Незаряженная форма проникает в периневрий и поступает в эндоневральное пространство, где часть молекул препарата снова приобретает положительный заряд в соответствии с локальным значением pH.
Аналогичный процесс происходит, когда лекарственное средство проникает через мембрану аксона (аксолемму) в аксоплазму, где и оказывает свое действие на Na+-канал, и снова при диффузии из эндоневрального пространства через нефенестрированный эндотелий капилляров в кровь.
Таким образом, концентрация местного анестетика (МА) в зоне его действия определяется скоростью проникновения в эндоневрий и аксоплазму и скоростью диффузии в капиллярную кровь. Для быстрого увеличения концентрации препарата должен быть соответственно высокий градиент концентрации между депо препарата в соединительной ткани и эндоневральном пространстве. Введение растворов низкой концентрации не даст эффекта. Однако следует избегать и слишком высоких концентраций из-за опасности интоксикации вследствие слишком быстрого попадания в системный кровоток.
Для обеспечения достаточно длительного местного эффекта при минимально выраженном системном действии с местного анестетика (МА) вводят вазоконстриктор (адреналин, реже — норадреналин или производные вазопрессина), который ограничивает распространение препарата из места его введения. Это обусловлено уменьшением диффузии препарата из эндоневрального пространства в капиллярную кровь.
Кроме того, добавление вазоконстриктора помогает создать относительную ишемию в операционном поле. К возможным недостаткам сосудосуживающих препаратов катехоламинового типа относятся реактивная гиперемия после «вымывания» вазоконстриктора и стимуляция сердечно-сосудистой системы при попадании адреналина в системный кровоток. Вместо адреналина в качестве вазоконстриктора используется аналог вазопрессина — фелипрессин. Этот препарат в меньшей степени вызывает реактивную гиперемию, не обладает аритмогенным свойством, но создает опасность коронароспазма. Вазоконстрикторы не должны применяться для местной анестезии пальцев рук и ног.
г) Химическая структура. Местные анестетики (МА) имеют сходную химическую структуру. Как правило, это вторичные или третичные амины. Азот связан через промежуточную углеродную цепь с липофильной группой, которая чаще всего представлена ароматическим кольцом.
Аминная функция означает, что местный анестетик (МА) в зависимости от рКa и фактического значения pH существуют в виде либо нейтрального амина, либо положительно заряженного катиона аммония, рКa типичных местных анестетиков (МА) составляет 7,5-9,0. В протонированной форме молекула содержит как полярный гидрофильный фрагмент (протонированный азот), так и неполярный липофильный фрагмент (ароматическое кольцо), т. е. обладает амфифильными свойствами.
В зависимости от значения рКa при физиологическом значении pH от 50 до 5% препарата присутствуют в незаряженной липофильной форме. Эта фракция имеет важное значение, т. к. представляет собой форму местного анестетика (МА), проходящую через липидный бислой мембраны. Для проявления эффекта незаряженные молекулы препарата должны превратиться в катионную амфифильную форму.
д) Местные анестетики (МА), используемые в клинике, — сложные эфиры или амиды. Местные анестетики (МА) эфирного типа инактивируются в тканях эстеразами. Это служит их преимуществом, т. к. снижает опасность системной интоксикации. С другой стороны, высокая скорость метаболизма сокращает продолжительность действия препарата.
Прокаин не используется для поверхностной анестезии, т. к. скорость его инактивации выше скорости проникновения в дерму или слизистую оболочку. В мепивакаине азот, который обычно расположен на конце боковой цепи, содержится в циклогексановом кольце.
Лидокаин разрушается в первую очередь в печени путем окислительного N-деалкилирования. Для эффективной местной анестезии используют 0,25— 1% растворы. Для местной анестезии применяют 5% мази. Лидокаин также используется в качестве ан-тиаритмического средства. Прилокаин и картикаин подвергаются окислительному N-деалкилированию лишь частично, т. к. в обеих молекулах имеется заместитель на углеродном атоме, прилегающем к группе азота. В молекуле картикаина имеется карбоксиметильная группа в тиофеновом кольце. В этом положении происходит расщепление сложного эфира с образованием полярной группы -СОО-, утратой амфифильности и образованием неактивного метаболита.
Бензокаин — представитель группы МА, не имеющих атома азота, который мог бы протонироваться при физиологическом значении pH. Он используется исключительно в качестве поверхностного анестезирующего средства.
Еще одно средство, используемое для поверхностной анестезии, — незаряженный полидоканол, который имеет формулу:
Н3С-(СН2)11—(О—СН2 —СН2)9-OH.
Он состоит из гидрофобных и гидрофильной частей. В высоких концентрациях полидоканол токсичен и используется для облитерации (варикозно-расширенных вен пищевода при циррозе печени).
е) Побочные эффекты местных анестетиков (МА). В клетке местный анестетик (МА) влияет на быстрые Na+-каналы, открытие которых иницирует образование ПД. Местные анестетики (МА) блокируют эти каналы. Быстрые Na+-каналытакже функционируют и в других возбудимых тканях, включая нервные клетки головного мозга и мышц, клетки специализированных проводящих тканей сердца. Поэтому действие местных анестетиков (МА) не ограничивается нервной тканью. Эти препараты не обладают органоспецифичностью.
Соответственно при быстром введении или попадании в циркуляцию слишком высоких концентраций местного анестетика (МА) развиваются серьезные побочные эффекты. В сердце нарушается проведение импульса, что приводит к АВ-блокадам или, в худшем случае к угнетению автоматизма желудочков. Нарушается функция различных отделов ЦНС, что вызывает потерю сознания и развитие судорог. Поскольку специфических антидотов для местных анестетиков (МА) не сущестует, следует немедленно начинать симптоматическое лечение. При наличии признаков торможения сердечной деятельности необходимо ввести в/в адреналин. При нарушении деятельности ЦНС следует ввести противосудорожные препараты, например, в/в диазепам.
Зиконотид — новый антиноцицептивный препарат для местного применения. Это синтетический аналог конотоксина, с помощью которого морские улитки с колпаковидной раковиной парализуют свою добычу. Этот эффект обусловлен блокадой нейрона Са2+-каналов N-типа. При сильной хронической боли зиконотид можно вводить через интратекальный тетер в спинной мозг, где он блокирует передачу импульсов в задний рог. Зиконотид плохо переносится и вызывает побочные эффекты со стороны ЦНС, поэтому его используют в крайнем случае.
– Также рекомендуем “Механизм действия опиоидов – морфина и трамадола”
Оглавление темы “Фармакология лекарств”:
- Лекарства при повышенной кислотности желудка и лечения язвы
- Слабительные препараты для лечения запора и нормализации стула
- Лекарства от поноса – для лечения диареи
- Лекарства влияющие на двигательную систему
- Механизм действия миорелаксантов и их эффекты
- Лекарства для лечения боли и ее уменьшения
- Механизм действия простагландинов и их эффекты
- Механизм действия жаропониющих обезболивающих и НПВС
- Механизм местной анестезии и эффекты местных анестетиков
- Механизм действия опиоидов – морфина и трамадола
Источник

Анестетики разделяют на:
- Местные
- Общие:
а) ингаляционные – летучие жидкости и газы
б) неингаляционные (внутривенные)
Таблица 1
1. Местные анестетики
Местные анестетики обратимо снижают возбудимость чувствительных нервных окончаний и блокируют проведение афферентных импульсов в нервных стволах в зоне непосредственного применения, используются для устранения боли.
Первый препарат этой группы — кокаин, был выделен в 1860 г. Альбертом Ньюманом из листьев южноамериканского кустарника Erythroxylon coca. Ньюман, как многие химики прошлого, попробовал новое вещество на вкус и отметил онемение языка. Профессор Военно-медицинской академии Санкт-Петербурга Василий Константинович Анреп в 1879г. подтвердил способность кокаина вызывать анестезию. В экспериментах на лягушках он обнаружил, что кокаин влияет «парализующим образом» на окончания чувствительных нервов. В. К. Анреп исследовал действие кокаина на себе: инъекция кокаина в дозе 1 — 5 мг под кожу сопровождалась полной анестезией — укол булавкой, прижигание тлеющей спичкой не вызывали боли. Аналогичный эффект наблюдался при закапывании раствора кокаина в глаз и нанесении его на слизистую оболочку языка.
Местные анестетики классифицируют на сложные эфиры (анестезин, дикаин, новокаин) и замещенные амиды (лидокаин, тримекаин, бупивакаин). Местные анестетики — сложные эфиры подвергаются гидролизу псевдохолинэстеразой крови и действуют в течение 30 — 60 мин. Их эффект пролонгируют антихолинэстеразные средства (прозерин). Продукт гидролиза — n-амино-бензойная кислота ослабляет бактериостатическое влияние сульфаниламидов. Замещенные амиды кислот инактивируются монооксигеназной системой печени в течение 2 — 3 ч. Бупивакин вызывает местную анестезию продолжительностью 3 — 6 ч, после ее прекращения длительно сохраняется анальгетический эффект.
С точки зрения практического применения анестетики подразделяют на следующие группы:
- Средства, применяемые для поверхностной (терминальной) анестезии: Кокаин, Дикаин, Анестезин, Пиромекаин
- Средства, применяемые преимущественно для инфильтрационной и проводниковой анестезии: Новокаин, Бупивакаин
- Средства, применяемые для всех видов анестезии: Лидокаин, Тримекаин
Механизм действия
Местные анестетики представляют собой третичные азотистые основания. Они состоят из гидрофильной и липофильной частей, соединенных эфирной или амидной связями. Механизм действия определяет липофильная часть, имеющая ароматическую структуру. Для нанесения на слизистые оболочки и кожу и парентерального введения применяют водные растворы хлористоводородных солей местных анестетиков. В слабощелочной среде тканей (рН=7,4) соли гидролизуются с освобождением оснований. Основания местных анестетиков растворяются в липидах мембран нервных окончаний и стволов, проникают к внутренней поверхности мембраны, где превращаются в ионизированную катионную форму.
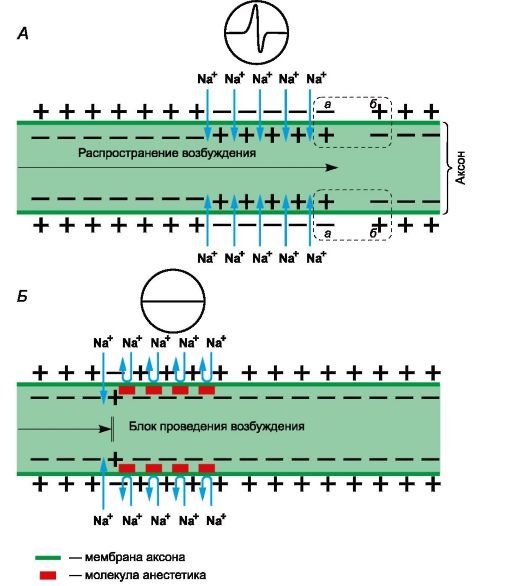 Рисунок 1 | Механизм действия местных анестетиков
Рисунок 1 | Механизм действия местных анестетиков
Рецепторы для местных анестетиков локализованы в S6-сегменте IV домена внутриклеточной части натриевых каналов. Связываясь с рецепторами, катионы местных анестетиков пролонгируют инактивированное состояние натриевых каналов, что задерживает развитие следующего потенциала действия. Местные анестетики не взаимодействуют с закрытыми каналами в период потенциала покоя. Таким образом, в зоне нанесения местных анестетиков не развиваются потенциалы действия, что сопровождается блоком проведения нервных импульсов. Избирательное влияние местных анестетиков на чувствительные афферентные нервы обусловлено генерацией в них длительных (более 5 мс) потенциалов действия с высокой частотой.
В первую очередь местные анестетики блокируют безмиелиновые С и миелиновые Аδ и Аβ волокна (афферентные пути, проводящие болевые и температурные раздражения; вегетативные нервы). На волокна, окруженные миелиновой оболочкой, местные анестетики действуют в области перехватов Ранвье. Толстые миелиновые волокна (афферентные пути, проводящие тактильные раздражения; двигательные нервы) слабее реагируют на местные анестетики. Кроме того, устойчивость двигательных нервов к анестезии обусловлена низкочастотными короткими (менее 5 мс) потенциалами действия. В очаге воспаления в условиях ацидоза нарушаются диссоциация хлористоводородных солей местных анестетиков и образование их свободных липидорастворимых оснований, поэтому обезболивающее влияние утрачивается. Например, местная анестезия может оказаться неэффективной при удалении зуба в случае тяжелого периодонтита.
2. Общие анестетики
2.1. Ингаляционные анестетики
2.1.1 Летучие жидкости
Теории механизма действия общих анестетиков
Эффекты ингаляционных анестетиков не могут быть объяснены одним молекулярным механизмом. Скорее всего многокомпонентное действие каждого анестетика реализуется через множество мишеней. Тем не менее, эти эффекты сходятся на ограниченном числе изменений, лежащих в основе физиологических эффектов. На данный момент существуют липидная и белковая теории анестезии, но ни одна из них пока не описывает последовательность событий, происходящих от взаимодействия молекулы анестетика и ее мишеней до физиологических эффектов.
 Рисунок 2 | Ингаляционные анестетики
Рисунок 2 | Ингаляционные анестетики
Активность ингаляционных анестетиков оценивают по минимальной альвеолярной концентрации (МАК). Доза, создающая 1 МАК, предотвращает у половины пациентов движения в ответ на хирургическое вмешательство. Сила общих анестетиков коррелирует с их растворимостью в жирах, что говорит о важности взаимодействия с гидрофильными мишенями. В частности, обнаружение связи между силой анестетика и его липофильностью (правило Мейер-Овертона) дало начало липидной теории механизма действия анестетиков. Липидная теория анестезии утверждает, что анестетики растворяются в двойном липидном слое биологических мембран и вызывают анестезию, достигая критической концентрации в мембране. Наиболее усложненные версии липидной теории требуют, чтобы молекулы анестетиков вызывали пертурбацию (изменение свойств) мембраны.
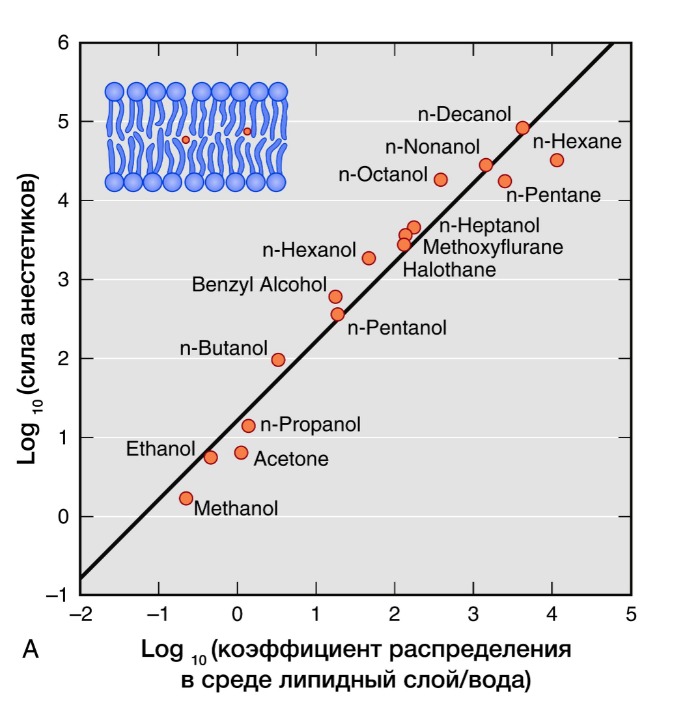 Рисунок 3 | Правило Мейер-Овертона
Рисунок 3 | Правило Мейер-Овертона
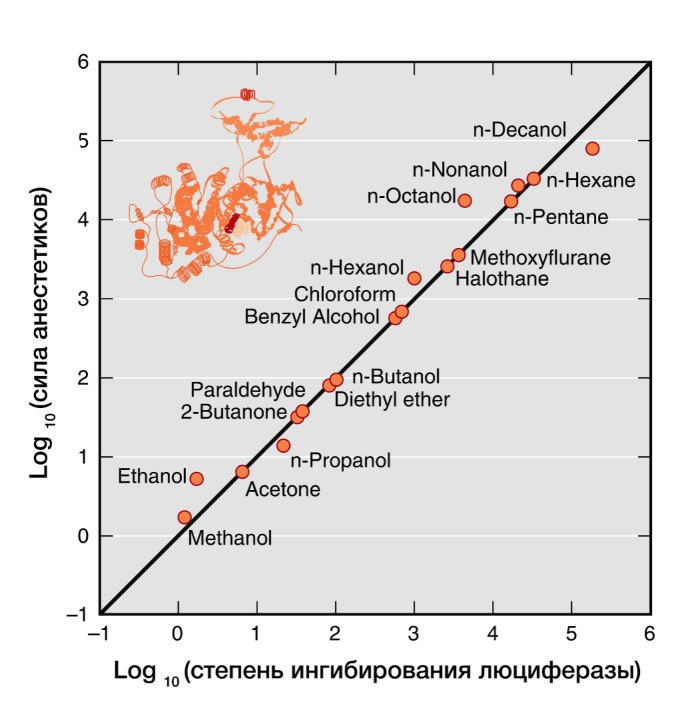 Рисунок 4 | В 20 веке было показано, что сила общих анестетиков коррелируют с их способностью ингибировать активность растворимого фермента люциферазы, который физиологически не является мишенью анестетиков, но служит в качестве безлипидной модели белковой молекулы для связывания анестетика.
Рисунок 4 | В 20 веке было показано, что сила общих анестетиков коррелируют с их способностью ингибировать активность растворимого фермента люциферазы, который физиологически не является мишенью анестетиков, но служит в качестве безлипидной модели белковой молекулы для связывания анестетика.
Современные факты позволяют утверждать, что белки в большей степени, чем липиды, являются молекулярными мишенями для действия анестетиков. Взаимодействие анестетиков с гидрофобными участками белков также объясняет правило Мейер-Овертона. Прямое взаимодействие молекул анестетиков с белками позволяет объяснить исключения из этого правила, так как любые участки связи с белком определяются как размером и формой молекулы, так и растворимостью. Многочисленные физические методы (рентгенодифракция, ЯМР-спектроскопия) подтверждают, что общие анестетики действуют путем непосредственного связывания с амфифильными полостями белковых молекул, а размер связанного участка объясняет эффект «обрубания» свойства (более длинные спирты теряют свойства анестетика).
Механизм действия
Таким образом, общие анестетики изменяют физико-химические свойства липидов мембран нейронов и нарушают взаимодействие липидов с белками ионных каналов. При этом уменьшается транспорт в нейроны ионов натрия, сохраняется выход менее гидратированных ионов калия, в 1,5 раза возрастает проницаемость хлорных каналов, управляемых ГАМК-А рецепторами. Итогом этих эффектов становится гиперполяризация с усилением процессов торможения. Общие анестетики подавляют вход в нейроны ионов кальция, блокируя Н-холинорецепторы и NMDA-рецепторы глутаминовой кислоты; снижают подвижность Са2+ в мембране, поэтому препятствуют кальций-зависимому выделению возбуждающих нейромедиаторов. Наиболее чувствительны к действию общих анестетиков полисинаптические системы ЦНС — кора больших полушарий (1013 – 1014 синапсов), таламус, ретикулярная формация, спинной мозг. К наркозу устойчивы дыхательный и сосудодвигательный центры продолговатого мозга.
Летучие ингаляционные анестетики:
- постсинаптически усиливают тормозящую передачу путем потенциирования лиганд-управляемых ионных каналов, активируемых ГАМК и глицином;
- экстрасинаптиески путем усиления ГАМК-рецепторов и ионных токов утечки;
- пресинаптически за счет повышения базального высвобождения ГАМК.
Ингаляционные анестетики подавляют возбуждающую синаптическую передачу путем снижения высвобождения глутамата и постсинаптически путем ингибирования ионотропных глутаматных рецепторов. Парализующий эффект местных анестетиков включает действие на спинной мозг, в то время как седация/наркоз и амнезия включают супраспинальные механизмы памяти, сна и сознания.
2.1.2. Газовый наркоз
В анестезиологии широко применяют ингаляционный газовый анестетик азота закись (N2O). В конце 1980-х гг. в зарубежную анестезиологическую практику вошел инертный газ ксенон.
Азота закись представляет собой бесцветный газ характерного запаха, хранится в металлических баллонах под давлением 50 атм в жидком состоянии, не горит, но поддерживает горение. Ее смеси с анестетиками группы летучих жидкостей в определенных концентрациях взрывоопасны. В субнаркотических концентрациях (20 — 30 %) азота закись вызывает эйфорию (веселящий газ) и сильную анальгезию. В концентрации 20 % обеспечивает обезболивание в такой же степени, как 15 мг морфина. Закись азота на ГАМК-А рецепторы не влияет. Используется только в комбинациях, так как МАК составляет 104 %.
Инертный газ ксенон считают лучшей альтернативой азота закиси, так как он обладает более выраженным наркозным действием, индифферентностью и экологической безопасностью. Способность ксенона вызвать наркоз была открыта в связи с практикой глубоководных погружений и развитием гипербарической физиологии. Ксенон бесцветен, не горит и не обладает запахом, при соприкосновении со слизистой оболочкой рта создает на языке ощущение горьковатого металлического вкуса. Отличается низкой вязкостью и высокой растворимостью в липидах, выводится легкими в неизмененном виде. Разработана технология ксенонсберегающей анестезии с включением минимального потока и системы рециклинга для повторного многократного использования газа. Такая технология успешно решает важную в практическом отношении проблему дефицита и дороговизны ксенона. В механизме наркозного эффекта ксенона имеют значение блокада циторецепторов возбуждающих нейромедиаторов — Н-холинорецепторов, NMDA-рецепторов глутаминовой кислоты, а также активация рецепторов тормозящего нейромедиатора глицина. При взаимодействии с циторецепторами ксенон выступает как протонсвязывающий кластер и образует комплексы с катионами НСО+, NH2+, HNCH+. Ксенон проявляет свойства антиоксиданта и иммуностимулятора, снижает выделение гидрокортизона и адреналина из надпочечников.
2.2. Неингаляционные (внутривенные) наркозные средства подразделяют на три группы:
Препараты короткого действия (3 — 5 мин)
- пропанидин (эпонтол, сомбревин)
- пропофол (диприван, рекофол)
Препараты средней продолжительности действия (20 — 30 мин)
- кетамин (калипсол, кеталар, кетанест)
- мидазолам (дормикум, флормидал)
- гексенал (гексобарбитал-натрий)
- тиопентал-натрий (пентотал)
Препараты длительного действия (0,5 — 2 ч)
- натрия оксибутират
 Рисунок 5 | Общие анестетики для внутривенного введения
Рисунок 5 | Общие анестетики для внутривенного введения
Механизм действия
Наиболее широко используемым внутривенный анестетиком является пропофол. Его механизм действия связан с увеличение хлорной проводимости ГАМК рецепторов.
Метогекситал по скорости наступления и выхода из наркоза близок к пропофолу.
Барбитураты использовались для анестезии до введения в практику пропофола. Тиопентал вызывает быстрое наступление и быстрый выход из наркоза при разовом введении, но он быстро накапливается при повторном или пролонгированном введении и таким образом замедляет выход из анестезии. Барбитураты являются лигандами барбитуратных рецепторов. В малых дозах они аллостерически усиливают действие ГАМК на ГАМК А-рецепторы . При этом удлиняется открытое состояние хлорных каналов, возрастает вход в нейроны анионов хлора, развиваются гиперполяризация и торможение. В больших дозах барбитураты прямо повышают хлорную проницаемость мембран нейронов. Кроме того, они тормозят высвобождение возбуждающих медиаторов ЦНС — ацетилхолина и глутаминовой кислоты, блокируют АМРА-рецепторы (квисквалатные рецепторы ) глутаминовой кислоты. Барбитураты обладают церебропротективными свойствами и могут быть использованы с такой целью.
Бензодиазепины используются в основном как анксиолитики и для седации с сохранением сознания.Все бензодиазепиновые рецепторы аллостерически усиливают кооперацию ГАМК с ГАМК А-рецепторами, что сопровождается повышением хлорной проводимости нейронов, развитием гиперполяризации и торможения. Реакция с бензодиазепиновыми рецепторами происходит только в присутствии ГАМК. Ремимазолам – самый молодой бензодиазепин, имеет очень короткое время действия из-за быстрой нейтрализации эстеразами плазмы.
Кетамин химически является производным фенциклидина. Синаптические механизмы действия кетамина многообразны. Он является неконкурентным антагонистом возбуждающих медиаторов головного мозга глутаминовой и аспарагиновой кислот в отношении NMDA-рецепторов. Эти рецепторы активируют натриевые, калиевые и кальциевые каналы мембран нейронов. При блокаде рецепторов нарушается деполяризация. Кроме того, кетамин стимулирует освобождение энкефалинов и β-эндорфина; тормозит нейрональный захват серотонина и норадреналина. Последний эффект проявляется тахикардией, ростом АД и внутричерепного давления. Кетамин расширяет бронхи. При выходе из кетаминового наркоза возможны бред, галлюцинации, двигательное возбуждение (эти нежелательные явления предупреждают введением дроперидола или транквилизаторов).Важным терапевтическим эффектом кетамина является нейропротективный. Как известно, в первые минуты гипоксии мозга происходит выброс возбуждающих медиаторов — глутаминовой и аспарагиновой кислот. Последующая активация NMDA-рецепторов, увеличивая во внутриклеточной среде концентрацию ионов натрия и кальция и осмотическое давление, вызывает набухание и гибель нейронов. Кетамин как антагонист NMDA-рецепторов устраняет перегрузку нейронов ионами и связанный с этим неврологический дефицит.
Самым новым внутривенным анестетиком является дексмедетомидин. Это высокоселективный агонист а2-адренорецепторов с седативными, симпатолитическими, снотворными и анальгетическими эффектами. Его основное действие – в качестве агониста на а2 рецепторы в голубом пятне.
Источники:
- Теории механизма действия – https://en.wikipedia.org/wiki/Theories_of_general_anaesthetic_action и https://www.esus.ru/php/content.php?id=744
- Венгеровский А.И., Лекции по фармакологии для врачей и провизоров 2007
- Харкевич, Фармакология изд. 10
- Miller’s anesthesia / [edited by] Ronald D. Miller ; associate editors, Neal H. Cohen, Lars I. Eriksson, Lee A. Fleisher, Jeanine P. Wiener-Kronish, William L. Young. — Eighth edition. 2015
Источник
