Авм сосудов головного мозга лечение

Артериовенозная мальформация (АВМ) головного мозга – это локальный дефект архитектоники внутричерепных сосудов, при котором формируется беспорядочное соединение между артериями и венами с образованием извитого сосудистого клубка. Патология возникает вследствие ошибки морфогенеза, а потому в основном является врожденной. Может быть одиночной или распространенной.
При мозговой АВМ кровоток осуществляется аномально: кровь из артериального бассейна прямиком, обходя капиллярную сеть, перебрасывается в венозную магистраль. В зоне мальформации отсутствует нормальная промежуточная капиллярная сеть, а связующий узел представлен фистулами или шунтами в количестве 1 и более единиц. Стенки артерий дегенерированы и не имеют надлежащего мышечного слоя. Вены, как правило, расширены и истончены по причине нарушенной ауторегуляции мозгового кровотока.
АВМ головного мозга, как и аневризмы, опасны внезапным внутримозговым кровоизлиянием, которое возникает вследствие разрыва стенки патологического сосуда. Разорвавшаяся мальформация чревата ишемией мозга, отеком, гематомой, прогрессией неврологического дефицита, что не всегда для больного заканчивается благополучно.
Статистика заболеваемости и последствий патологии
Артериовенозная мальформация в структуре всех патологий с объемными образованиями в тканях головного мозга в среднем составляет 2,7%. В общей статистике острых нетравматических геморрагий в субарахноидальное пространство, 8,5%-9% случаев кровоизлияний происходят по причине мальформаций. Инсультов головного мозга – 1%.
Встречаемость заболевания происходит со следующей средней частотой в год: 4 случая на 100 тыс. населения. Некоторые зарубежные авторы указывают другую цифру – 15-18 случаев. Несмотря на врожденную природу развития, клинически проявляется только у 20%-30% детей. Причем возрастной пик обнаружения АВМ ГМ у детей приходится на младенчество (≈13,5%) и возраст 8-9 лет (столько же %). Считается, что у ребенка с таким диагностированным сосудистым нарушением риски разрыва гораздо выше.
Видео ангиографии:
По статистике, мальформации проявляют себя по большей мере в возрасте 30-40 лет, поэтому диагностируются чаще у людей именно этой возрастной группы. Заболевание обычно протекает скрыто в течение десятков лет, чем и объясняется такая тенденция его определения далеко не в детские годы. Половой закономерности в развитии церебральных АВМ у мужского и женского пола пациентов не обнаружено.
При наличии мальформации ГМ вероятность разрыва составляет от 2% до 5% в год, с каждым последующим годом риски увеличиваются. Если кровоизлияние уже состоялось, риск его повторного рецидива существенно возрастает, вплоть до 18%.
Летальные исходы из-за внутричерепного кровоизлияния, которое часто является первым проявлением болезни (в 55%-75% случаев), случаются у 10%-25% пациентов. Смертность вследствие разрыва, согласно исследованиям, больший процент имеет у детей (23%-25%), чем у взрослых людей (10%-15%). Инвалидизация от последствий заболевания отмечается у 30%-50% больных. Примерно к 10%-20% пациентов возвращается полноценное или приближенное к норме качество жизни. Причина такой грозной тенденции заключается в поздней диагностике, несвоевременном получении квалифицированной медицинской помощи.
В какой части головы локализируются АВМ головного мозга?
Распространенная локализация артериовенозной аномалии – это супратенториальное пространство (верхние отделы мозга), проходящее над палаткой мозжечка. Чтобы было понятнее, изъяснимся проще: сосудистый дефект примерно в 85% случаев обнаруживается в больших полушариях. Преобладают поражения сосудистых звеньев теменной, лобной, затылочной, височной долей больших полушарий.
В целом, АВМ могут располагаться в любом полюсе головного мозга, причем как в поверхностных частях, так и глубинных слоях (таламусе и др.). Достоверно определить точную локализацию очага возможно только после прохождения аппаратного исследования с возможностями визуализации мягких тканей. К базовым принципам диагностики относят МРТ и метод ангиографии. Эти методы позволяют качественно оценить порядок ветвления артерий и построение вен, их соединение между собой, калибр ядра АВМ, афференты артерий, дренирующие вены.
Причины развития артериовенозного порока и симптомы
Заболевание является врожденным, поэтому анормальная закладка сосудов в определенных зонах мозга происходит в ходе внутриутробного периода. Достоверные причины развития патологии до текущего момента так и не установлены. Но, по словам специалистов, на аномальное строение сосудистой системы ГМ у плода предположительно могут способствовать негативные факторы в течение беременности:
- получение организмом матери высоких доз радиации;
- внутриутробные инфекции, передающиеся в дородовом периоде от матери к ребенку;
- хронические или острые интоксикации;
- курение и прием алкогольных напитков;
- наркотические средства, в том числе из ряда медикаментов;
- лекарственные препараты, обладающие тератогенным действием;
- хронические болезни у беременной в анамнезе (клубочковый нефрит, диабет, бронхиальная астма, пр.).
Специалисты также полагают, что в формировании порока может играть роль и генетический фактор. Наследственность до недавнего времени не воспринималась как причина патологии серьезно. Сегодня же все больше поступает сообщений о причастности и данного фактора. Так, в ряде случаев у кровных родственников больного определяются аналогичного типа сосудистые пороки. Предположительно их вызывает передающаяся по наследству генная мутация, затрагивающая хромосому 5q, локус СМС1 и RASA1.
МРТ.
Как было сказано ранее, для заболевания характерно продолжительное «немое» течение, которое может продолжаться десятилетиями. О диагнозе либо узнают случайно в момент диагностического обследования структур головного мозга, либо уже после случившегося разрыва мальформации. В немногочисленных вариантах болезнь может давать о себе знать до того как лопнет сосуд. Тогда клиника патологии чаще проявляется такими симптомами, как:
- шум в ушах (звон, гул, шипение и т.п.);
- частые головные боли;
- судорожный синдром, который схож с эпилептическими приступами;
- неврологические симптомы (парестезии, ощущения онемения, покалывания, вялость и апатия, пр.).
Клиническая картина при разрыве АВМ подобна всем типам внутричерепных кровоизлияний:
- резкое появление сильной головной боли, быстро прогрессирующей;
- головокружение, спутанность сознания;
- обмороки, вплоть до развития комы;
- тошнота, рвота;
- выпадение чувствительности половины тела;
- нарушение зрения, слуха;
- экспрессивная афазия, дизартрия (нарушения произношения);
- быстро нарастающий неврологический дефицит.
У детей заболевание зачастую проявляется отставанием в психическом развитии, задержкой речевых функций, эпиприступами, симптомами сердечной недостаточности, когнитивными нарушениями.
Виды церебральных мальформаций венозно-артериального русла
Патологические образования принято различать по топографо-анатомическому признаку, гемодинамической активности, размерам. Первый параметр характеризует место расположения мальформации в головном мозге, отсюда происходят их названия:
- поверхностные АВМ – сосредоточены в коре больших полушарий мозга (на поверхности мозга) и прилежащих структурах белого вещества;
- глубинные АВМ – локализуются в глубине мозговых извилин, базальных ганглиях, внутри желудочков, в структурах ствола ГМ.
По гемодинамической активности выделяют мальформации:
- активные – к ним причисляют смешанного вида АВМ ГМ (самая частая разновидность, при которой обнаруживается частичная деструкция капилляров) и фистулезного типа (артерия прямо переходит в вену, капиллярная сеть полностью разрушена);
- неактивные – капиллярные (телеангиоэктазии), венозные, артериовенозные кавернозные.
Поражение также оценивается по размерам, учитывается диаметр только клубка мальформации. При диагностике размеров используют следующие наименования АВМ:
- микромальформации – менее 10 мм;
- малые – от 10 мм до 20 мм;
- средние – 20-40 мм
- большие – 40-60 мм
- гигантские – более 6 см в диаметре.
Для предупреждения тяжелой геморрагии и связанных с ней необратимых осложнений крайне важно выявить и устранить очаг в ближайшее время, до разрыва. Почему? Объяснение куда более убедительное – при разрывах слишком большой процент людей погибает (до 75% пациентов) от обширного кровоизлияния, несопоставимого с жизнью.
Необходимо понимать, что сосуды АВМ слишком подвержены прорывам, так как они серьезно истощены на почве ненормального строения и нарушенного тока крови. Одновременно с этим, крупные порочные образования сдавливают и повреждают окружающие мозговые ткани, что несет дополнительную угрозу состоятельности функций ЦНС. Поэтому, если диагноз подтвержден клинически, оттягивать с лечением ни в коем случае нельзя.
Методы лечения мальформаций сосудов головного мозга
Терапия заключается в полной резекции или полноценной облитерации сосудистого дефекта хирургическим путем. Существует 3 вида высокотехнологичных операций, которые применяются в этих целях: эндоваскулярное лечение, стереотаксическая радиохирургия, микрохирургическое вмешательство.
- Эндоваскулярная операция. Метод подходит для лечения глубоко расположенных и крупных образований. Вмешательство выполняется под рентгенологическим контролем, анестезиологическое обеспечение – наркоз общего типа. Эта малоинвазивная тактика нередко является начальным этапом лечения перед предстоящей открытой операцией.
- К патологической части головного мозга через бедренную артерию по сосудам подводят тонкую трубочку катетера.
- Через установленный проводник в область мальформации подается специальный клеевый биоматериал, похожий на монтажную пену.
- Нейрохирург пенным составом перекрывает участки поражения, то есть тромбирует аномально развитые сосуды при сохранении здоровых.
- Эмболизация позволяет «выключить» патологическое сплетение из общей системы мозгового кровообращения.
- После выполненной операции под стационарным наблюдением пациент обычно находится 1-5 суток.
- Стереотаксическая радиохирургия. Лечебная тактика хоть и относится к ангионейрохирургии, но не является травматичной. Это означает, что никаких разрезов, введения внутрисосудистых зондов вообще не будет. Подходит для лечения сосудистого порока небольших размеров (до 3,5 см) или в том случае, когда очаг расположен в неоперабельной секции мозга.
- Радиохирургия предполагает разрушение ангиом системами вида Кибер-нож или Гамма-нож.
- Аппараты работают по принципу прицеленного воздействия на аномалию радиоактивным облучением.
- Лучи испускаются с разных сторон и сходятся в одной точке только дефектной зоны, здоровые структуры не затрагиваются. В результате сосуды АВМ срастаются, очаг подавляется.
- На Кибер- или Гамма-ноже процедуры абсолютно безболезненные, во время лечения пациент находится в сознании. Аппараты, на кушетке которых нужно будет просто неподвижно лежать (от 30 минут до 1,5 часов), напоминают традиционные томографы.
- При лечении Гамма-ножом на голову надевается специальный шлем и жестко фиксируется. Чтобы пациент, которому ставят шлем, не испытывал чувства дискомфорта, делают поверхностное местное обезболивание отдельных участков головы. Операция на Кибер-ноже не требует анестезии и помещения головы в жесткую конструкцию.
- В госпитализации нет необходимости. Но возможно понадобится пройти не один сеанс радиохирургии, чтобы окончательно ликвидировать остаточные явления АВМ ГМ. Иногда процесс облитерации длится 2-4 года.
- Прямое микрохирургическое удаление. Микрохирургия при данном диагнозе – единственный метод, который дает максимально высокие шансы на радикальное излечение патологии, сведение до минимума рисков рецидива. Является «золотым стандартом» в лечении данного заболевания с поверхностной локализацией и компактными формами узла.
- Микрохирургическая операция не обходится без типичной краниотомии, обязательно выполняется экономное вскрытие черепа для проведения основных хирургических манипуляций на мозге.
- Вмешательство проходит под общей эндотрахеальной анестезией, под контролем сверхмощного интраоперационного микроскопа и ультразвукового оборудования.
- Для предотвращения кровяного сброса по питающему артериальному сосуду и вене применяется метод биполярной коагуляции, то есть осуществляется прижигание.
- Далее единым блоком через трепанационное окно производится одномоментное иссечение всего тела мальформации с минимальными кровопотерями.
- В конце операционного сеанса отверстие в черепе закрывается костным лоскутом, на кожные покровы накладывается шов.
- Выписка возможна ориентировочно через 14 суток после операции. Далее нужно продолжить послеоперационное восстановление в специализированном центре реабилитации. Продолжительность реабилитации устанавливается индивидуально.
Видео открытой операции можно посмотреть по ссылке: https://www.youtube.com/watch?v=WA2FTX1NK1Y
В определенных ситуациях невозможно сразу приступить к прямой микрохирургии ввиду высоких интраоперационных рисков, особенно при АВМ больших размеров. Или же другой вариант: ангиома после стереотаксии или катетерной эмболизации лишь частично компенсирована, что крайне плохо. Поэтому иногда целесообразно обращаться к поэтапному лечению, используя последовательную комбинацию нескольких ангионейрохирургических методов.
Где лучше оперироваться и цены операции
Грамотно спланированный алгоритм лечебных действий поможет полностью удалить сосудистый конгломерат не в ущерб жизненно важным тканям. Адекватность терапии с учетом принципа индивидуальности убережет от прогрессии неврологических отклонений, возможного раннего рецидива со всеми вытекающими последствиями.
Оперировать высший орган ЦНС, который отвечает за множество функций в организме (двигательные способности, память, мышление, речь, обоняние, зрение, слух и пр.), следует доверять мирового уровня нейрохирургам. Кроме того, медучреждение должно быть снаряжено широкой базой высокотехнологичного интраоперационного оборудования передового образца.
В зарубежных странах с высокоразвитой нейрохирургией услуги стоят дорого, зато там, что называется, возвращают пациентов к жизни. Среди популярных направлений, одинаково продвинутых в хирургии головного мозга, выделяют Чехию, Израиль и Германию. В чешских клиниках цены на медицинскую помощь по поводу артериовенозных мальформаций самые низкие. Невысокая стоимость, совершенная квалификация чешских врачей-нейрохирургов сделали Чехию самым востребованным направлением. В это государство стремятся попасть не только пациенты из России и Украины, но и Германии, Израиля, других стран. И коротко о ценах.
Центральный военный госпиталь г.Прага.
| Метод хирургии | Россия (руб.) | Чехия (евро) | Германия, Израиль (евро) |
| Операция на CyberKnife или GammaKnife | от 200000 | 8000-12000 | от 20000 |
| Эндоваскулярное вмешательство | от 75000 | до 8000 | от 15000 и более |
| Микрохирургическая резекция | 150000-250000 | 7000-10000 | 13000-18000 |
Источник
Алгоритм лечения артерио-венозной мальформации головного мозга – Европейские рекомендации
I. Хирургическое лечение артерио-венозной мальформации (АВМ) головного мозга. Хотя существуют различные виды современной терапии при церебральных артерио-венозных мальформаций (АВМ), хирургическое лечение является наиболее известным вариантом и относится к первому выбору при наличии такой возможности. С развитием микрохирургических методов показатели эффективности полного удаления заметно улучшились.
Принятие решений при церебральных артерио-венозных мальформаций (АВМ) является одним из наиболее сложных аспектов нейрохирургической практики. Решение, следует ли рекомендовать операцию, должно быть основано на объективном сравнении долгосрочных рисков неоперированной артерио-венозной мальформации (АВМ) с риском оперативного лечения.
У молодых пациентов, особенно при наличии неврологических симптомов, попытки хирургического удаления связаны с хирургическим риском, хотя и высоким, но по-прежнему меньшим, чем при естественном течении. У пациентов средних лет и пожилых пациентов с минимальной симптоматикой консервативный подход кажется более разумным, так как риск лечения может быть не меньше, чем при естественном течении.
Наиболее популярная система для оценки риска операции — пятибалльная шкала, разработанная Spetzler и Martin. Она включает в себя три переменные:
• Размер артерио-венозной мальформации (АВМ)
• Характер венозного оттока
• Локализацию артерио-венозной мальформации (АВМ) (функционально значимая зона или нет).
Тип I — малые размеры, поверхностные и расположенные в функционально незначимой зоне мозга, в то время как тип поражения V — это большие, глубокие АВМ в функционально значимой зоне мозга. Размер и структуру венозного оттока из АВМ как хирургические факторы риска оценить довольно несложно, но гораздо сложнее определиться в отношении функционально значимых зон мозга. Повреждение извилин и перемещение функций в связи с реорганизацией коры у пациентов с АВМ может затруднять выявление функционально значимых зон.
Перед операцией полезно проведение функциональной МРТ или ПЭТ для определения функциональных областей мозга и для получения информации о местонахождении зон речи, сенсорной и зрительной коры. Во время операции, выявлению и сохранению важных областей мозговой ткани могут способствовать электрофизиологический мониторинг, системы картирования и корковой нейронавигации.
При хирургическом вмешательстве в принципе допустимы мелкие и средние повреждения конвекситальной поверхности мозга вне критических областей. По сравнению с радиохирургией или наблюдением только хирургическое иссечение является рентабельным и очень эффективным способом улучшения качества и продлении жизни.
По нашему опыту, примерно треть пациентов с АВМ может быть направлена только на хирургическое лечение, а в остальных случаях необходимы эмболизация и/или радиохирургия до, после или вместо хирургического вмешательства.
Лечение при больших АВМ, расположенных в критически важных областях с подкорковыми клинообразными расширениями, достигающими стенок бокового желудочка, представляет собой сложную задачу. Глубокая их часть обычно снабжается из хориоидальных артерий или мелких сосудов, обычно питающих базальные ганглии, внутреннюю капсулу и таламус. Кровотечение из этих сосудов во время операции может привести к гематоцефалии.
Кроме того, трудности контроля глубоких сосудов, таких как лентикулостриарные артерии, при использовании транскортикального или трансвентрикулярного подхода увеличивают риск хирургических осложнений. В этих случаях полезно проведение эндоваскулярной эмболизации до операции.
При больших высокопотоковых артерио-венозных мальформаций (АВМ) обычно требуется предоперационная эмболизация, а некоторые авторы рекомендуют несколько этапов резекции. Поэтапное лечение при больших АВМ может свести к минимуму риски синдрома гиперперфузии и кровоизлияния в мозг после хирургического лечения.
II. Эндоваскулярное лечение артерио-венозной мальформации (АВМ). Альтернативой хирургической резекции артерио-венозной мальформации (АВМ) является эндоваскулярная эмболизация. Принцип эмболизации заключается в окклюзии тела АВМ либо частицами, либо жидким веществом, которое быстро затвердевает при попадании в кровеносный сосуд. Так как частицы не приводят к достаточно надежной окклюзии, в настоящее время используют эмболизаты на основе NBCA (N-бутил-цианакрилат) и ONYX®. Оба агента в настоящее время достаточно изучены для оценки результатов после долгосрочного наблюдения.
Эмболизация обычно проводится под общим наркозом. После пункции бедренной артерии, катетер проводится в сонную артерию по методике Сельдингера. С помощью микрокатетера выполняется суперселективная катетеризация питающих сосудов АВМ, что позволяет получить точное изображение тела АВМ и выявить возможные факторы риска, такие как интранидальные аневризмы. Так как большинство артериальных афферентов не только питают очаг, но и снабжают нормальные ткани мозга (так называемые «транзитные» артерии), устанавливают кончик микрокатетера в положении, из которого снабжается только тело АВМ. В этом положении эмболизационный агент высвобождается и продвигается в тело.
Как правило, для достижения благоприятного результата необходимо проведение нескольких этапов эмболизации.
Хотя метод эндоваскулярной эмболизации достаточно изящен и привлекателен для пациента отказом от краниотомии, к его недостаткам относится возможность излечения лишь в 15% случаев, а неоднократная эмболизация ведет к кумуляции осложнений. Поэтому, эмболизация обычно применяется в составе комбинированной терапии вместе с хирургией или радиохирургией при АВМ степени 3 или выше по Spetzler. Эмболизация служит, например для того, чтобы уменьшить размеры патологического очага и, следовательно, улучшить результаты радиохирургического лечения, или эмболизировать глубокие сосуды, которые трудно контролировать при хирургической резекции АВМ.
В качестве заключения следует сказать, что, эндоваскулярная эмболизация является устоявшимся методом в лечении АВМ. Возможные риски следует соотнести с потенциальным эффектом в каждом конкретном случае. Таким образом, она заняла свое место, в основном, в комбинированном лечении.
III. Стереотаксическая радиохирургия в лечении артерио-венозной мальформации (АВМ):
а) Определение. Однофракционное высокофокусированное стереотаксически направленное излучение малого объема, применяемое для облучения внутричерепных объектов.
б) Синонимы. Радиохирургия, SRS, STRS, хирургия гамма-ножом.
в) История развития:
– 1951 г.: понятие введено Lars Leksell (1907-1986)
– Первое лечение было проведено в 1950 г. с применением рентгеновской трубки и стереотаксической дуги
– 1954 г.: в лаборатории Lawrence и Berkeley разработан перекрестный пучок протонов
– 1968 г.: проведено лечение гамма-ножом
– 1985 г.: Colombo разработал модифицированный линейный ускоритель
– 2000 г.: для гамма-ножа была разработана автоматическая система позиционирования (APS).

г) Принципы радиохирургии. Лечение обычно проводится под местной анестезией, у всех пациентов, кроме детей и лиц, страдающих клаустрофобией. Принцип действий:
• Формирование контуров патологического очага
• Планирование дозы
• Доставка дозы.
1. Формирование контуров патологического очага. Прежде всего, вокруг головы с помощью стереотаксической рамы устанавливается набор стандартных ориентиров или «нормирующих систем».
Контуры патологического очага формируются при помощи цифровой субтракционной ангиографии (DSA), дополненной МРТ и/или КТ в аксиальной проекции. В редких случаях, аксиальных изображений может быть достаточно. Затем вычерчивают контур мишени.
2. Планирование дозы. Цель заключается в максимально точном соответствии дозы лучистой энергии контурам очага поражения. Включение смежных нормальных тканей может привести к побочным эффектам и осложнениям, в то время как эффективность облучения патологического очага снижается. Помимо соответствия форме, внимание уделяется тому, чтобы избежать прохождения пучков излучения через важные структуры, прилегающие к очагу поражения или даже на расстоянии (например, хрусталик глаза). Это достигается путем подключения нескольких источников излучения в гамма-нож или выбором лечения при помощи линейного ускорителя.
3. Доставка дозы. Существуют две основные технологии для доставки дозы: гамма-нож и линейный ускоритель. С точки зрения количества пациентов и публикаций, гамма-нож доминирует над ускорителем и, следовательно, считается «золотым стандартом».
– Гамма-нож. Концентрический массив из 201 источника кобальт-60 обеспечивает выход гамма-лучей, сфокусированных на цели. Комбинация стационарных источников и коллиматоров позволяет достичь точности в 0,1 мм.
– Линейный ускоритель. Существует несколько методов лечения с помощью линейного ускорителя (LINAC — «linear accelerator»). Может быть использована модифицированная LINAC лучевая терапия с вторичной системой коллиматоров или выделенная LINAC лучевая терапия. Наиболее часто применяется многоуровневая однофокусная некомпланарная дуга и методы конформного блока. При первой технике источник излучения перемещается вдоль нескольких дуг, а вторая основана на высоковольтном трансформаторе, создающим высокое переменное напряжение, после чего пучок проходит в нужной фазе вблизи максимума электрического поля.
Коллиматор состоит из ряда индивидуально моторизованных листов вольфрама, которые устанавливаются автоматически и создают любую форму пучка. При технике модуляции интенсивности доза радиации различной интенсивности доставляется по периметру всего очага поражения. Коллиматор динамически открывается и закрывается под управлением компьютера для выбора экспозиции или частей мишени. Эта технология пока находится на раннем этапе развития, в стадии клинической оценки.
4. Лечение артерио-венозной мальформации (АВМ). Целью является тело АВМ. Тело определяется как сеть слабо дифференцированных и незрелых сосудов, в которой сходятся питающие артерии и выходят переполненные вены.
Механизмы действия:
– Преобладающий фактор: пролиферация эндотелиальных клеток и гиалинизация стенок сосудов.
– Вторичный фактор: развитие миофибробластов адвентициальной оболочки.
5. Критерии отбора пациентов. Лечение артерио-венозной мальформации (АВМ) является мультидисциплинарным. Критерии отбора представлены в таблице ниже.

6. Подходящие артерио-венозные мальформации (АВМ). Большинство артерио-венозных мальформаций (АВМ) поддается терапии. В идеальном случае АВМ небольших размеров (<3 см), компактная и глубоко расположена в функционально значимой зоне. Особенности непригодной АВМ:
• Фистулезное строение (эндоваскулярное лечение, как правило, достаточно).
• Множественные узлы (часто неизлечимы независимо от метода лечения).
• Расположенные вокруг функционально важной структуры, например, вокруг зрительного нерва при синдроме Wyburn-Mason.
• Большинство дуральных АВМ (большой объем, плоская форма и нет истинного узла).
• Диаметр >4 см.
7. Результаты. Результат зависит от размера очага и дозы. При небольших (<2 см) артерио-венозных мальформациях (АВМ) излечение наступает у 85-95% пациентов.
8. Осложнения лечения артерио-венозной мальформации (АВМ):
– Отек, выявляемый на МРТ. В среднем развивается через 11 месяцев примерно у 2,5% больных
– Очаговый неврологический дефицит (парезы, поле зрения, учащение судорог у 2-8%).
– Факторы риска: функционально значимая зона (например, ствол мозга, таламус), размер > 3,5 см, периферическая доза > 25 Гр.
9. Варианты лечения при крупных артерио-венозных мальформациях (АВМ):
• Выжидательная тактика
• Стереотаксическая радиохирургия:
— Малая доза менее эффективна
— Стадирование (радиохирургия проводится с интервалом в несколько месяцев между процедурами)
• Уменьшение объема:
— Хирургия
— Эмболизация
III. Консервативное лечение артерио-венозной мальформации (АВМ) без операции. Сведения о долгосрочных спонтанных исходах у пациентов с АВМ в значительной степени основаны на данных Ondra et al. Частота массивных повторных кровоизлияний составила 4,0%, а смертность 1,0% в год, 23% пациентов погибли из-за кровоизлияния из АВМ. Совокупная частота тяжелых осложнений и смертность составили 2,7% в год. Эти ежегодные показатели практически не менялись в течение всего периода исследования. Риск лечения АВМ IV-V степени по Spetzler сопоставим с рисками естественного течения в течение 10 лет.
Таким образом, только в случае эпилепсии или головной боли консервативное лечение может быть оправдано с рекомендацией пересмотра в случае кровоизлияния.
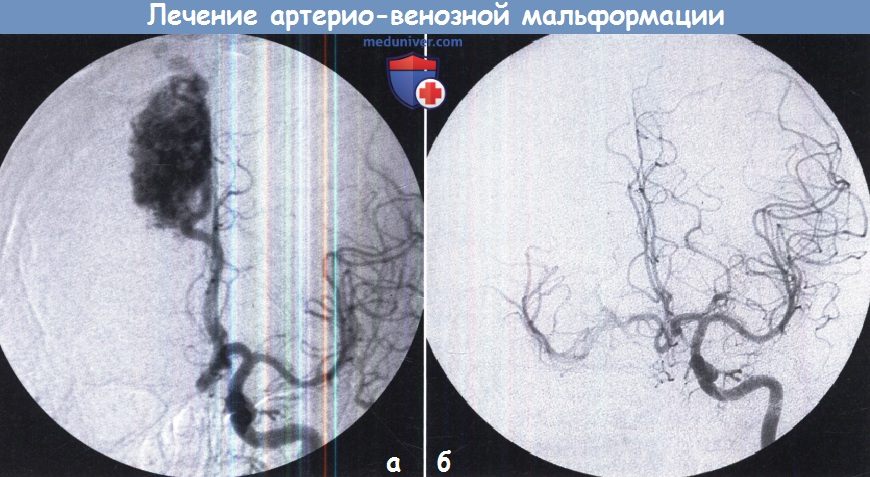
а – Артериовенозная мальформация до радиохирургии.
б – Спустя два года контрольная ангиография показывает полную облитерацию после радиохирургии.
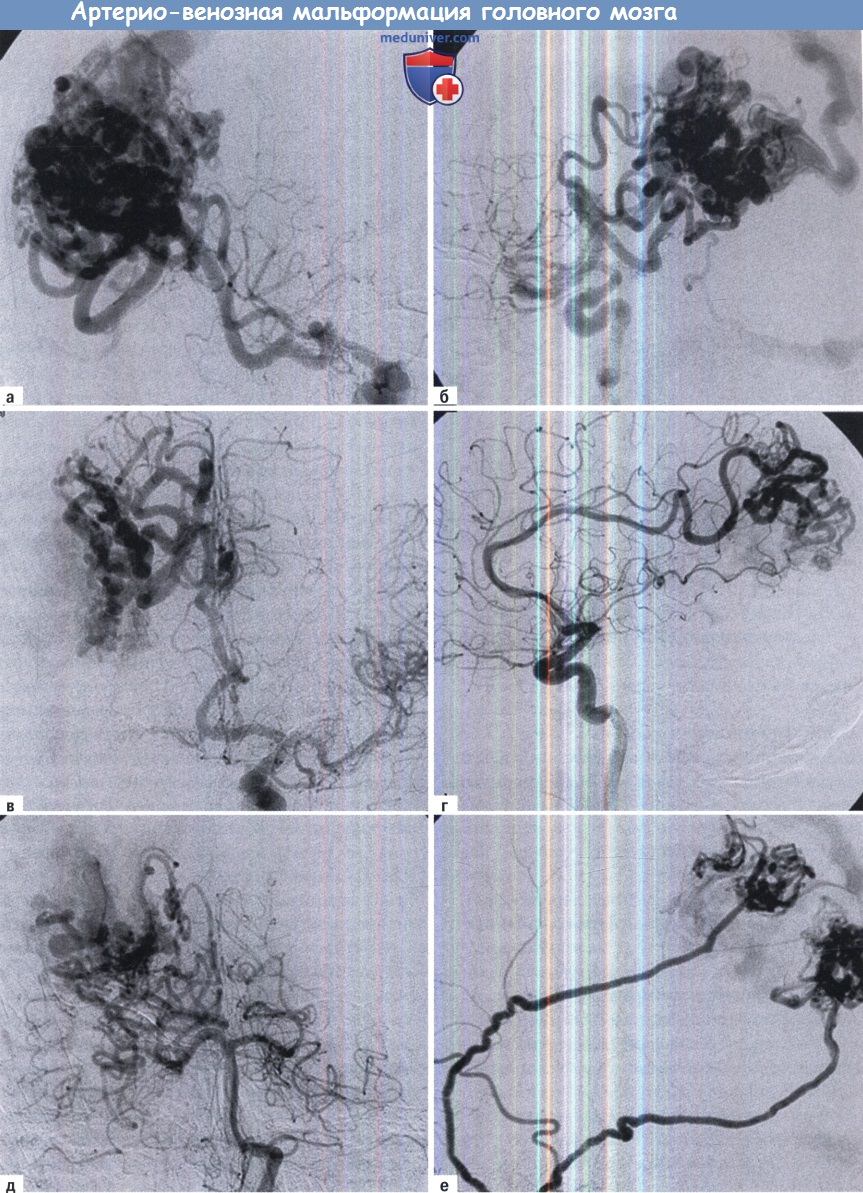
(А, Б) Пример обширной артериовенозной мальформации теменной локализации, питаемой из средней (В, Г) передней и (Д) задней мозговых артерий, а так же из (Е) наружной сонной артерии.
Данный пациент 63 лет поступил с кровоизлиянием. Венозный дренаж осуществляется через верхний сагиттальный синус.
Лечение состояло из совмещения эмболизации и микрохирургии.
– Также рекомендуем “Алгоритм диагностики каверномы головного мозга – Европейские рекомендации”
Оглавление темы “Болезни сосудов головного мозга.”:
- Алгоритм эндоваскулярного лечения аневризмы сосуда головного мозга – Европейские рекомендации
- Алгоритм диагностики артерио-венозных мальформаций головного мозга – Европейские рекомендации
- Алгоритм лечения артерио-венозной мальформации головного мозга – Европейские рекомендации
- Алгоритм диагностики каверномы головного мозга – Европейские рекомендации
- Алгоритм лечения каверномы головного мозга – Европейские рекомендации
- Причины и классификация дуральных артериовенозных фистул (ДАВФ)
- Алгоритм диагностики и лечения дуральной артериовенозной фистулы – Европейские рекомендации
- Алгоритм диагностики сужения сосуда головного мозга и его окклюзии – Европейские рекомендации
- Алгоритм лечения сужения сосуда головного мозга и его окклюзии – Европейские рекомендации
- Алгоритм лечения заболеваний сосудов головного мозга – Европейские рекомендации
Источник
