Частота ударов о стенку сосуда

Получим формулу для вычисления числа ударов молекул в единицу времени о единичную площадь стенки сосуда, в котором находится газ.
Возьмем на стенке сосуда, бесконечно малую площадку dS, перпендикулярную оси Z системы координат XYZ ( рис. 8).
На этой площадке , как на основании, построим бесконечно узкий цилиндр с осью, имеющей направление, определяемое сферическими углами j и J,идлина которой равна vdt, где v – скорость молекулы, dt – промежуток времени. Объем этого цилиндра
, (1.4.1)
а число молекул в нем dn=ndV, где n – концентрация молекул в сосуде. Из-за хаотичности движения не все dn молекул достигнут площадки dS за время dt. Ее достигнут только те из молекул, которые, во-первых, движутся в направлении к площадке dS и, во-вторых, имеют скорости, близкие к u, при этом за время dt они проходят расстояние udt, равное длине образующей цилиндра, и достигают площадки dS. Найдем число таких молекул в объеме dV цилиндра.
И если к моменту времени t эти молекулы находились в объеме dV цилиндра, тогда время от t до t+dt все они достигнут площадки dS.
Р и с. 8
Обозначим через dnu число молекул в единице объема газа, которые имеют скорости, заключенные в интервале (u, u+du). Пусть среди этих молекул молекул в единице объема имеют направления движения, определяемые сферическими углами, взятыми из интервалов (j,j+dj) и (J,J+dJ). Согласно формуле (1.3.5), количество таких молекул в единице объема газа равно
(1.4.2)
Число же указанных молекул в объеме dV рассматриваемого цилиндра
dnu,J,j=dnu,J,j × dV (1.4.3)
С учетом формул (1.4.1) и (1.4.2) выражение (1.4.3) примет вид
(1.4.4) Таким образом, среди всех молекул, находящихся в объеме dV цилиндра, dnu,J,j молекул имеют близкие к u скорости, и их направления движения определяются углами, близкими к углам J и j. Однако из объема V, занимаемого газом, к площадке dS подлетают молекулы с других направлений и с иными скоростями. Чтобы учесть эти молекулы, необходимо проинтегрировать выражение (1.4.4) по всем возможным углам j и J и скоростям u:
(1.4.5)
Сферический угол J в общем случае изменяется от 0 до p. В выражении (1.4.5) интегрирование по J произведено от 0 до p/2, так как при интегрировании по J в пределах от p/2 до p рассматриваемые молекулы, как легко видеть из рис.8, будут иметь направление движения, соответствующее их удалению от площадки.
Разделив обе части соотношения (1.4.5) на dtdS, получим
(1.4.6)
Таким образом, выражение (1.4.6) определяет число ударов молекул газа в единицу времени о единичную площадку стенки сосуда.
Для выяснения смысла величины интеграла в выражении (1.4.6) умножим и разделим его на концентрацию молекул n=N/V.
(1.4.7)
Если обозначить через dNu число молекул в объеме V, которые имеют скорость от u до u + du, то dnu=dNu /V будет определять число таких молекул в единице объема газа. Величина же
(1.4.8)
при больших N представляет собой вероятность того, что случайно “взятая” в газе молекула будет иметь скорость, заключенную в интервале (u,u+du). Эта вероятность связана с функцией распределения (плотностью вероятности) следующим соотношением (см. А.23):
(1.4.9)
Функция распределения молекул по скоростям F(u) является важнейшей характеристикой равновесного состояния газа. Ее явный вид будет получен в последующих параграфах из весьма общих предпосылок.
С учетом формул (1.4.8) и (1.4.9), выражение (1.4.7) примет вид
(1.4.10)
Интеграл, стоящий в соотношении (1.4.10), представляет среднее значение скорости (см. формулу (А.25) Приложения А):
(1.4.11)
Поэтому
(1.4.12)
Как видно из выражения (1.4.12), число ударов молекул газа в единицу времени о единичную площадку пропорционально концентрации и средней скорости их движения, что находится в полном согласии с нашей интуицией.
Пример
1. В космическом корабле находится воздух объема V с концентрацией n0, поддерживаемый при постоянной температуре. За бортом корабля вакуум. Найти зависимость концентрации молекул воздуха в корабле от времени, если в тонкой части его стенки образовалось малое отверстие площади S?

Решение. Пусть через время t после образования отверстия концентрация воздуха в корабле стала равной n(t). Тогда число молекул воздуха, влетающих в отверстие площади S за время dt (от момента t до t+dt), согласно формуле (1.4.5)
dn= n(t)<u>Sdt (1.4.13)
Эти молекулы покидают кабину корабля. С другой стороны, это число молекул можно выразить иначе.
Изменение концентрации воздуха в корабле за время dt (от t до t+dt)
Откуда находим
dn = -Vdn (1.4.14)
Сравнивая выражения (1.36) и (1.37), получаем
(1.4.15)
Проинтегрируем равенство (1.4.15).
Откуда находим искомую зависимость концентрации от времени
(1.4.16)
Источник
Число ударов молекул газа о стенку площадью м2 за одну секунду.
,
где – концентрация молекул, – средняя скорость молекул газа.
8-1. Один моль водорода находится в сосуде с объемом V при температуре Т. Найти число ударов молекул о площадку стенки сосуда S за одну секунду.
V= 1м3; Т = 300 К; S = 1 см2; = 2 г/моль.
Ответ: 2,671022.
8-2. В сосуде с объемом V находится Nмолекул водорода при температуре Т. Найти число ударов молекул о площадку стенки сосуда S за одну секунду.
V= 1м3; N= 1023; Т = 300 К; S = 1 см2; = 2 г/моль.
Ответ: 4,461021
8-3. В сосуде с объемом V находится Nмолекул водорода, средняя вероятная скорость которых равна . Найти число ударов молекул о площадку стенки сосуда S за одну секунду.
V= 1м3; N= 1023; = 500 м/с; S = 1 см2; = 2 г/моль.
Ответ: 1,411021
8-4. В сосуде с объемом V находится Nмолекул водорода, средняя квадратичная скорость которых равна . Найти число ударов молекул о площадку стенки сосуда S за одну секунду.
V= 1м3; N= 1023; = 500 м/с; S = 1 см2; = 2 г/моль.
Ответ: 1,151021
8-5. В сосуде с объемом V находится Nмолекул водорода. Сумма величин скоростей всех молекул равна . Сколько молекул вылетит из отверстия в стенке сосуда с площадью S за одну секунду.
V= 1м3; N= 1024; = 51026 м/с; S = 1 см2; = 2 г/моль.
Ответ: 1,251022
8-6. В сосуде с объемом V находится Nмолекул водорода. Через отверстие в стенке сосуда с площадью S за одну секунду вылетает N1 молекул. Найти температуру газа в сосуде. V= 1м3; N= 1023; N1= 51021;S = 1 см2; = 2 г/моль.
Ответ: 378 K
8-7. В первом сосуде с объемом V находится N1молекул водорода
(1 = 2 г/моль), а во втором таком же сосуде находится N2 молекул азота
(2=28 г/моль). В первом сосуде сделали отверстие площадью S1, а во втором S2.Число молекул, вылетающих за одну секунду из первого сосуда в nраз больше, чем из второго. Во сколько раз температура газа в первом сосуде отличается от температуры газа во втором сосуде.
V= 1м3; N1= 91023; N2= 1024; S1 = 1 см2; S2 = 2 см2; n = 2.
Ответ: в 1,41 раза
8-8. В первом сосуде с объемом V находится N1молекул водорода (1 = 2 г/моль), а во втором таком же сосуде находится N2 молекул азота (2=28 г/моль). В сосудах сделали отверстия площадью S1 и S2.Число молекул, вылетающих за одну секунду из первого сосуда в nраз больше, чем из второго. Найти отношение площадей , если температуры газов в сосудах одинаковы. V= 1м3; N1= 1023; N2= 1024; n = 3.
Ответ: 8,02
8-9. В первом сосуде с объемом V находится N1молекул водорода (1 = 2 г/моль) со средней квадратичной скоростью , а во втором таком же сосуде находится N2 молекул азота (2=0,028 кг/моль) со средней вероятной скоростью . В сосудах сделали одинаковые отверстия площадью S.
V= 1м3; N1= 1023; N2= 1024; = 500 м/с; =400 м/с; S= 1 мм2.
а) На сколько отличается число молекул, вылетающих из разных сосудов за одну секунду.
б) Во сколько раз число молекул, вылетающих за одну секунду из второго сосуда, больше, чем из первого?
Ответы: а) 1,011020; б) в 9,80 раз
8-10. Идеальный газ находился в закрытом сосуде, а средняя квадратичная скорость молекул была равна . Потом газ был нагрет так, что средняя вероятная скорость молекул стала равна . =500 м/с; =450 м/с.
Найти:
а) отношение частоты ударов молекул о единичную площадку в первом и во втором состояниях .
б) отношение частоты ударов молекул о единичную площадку во втором и в первом состояниях .
Ответы: а) 0,907; б) 1,10
8-11. Идеальный газ находился в закрытом сосуде, а средняя квадратичная скорость молекул была равна . Потом газ был нагрет так, что средняя скорость молекул стала равна . =500 м/с; =470 м/с. Найти:
а) отношение частоты ударов молекул о единичную площадку во втором и в первом состояниях .
б) отношение частоты ударов молекул о единичную площадку в первом и во втором состояниях .
Ответы: а) 1,02; б) 0,980.
8-12. Идеальный газ находился в закрытом сосуде, а средняя скорость молекул была равна . Потом газ был нагрет так, что средняя вероятная скорость молекул стала равна . =500 м/с; =470 м/с. Найти:
а) отношение частоты ударов молекул о единичную площадку в первом и во втором состояниях .
б) Найти отношение частоты ударов молекул о единичную площадку во втором и в первом состояниях .
Ответы: а) 0,943; б) 1,06
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Рассмотрим находящийся в равновесии газ, заключенный в некотором сосуде. Допустим, что молекулы газа движутся только вдоль трех взаимно ┴ направлений. Это можно допустить из-за хаотичности движения молекул. Если в сосуде находится N молекул, то в любой момент времени вдоль каждого из направлений будет двигаться N/3 молекул и половина из них – N/6 вдоль данного направления в одну сторону, а вторая половина – в другую. Следовательно, в интересующем нас направлении по нормали к данному элементу ΔS стенки сосуда движется N/6 молекул, а для единицы объема –  ,n – концентрация молекул.
,n – концентрация молекул.
Пусть все молекулы движутся с одинаковой средней скоростью <v>. За время Δt элемента стенки ΔS достигают все молекулы, находящиеся в параллелипипеде с площадью основания ΔS и длиной  <v>Δt. Их число Δν = (n/6)ΔS<v>Δt, следовательно, число ударов о единичную площадку в единицу времени
<v>Δt. Их число Δν = (n/6)ΔS<v>Δt, следовательно, число ударов о единичную площадку в единицу времени
Δν/ΔSΔt = (n/6)<v>.
Если отказаться от допущения, что все молекулы движутся с одинаковой скоростью v = <v>, то необходимо выделить в единице объема молекулы, скорости которых лежат в интервале от v до v+dv. Их число – . Количество ударов таких молекул, долетающих до площадки ΔS за время Δt равно dνv = (1/6)(dnvΔS
. Количество ударов таких молекул, долетающих до площадки ΔS за время Δt равно dνv = (1/6)(dnvΔS
vmax
vΔt).
vmax
Полное число ударов:
Δν =  dνv = 1/6ΔSΔt
dνv = 1/6ΔSΔt  vdnv = Выражение
vdnv = Выражение 
 vdnv по определению является средней скоростью молекулы, тогда Δν = 1/6ΔSΔtn<v> , т.е., получили то же самое значение числа ударов.
vdnv по определению является средней скоростью молекулы, тогда Δν = 1/6ΔSΔtn<v> , т.е., получили то же самое значение числа ударов.
3.4 Давление газа на стенку сосуда
Давление по определению можно записать:  , а поскольку, из второго закона Ньютона:
, а поскольку, из второго закона Ньютона: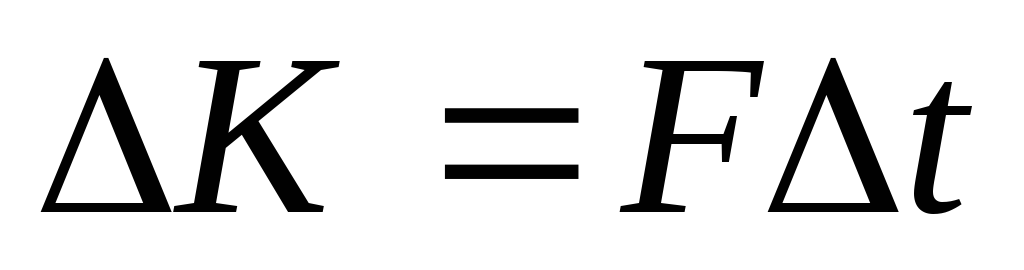 , то
, то . Значит, необходимо вычислить импульс
. Значит, необходимо вычислить импульс , передаваемый всеми молекулами со всеми скоростями единице площади за единицу времени.
, передаваемый всеми молекулами со всеми скоростями единице площади за единицу времени.
Число молекул со скоростью v из общего количества n, долетающих до площадки ΔS за время Δt равно:
dνv = (1/6)(dnvΔSvΔt)
Далее, умножив это число на импульс, сообщаемый каждой молекулой при ударе равный – 2mv, получим импульс, сообщаемый площадке ΔS за время Δt этими молекулами. Изменение импульса одной молекулы равно K2-K1= -2mv, значит, импульс передаваемый молекулой сте
vmax
нке равен +2mv.
vmax
Импульс, передаваемый молекулами со скоростями, лежащими в интервале от v до v +dv
равен  v.
v.
Импульс, передаваемый всеми молекулами со всеми скоростями:
 K =
K =  (1/6)(dnvΔSvΔt)2mv = 1/3 m ΔSΔt
(1/6)(dnvΔSvΔt)2mv = 1/3 m ΔSΔt  v2dnv (*)
v2dnv (*)
Выражение 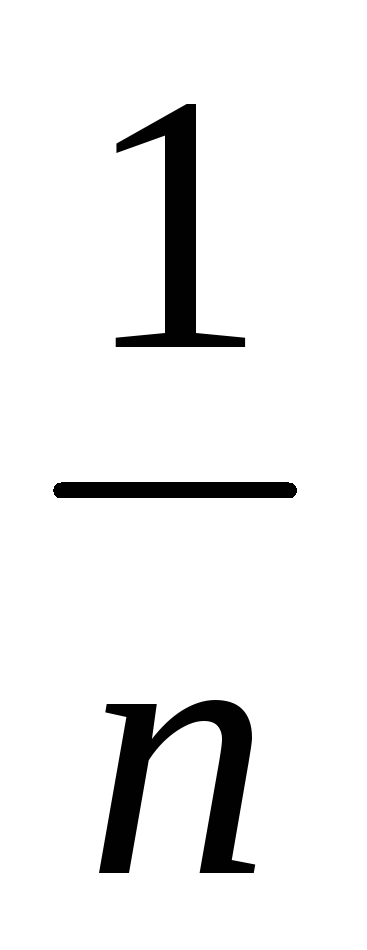
 v2dnv представляет собой среднее значение квадрата скорости молекул, тогда, заменив в (*) интеграл и, разделив это выражение на ΔS и Δt, получим давление газа на стенку сосуда:
v2dnv представляет собой среднее значение квадрата скорости молекул, тогда, заменив в (*) интеграл и, разделив это выражение на ΔS и Δt, получим давление газа на стенку сосуда:
р = 1/3mn<v2>
т.к. m<v2>/2 = <εпост> по определению, получим:
р =2/3n<εпост>
– основное уравнение молекулярно- кинетической теории. Это уравнение раскрывает физический смысл макропараметра р: давление определяется средним значением кинетической энергии поступательного движения молекул.
3.5 Средняя энергия молекул
Из уравнения состояния идеального газа p=nkT и выражения для давления газа на стенку сосуда р =2/3n<εпост> следует, что
<εпост> = 3/2kT (1), откуда можно заключить, что температура есть величина, прямо пропорциональная средней энергии поступательного движения молекул.
Поступательно движутся молекулы газа. Молекулы твердых и жидких тел совершают колебания вблизи положений равновесия.
Из выражения (1) видно, что <εпост> зависит только от Т и не зависит от массы молекулы.
Т.к., <εпост> = <mv2/2> = m<v2>/2, то из сравнения с выражением (1), получим: <v2> = 3kT/m а средняя квадратичная скорость:
vср.кв. = √<v2> = √3kT/m .
Можно представить <v2> = <v2x>+<v2y>+<v2z> = 3<v2x>, поскольку, все направления движения молекул равноправны, т.е., <v2x> = <v2y> = <v2z>, тогда:
<v2x> = 1/3<v2> = kT/m
Формула (1) определяет энергию поступательного движения молекул. Наряду с этим движением возможны также вращение молекул и колебания атомов, входящих в состав молекул. Например, для двухатомной жесткой молекулы это вращение вокруг двух взаимно перпендикулярных осей, проходящих через центр масс молекулы. Эти виды движения также связаны с запасом энергии молекулы. Ее полную энергию позволяет определить, устанавливаемое статистической физикой, положение о равнораспределении энергии по степеням свободы молекулы. Такую гипотезу впервые высказал Больцман.
Числом степеней свободы механической системы называется количество независимых величин, с помощью которых может быть задано ее положение. Положение материальной точки определяется в пространстве значением трех координат, она имеет три степени свободы. Одноатомной молекуле следует приписывать три степени свободы, двухатомной: в зависимости от характера связи между атомами – либо три поступательных и две вращательных (жесткая связь), т.е. всего пять степеней; либо n = 3+2+1=6 с учетом колебательной степени свободы для нежесткой молекулы.
Поскольку ни одна из поступательных степеней свободы не имеет преимущества перед остальными, на каждую из них приходится в среднем одинаковая энергия 1/2kT. Согласно закону равнораспределения на каждую степень свободы молекулы приходится в среднем одинаковая энергия, равная 1/2kT. Согласно закону среднее значение энергии одной молекулы <ε> будет тем больше, (при одинаковой Т), чем сложнее молекула и чем больше у нее степеней свободы. При определении <ε> необходимо учесть, что колебательная степень свободы обладает вдвое большей «энергетической емкостью» по сравнению с поступательной или вращательной. Это объясняется тем, что колебательное движение связано с наличием кинетической и потенциальной энергии, поэтому на колебательную степень приходится (1/2kT+1/2kT) = kT, т.е., одна половинка в виде εкин , а вторая – εпост.
Т.о. средняя энергия молекулы: <ε> = (i/2)(kT),
Где i- сумма поступательных, вращательных и удвоенного числа колебательных степеней свободы молекул.
i = nпост+nвращ+2nкол , здесь n – число степеней свободы.
Для молекул с жесткой связью i совпадает с числом степеней свободы.
Внутренняя энергия и теплоемкость идеальных газов
В идеальном газе молекулы не взаимодействуют между собой, внутренняя энергия одного моля газа:
Uм = NA<ε> = i/2 NAkT = i/2 RT . Uм = i/2RT.
Если вспомнить, что по определению: Cv = δQ/dT = dU/dT, поскольку, δQ = dU+pdV, а для изохорного процесса dV = 0.
Тогда Cv = (i/2) R , а, учитывая, что Cр = Cv+R, получим:
Cр = (i+2)/2 R
Следовательно, коэффициент Пуассона γ = Cp/Cv = (i+2)/i , таким образом, γ определяется числом и характером степеней свободы молекулы.
Согласно этой ф-лы для одноатомной молекулы i = 3 и γ = 1,67; жесткой двухатомной i =5 и γ = 1,4; упругой двухатомной i = 7, а γ = 1,29. В области температур, близких к комнатной, это хорошо согласуется с опытом. Однако, в широком температурном интервале это не так. Оказывается, что вращательная и колебательная энергии молекулы квантованы. При низких Т вращательные и колебательные степени свободы не возбуждены. Молекула Н2 , например,ведет себя как одноатомная в этой области температур, i = 3. В области Т ≈ 500К вращательные степени «разморожены» <ε> > εвращ и молекула Н2 ведет себя как жесткая двухатомная с = 3+2 = 5. При Т>1000К энергии <ε> достаточно для возбуждения колебательной степени свободы, «включены» все степени свободы, i = 7.
Источник
Получим формулу для вычисления числа ударов молекул в единицу времени о единичную площадь стенки сосуда, в котором находится газ. Возьмем на стенке сосуда, бесконечно малую площадку dS, перпендикулярную оси Z системы координат XYZ ( рис. 8). На этой площадке, как на основании, построим бесконечно узкий цилиндр с осью, имеющей направление, определяемое сферическими углами j и J,идлина которой равна ndt, где n – скорость молекулы, dt – промежуток времени. Объем этого цилиндра , (1.4.1) а число молекул в нем dn = ndV, где n – концентрация молекул в сосуде. Из-за хаотичности движения не все dn молекул достигнут площадки dS за время dt. Ее достигнут только те из молекул, которые, во-первых, движутся в направлении к площадке dS и, во-вторых, имеют скорости, близкие к n, при этом за время dt они проходят расстояние ndt, равное длине образующей цилиндра, и достигают площадки dS. И если к моменту времени t эти молекулы находились в объеме dV цилиндра, тогда время от t до t + dt все они достигнут площадки dS. Найдем число таких молекул в объеме dV цилиндра. Р и с. 9 Обозначим через dnu число молекул в единице объема газа, которые имеют скорости, заключенные в интервале (u, u + du). Пусть среди этих молекул dnuJj молекул в единице объема имеют направления движения, определяемые сферическими углами, взятыми из интервалов (j,j + dj) и (J,J + dJ). Согласно формуле (1.3.5), количество таких молекул в единице объема газа равно (1.4.2) Число же указанных молекул в объеме dV рассматриваемого цилиндра (1.4.3) С учетом формул (1.4.1) и (1.4.2) выражение (1.4.3) примет вид (1.4.4) Таким образом, среди всех молекул, находящихся в объеме dV цилиндра, dnu,J,j молекул имеют близкие к u скорости, и их направления движения определяются углами, близкими к углам J и j. Однако из объема V, занимаемого газом, к площадке dS подлетают молекулы с других направлений и с иными скоростями. Чтобы учесть это, необходимо проинтегрировать выражение (1.4.4) по всем возможным углам jи J и скоростям u: (1.4.5) Сферический угол J в общем случае изменяется от 0 до p. В выражении (1.4.5) интегрирование по J произведено от 0 до p/2, так как при интегрировании по J в пределах от p/2 до p рассматриваемые молекулы, как легко видеть из рис. 9, будут иметь направление движения, соответствующее их удалению от площадки. Разделив обе части соотношения (1.4.5) на dtdS, получим (1.4.6) Таким образом, выражение (1.4.6) определяет число ударов молекул газа в единицу времени о единичную площадку стенки сосуда. Для выяснения смысла величины интеграла в выражении (1.4.6) умножим и разделим его на концентрацию молекул n = N/V. (1.4.7) Если обозначить через dNu число молекул в объеме V, которые имеют скорость от u до u + du, то dnu = dNu /V будет определять число таких молекул в единице объема газа. Величина же (1.4.8) при больших N представляет собой вероятность того, что случайно взятая в газе молекула будет иметь скорость, заключенную в интервале (u,u+du). Эта вероятность связана с функцией распределения (плотностью вероятности) следующим соотношением (см. А.23 прил. А): (1.4.9) Функция распределения молекул по скоростям F(u) является важнейшей характеристикой равновесного состояния газа. Ее явный вид будет получен далее из весьма общих предпосылок. С учетом формул (1.4.8) и (1.4.9) выражение (1.4.7) примет вид (1.4.10) Интеграл, стоящий в соотношении (1.4.10), представляет среднее значение скорости (см. формулу А.25 приложения А): (1.4.11) Поэтому (1.4.12) Как видно из выражения (1.4.12), число ударов молекул газа в единицу времени о единичную площадку пропорционально концентрации и средней скорости их движения, что находится в полном согласии с нашей интуицией. Пример 1. В космическом корабле находится воздух объема V с концентрацией n0, поддерживаемый при постоянной температуре. За бортом корабля вакуум. Найти зависимость концентрации молекул воздуха в корабле от времени, если в тонкой части его стенки образовалось малое отверстие площадью S? Решение. Пусть через время t после образования отверстия концентрация воздуха в корабле стала равной n(t). Тогда число молекул воздуха, влетающих в отверстие площади S за время dt (от момента t до t + dt), согласно формуле (1.4.5) dn= n(t)< u > Sdt. (1.4.13) Эти молекулы покидают кабину корабля. С другой стороны, это число молекул можно выразить иначе. Изменение концентрации воздуха в корабле за время dt (от t до t + dt) Откуда находим dn = -Vdn. (1.4.14) Сравнивая выражения (1.4.13) и (1.4.14), получаем (1.4.15) Проинтегрируем равенство (1.4.15): Откуда находим искомую зависимость концентрации от времени (1.4.16) Рекомендуемые страницы: Читайте также:
|
Источник

