Чем газ давит на стенки сосуда
В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатных состояния точно три?
На самом деле, есть еще четвертое – плазма. Звучит, как что-то из научной фантастики, но это просто ионизированный газ – газ, в котором помимо нейтральных частиц, есть еще и заряженные. Ионизаторы воздуха как раз строятся на принципе перехода из газообразного вещества в плазму.
Давление газа
Мы только что выяснили, что молекулы газа беспорядочно движутся. Во время движения они сталкиваются друг с другом, а также со стенками сосуда, в котором этот газ находится. Поскольку молекул много, ударов тоже много.
Например, в комнате, в которой вы сейчас находитесь, на каждый квадратный сантиметр за 1 с молекулами воздуха наносится столько ударов, что их количество выражается двадцати трехзначным числом.
Хотя сила удара отдельной молекулы мала, действие всех молекул о стенки сосуда приводит к значительному давлению. Это как если бы один комар толкал машину, то она бы и не сдвинулась с места, а вот пару сотен миллионов комаров вполне себе способны эту машину сдвинуть.
Зависимость давления от других величин
Зависимость давления от объема
В механике есть формула давления, которая показывает: давление прямо пропорционально силе и обратно пропорционально площади, на которую эта сила оказывается.
Давление
p = F/S
p – давление [Па]
F – сила [Н]
S – площадь [м^2]
То есть, если наши двести миллионов комаров будут толкать легковую машину, они распределятся по меньшей площади, чем если бы они толкали грузовой автомобиль (просто потому что легковая меньше грузовика).
Из формулы давления следует, что давление на легковой автомобиль будет больше из-за меньшей площади.
Давайте рассмотрим аналогичный пример с двумя сосудами разной площади.
Давление в левом сосуде будет больше, чем во втором, по аналогичной схеме – потому что площадь меньше. Но если площадь основания меньше, то и объем меньше. Это значит, что давление будет зависеть от объема следующим образом: чем больше объем, тем меньше давление – и наоборот.
При этом зависимость будет не линейная, а примет вот такой вид (при условии, что температура постоянна):
Такая зависимость называется законом Бойля-Мариотта.
Она экспериментально проверяется с помощью такой установки.
Объем шприца увеличивают с помощью насоса, а манометр измеряет давление. Эксперимент показывает, что при увеличении объема давление действительно уменьшается.
Зависимость давления от температуры
Рассмотрим зависимость давления газа от температуры при условии неизменного объема определенной массы газа. Эти исследования были впервые произведены в Жаком Шарлем.
Газ нагревался в большой колбе, соединенной с ртутным манометром в виде узкой изогнутой трубки. Пренебрегая ничтожным увеличением объема колбы при нагревании и незначительным изменением объема при смещении ртути в узкой манометрической трубке.
Таким образом, можно считать объем газа неизменным. Подогревая воду в сосуде, окружающем колбу, измеряли температуру газа по термометру, а соответствующее давление – по манометру.
Этот эксперимент показал, что давление газа увеличивается с увеличением температуры. Это связано с тем, что при нагревании молекулы газа движутся быстрее, из-за чего чаще ударяются о стенки сосуда.
С температурой все проще. Зависимость давления от температуры при постоянных объеме и массе будет линейно:
Эта зависимость называется законом Шарля.
Хранение и транспортировка газов
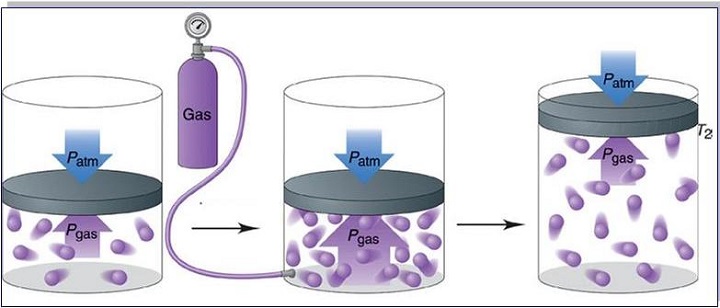
Если нужно перевезти значительное количество газа из одного места в другое, или когда газы необходимо длительно хранить – их помещают в специальные прочные металлические сосуды. Из-за того, что при уменьшении объема увеличивается давление, газ можно закачать в небольшой баллон, но он должен быть очень прочным.
Сосуды, предназначенные для транспортировки газов, выдерживают высокие давления. Поэтому с помощью специальных насосов (компрессоров) туда можно закачать значительные массы газа, которые в обычных условиях занимали бы в сотни раз больший объем.
Поскольку давление газов в баллонах даже при комнатной температуре очень велико, их ни в коем случае нельзя нагревать. Например, держать под прямыми лучами солнца или любым способом пытаться сделать в них отверстие, даже после использования.
Понимать и любить этот мир проще, когда разбираешься в физике. В этом помогут небезразличные и компетентные преподаватели онлайн-школы Skysmart.
Чтобы формулы и задачки ожили и стали более дружелюбными, на уроках мы разбираем примеры из обычной жизни современных подростков. Приходите на бесплатный вводный урок по физике и начните учиться в удовольствие уже завтра!
Источник
Давление газа – что это за параметр
Определение
Давление в физике представляет собой один из трех ключевых термодинамических макроскопических характеристик для измерения любой газовой системы.
Определение
Газ – это одно из четырех, включая плазму, агрегатных состояний материи, характеризующееся очень слабыми связями между составляющими его частицами, а также их большой подвижностью.
В газообразной среде частицы в определенной концентрации расположены не упорядоченно и перемещаются в хаотичном порядке в разных направлениях с одинаковой вероятностью. Подобное строение не позволяет газам сохранять стабильность объема и формы даже при малом внешнем силовом воздействии. Для любого газа, включая одноатомный, значение средней кинетической энергии его частиц в виде атомов и молекул будет превышать энергию межмолекулярного взаимодействия между ними.
Кроме того, расстояние, на которое удалены частицы, значительно превышает их собственные размеры. В том случае, когда молекулярными взаимодействиями и габаритами частиц допускается пренебрегать, газ считают идеальным. Для такой формы материи характерен только один тип внутреннего взаимодействия в виде упругих столкновений. Так как размер частиц пренебрежимо мал по сравнению с расстоянием, на которое они удалены, вероятность столкновений частиц между собой будет низкой.
Примечание
По этой причине в идеальной газовой среде можно наблюдать лишь столкновения частиц со стенками сосуда. Какой-либо реальный газ с хорошей точностью можно отнести к идеальному, когда их температура выше, чем комнатная, а давление несущественно больше, чем атмосферное.
Причина возникновения давления в газах
Давление газа нельзя объяснить теми же причинами, что и давление твердого тела на опору. Расстояние, на которое удалены молекулы газообразной среды, существенно больше. В результате хаотичного движения они сталкиваются между собой и со стенками сосуда, который они занимают. Давление газа на стенки сосуда и вызвано ударами его молекул.
Данный параметр увеличивается по мере того, как нарастает сила ударов молекул о стенки. Газ характеризуется одинаковым давлением во всех направлениях, которое является следствием хаотичного движения огромного числа молекул.
Примечание
Важно отметить, что газ оказывает давление на дно и стенки сосуда, объем которого он занимает, во всех направления равномерно. В связи с этим, воздушный шарик сохраняет форму, несмотря на то, что его оболочка достаточно эластична.
Перед тем как транспортировать или отправить на хранение газообразные вещества, их сильно сжимают. В этом случае давление газа увеличивается. Его помещают в специальные баллоны из стали высокой прочности. Такие емкости необходимы для хранения сжатого воздуха на подводных лодках и кислорода, предназначенного для сварки металлов.
Свойства давления газа:
- Если объем уменьшается, то давление газа возрастает, а во время увеличения объема, давление будет снижаться при постоянных величинах массы и температуры вещества.
- Газ, находящийся в закрытом сосуде, характеризуется давлением, которое возрастает по мере увеличения температуры вещества при условии постоянства его массы и объема.
- В том случае, когда масса газа увеличивается, его давление также будет возрастать и наоборот.

Запись формул для определения давления газа начинают с выяснения причин, по которым оно возникает в рассматриваемой системе. Исходя из физического смысла, давление представляет собой величину, равную отношению силы, перпендикулярно воздействующей на некоторое основание, к площади этого основания:
(P=frac{F}{S})
Как было отмечено ранее, для идеальной газовой системы характерен лишь один тип взаимодействия – это абсолютно упругие столкновения. В процессе частицы передают количество движения Δp стенкам сосуда в течение времени соударения Δt. В данном случае применим второй закон Ньютона:
(F*Δt = Δp)
Таким образом, конкретно сила F является причиной формирования давления на стенки сосуда. Данная величина F, производимая одной частицей, незначительна. Однако, когда количество частиц огромно, они в совокупности создают ощутимый эффект, проявляемый в виде наличия давления в сосуде.
Формула давления идеального газа из молекулярно-кинетической теории
Объяснение концепции идеального газа построено на основных положениях молекулярно-кинетической теории, которая вытекает из принципов статистической механики. Наука получила активное развитие во второй половине XIX, благодаря таким ученым, как Джеймс Максвелл и Людвиг Больцман. Основы дисциплины были заложены еще Бернулли в первой половине XVIII века.
Исходя из статистики Максвелла-Больцмана, все частицы в системе обладают разными скоростями движения. При этом можно наблюдать небольшой процент частиц со скоростями, приближенными к нулю, и малую долю частиц, обладающих огромной скоростью. Средняя квадратичная скорость в этом случае будет соответствовать некоторой величине, не изменяющейся с течением времени.
Средняя квадратичная скорость частиц однозначно характеризует температуру газа. Используя приближения молекулярно-кинетической теории в виде невзаимодействующих безразмерных и хаотично движущихся частиц, получают формулу для расчета давления газа в сосуде:
(P=frac{N*m*v^{2}}{3*V})
где N является количеством частиц в системе; V обозначает объем; v представляет собой среднюю квадратичную скорость; m является массой одной частицы.
При наличии указанных в формуле параметров, выраженных в единицах СИ, можно вычислить давление газа в сосуде.
Второй способ записи основного уравнения МКТ
Определение
В середине 30-х годов XIX столетия французскому инженеру Эмилю Клапейрону удалось обобщить накопленный до этого времени экспериментальный опыт изучения поведения газов во время разнообразных изопроцессов и получить формулу, которую в будущем назвали универсальным уравнением состояния идеального газа:
(P*V = n*R*T )
n является количеством вещества в молях; T представляет собой температуру по абсолютной шкале и обозначается в кельвинах.
Величина R является универсальной газовой постоянной. Этот термин был введен в уравнение русским химиком Д.И. Менделеевым. Исходя из этого, запись уравнения называют законом Клапейрона-Менделеева.
Определение
С помощью данного выражения можно определить формулу для расчета давления газа:
(P=frac{n*R*T}{V})
Полученное уравнение объясняет линейный рост давления при увеличении температуры в условиях стабильности объема. Если объем уменьшается с сохранением температуры, то давление увеличивается по гиперболе. Данные закономерности явления отражены в законах Гей-Люссака и Бойля-Мариотта.
Сравнивая представленное выражение с записью формулы, которая вытекает из положений молекулярно-кинетической теории, можно установить связь кинетической энергии одной частицы, либо системы в общем, и абсолютной температуры.
Важно отметить, что при расчетах с использованием формулы для Р, вытекающей из уравнения Клапейрона, связь с химическим составом газа отсутствует. Если давление определяют с помощью выражения, согласно понятию молекулярно-кинетической теории, то данную связь следует учитывать в виде параметра m. В том случае, когда определяют давление смеси идеальных газов, применяют один из следующих методов:
- Расчет средней массы частиц m, либо среднего значения молярной массы М с учетом атомных процентов каждого газа в смеси.
- Применение закона Дальтона, согласно которому давление в системе равно сумме парциальных давлений всех ее компонентов.
Пример
Предположим, что молекулы кислорода движутся со средней скоростью в 500 м/с. Требуется рассчитать, каково давление в сосуде, объем которого равен 10 литров, содержащий 2 моль молекул.
Для того чтобы найти ответ, следует применить формулу для Р из молекулярно-кинетической теории:
(P=frac{N*m*v^{2}}{3*V})
Из-за неизвестных параметров m и N требуется выполнить некоторые преобразования формулы:
(m=frac{M}{NA})
(n=frac{N}{NA})
(m*N= M*n)
(P=frac{M*n*v^{2}}{3*V})
Таким образом, удельный объем сосуда в кубических метрах равен 0,01. Молярная масса молекулы кислорода М составляет 0,032 кг/моль. Данные параметры можно подставить в уравнение вместе со скоростью и количеством вещества. Тогда Р = 533333 Па, что представляет собой давление в 5,3 атмосферы.
Источник
Давление газа
Details : О давлении on Tuesday, 02 December 2014 16:18 Hits: 11563
Где бы ни находился газ: в воздушном шаре, автомобильной шине, или металлическом баллоне – он заполняет собой весь объём сосуда, в котором находится.
Давление газа возникает совсем по другой причине, нежели давление твёрдого тела. Оно образуется в результате ударов молекул о стенки сосуда.
Давление газа на стенки сосуда
Двигаясь хаотично в пространстве, молекулы газа сталкиваются между собой и со стенками сосуда, в котором находятся. Сила удара одной молекулы мала. Но так как молекул очень много, и сталкиваются они с большой частотой, то, действуя сообща на стенки сосуда, они создают значительное давление. Если в газ помещено твёрдое тело, то оно также подвергается ударам молекул газа.
Проведём несложный опыт. Под колокол воздушного насоса поместим завязанный воздушный шарик, не полностью наполненный воздухом. Так как воздуха в нём мало, шарик имеет неправильную форму. Когда же мы начнём откачивать воздух из-под колокола, шарик станет раздуваться. Через некоторое время он примет форму правильного шара.
Что же произошло с нашим шариком? Ведь он был завязан, следовательно, количество воздуха в нём осталось прежним.
Всё объясняется довольно просто. Во время движения молекулы газа сталкиваются с оболочкой шарика снаружи и внутри него. Если воздух откачивается из колокола, молекул становится меньше. Уменьшается плотность, а значит и частота ударов молекул о наружную оболочку также уменьшается. Следовательно, давление снаружи оболочки падает. А так как внутри оболочки число молекул осталось прежним, то внутреннее давление превышает наружное. Газ давит изнутри на оболочку. И по этой причине она постепенно раздувается и принимает форму шара.
Закон Паскаля для газов
Молекулы газа очень подвижны. Благодаря этому давление они передают не только в направлении действия силы, вызывающей это давление, но и равномерно по всем направлениям. Закон о передаче давления сформулировал французский учёный Блез Паскаль: «Давление, производимое на газ или жидкость, передаётся без изменений в любую точку по всем направлениям». Этот закон называют основным законом гидростатики – науки о жидкости и газе в состоянии равновесия.
Закон Паскаля подтверждается опытом с прибором, который называют шаром Паскаля. Этот прибор представляет собой шар из твёрдого вещества с проделанными в нём крошечными отверстиями, соединённый с цилиндром, по которому двигается поршень. Шар заполняется дымом. При сжатии поршнем дым выталкивается из отверстий шара одинаковыми струйками.
Давление газа вычисляют по формуле:
где еlin – средняя кинетическая энергия поступательного движения молекул газа;
n – концентрация молекул
Парциальное давление. Закон Дальтона
На практике чаще всего нам приходится встречаться не с чистыми газами, а с их смесями. Мы дышим воздухом, являющимся смесью газов. Выхлопные газы автомобилей – тоже смесь. При сварке уже давно не применяется чистый углекислый газ. Вместо него также используют газовые смеси.
Газовой смесью называют смесь газов, не вступающих в химические реакции между собой.
Давление отдельного компонента газовой смеси называется парциальным давлением.
Если предположить, что все газы смеси являются идеальными газами, то давление смеси определяется законом Дальтона: «Давление смеси идеальных газов, не взаимодействующих химически, равно сумме парциальных давлений».
Его величина определяется по формуле:
Каждый газ в смеси создаёт парциальное давление. Его температура равна температуре смеси.
Давление газа можно изменить, меняя его плотность. Чем больше газа будет закачано в металлический баллон, тем больше в нём будет молекул, ударяющихся о стенки, и тем выше станет его давление. Соответственно, откачивая газ, мы разрежаем его, и давление снижается.
Но давление газа также можно изменить, изменив его объём или температуру, то есть, сжав газ. Сжатие проводят, воздействуя силой на газообразное тело. В результате такого воздействия уменьшается занимаемый им объём, повышается давление и температура.
Газ сжимается в цилиндре двигателя при движении поршня. На производстве высокое давление газа создают, сжимая его с помощью сложных устройств – компрессоров, которые способны создать давление до нескольких тысяч атмосфер.
Источник
Давление газа. 7 класс
Подробности Просмотров: 243
1. Каковы физические свойства газов?
Газы, в отличие от твердых тел и жидкостей, заполняют весь сосуд, в котором они находятся.
Газ оказывает давление на стенки, дно и крышку сосуда, в котором он находится.
2. Как объясняют давление газа?
Давление газа на дно и стенки сосуда (и на помещенное в газ тело) вызывается ударами множества молекул газа, которые беспорядочно движутся.
3. Почему газ производит одинаковое давление по всем направлениям?
Рассмотрим следующий опыт.
Под колоколом воздушного насоса лежит завязанный и слегка наполненный воздухом резиновый шарик неправильной формы.
Начинают насосом откачивать воздух из-под колокола.
Оболочка шарика раздувается и принимает форму шара. Почему?

Число молекул под колоколом уменьшается, а внутри шарика не меняется.
При этом число ударов молекул воздуха о внешние стенки шарика становится меньше, чем о внутренние.
Шарик раздувается, пока сила упругости резины не станет равной силе давления газа в шарике.
Оболочка шарика принимает форму шара, так как газ давит на стенки шара по всем направлениям одинаково.
Одинаковое давление газа по всем направлениям в сосуде является следствием беспорядочного движения молекул этого газа.
4 . Как меняется давление газа при сжатии или при расширении?
Если сжать какой-то объем газа (т.е. уменьшить его объем) так, чтобы масса его осталась прежней.
Тогда число молекул газа в единице объема и плотность газа увеличатся.
Число ударов молекул о стенки сосуда при этом возрастет, значит возрастет и давление газа.
Например:
Если вдвигать поршень в трубку, то объем воздуха в трубке уменьшится.
А резиновая пленка выгнется наружу, показывая, что давление воздуха в трубке увеличилось.

При вытягивании поршня из трубки объем воздуха увеличится.
Пленка прогнется внутрь трубки, показыва, что давление воздуха в трубке уменьшилось.
П ри уменьшении объема газа его давление увеличивается, а при увеличении объема давление уменьшается при условии, что масса и температура газа остаются неизменными.
5 . Как изменится давление газа при нагревании, если не менять объема сосуда?
Скорость движения молекул газа при нагревании увеличивается.
Двигаясь быстрее, молекулы начинают ударять о стенки сосуда чаще.
При этом каждый удар молекулы о стенку сосуда станет сильнее.
В результате стенки сосуда будут испытывать большее давление.
Давление газа тем больше, чем чаще и сильнее молекулы ударяют о стенки сосуда.
Давление газа в закрытом сосуде тем больше, чем выше температура газа, при условии, что масса газа и объем не изменяются.
6. Как хранят газы?
Для хранения и перевозки газов их сильно сжимают.
При этом давление газов возрастает.
Поэтому газы приходится заключать в специальные, очень прочные стальные баллоны.
В таких баллонах, например, содержат сжатый воздух в подводных лодках, кислород, используемый при сварке металлов,
Следующая страница – смотреть
Назад в “Оглавление” – смотреть
Источник
