Чем отличается насыщенный пар от ненасыщенного в закрытом сосуде

Прежде, чем отвечать на вопрос, поставленный в названии статьи, разберемся, что такое пар. Образы, возникающие у большинства людей при этом слове: кипящий чайник или кастрюля, парилка, горячий напиток и еще множество подобных картинок. Так или иначе, в наших представлениях присутствует жидкость и газообразная субстанция, поднимающаяся над ее поверхностью. Если вас попросят привести пример пара, вы сразу вспомните водяной пар, пары спирта, эфира, бензина, ацетона.

Существует еще одно слово для обозначения газообразных состояний – газ. Здесь мы обычно вспоминаем кислород, водород, азот и другие газы, не ассоциируя их с соответствующими жидкостями. При этом хорошо известно, что они существуют и в жидком состоянии. На первый взгляд различия заключаются в том, что пар соответствует естественным жидкостям, а газы надо сжижать специально. Однако это не совсем верно. Более того, образы, возникающие при слове пар – паром не являются. Чтобы дать более точный ответ, разберемся, как возникает пар.
Чем отличается пар от газа?
Агрегатное состояние вещества задается температурой, точнее соотношением между энергией, с которой взаимодействуют его молекулы и энергией их теплового хаотического движения. Приближенно, можно считать, что если энергия взаимодействия значительно больше – твердое состояние, если значительно больше энергия теплового движения — газообразное, если энергии сравнимы – жидкое.
Молекула газа
Получается, чтобы молекула могла оторваться от жидкости и участвовать в образовании пара, величина тепловой энергии должна быть больше энергии взаимодействия. Как это может произойти? Средняя скорость теплового движения молекул равна определенному значению, зависящему от температуры. Однако индивидуальные скорости молекул различны: большая их часть обладает скоростями близкими к среднему значению, но некоторая часть имеет скорости больше средней, некоторая — меньше.
Более быстрые молекулы могут иметь тепловую энергию большую, чем энергия взаимодействия, а значит, попав на поверхность жидкости, способны оторваться от нее, образуя пар. Такой способ парообразования называется испарением. Из-за того же распределения скоростей существует и противоположный процесс — конденсация: молекулы из пара переходят в жидкость. Кстати образы, которые обычно возникают при слове пар, это не пар, а результат противоположного процесса — конденсации. Пар увидеть нельзя.

Испарение
Пар при определенных условиях может стать жидкостью, но для этого его температура не должна превышать определенного значения. Это значение называется критической температурой. Пар и газ — газообразные состояния, отличающиеся температурой, при которой они существуют. Если температура не превышает критической — пар, если превышает – газ. Если поддерживать температуру постоянной и уменьшать объем, пар — сжижается, газ – не сжижается.
Что такое пар насыщенный и ненасыщенный
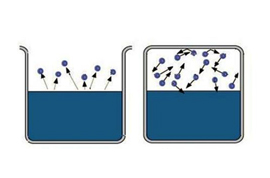
Само слово «насыщенный» несет определенную информацию, трудно насытить большую область пространства. Значит, чтобы получить насыщенный пар, надо ограничить пространство, в котором находится жидкость. Температура при этом должна быть меньше критической для данного вещества. Теперь испарившиеся молекулы остаются в пространстве, где находится жидкость. Сначала большинство переходов молекул будет происходить из жидкости, при этом плотность пара будет повышаться. Это в свою очередь вызовет большее число обратных переходов молекул в жидкость, что увеличит скорость процесса конденсации.
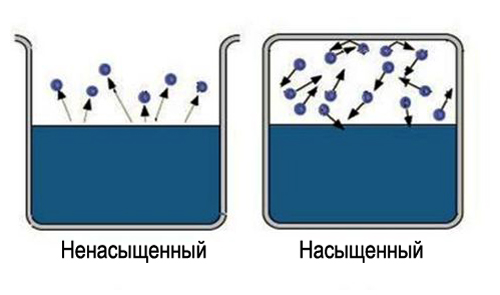
Наконец, устанавливается состояние, для которого среднее число молекул, переходящих из одной фазы в другую будет равным. Такое состояние называется динамическое равновесие. Для этого состояния характерно одинаковое изменение величины и направления скоростей испарения и конденсации. Это состояние соответствует насыщенному пару. Если состояние динамического равновесия не достигнуто, это соответствует ненасыщенному пару.
Начинают изучение какого-то объекта, всегда с самой простой его модели. В молекулярно-кинетической теории это — идеальный газ. Основные упрощения здесь — пренебрежение собственным объемом молекул и энергией их взаимодействия. Оказывается, подобная модель вполне удовлетворительно описывает ненасыщенный пар. Причем чем менее он насыщен, тем правомернее ее применение. Идеальный газ — это газ, он не может стать ни паром, ни жидкостью. Следовательно, для насыщенного пара подобная модель не является адекватной.
Основные отличия насыщенного пара от ненасыщенного
- Насыщенный означает, что данный объект имеет самое большое из возможных значений некоторых параметров. Для пара — это плотность и давление. Эти параметры для ненасыщенного пара имеют меньшие значения. Чем дальше пар от насыщения, тем меньше эти величины. Одно уточнение: температура сравнения должна быть постоянной.
- Для ненасыщенного пара выполняется закон Бойля-Мариотта: если температура и масса газа постоянны, увеличение или уменьшение объема, вызывает уменьшение или увеличение давления во столько же раз, давление и объем — связаны обратно пропорциональной зависимостью. Из максимальности плотности и давления при постоянной температуре вытекает их независимость от объема насыщенного пара, получается, что для насыщенного пара давление и объем — не зависят друг от друга.
- Для ненасыщенного пара плотность не зависит от температуры, и если объем сохраняется, не меняется и значение плотности. Для насыщенного пара при сохранении объема плотность изменяется, если изменяется температура. Зависимость в данном случае прямая. Если увеличивается температура, увеличивается и плотность, если температура уменьшается, так же изменяется плотность.
- Если объем постоянен, ненасыщенный пар ведет себя в соответствии с законом Шарля: при увеличении температуры во столько же раз увеличивается и давление. Такая зависимость называется линейной. У насыщенного пара при увеличении температуры давление возрастает быстрее, чем у ненасыщенного пара. Зависимость имеет экспоненциальный характер.
Подводя итог, можно отметить значительные различия свойств сравниваемых объектов. Основное отличие в том, что пар, в состоянии насыщения, нельзя рассматривать в отрыве от его жидкости. Это двухкомпонентная система, к которой нельзя применять большинство газовых законов.
Источник
Жидкости имеют свойство испаряться. Если бы мы капнули на стол по капле воды, эфира и ртути (только не делайте этого в домашних условиях!), смогли бы наблюдать, как постепенно капли исчезают – испаряются. Одни жидкости испаряются быстрее, другие медленнее. Процесс испарения жидкости еще называется парообразованием. А обратный процесс превращения пара в жидкость – конденсацией.

Эти два процесса иллюстрируют фазовый переход – процесс перехода веществ из одного агрегатного состояния в другое:
- испарение (переход из жидкого в газообразное состояние);
- конденсация (переход из газообразного состояния в жидкое);
- десублимация (переход из газообразного состояния в твердое, минуя жидкую фазу);
- возгонка, она же сублимация (переход из твердого в газообразное состояние, минуя жидкое).
Сейчас, к слову, подходящий сезон, чтобы наблюдать процесс десублимации в природе: иней и изморозь на деревьях и предметах, морозные узоры на окнах – ее результат.
Как образуется насыщенный и ненасыщенный пар
Но вернемся к парообразованию. Мы продолжим экспериментировать и нальем жидкость – воду, например, в открытый сосуд, а к нему подсоединим манометр. Невидимое глазу, в сосуде происходит испарение. Все молекулы жидкости находятся в непрерывном движении. Некоторые движутся так быстро, что их кинетическая энергия оказывается сильнее той, что связывает молекулы жидкости вместе.
Покинув жидкость, эти молекулы продолжают хаотически двигаться в пространстве, подавляющее их большинство рассеивается в нем – так образуется ненасыщенный пар. Лишь небольшая их часть возвращается обратно в жидкость.
Если закроем сосуд, молекул пара постепенно будет становиться все больше. И все больше их будет возвращаться в жидкость. При этом будет увеличиваться давление пара. Это зафиксирует подсоединенный к сосуду манометр.
Спустя какое-то время число молекул, вылетающих из жидкости и возвращающихся в нее, сравняется. Давление пара перестанет изменяться. В результате насыщения пара установится термодинамическое равновесие системы жидкость-пар. То есть испарение и конденсация будут равны.
Свойства насыщенного пара
Чтобы их проиллюстрировать наглядно, используем еще один эксперимент. Призовите всю силу своего воображения, чтобы представить его. Итак, возьмем ртутный манометр, состоящий из двух колен – сообщающихся трубок. В оба налита ртуть, один конец открыт, второй запаян и над ртутью в нем находится еще некоторое количество эфира и его насыщенного пара. Если опускать и поднимать не запаянное колено, уровень ртути в запаянном будет также опускаться и подниматься.
При этом будет изменяться и количество (объем) насыщенного пара эфира. Разность уровней ртутных столбиков в обоих коленах манометра показывает давление насыщенного пара эфира. Оно будет сохраняться неизменным все время.
Отсюда вытекает свойство насыщенного пара – его давление не зависит от занимаемого им объема. Давление насыщенных паров различных жидкостей (воды и эфира, к примеру) разное при одинаковой температуре.
Однако температура насыщенного пара имеет значение. Чем выше температура, тем выше и давление. Давление насыщенного пара с увеличением температуры возрастает быстрее, чем это происходит с ненасыщенным паром. Температура и давление ненасыщенного пара связаны линейной зависимостью.
Можно провести еще один любопытный опыт. Взять пустую колбу без паров жидкости, закрыть ее и подсоединить манометр. Постепенно, по капле, подавать внутрь колбы жидкость. По мере поступления жидкости и ее испарения устанавливается давление насыщенного пара, наибольшее для данной жидкости при данной температуре.
Еще о температуре и насыщенном паре
Температура пара влияет и на скорость конденсации. Так же, как температура жидкости определяет скорость испарения – число молекул, которые вылетают с поверхности жидкости в единицу времени, другими словами.
У насыщенного пара его температура равна температуре жидкости. Чем выше температура насыщенного пара, тем выше его давление и плотность, ниже плотность жидкости. При достижении критической для вещества температуры плотность жидкости и пара одинаковая. Если температура пара выше критической для вещества температуры, физические различия между жидкостью и насыщенным паром стираются.
Определение давления насыщенного пара в смеси с другими газами
Мы сказали о неизменном при постоянной температуре давлении насыщенного пара. Мы определяли давление в «идеальных» условиях: когда в сосуде или колбе присутствуют жидкость и пар только одного вещества. Рассмотрим еще эксперимент, в котором молекулы вещества рассеяны в пространстве в смеси с другими газами.
Для этого возьмем два открытых стеклянных цилиндра и поместим в оба закрытые сосуды с эфиром. Как водится, подсоединим манометры. Один сосуд с эфиром раскрываем, после чего манометр фиксирует повышение давления. Разность между этим давлением и давлением в цилиндре с закрытым сосудом эфира и позволяет узнать давление насыщенного пара эфира.
О давлении и кипении
Испарение возможно не только с поверхности жидкости, но и в ее объеме – тогда его называют кипением. При повышении температуры жидкости образуются пузырьки пара. Когда давление насыщенного пара больше либо равно давлению газа в пузырьках, жидкость испаряется внутрь пузырьков. А те расширяются и поднимаются на поверхность.
Жидкости кипят при разных температурах. В обычных условиях вода закипает при 1000С. Но с изменением атмосферного давления меняется и температура кипения. Так, в горах, где воздух сильно разрежен и атмосферное давление ниже, по мере подъема в горы снижается и температура кипения воды.
Кстати, в герметично закрытом сосуде кипение невозможно вообще.

Еще один пример взаимосвязи давления пара и испарения демонстрирует такая характеристика содержания паров воды в воздухе, как относительная влажность воздуха. Она представляет собой отношение парциального давления паров воды к давлению насыщенного пара и определяется по формуле: φ = р/ро * 100%.
При понижении температуры воздуха концентрация водяных паров в нем повышается, т.е. они становятся более насыщенными. Эта температура называется точкой росы.
Подведем итоги
На несложных примерах мы разобрали суть процесса испарения и образующиеся в его результате ненасыщенный и насыщенный пар. Все эти явления вы ежедневно можете наблюдать вокруг себя: например, видеть высыхающие после дождя лужи на улицах или запотевшее от пара зеркало в ванной комнате. В ванной вы даже можете наблюдать, как сначала происходит парообразование, а потом конденсация скопившейся на зеркале влаги обратно в воду.
Вы также можете использовать эти знания, чтобы сделать свою жизнь более комфортной. Например, зимой во многих квартирах воздух очень сухой, и это плохо сказывается на самочувствии. Вы можете использовать современный прибор-увлажнитель, чтобы сделать его более влажным. Или по старинке поставить в комнате емкость с водой: постепенно испаряясь, вода насытит воздух своими парами.
Поделитесь ссылкой на эту статью со своими одноклассниками и друзьями. Сделать это совсем не сложно – специальные кнопки есть под текстом. А кто-нибудь даже скажет вам спасибо за полезную информацию.
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Источник
Íàñûùåííûé ïàð.
Ïðè èñïàðåíèè îäíîâðåìåííî ñ ïåðåõîäîì ìîëåêóë èç æèäêîñòè â ïàð ïðîèñõîäèò è îáðàòíûé ïðîöåññ. Áåñïîðÿäî÷íî äâèãàÿñü íàä ïîâåðõíîñòüþ æèäêîñòè, ÷àñòü ìîëåêóë, ïîêèíóâøèõ åå, ñíîâà âîçâðàùàåòñÿ â æèäêîñòü.
Åñëè èñïàðåíèå ïðîèñõîäèò â çàêðûòîì ñîñóäå, òî ñíà÷àëà ÷èñëî ìîëåêóë, âûëåòåâøèõ èç æèäêîñòè, áóäåò áîëüøå ÷èñëà ìîëåêóë, âîçâðàòèâøèõñÿ îáðàòíî â æèäêîñòü. Ïîýòîìó ïëîòíîñòü ïàðà â ñîñóäå áóäåò ïîñòåïåííî óâåëè÷èâàòüñÿ. Ñ óâåëè÷åíèåì ïëîòíîñòè ïàðà óâåëè÷èâàåòñÿ è ÷èñëî ìîëåêóë, âîçâðàùàþùèõñÿ â æèäêîñòü. Äîâîëüíî ñêîðî ÷èñëî ìîëåêóë, âûëåòàþùèõ èç æèäêîñòè, ñòàíåò ðàâíûì ÷èñëó ìîëåêóë ïàðà, âîçâðàùàþùèõñÿ îáðàòíî â æèäêîñòü. Ñ ýòîãî ìîìåíòà ÷èñëî ìîëåêóë ïàðà íàä æèäêîñòüþ áóäåò ïîñòîÿííûì. Äëÿ âîäû ïðè êîìíàòíîé òåìïåðàòóðå ýòî ÷èñëî ïðèáëèçèòåëüíî ðàâíî 1022 ìîëåêóë çà 1 ñ íà 1 ñì2 ïëîùàäè ïîâåðõíîñòè. Íàñòóïàåò òàê íàçûâàåìîå äèíàìè÷åñêîå ðàâíîâåñèå ìåæäó ïàðîì è æèäêîñòüþ.
Ïàð, íàõîäÿùèéñÿ â äèíàìè÷åñêîì ðàâíîâåñèè ñî ñâîåé æèäêîñòüþ, íàçûâàåòñÿ íàñûùåííûì ïàðîì.
Ýòî îçíà÷àåò, ÷òî â äàííîì îáúåìå ïðè äàííîé òåìïåðàòóðå íå ìîæåò íàõîäèòüñÿ áîëüøåå êîëè÷åñòâî ïàðà.
Ïðè äèíàìè÷åñêîì ðàâíîâåñèè ìàññà æèäêîñòè â çàêðûòîì ñîñóäå íå èçìåíÿåòñÿ, õîòÿ æèäêîñòü ïðîäîëæàåò èñïàðÿòüñÿ. Òî÷íî òàê æå íå èçìåíÿåòñÿ è ìàññà íàñûùåííîãî ïàðà íàä ýòîé æèäêîñòüþ, õîòÿ ïàð ïðîäîëæàåò êîíäåíñèðîâàòüñÿ.
Äàâëåíèå íàñûùåííîãî ïàðà .
Ïðè ñæàòèè íàñûùåííîãî ïàðà, òåìïåðàòóðà êîòîðîãî ïîääåðæèâàåòñÿ ïîñòîÿííîé, ðàâíîâåñèå ñíà÷àëà íà÷íåò íàðóøàòüñÿ: ïëîòíîñòü ïàðà âîçðàñòåò, è âñëåäñòâèå ýòîãî èç ãàçà â æèäêîñòü áóäåò ïåðåõîäèòü áîëüøå ìîëåêóë, ÷åì èç æèäêîñòè â ãàç; ïðîäîëæàòüñÿ ýòî áóäåò äî òåõ ïîð, ïîêà êîíöåíòðàöèÿ ïàðà â íîâîì îáúåìå íå ñòàíåò ïðåæíåé, ñîîòâåòñòâóþùåé êîíöåíòðàöèè íàñûùåííîãî ïàðà ïðè äàííîé òåìïåðàòóðå (è ðàâíîâåñèå âîññòàíîâèòñÿ). Îáúÿñíÿåòñÿ ýòî òåì, ÷òî ÷èñëî ìîëåêóë, ïîêèäàþùèõ æèäêîñòü çà åäèíèöó âðåìåíè, çàâèñèò òîëüêî îò òåìïåðàòóðû.
Èòàê, êîíöåíòðàöèÿ ìîëåêóë íàñûùåííîãî ïàðà ïðè ïîñòîÿííîé òåìïåðàòóðå íå çàâèñèò îò åãî îáúåìà.
Ïîñêîëüêó äàâëåíèå ãàçà ïðîïîðöèîíàëüíî êîíöåíòðàöèè åãî ìîëåêóë, òî è äàâëåíèå íàñûùåííîãî ïàðà íå çàâèñèò îò çàíèìàåìîãî èì îáúåìà. Äàâëåíèå ð0, ïðè êîòîðîì æèäêîñòü íàõîäèòñÿ â ðàâíîâåñèè ñî ñâîèì ïàðîì, íàçûâàþò äàâëåíèåì íàñûùåííîãî ïàðà.
Ïðè ñæàòèè íàñûùåííîãî ïàðà áîëüøàÿ åãî ÷àñòü ïåðåõîäèò â æèäêîå ñîñòîÿíèå. Æèäêîñòü çàíèìàåò ìåíüøèé îáúåì, ÷åì ïàð òîé æå ìàññû.  ðåçóëüòàòå îáúåì ïàðà ïðè íåèçìåííîé åãî ïëîòíîñòè óìåíüøàåòñÿ.
Çàâèñèìîñòü äàâëåíèÿ íàñûùåííîãî ïàðà îò òåìïåðàòóðû.
Äëÿ èäåàëüíîãî ãàçà ñïðàâåäëèâà ëèíåéíàÿ çàâèñèìîñòü äàâëåíèÿ îò òåìïåðàòóðû ïðè ïîñòîÿííîì îáúåìå. Ïðèìåíèòåëüíî ê íàñûùåííîìó ïàðó ñ äàâëåíèåì ð0 ýòà çàâèñèìîñòü âûðàæàåòñÿ ðàâåíñòâîì:
p0=nkT.
Òàê êàê äàâëåíèå íàñûùåííîãî ïàðà íå çàâèñèò îò îáúåìà, òî, ñëåäîâàòåëüíî, îíî çàâèñèò òîëüêî îò òåìïåðàòóðû.
Ýêñïåðèìåíòàëüíî îïðåäåëåííàÿ çàâèñèìîñòü p0(T) îòëè÷àåòñÿ îò çàâèñèìîñòè (p0=nkT) äëÿ èäåàëüíîãî ãàçà.

Ñ óâåëè÷åíèåì òåìïåðàòóðû äàâëåíèå íàñûùåííîãî ïàðà ðàñòåò áûñòðåå, ÷åì äàâëåíèå èäåàëüíîãî ãàçà (ó÷àñòîê êðèâîé À íà ðèñóíêå). Ýòî ñòàíîâèòñÿ îñîáåííî î÷åâèäíûì, åñëè ïðîâåñòè èçîõîðó ÷åðåç òî÷êó A (ïóíêòèðíàÿ ïðÿìàÿ). Ïðîèñõîäèò ýòî ïîòîìó, ÷òî ïðè íàãðåâàíèè æèäêîñòè ÷àñòü åå ïðåâðàùàåòñÿ â ïàð, è ïëîòíîñòü ïàðà ðàñòåò. Ïîýòîìó, ñîãëàñíî ôîðìóëå (p0=nkT), äàâëåíèå íàñûùåííîãî ïàðà ðàñòåò íå òîëüêî â ðåçóëüòàòå ïîâûøåíèÿ òåìïåðàòóðû æèäêîñòè, íî è âñëåäñòâèå óâåëè÷åíèÿ êîíöåíòðàöèè ìîëåêóë (ïëîòíîñòè) ïàðà. Ãëàâíîå ðàçëè÷èå â ïîâåäåíèè èäåàëüíîãî ãàçà è íàñûùåííîãî ïàðà çàêëþ÷àåòñÿ â èçìåíåíèè ìàññû ïàðà ïðè èçìåíåíèè òåìïåðàòóðû ïðè íåèçìåííîì îáúåìå (â çàêðûòîì ñîñóäå) èëè ïðè èçìåíåíèè îáúåìà ïðè ïîñòîÿííîé òåìïåðàòóðå. Ñ èäåàëüíûì ãàçîì íè÷åãî ïîäîáíîãî ïðîèñõîäèòü íå ìîæåò (ìîëåêóëÿðíî-êèíåòè÷åñêàÿ òåîðèÿ èäåàëüíîãî ãàçà íå ïðåäóñìàòðèâàåò ôàçîâîãî ïåðåõîäà ãàçà â æèäêîñòü).
Ïîñëå èñïàðåíèÿ âñåé æèäêîñòè ïîâåäåíèå ïàðà áóäåò ñîîòâåòñòâîâàòü ïîâåäåíèþ èäåàëüíîãî ãàçà (ó÷àñòîê ÂÑ êðèâîé íà ðèñóíêå âûøå).
Íåíàñûùåííûé ïàð.
Åñëè â ïðîñòðàíñòâå, ñîäåðæàùåì ïàðû êàêîé-ëèáî æèäêîñòè, ìîæåò ïðîèñõîäèòü äàëüíåéøåå èñïàðåíèå ýòîé æèäêîñòè, òî ïàð, íàõîäÿùèéñÿ â ýòîì ïðîñòðàíñòâå, ÿâëÿåòñÿ íåíàñûùåííûì.
Ïàð, íå íàõîäÿùèéñÿ â ñîñòîÿíèè ðàâíîâåñèÿ ñî ñâîåé æèäêîñòüþ, íàçûâàåòñÿ íåíàñûùåííûì.
Íåíàñûùåííûé ïàð ìîæíî ïðîñòûì ñæàòèåì ïðåâðàòèòü â æèäêîñòü. Êàê òîëüêî ýòî ïðåâðàùåíèå íà÷àëîñü, ïàð, íàõîäÿùèéñÿ â ðàâíîâåñèè ñ æèäêîñòüþ, ñòàíîâèòñÿ íàñûùåííûì.
Источник
Согласно молекулярно-кинетической теории в твердых и жидких веществах всегда присутствует некоторое количество молекул, имеющих большие скорости, которые позволяет им покинуть пределы основного вещества, то есть испариться. Таким образом молекулы переходят в газообразное состояние и становятся паром. Различают насыщенные и ненасыщенные пары. Разберемся чем они отличаются друг от друга.

Процесс образования пара
Температура вещества определяется средней кинетической энергией молекул. Но при любой температуре находятся “быстрые” молекулы, имеющие скорости (и кинетическую энергию) на много больше средней. Это позволяет им преодолеть силу притяжения соседних молекул и “вырваться наружу”, то есть превратиться в пар и перейти в газообразное состояние. Доля таких молекул от общего их количества определяется распределением Максвелла.
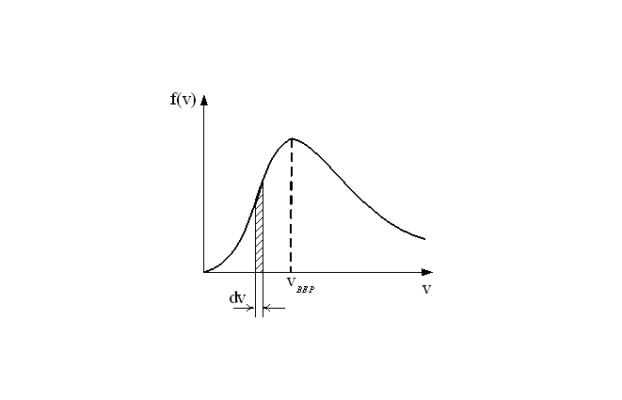
Рис. 1. Распределения Максвелла для скоростей и кинетических энергий молекул идеального газа.
Часть быстрых молекул пара, сталкиваясь с другими молекулами и стенками сосуда, теряет скорость, “охлаждается”, и возвращается обратно в жидкость. Обратный процесс перехода из парообразного состояния в жидкое называется конденсацией.
Эксперименты показывают, что для превращения жидкости в пар при постоянной температуре необходимо передать ей количество теплоты Q, пропорциональное массе m жидкости, превратившейся в пар:
$ Q = r * m $ (1),
где: коэффициент пропорциональности r — удельная теплота парообразования, (Дж/кг). Удельная теплота парообразования указывает, какое количество теплоты требуется для превращения 1 кг жидкости в пар при постоянной температуре.
Что такое насыщенный пар
Наблюдения показывают, что при увеличении температуры скорость испарения возрастает. Лужи после дождя исчезают гораздо быстрее, когда есть ветер. Это говорит о том, что скорость испарения увеличивается, если образовавшийся пар удаляется с границы раздела жидкость – пар. Если пар совсем не удалять, например, плотно закупорить сосуд пробкой, то испарение прекратится. То есть установится равновесная ситуация — число частиц, покидающих вещество за единицу времени, будет равно числу частиц возвращающихся обратно за тот же промежуток времени. При этом говорят, что система вещество-пар находится в динамическом равновесии, а пар называется насыщенным. Само название говорит о том, что в данном объеме достигнут предел по количеству пара.

Рис. 2. Динамическое равновесия жидкости и пара.
Что такое ненасыщенный пар
Если число частиц, покидающих вещество за единицу времени больше числа частиц возвращающихся обратно за то же время, то пар называется ненасыщенным. Значит, когда пар ненасыщен, процесс испарения идет не останавливаясь, и масса вещества в жидкой (или твердой) фазе уменьшается, а количество ненасыщенного пара увеличивается. Ситуация становится неравновесной: динамическое равновесие отсутствует.
Не следует путать водяной пар и туман, хотя и тот, и другой состоят из молекул воды. Туман образуется в атмосфере в результате конденсации водяных паров, которые собираются в мелкие водяные капли. При этом воздух утрачивает свою оптическую прозрачность. Водяной пар образовывается над поверхностями водоемов, оставаясь абсолютно прозрачным.

Рис. 3. Пар, облака и туман.
Что мы узнали?
Итак, мы узнали, чем отличается насыщенный пар от ненасыщенного. Если число частиц, покидающих вещество за единицу времени больше числа частиц возвращающихся обратно за то же время, то пар называется ненасыщенным. Когда число молекул, покидающих вещество за единицу времени равно числу молекул возвращающихся обратно за то же время, то этом случае пар называется насыщенным.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
Средняя оценка: 4.7. Всего получено оценок: 227.
Источник
