Чему равен газ в закрытом сосуде
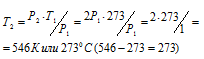
5.4. Практическое применение уравнения состояния идеального газа
5.4.2. Уравнение состояния для газа в закрытом сосуде
При рассмотрении идеального газа, находящегося в закрытом сосуде (баллоне), необходимо учитывать, что изменение термодинамических параметров происходит при постоянной массе газа.
Для идеального газа, находящегося в закрытом сосуде, необходимо учитывать следующее:
- масса газа, находящегося в закрытом сосуде, вследствие изменения его термодинамических параметров не изменяется:
m = const;
- объем газа, заполняющего сосуд определенного объема, также фиксирован: V = const;
- постоянными также остаются следующие параметры газа:
ρ = const; ν = const; n = const;
где ρ — плотность газа; ν — количество вещества (газа); n — концентрация молекул (атомов) газа.
Для идеального газа, находящегося в закрытом сосуде и изменяющего свое состояние, уравнение Менделеева — Клапейрона записывается в виде системы (рис. 5.8):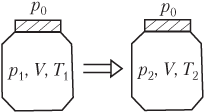
p1V=νRT1,p2V=νRT2,}
где p
1, T
1 — давление и температура газа в начальном состоянии; p
2, T
2 — давление и температура газа в конечном состоянии; V — объем баллона; ν — количество газа; R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К).
Термин избыточное давление, встречающийся в задачах об идеальном газе в закрытом сосуде (баллоне), означает абсолютную разность между давлением газа, находящегося в сосуде, и давлением на стенки сосуда снаружи:
p
изб = |p − p
0|,
где p — давление газа, находящегося внутри сосуда; p
0 — давление (атмосферное либо гидростатическое) на стенки сосуда снаружи.
Пример 13. Баллон рассчитан на максимальное избыточное давление 150 МПа. В него накачали газ при температуре 300 К до давления 120 МПа. Постепенно нагревая газ, баллон погружают в воду плотностью 1000 кг/м3 на глубину 1000 м. До какой максимальной температуры можно нагреть газ в баллоне, чтобы он не взорвался?
Решение. Запишем уравнение Менделеева — Клапейрона для двух состояний газа, находящегося в баллоне:
- в начале нагревания
p
1V = νRT
1;
- в конце нагревания
p
2V = νRT
2;
где p
1 — первоначальное давление газа в баллоне; p
2 — давление газа в баллоне в конце нагревания; V — объем газа (баллона), V = const; ν — количество вещества (газа) в баллоне; R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К); T
1 — температура газа в начале процесса; T
2 — температура газа в конце процесса.
Отношение уравнений
p1Vp2V=νRT1νRT2
позволяет определить давление газа в конце процесса:
p2=p1T2T1.
В условии задачи задано максимальное избыточное давление, определяемое формулой
pизбmax=|p2−p0|,
где p
0 — давление снаружи баллона; p
2 — давление газа внутри баллона.
При погружении баллона в воду с одновременным нагреванием указанные давления снаружи и внутри баллона определяются следующими формулами:
- снаружи (сумма атмосферного и гидростатического давлений) —
p
0 = p
атм + p
гидр = p
атм + ρ0gh,
где p
атм — атмосферное давление; p
гидр — гидростатическое давление, p
гидр = ρ0gh; ρ0 — плотность воды; g — модуль ускорения свободного падения; h — глубина погружения баллона;
- внутри (давление газа) —
p2=p1T2T1,
где T
2 — максимальная температура газа (искомая величина).
Подстановка выражений для давлений внутри и снаружи баллона в формулу для избыточного давления дает
pизбmax=|p1T2T1−ρ0gh−pатм|≈|p1T2T1−ρ0gh|,
так как p
атм << ρ0gh, p
атм << p
2.
Данное уравнение содержит модуль разности, что приводит к двум независимым уравнениям:
pизбmax=p1T2T1−ρ0gh, pизбmax=ρ0gh−p1T2T1,
из которых следуют две формулы для расчета искомой величины:
T2=T1⋅ρ0gh+pизбmaxp1, T2=T1⋅ρ0gh−pизбmaxp1.
Максимальному значению искомой температуры соответствует значение, рассчитанное по первой формуле:
T2=300⋅1000⋅10⋅1000+150⋅106120⋅106=400 К.
Чтобы баллон не взорвался, его можно погрузить на заданную глубину, одновременно нагревая до температуры 400 К.
Пример 14. Бутылка емкостью 0,75 л выдерживает максимальное избыточное давление 150 кПа. Из бутылки откачивают воздух и запечатывают некоторое количество твердого углекислого газа с молярной массой 44,0 г/моль. Атмосферное давление равно 100 кПа. Считая, что объем твердого углекислого газа пренебрежимо мал по сравнению с объемом бутылки, найти его максимальную массу, которая не вызовет взрыва бутылки при температуре 300 К?
Решение. Запишем уравнение Менделеева — Клапейрона для углекислого газа, находящегося в бутылке, после его превращения в газообразное состояние:
pV=mMRT,
где p — давление углекислого газа в бутылке; V — объем газа (бутылки); m — масса углекислого газа в бутылке; M — молярная масса углекислого газа; R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К); T — температура газа.
Записанное уравнение позволяет получить выражение для расчета давления газа внутри бутылки:
p=mRTVM.
В условии задачи задано максимальное избыточное давление, определяемое формулой
pизбmax=|p−p0|,
где p
0 — давление снаружи бутылки.
Указанные давления снаружи и внутри бутылки определяются следующим образом:
- снаружи (атмосферное давление) — p
0; - внутри (давление углекислого газа) —
p=mRTVM,
где m соответствует искомой величине — максимальной массе углекислого газа.
Подстановка выражений для давлений внутри и снаружи баллона в формулу для избыточного давления дает
pизбmax=|mRTVM−p0|.
Данное уравнение содержит модуль разности, что приводит к двум независимым уравнениям:
pизбmax=mRTVM−p0, pизбmax=p0−mRTVM,
из которых следуют две формулы для расчета искомой величины:
m=VM(p0+pизбmax)RT, m=VM(p0−pизбmax)RT.
Максимальному значению искомой массы соответствует значение, рассчитанное по первой формуле:
m=0,75⋅10−3⋅44,0⋅10−3(100+150)⋅1038,31⋅300=3,3⋅10−3 кг=3,3 г.
Чтобы бутылка не взорвалась, в нее можно запечатать не более 3,3 г твердого углекислого газа.
Пример 15. В наличии имеется неограниченное количество баллонов объемом по 4,0 л, заполненных некоторым идеальным газом до давления 500 кПа. Баллоны предназначены для наполнения газом оболочки аэрозонда и их можно соединять между собой. Сколько баллонов с газом необходимо одновременно подсоединить к пустой оболочке аэрозонда объемом 800 дм3, чтобы наполнить ее до давления 100 кПа, равного атмосферному? Температура газа при заполнении оболочки не изменяется.
Решение. Для осуществления процесса, описанного в условии задачи, требуется определенное количество газа ν.
Необходимое количество газа заполняет следующий объем:
- в начале процесса (до заполнения оболочки)
V
1 = NV
бал,
где N — количество баллонов; V
бал — объем одного баллона, V
бал = 4,0 л;
- в конце процесса (после заполнения оболочки)
V
2 = NV
бал + V
обол,
где V
обол — объем оболочки, V
обол = 800 дм3.
Указанное количество газа находится при давлении:
- в начале процесса (до заполнения оболочки) —
p
1 = 500 кПа
и совпадает с давлением газа в каждом из баллонов;
- в конце процесса (после заполнения оболочки) —
p
2 = 100 кПа
и совпадает с давлением в оболочке.
Считая процесс заполнения газом оболочки аэрозонда изотермическим, запишем уравнение Менделеева — Клапейрона следующим образом:
- в начале процесса (до заполнения оболочки) —
p
1V
1 = νRT,
где ν — количество вещества (газа) в оболочке; R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К); T — температура газа (не изменяется в ходе процесса);
- в конце процесса (после заполнения оболочки) —
p
2V
2 = νRT.
Равенство
p
1V
1 = p
2V
2,
записанное в явном виде
p
1NV
бал = p
2(NV
бал + V
обол),
позволяет получить формулу для вычисления искомого числа баллонов:
N=VоболVбал⋅p2p1−p2.
Произведем расчет:
N=800⋅10−34,0⋅10−3⋅100⋅103(500−100)⋅103=50.
Следовательно, для заполнения оболочки до указанного давления необходимо 50 баллонов с газом.
Пример 16. Аэростат, оболочка которого заполнена азотом с молярной массой 28 г/моль, находится в воздухе. Молярная масса воздуха равна 29 г/моль. Массы гондолы и оболочки аэростата пренебрежимо малы. Во сколько раз возрастет подъемная сила аэростата, если азот в его оболочке заменить на водород с молярной массой 2,0 г/моль, не изменяя при этом объем аэростата?
Решение. Силы (сила тяжести mg→ и сила Архимеда F→A), действующие на аэростат, показаны на рисунке.
Подъемная сила — это векторная сумма силы тяжести и силы Архимеда:
F→под=F→A+mg→,
где F→A — сила Архимеда, действующая на оболочку со стороны воздуха; mg→ — сила тяжести; m — масса газа, заполняющего оболочку аэростата; g→ — ускорение свободного падения.
В проекциях на вертикальную ось подъемная сила определяется следующими выражениями:
- при заполнении оболочки азотом —
F
под1 = F
A1 − m
1g,
где F
A1 — модуль силы Архимеда, действующей на оболочку аэростата при заполнении оболочки азотом, F
A1 = ρ0gV
1; ρ0 — плотность воздуха; V
1 — объем оболочки аэростата при заполнении ее азотом (объем воздуха, вытесненного оболочкой); m
1 — масса азота, заполняющего оболочку, m
1 = ρ1V
1; ρ1 — плотность азота;
- при заполнении оболочки водородом —
F
под2 = F
A2 − m
2g,
где F
A2 — модуль силы Архимеда, действующей на оболочку аэростата при заполнении оболочки водородом, F
A2 = ρ0gV
2; V
2 — объем оболочки аэростата при заполнении ее водородом (объем воздуха, вытесненного оболочкой); m
2 — масса водорода, заполняющего оболочку, m
2 = ρ2V
2; ρ2 — плотность водорода.
Искомой величиной является отношение
Fпод2Fпод1=FA2−m2gFA1−m1g.
С учетом записанных выражений для сил Архимеда, масс азота и водорода, а также равенства объемов оболочки при заполнении ее азотом и водородом (V
1 = V
2), указанное отношение принимает вид
Fпод2Fпод1=ρ0gV2−ρ2V2gρ0gV1−ρ1V1g=(ρ0−ρ2)V2g(ρ0−ρ1)V1g=ρ0−ρ2ρ0−ρ1.
Плотности воздуха, азота и водорода определим как отношения:
- для воздуха
ρ0=M0Vμ0,
где M
0 — молярная масса воздуха; V
µ0 — молярный объем воздуха;
- для азота
ρ1=M1Vμ1,
где M
1 — молярная масса азота; V
µ1 — молярный объем азота;
- для водорода
ρ2=M2Vμ2,
где M
2 — молярная масса водорода; V
µ2 — молярный объем водорода.
Молярные объемы (объемы одного моля) воздуха, азота и водорода равны между собой, так как газы находятся при одних и тех же условиях:
V
µ0 = V
µ1 = V
µ2 = V
µ.
Поэтому формула для расчета искомого отношения приобретает вид
Fпод2Fпод1=ρ0−ρ2ρ0−ρ1=M0−M2M0−M1.
Расчет дает значение:
Fпод2Fпод1=29⋅10−3−2,0⋅10−329⋅10−3−28⋅10−3=27.
При замене азота на водород в оболочке аэростата его подъемная сила возрастет в 27 раз.
Пример 17. Воздушный шар с температурой 300 К находится в воздухе при атмосферном давлении 100 кПа. Молярная масса воздуха составляет 29,0 г/моль. Объем воздушного шара равен 830 дм3, а масса его оболочки равна 333 г. На сколько градусов необходимо нагреть газ в оболочке, чтобы шар взлетел? Воздух в оболочке шара сообщается с атмосферой.
Решение. Силы, действующие на воздушный шар, показаны на рисунке:
- сила Архимеда
F
A = ρ0gV,
где ρ0 — плотность воздуха, окружающего шар; g — модуль ускорения свободного падения; V — объем оболочки шара (объем вытесненного оболочкой воздуха);
- сила тяжести
mg = (m
обол + m
возд)g,
где m
обол — масса оболочки; m
возд — масса воздуха в оболочке, m
возд = ρV; ρ — плотность воздуха внутри оболочки.
Шар взлетает, когда выполняется равенство
F→A+mg→=0,
или, в проекции на вертикальную ось, —
F
A − mg = 0.
Преобразуем равенство (условие равновесия шара в воздухе)
F
A = mg
с учетом записанных выше выражений
ρ0gV = (m
обол + m
возд)g, или (ρ0 − ρ)V = m
обол.
Входящие в равенство плотности воздуха не известны, но фигурируют в качестве параметра в уравнении состояния:
- для воздуха снаружи оболочки воздушного шара
p0=ρ0RT1M,
где p
0 — атмосферное давление; ρ0 — плотность воздуха снаружи оболочки; R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К); T
1 — температура окружающего шар воздуха; M — молярная масса воздуха;
- для воздуха внутри оболочки воздушного шара
p=ρRT2M,
где p — давление воздуха внутри оболочки; ρ — плотность воздуха внутри оболочки; T
2 — температура воздуха внутри оболочки.
Давления воздуха внутри и снаружи оболочки воздушного шара одинаковы, так как воздух, находящийся в оболочке, сообщается с атмосферой; поэтому
p = p
0.
Плотности:
- для воздуха снаружи оболочки воздушного шара
ρ0=p0MRT1;
- для воздуха внутри оболочки воздушного шара
ρ=p0MRT2.
Подставим выражения для плотностей в условие равновесия шара в воздухе:
(1T1−1T2)p0MVR=mобол.
Температура воздуха внутри оболочки, при которой шар начинает взлетать, определяется как
T2=p0MVT1p0MV−RT1mобол,
а искомая разность —
ΔT=T2−T1=p0MVT1p0MV−RT1mобол−T1=T1p0MVRT1mобол−1.
Произведем вычисление:
ΔT=300100⋅103⋅29,0⋅10−3⋅830⋅10−38,31⋅300⋅333⋅10−3−1=158 К.
Следовательно, чтобы воздушный шар начал взлетать, воздух в его оболочке необходимо нагреть на 158 К, или 158 °С.
Пример 18. Камеру футбольного мяча объемом 3,00 л накачивают с помощью насоса, забирающего из атмосферы 0,150 л воздуха при каждом качании. Атмосферное давление составляет 100 кПа. Определить давление в камере после 30 качаний, если первоначально она была пустой. Температура постоянна.
Решение. За N качаний насос забирает из атмосферы определенное количество воздуха ν. Это же количество воздуха попадает в камеру футбольного мяча.
Указанное количество воздуха имеет следующий объем:
- воздух, забранный из атмосферы за N качаний насоса, —
V
1 = NV
нас,
где V
нас — объем насоса, V
нас = 0,150 л; N — количество качаний;
- воздух, накачанный в камеру футбольного мяча, —
V
2 = V
мяч,
где V
мяч — объем камеры мяча, V
мяч = 3,00 л.
Данное количество воздуха находится при следующем давлении:
- воздух, забранный из атмосферы за N качаний насоса, —
p
1 = 100 кПа
совпадает с атмосферным давлением;
- воздух, накачанный в камеру футбольного мяча, — p
2 (является искомой величиной).
Считая процесс заполнения воздухом камеры мяча изотермическим, запишем уравнение Менделеева — Клапейрона следующим образом:
- для воздуха, забранного из атмосферы за N качаний насоса, —
p
1V
1 = νRT,
где R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К); T — температура газа (не изменяется в ходе процесса);
- для воздуха, накачанного в камеру футбольного мяча, —
p
2V
2 = νRT.
Равенство
p
1V
1 = p
2V
2,
записанное в явном виде
p
1NV
нас = p
2V
мяч,
позволяет получить формулу для вычисления давления в камере футбольного мяча:
p2=p1NVнасVмяч.
Произведем вычисление:
p2=100⋅103⋅30⋅0,15⋅10−33,00⋅10−3=150⋅103 Па=150 кПа.
Источник
Задача 28.
При 17°С некоторое количество газа занимает объем 580 мл. Какой объем займет это же количество газа при 100°С, если давление его останется неизменным?
Решение:
По закону Гей – Люссака при постоянном давлении объём газа изменяется прямо пропорционально абсолютной температуре (Т):
V2 – искомый объём газа;
T2 – соответствующая V2 температура;
V1 – начальный объём газа при соответствующей температуре Т1.
По условию задачи V1 = 580мл; Т1 = 290К (273 + 17 = 290) и Т2 = 373К (273 + 100 = 373). Подставляя эти значения в выражение закона Гей – Люссака, получим:
Ответ: V2 = 746мл.
Задача 29.
Давление газа, занимающего объем 2,5л, равно 121,6 кПа (912мм рт. ст.). Чему будет равно давление, если, не изменяя температуры, сжать газ до объема в 1л?
Решение:
Согласно закону Бойля – Мариотта, при постоянной температуре давление, производимое данной массой газа, обратно пропорционально объёму газа:
Обозначив искомое давление газа через Р2, можно записать:
Ответ: Р2 = 304кПа (2280мм.рт.ст.).
Задача 30. На сколько градусов надо нагреть газ, находящийся в закрытом сосуде при 0 °С, чтобы давление его увеличилось вдвое?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально температуре:
По условию задачи Т1 = 0 °С + 273 = 273К; давление возросло в два раза: Р2 = 2Р1.
Подставляя эти значения в уравнение, находим:
Ответ: Газ нужно нагреть на 2730С.
Задача 31.
При 27°С и давлении 720 мм.рт. ст. объем газа равен 5л. Кой объем займет это же количество газа при 39°С и давлении 104кПа?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 5л; Т = 298К (273 + 25 = 298); Р = 720 мм.рт.ст. (5,99 кПа); Р0 = 104 кПа; Т = 312К (273 + 39 = 312); Т = 273К. Подставляя данные задачи в уравнение, получим:
Ответ: V0 = 4,8л
Задача 32.
При 7°С давление газа в закрытом сосуде равно 96,0 кПа. Каким станет давление, если охладить сосуд до —33 °С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:
Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 96,0 кПа; Т1 = 280К (273 + 7 = 280); Т2 = 240К (273 – 33 = 240). Подставляя эти значения в уравнение, получим:
Ответ: Р2 = 82,3кПа.
Задача 33.
При нормальных условиях 1г воздуха занимает объем 773 мл. Какой объем займет та же масса воздуха при 0 °С и )и давлении, равном 93,3 кПа (700мм. рт. ст.)?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V0 = 773мл; Т0 = 298К (273 + 25 = 298); Т = 273К; Р = 93,3кПа. Подставляя данные задачи и преобразуя уравнение, получим:
Ответ: V = 769, 07 мл.
Задача 34.
Давление газа в закрытом сосуде при 12°С равно 100 кПа (750мм рт. ст.). Каким станет давление газа, если нагреть сосуд до 30°С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:
Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 100 кПа; Т1 = 285К (273 + 12 = 285); Т2 = 303К (273 + 30 = 303). Подставляя эти значения в уравнение, получим:
Ответ: Р2 = 106,3кПа.
Задача 35.
В стальном баллоне вместимостью 12л находится при 0°С кислород под давлением 15,2 МПа. Какой объем кислорода, находящегося при нормальных условиях можно получить из такого баллона?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 12л; Т = 273К (273 + 0 = 2273); Р =15,2МПа); Р0 = 101,325кПа; Т0 = 298К (273 + 25 = 298). Подставляя данные задачи в уравнение, получим:
Ответ: V0 = 1,97м3.
Задача 36.
Температура азота, находящегося в стальном баллоне под давлением 12,5 МПа, равна 17°С. Предельное давление для баллона 20,3МПа. При какой температуре давление азота достигнет предельного значения?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:
Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 12,5МПа; Т1 = 290К (273 + 17 = 290); Р2 = 20,3МПа. Подставляя эти значения в уравнение, получим:
Ответ: Т2 = 1980С.
Задача 37.
При давлении 98,7кПа и температуре 91°С некоторое количество газа занимает объем 680 мл. Найти объем газа при нормальных условиях.
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V = 680мл; Т0 = 298К (273 + 25 = 298); Т = 364К (273 + 91 = 364); Р = 98,7кПа. Подставляя данные задачи и преобразуя уравнение, получим:
<
Ответ: V0 = 542,3мл.
Задача 38.
При взаимодействии 1,28г металла с водой выделилось 380 мл водорода, измеренного при 21°С и давлении 104,5кПа (784мм рт. ст.). Найти эквивалентную массу металла.
Решение:
Находим объём выделившегося водорода при нормальных условиях, используя уравнение:
где Р и V – давление и объём газа при температуре Т = 294К (273 +21 = 294); Р0 = 101,325кПа; Т0 = 273К; Р = 104,5кПа. Подставляя данные задачи в уравнение,
получим:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 22,4 : 2 = 11,2л или 11200 мл. Тогда, используя формулу закона эквивалентов, рассчитаем эквивалентную массу металла:
Ответ: mЭ(Ме) = 39,4г/моль.
Задача 39.
Как следует изменить условия, чтобы увеличение массы данного газа не привело к возрастанию его объема: а) понизить температуру; б) увеличить давление; в) нельзя подобрать условий?
Решение:
Для характеристики газа количеством вещества (n, моль) применяется уравнение РV = nRT, или – это уравнение Клапейрона-Менделеева. Оно связывает массу (m, кг); температуру (Т, К); давление (Р, Па) и объём (V, м3) газа с молярной массой (М, кг/моль).
Тогда из уравнения Клапейрона-Менделеева объём газа можно рассчитать по выражению:
Отсюда следует, что V = const, если при увеличении массы (m) газа на некоторую величину будет соответственно уменьшена температура (T) системы на некоторое необходимое значение. Объём системы также не изменится при постоянной температуре, если при увеличении массы (m) газа на некоторую величину будет соответственно увеличено давление (P) системы на необходимую величину.
Таким образом, при увеличении массы газа объём системы не изменится, если понизить температуру системы или же увеличить давление в ней на некоторую величину.
Ответ: а); б).
Задача 40.
Какие значения температуры и давления соответствуют нормальным условиям для газов: а) t = 25 °С, Р = 760 мм. рт. ст.; б) t = 0 °С, Р = 1,013 • 105Па; в) t = 0°С, Р = 760 мм. рт. ст.?
Решение:
Состояние газа характеризуется температурой, давлением и объёмом. Если температура газа равна 0 °С (273К), а давление составляет 101325 Па (1,013 • 105) или 760 мм. рт. ст., то условия, при которых находится газ, принято считать нормальными.
Ответ: б); в).
Источник
