Чему равно давление водорода в сосуде

Прибор Рамзая для обнаружения парциального давления.
Во внутреннем сосуде Р из палладия находится смесь азота и водорода под общим давлением в 1 атм. Сосуд Р соединён с дифференциальным манометром и помещён в сосуд большего размера. При высоких температурах водород легко диффундирует через палладиевую оболочку, и стенки сосуда Р становятся полупроницаемыми — они проницаемы для водорода, но непроницаемы для азота. Пропуская нагретый водород с давлением в 1 атм через больший сосуд, исследователь обнаружит, что давление смеси газов в сосуде Р превысит 1 атм на величину парциального давления азота при данной температуре.
Парциа́льное давление (лат. partialis «частичный» от pars «часть») — давление отдельно взятого компонента газовой смеси[1][2]. Общее давление газовой смеси является суммой парциальных давлений её компонентов.
В химии парциальное давление газа в смеси газов определяется как указано выше. Парциальное давление газа, растворённого в жидкости, является парциальным давлением того газа, который образовался бы в фазе газообразования в состоянии равновесия с жидкостью при той же температуре. Парциальное давление газа измеряется как термодинамическая активность молекул газа. Газы всегда будут вытекать из области с высоким парциальным давлением в область с более низким давлением; и чем больше разница, тем быстрее будет поток. Газы растворяются, диффундируют и реагируют соответственно их парциальному давлению и не обязательно зависимы от концентрации в газовой смеси.
Законы Дальтона парциального давления[править | править код]
Для идеального газа парциальное давление в смеси равно давлению, которое будет оказываться, если бы он занимал тот же объём, что и вся смесь газов, при той же температуре. Причина этого в том, что между молекулами идеального газа по определению не действуют силы притяжения или отталкивания, их соударения между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями. Насколько условия реально существующей смеси газов близки этому идеалу, настолько общее давление смеси равно сумме парциальных давлений каждого газа смеси, как это формулирует закон Дальтона[3]. Например, дана смесь идеального газа из азота (N2), водорода (H2) и аммиака (NH3):
, где:
= общему давлению в газовой смеси
= парциальному давлению азота (N2)
= парциальному давлению водорода (H2)
= парциальному давлению аммиака (NH3)
Смеси идеальных газов[править | править код]
Мольная доля отдельных компонентов газа в идеальной газовой смеси может быть выражена в пределах парциальных давлений компонентов или молей компонентов:
и парциальное давление отдельных компонентов газов в идеальном газе может быть получено используя следующее выражение:
, где:
= мольной доле любого отдельного компонента газа в газовой смеси
= парциальному давлению любого отдельного компонента газа в газовой смеси
= молям любого отдельного компонента газа в газовой смеси
= общему числу молей газовой смеси
= общему давлению в газовой смеси
Мольная доля отдельного компонента в газовой смеси равна объёмной доле этого компонента в газовой смеси[4].
См. также[править | править код]
- Пар
- Газ, Идеальный газ и Уравнение состояния идеального газа
- Мольная доля и Моль
- Законы Дальтона
- Объёмный процент
- Закон Генри
Примечания[править | править код]
Источник
Задача 62.
Вычислить массу: а) 2л Н2 при 15 °С и давлении 100,7кПа (755мм рт. ст.); 6) 1м3 N2 при 10 °С и давлении 102,9 кПа (772мм рт. ст.); в) 0,5 м3 Cl2 при 20 °С и давлении 99,9 кПа (749,3мм рт. ст.).
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где P и V – давление и объём газа при температуре T; P0 (101,325кПа) и V0 – давление и объём газа при нормальных условиях; T0 (273К) – абсолютная температура. Преобразуя уравнение, получим выражение для расчета объёма газов при нормальных условиях:

Рассчитаем массу каждого газа, учитывая, что мольный объём газа равен 22,4л и, зная молекулярную массу газов, получим:

Ответ: а) 0,168г; б) 1.23кг; в) 1,456кг.
Задача 63.
Определить объем, занимаемый 0,07кг N2 при 21°С и давлении 142 кПа (106 мм рт. ст.).
Решение:
Зная мольный объём и мольную массу азота (28г/моль), находим объём, который будет занимать 0,07кг (70г) азота при нормальных условиях:

Затем приведём полученный объём к температуре Т = 21оС (294К) и Р = 142кПа, используя выражение, объединяющее законы Гей-Люссака и Бойля-Мариотта:

где P и V – давление и объём газа при температуре T; P0 (101,325кПа) и V0 – давление и объём газа при нормальных условиях; (273 К) – абсолютная температура. Преобразуя уравнение, получим выражение для расчета объёма газа при заданной температуре

Ответ: 43л.
Задача 64.
Бертолетова соль при нагревании разлагается с образованием КСI и О2. Сколько литров кислорода при 0 °С и давлении 101,3 кПа можно получить из 1 моля КСIО3?
Решение:
Уравнение реакции термического разложения бертолетовой соли имеет вид:

Из уравнения реакции следует, что из двух молей бертолетовой соли образуется три моля кислорода, т.е. из одного моля соли образуется полтора моля кислорода (2:3 = 1:х; x = 1.3/2 = 1,5моль).
Объём кислорода при нормальных условиях (T0 =0 °С и P0 =101.325кПа) можно рассчитать по формуле:

V(B) – объём газа, л;
 (B) – количество газа, моль;
(B) – количество газа, моль;
V(M) – мольный объём, 22,4л.
Тогда
V(кислорода) = 1,5 . 22,4 = 33,6л.
Ответ: 33,6л.
Задача 65.
Сколько молей содержится в 1м3 любого газа при нормальных условиях?
Решение:
Зная, что один моль любого газа при нормальных условиях (Т0 =0 °С и Р0 =101.325 кПа) занимает 22,4л, рассчитаем количество молей газа в 1м3 (1000 л) из пропорции:

Ответ: 44,64моль.
Задача 66.
Чему равно атмосферное давление на вершине Казбека, если при 0 °С масса 1л взятого там воздуха равна 700 мг?
Решение:
Мольная масса воздуха равна 29 г/моль. Нормальными условиями для газов являются температура 0 °С и давление 101,325 кПа (760 мм рт ст.). Масса одного литра воздуха при нормальных условиях равна 1296,64 мг:

Теперь рассчитаем атмосферное давление на вершине Казбека из пропорции:

Ответ: 54,7к Па (410,3 мм рт. ст.).
Задача 67.
При взаимодействии одного объема СО и одного объема Сl2 образуется один объем фосгена. Установить формулу фосгена.
Решение:
По условию задачи выходит, что из молекулы угарного газа и одной молекулы хлора образуется одна молекула фосгена. Так как молекула угарного газа СО состоит из одного атома углерода и одного атома кислорода, а молекула хлора Cl2 состоит из двух атомов хлора, то, следовательно, молекула фосгена будет состоять из одного атома углерода, одного атома кислорода и двух атомов хлора. Тогда формула фосгена будет иметь вид: CCl2O.
Уравнение реакции будет иметь вид:
СО + Cl2 → ССl2O.
Ответ: ССl2O.
Задача 68.
Какой объем СО2 получается при сгорании 2л бутана? Объемы обоих газов измерены при одинаковых условиях.
Решение:
Уравнение реакции горения бутана имеет вид:
2С4Н10 + 13О2 = 8СО2 + 10Н2О
Из уравнения реакции следует, что при сгорании одного моля бутана образуется четыре моля углекислого газа. Известно, что при одинаковых условиях одинаковое количество газов занимают одинаковый объём. Один моль любого газа при нормальных условиях занимает объём в 22,4 л.
Исходя, из этих утверждений рассчитаем объём выделившегося углекислого газа при сгорании 2 л бутана, составив пропорцию:

Ответ: 8л.
Задача 69.
В замкнутом сосуде при 120°С и давлении 600 кПа находится смесь, состоящая из трех объемов О2 и одного объема СН4. Каково будет давление в сосуде, если взорвать смесь и привести содержимое сосуда к первоначальной температуре?
Решение:
Уравнение реакции имеет вид:
CH4 + 2O2 → CO2 + 2H2O
Из уравнения реакции следует, что из одной молекулы метана и двух молекул кислорода образуются одна молекула углекислого газа и две молекулы воды, т. е. реакция протекает без изменения объёма. Начальный объём системы состоял из одного объёма метана и трёх объёмов кислорода, после реакции в системе остался один объём не прореагировавшего кислорода и три объёма продуктов реакции (один объём метана и два объёма паров воды). Поскольку реакция протекает без изменения объёма, а по окончании реакции содержимое сосуда приводится к первоначальной температуре, а общее число молекул газов не изменилось, то давление в системе останется прежним, т. е. 600 кПа.
Ответ: не изменится.
Задача 70. После взрыва 0,020 л смеси водорода с кислородом осталось 0,0032 л кислорода. Выразить в процентах по объему первоначальный состав смеси.
Решение:
Находим объём газов, вступивших в реакцию:
0,020 – 0,0032 = 0,0168 л.
Уравнение реакции горения водорода имеет вид:
2Н2 + О2 = 2Н2О
При взаимодействии водорода с кислородом из двух молекул водорода и одной молекулы кислорода получаются две молекулы воды, следовательно, из трёх молекул образовавшихся газов одна молекула будет принадлежать кислороду. Таким образом, объём кислорода, вступившего в реакцию, будет составлять одну треть объёма смеси газов – продуктов реакции. Отсюда количество кислорода, вступившего в реакцию, составляет 0,00565 л (0 0168/3 = 0,0056).
Следовательно, общее количество кислорода до реакции составляло 0,0088л (0,0056 + 0,0032 = 0,0088).
Тогда содержимое водорода до реакции составляло 0,0112л (0,02 – 0,0088 = 0.0112).
Рассчитаем в процентах первоначальный состав газовой смеси:

Ответ: 56%Н2; 44%О2.
Источник
Задача 47.
0,350г металла вытеснили из кислоты 209 мл водорода, собранного над водой при 20 °С и давлении 104,3 кПа. Давление насыщенного пара воды при этой температуре составляет 2,3кПа. Найти эквивалентную массу металла.
Решение:
Парциальное давление кислорода равно разности общего давления и парциального давления паров воды:
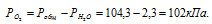
Обозначив искомый объём через и, используя объединённое уравнение закона Бойля- Мариотта и Гей-Люссака, находим V0:
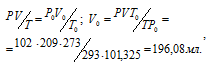
где Р и V – давление и объём газа при температуре T = 293К (273 +20 = 293); P0 = 101,325кПа; T0 = 273К; = 102кПа; V0 – объём газа при н.у..
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
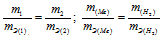
Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 22,4 : 2 = 11,2л или 11200мл. Тогда, используя формулу закона эквивалентов, рассчитаем эквивалентную массу металла:
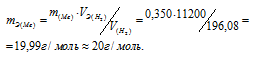
Ответ: m(Э) = 20г/моль.
Задача 48.
250 мл водорода собраны над водой при 26°С и давлении 98,7кПа. Давление насыщенного пара воды при 26°С составляет 3,4кПа. Вычислить объем водорода при нормальных условиях и его массу.
Решение:
Парциальное давление кислорода равно разности общего давления и парциального давления паров воды:
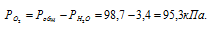
Обозначив искомый объём через V0 и, используя объединённое уравнение закона Бойля- Мариотта и Гей-Люссака, находим V0:
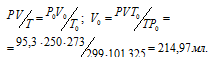
где P и V – давление и объём газа при температуре T = 299К (273 +26 = 299); P0 = 101,325кПа; T0 = 273К; V0 = 95,3кПа; – объём газа при н.у..
Учитывая, что 1г Н2 занимает 11200 мл рассчитаем массу водорода, содержащуюся в 214,97мл, составив пропорцию:
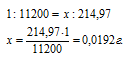
Ответ: 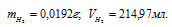
Задача 49.
0,604г двухвалентного металла вытеснили из кислоты 581мл водорода, собранного над водой при 18°С и давлении 105,6 кПа. Давление насыщенного пара воды при 18°С составляет 2,1кПа. Найти относительную атомную массу металла.
Решение:
Парциальное давление кислорода равно разности общего давления и парциального давления паров воды.
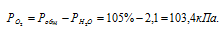
Обозначив искомый объём через V0 и, используя объединённое уравнение закона Бойля- Мариотта и Гей-Люссака, находим V0:
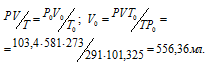
где P и V – давление и объём газа при температуре T = 291K (273 + 18 = 291); T0 = 273К; P0 = 101,325 Kпа; V0 -объём газа при н.у.
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
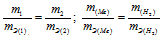
Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 22,4 : 2 = 11,2л или 11200мл. Тогда, используя формулу закона эквивалентов, рассчитаем эквивалентную массу металла:
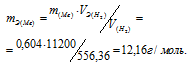
Молекулярная масса металла равна произведению эквивалентной массы на валентность его:
M(Me) = mЭ(Me). B, где B – валентность металла. Тогда M(Me) = 12,16 . 2 = 24,32г/моль.
Ответ: M(Me) = 24,32г/моль.
Задача 50.
Сосуд наполнен смесью кислорода и азота. При каком соотношении парциальных давлений массы газов будут одинаковы:
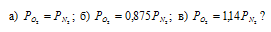
Решение:
Парциальным давлением любого газа в смеси называется давление, которое производил бы газ, занимая при тех же условиях объём всей газовой смеси.
Так как 1моль любого газа занимает одинаковый объём при одинаковых физических условиях (например, 22,4л при н.у.), следовательно, и парциальные давления 1-го моля любого газа при тех же физических условиях будут одинаковы.
Молекулярная масса кислорода больше молекулярной массы азота в 1,14 раза (32/!4 = 1,14), то при одинаковых массах данных газов, соответственно, парциальное давление азота будет в 1,14 раза меньше, чем у кислорода, т. е.:
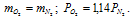
Ответ: б).
Задача 51.
Парциальное давление кислорода в воздухе равно 22 кПа. Чему равно содержание кислорода в процентах по объему: а) 42%; 6) 21%; в) 10,5%?
Решение:
Воздух представляет собой, в основном, смесь азота и кислорода. Для нахождения приведённого объёма кислорода, входящего в состав воздуха, приведённый к давлению смеси (Рвозд.) и температуре (Т) необходимо воспользоваться законом Бойля-Мариотта:
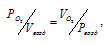
где 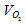 – объём кислорода; Vвозд. – объём воздуха; Рвозд. – общее давление смеси кислорода и азота (н.у.), 101,325кПа;
– объём кислорода; Vвозд. – объём воздуха; Рвозд. – общее давление смеси кислорода и азота (н.у.), 101,325кПа; 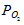 – парциальное давление кислорода, 22кПа.
– парциальное давление кислорода, 22кПа.
Сумма приведённых объёмов отдельных газов в смеси равняется общему объёму смеси, т. е.:
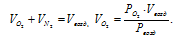
Отношение приведённых объёмов кислорода и азота к общему объёму воздуха называется объёмной долей и обозначается через r. Тогда:
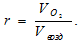
Следовательно, содержание кислорода в процентах по объёму в воздухе с учётом закона Бойля-Мариотта, равно:
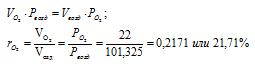
Ответ: б) 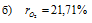
Задача 52.
Водород собирали в одном случае над водой, в другом над ртутью при одинаковых условиях. В обоих случаях объем газа оказался одинаковым. Одинаковы ли количества собранного водорода: а) одинаковы; б) количество водорода, собранного над ртутью, больше; в) количество водорода, собранного над водой, больше?
Решение:
Водород собирали над водой и над ртутью при одинаковых условиях при этом объёмы обеих систем оказались одинаковы. Учитывая, что ртуть имеет большую плотность, чем вода, то можно предположить, что количество водорода, собранное над ртутью будет больше, чем собранное над водой.
В обоих случаях объём газовой смеси будет складываться из определённого объёма водорода и паров жидкости, над которой собран газ. Так как температура кипения ртути и её плотность значительно выше, чем у воды, то в равных объёмах газов водорода будет содержаться больше над ртутью, так как ртути (её паров) будет в смеси значительно меньше, чем паров воды.
Таким образом, вследствие малой испаряемости ртути по отношению к воде парциальное давление паров ртути над жидкой ртутью будет меньше, чем парциальное давление паров воды над жидкой водой при одинаковых условиях и, следовательно, парциальное давление водорода над ртутью будет больше, чем над водой. Отсюда вытекает, что количество водорода, собранного над ртутью, больше, чем над водой.
Ответ: б).
Источник
Задача 47.
0,350г металла вытеснили из кислоты 209 мл водорода, собранного над водой при 20 °С и давлении 104,3 кПа. Давление насыщенного пара воды при этой температуре составляет 2,3кПа. Найти эквивалентную массу металла.
Решение:
Парциальное давление кислорода равно разности общего давления и парциального давления паров воды:
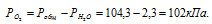
Обозначив искомый объём через и, используя объединённое уравнение закона Бойля- Мариотта и Гей-Люссака, находим V0:
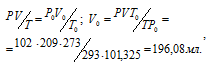
где Р и V – давление и объём газа при температуре T = 293К (273 +20 = 293); P0 = 101,325кПа; T0 = 273К; = 102кПа; V0 – объём газа при н.у..
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
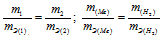
Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 22,4 : 2 = 11,2л или 11200мл. Тогда, используя формулу закона эквивалентов, рассчитаем эквивалентную массу металла:
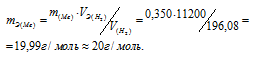
Ответ: m(Э) = 20г/моль.
Задача 48.
250 мл водорода собраны над водой при 26°С и давлении 98,7кПа. Давление насыщенного пара воды при 26°С составляет 3,4кПа. Вычислить объем водорода при нормальных условиях и его массу.
Решение:
Парциальное давление кислорода равно разности общего давления и парциального давления паров воды:
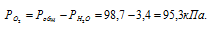
Обозначив искомый объём через V0 и, используя объединённое уравнение закона Бойля- Мариотта и Гей-Люссака, находим V0:
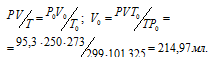
где P и V – давление и объём газа при температуре T = 299К (273 +26 = 299); P0 = 101,325кПа; T0 = 273К; V0 = 95,3кПа; – объём газа при н.у..
Учитывая, что 1г Н2 занимает 11200 мл рассчитаем массу водорода, содержащуюся в 214,97мл, составив пропорцию:
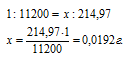
Ответ: 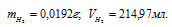
Задача 49.
0,604г двухвалентного металла вытеснили из кислоты 581мл водорода, собранного над водой при 18°С и давлении 105,6 кПа. Давление насыщенного пара воды при 18°С составляет 2,1кПа. Найти относительную атомную массу металла.
Решение:
Парциальное давление кислорода равно разности общего давления и парциального давления паров воды.
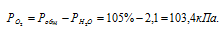
Обозначив искомый объём через V0 и, используя объединённое уравнение закона Бойля- Мариотта и Гей-Люссака, находим V0:
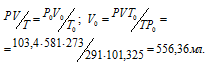
где P и V – давление и объём газа при температуре T = 291K (273 + 18 = 291); T0 = 273К; P0 = 101,325 Kпа; V0 -объём газа при н.у.
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
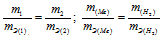
Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 22,4 : 2 = 11,2л или 11200мл. Тогда, используя формулу закона эквивалентов, рассчитаем эквивалентную массу металла:
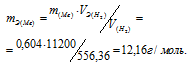
Молекулярная масса металла равна произведению эквивалентной массы на валентность его:
M(Me) = mЭ(Me). B, где B – валентность металла. Тогда M(Me) = 12,16 . 2 = 24,32г/моль.
Ответ: M(Me) = 24,32г/моль.
Задача 50.
Сосуд наполнен смесью кислорода и азота. При каком соотношении парциальных давлений массы газов будут одинаковы:
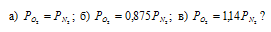
Решение:
Парциальным давлением любого газа в смеси называется давление, которое производил бы газ, занимая при тех же условиях объём всей газовой смеси.
Так как 1моль любого газа занимает одинаковый объём при одинаковых физических условиях (например, 22,4л при н.у.), следовательно, и парциальные давления 1-го моля любого газа при тех же физических условиях будут одинаковы.
Молекулярная масса кислорода больше молекулярной массы азота в 1,14 раза (32/!4 = 1,14), то при одинаковых массах данных газов, соответственно, парциальное давление азота будет в 1,14 раза меньше, чем у кислорода, т. е.:
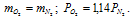
Ответ: б).
Задача 51.
Парциальное давление кислорода в воздухе равно 22 кПа. Чему равно содержание кислорода в процентах по объему: а) 42%; 6) 21%; в) 10,5%?
Решение:
Воздух представляет собой, в основном, смесь азота и кислорода. Для нахождения приведённого объёма кислорода, входящего в состав воздуха, приведённый к давлению смеси (Рвозд.) и температуре (Т) необходимо воспользоваться законом Бойля-Мариотта:
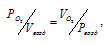
где 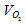 – объём кислорода; Vвозд. – объём воздуха; Рвозд. – общее давление смеси кислорода и азота (н.у.), 101,325кПа;
– объём кислорода; Vвозд. – объём воздуха; Рвозд. – общее давление смеси кислорода и азота (н.у.), 101,325кПа; 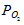 – парциальное давление кислорода, 22кПа.
– парциальное давление кислорода, 22кПа.
Сумма приведённых объёмов отдельных газов в смеси равняется общему объёму смеси, т. е.:
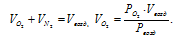
Отношение приведённых объёмов кислорода и азота к общему объёму воздуха называется объёмной долей и обозначается через r. Тогда:
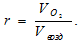
Следовательно, содержание кислорода в процентах по объёму в воздухе с учётом закона Бойля-Мариотта, равно:
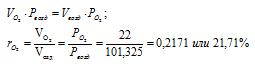
Ответ: б) 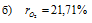
Задача 52.
Водород собирали в одном случае над водой, в другом над ртутью при одинаковых условиях. В обоих случаях объем газа оказался одинаковым. Одинаковы ли количества собранного водорода: а) одинаковы; б) количество водорода, собранного над ртутью, больше; в) количество водорода, собранного над водой, больше?
Решение:
Водород собирали над водой и над ртутью при одинаковых условиях при этом объёмы обеих систем оказались одинаковы. Учитывая, что ртуть имеет большую плотность, чем вода, то можно предположить, что количество водорода, собранное над ртутью будет больше, чем собранное над водой.
В обоих случаях объём газовой смеси будет складываться из определённого объёма водорода и паров жидкости, над которой собран газ. Так как температура кипения ртути и её плотность значительно выше, чем у воды, то в равных объёмах газов водорода будет содержаться больше над ртутью, так как ртути (её паров) будет в смеси значительно меньше, чем паров воды.
Таким образом, вследствие малой испаряемости ртути по отношению к воде парциальное давление паров ртути над жидкой ртутью будет меньше, чем парциальное давление паров воды над жидкой водой при одинаковых условиях и, следовательно, парциальное давление водорода над ртутью будет больше, чем над водой. Отсюда вытекает, что количество водорода, собранного над ртутью, больше, чем над водой.
Ответ: б).
Источник
