Чему равно соотношение давлений в сосудах с кислородом

Команда “Газы!” была объявлена еще две недели назад. И что?! Легкие задачи порешали и расслабились?! Или вы думаете, что задачи на газы касаются только 28-х заданий ЕГЭ?! Как бы не так! Если газов пока еще не было в 34-х заданиях, это ничего не значит! Задач на электролиз тоже не было в ЕГЭ до 2018 года. А потом как врезали, мама не горюй! Обязательно прочитайте мою статью “Тайны задач по химии? Тяжело в учении – легко в бою!”. В этой статье очень подробно рассказывается о новых фишках на электролиз. Статья вызвала шквал самых разных эмоций у преподавателей химии. До сих пор мне и пишут, и звонят, и благодарят, и бьются в конвульсиях. Просто цирк с конями, в котором я – зритель в первом ряду.
Однако, вернемся к нашим баранам, вернее, Газам. Я прошла через огонь и воду вступительных экзаменов и знаю точно – хочешь завалить абитуриента, дай ему задачу на Газы. Почитайте на досуге сборник задач И.Ю. Белавина. Я процитирую одну такую “мозгобойню”, чтобы вам жизнь медом не казалась. Попробуйте решить.
И.Ю. Белавин, 2005, задача 229
“Два из трех газов (сероводород, водород и кислород) смешали и получили газовую смесь, плотность которой оказалась равной плотности оставшегося газа. Полученную газовую смесь вместе с равным ей объемом третьего газа под давлением поместили в замкнутый сосуд емкостью 4 л, содержавший азот при н.у. и нагревали при 600 С до окончания химических реакций, затем постепенно охладили. Определите массы веществ, содержавшихся в сосуде после охлаждения, если плотность газовой смеси в сосуде перед нагреванием равнялась 9,25г/л. (Ответ: m(S) = 7,5 г, m(SO2) = 15 г, m(Н2О) = 9 г)”
Ну как, решили? Нет?! А ваши репетиторы?! Извините, это был риторический вопрос. Кстати, мои ученики, абитуриенты 2003-2008 гг. такие задачи щелкали, как семечки, на экзаменах во 2-й медицинский (теперь РНИМУ им. Н.И. Пирогова). Надеюсь, вам понятно, что 34-м задачам ЕГЭ еще есть куда усложняться, perfectio interminatus est (нет предела совершенству), с газами нужно работать, работать и работать. Поэтому команду “Газы!” отменять рано. Итак, поехали!
Сегодня мы поговорим о газовых смесях, затронем понятие плотности газа (абсолютной и относительной), средней молярной массы, решим задачи: определение средней молярной массы и плотности газа по компонентам смеси и наоборот.
• Газовая смесь – смесь отдельных газов НЕ вступающих между собой в химические реакции. К смесям газов относятся: воздух (состоит из азота, кислорода, углекислого газа, водяного пара и др.), природный газ (смесь предельных и непредельных углеводородов, оксида углерода, водорода, сероводорода, азота, кислорода, углекислого газа и др.), дымовые газы (содержат азот, углекислый газ, пары воды, сернистый газ и др.) и др.
• Объемная доля – отношение объема данного газа к общему объему смеси, показывает, какую часть общего объема смеси занимает данный газ, измеряется в долях единицы или в процентах.
• Мольная доля – отношение количества вещества данного газа к общему количеству вещества смеси газов, измеряется в долях единицы или в процентах.
• Плотность газа (абсолютная) – определяется как отношение массы газа к его объему, единица измерения (г/л). Физический смысл абсолютной плотности газа – масса 1 л, поэтому молярный объем газа (22,4 л при н.у. t° = 0°C, P = 1 атм) имеет массу, численно равную молярной массе.
• Относительная плотность газа (плотность одного газа по другому) – это отношение молярной массы данного газа к молярной массе того газа, по которому она находится
• Средняя молярная масса газа – рассчитывается на основе молярных масс составляющих эту смесь газов и их объемных долей
Настоятельно рекомендую запомнить среднюю молярную массу воздуха Мср(в) = 29 г/моль, в заданиях ЕГЭ часто встречается.
Обязательно посетите страницу моего сайта “Изучаем Х-ОбХ-04. Закон Авогадро. Следствия из закона Авогадро. Нормальные условия. Молярный объем газа. Абсолютная и относительная плотность газа. Закон объемных отношений”и сделайте конспекты по теории. Затем возьмите бумагу и ручку и решайте задачи вместе со мной.
ВАНГУЮ: чует мое сердце, что ЕГЭ по химии 2019 года устроит нам газовую атаку, а противогазы не выдаст!
Задача 1
Определить плотность по азоту газовой смеси, состоящей из 30% кислорода, 20% азота и 50% углекислого газа.
Задача 2
Вычислите плотность по водороду газовой смеси, содержащей 0,4 моль СО2, 0,2 моль азота и 1,4 моль кислорода.
Задача 3
5 л смеси азота и водорода имеют относительную плотность по водороду 12. Определить объем каждого газа в смеси.
Несколько задач со страницы моего сайта
Задача 4
Плотность по водороду пропан-бутановой смеси равна 23,5. Определите объемные доли пропана и бутана
Задача 5
Газообразный алкан объемом 8 л (н.у.) имеет массу 14,28 г. Чему равна его плотность по воздуху
Задача 6
Плотность паров альдегида по метану равна 2,75. Определите альдегид
Ну как? Пошло дело? Если туго, вернитесь к задачам и решайте их самостоятельно до тех пор, пока не щелкнет! А для стимуляции – десерт в виде еще одной задачи И.Ю. Белавина на газы. Наслаждайтесь ее решением самостоятельно!
И.Ю. Белавин, 2005, задача 202
“Сосуд емкостью 5,6 л при н.у. заполнили метаном, затем нагрели до высокой температуры, в результате чего произошло частичное разложение метана. Определите массу образовавшейся сажи, если известно, что после приведения к нормальным условиям объем полученной газовой смеси оказался в 1,6 раза больше объема исходного метана, эта газовая смесь обесцвечивает бромную воду и имеет плотность по воздуху 0,2931. (Ответ: m(C) = 0,6 г)”
Задачи И.Ю. Белавина – это крутой драйв! Попробуйте порешать, и вы откажетесь от просмотра любых ужастиков, поскольку запасетесь адреналином надолго! Но нам нужно спуститься на землю к ЕГЭ, простому и надежному, как первый советский трактор. Кстати, у меня в коллекции припасено немало сюрпризов с газовыми фишками, собранными за все годы работы и бережно хранимыми. Думаю, пришло время сказать им: “И снова здравствуйте!”, поскольку ЕГЭ с каждым годом становится “все чудесатее и чудесатее”. Но это уже совсем другая история. Читайте мои статьи – и вы подстелите соломку под свою ЕГЭшную попу.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии https://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Позвоните мне +7(903)186-74-55, приходите ко мне на курс, на бесплатные Мастер-классы “Решение задач по химии”. Я с удовольствием вам помогу.
Репетитор по химии и биологии кбн В.Богунова
Источник
Баннер “Эникс” рассказал,
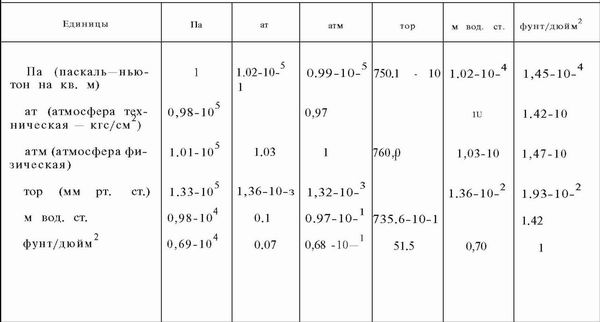
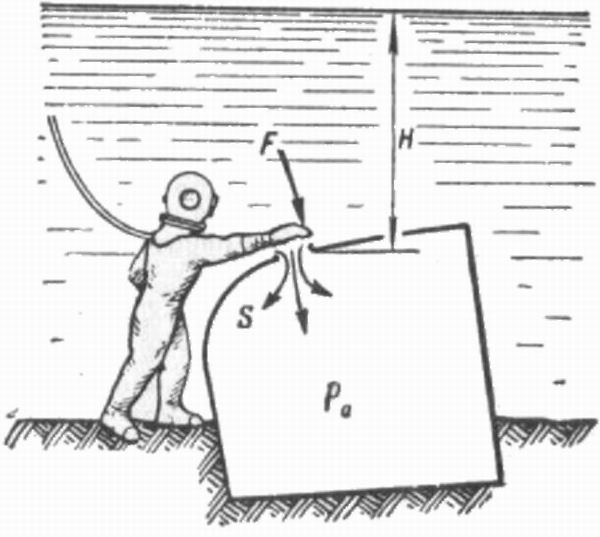
| Главная / Издания / Литература / Книжная полка / Справочник водолаза В водолазной практике часто приходится встречаться с В системах СИ и МКС единицей давления служит Механическое давление измеряется силой, действующей где р — давление, кгс/см2; Пример 10.1. Определить давление, которое водолаз оказывает р = 180/360 = 0.5 кгс/см или в единицах СИ р = 0,5 * 0,98.105 = 49000 Па = 49 кПа. Таблица 10.1. | |||||||||
Источник
Парциальное давление кислорода в крови
Диффузия газов в легких
В обычных условиях человек дышит обычным воздухом, имеющим относительно постоянный состав (табл. 1). В выдыхаемом воздухе всегда меньше кислорода и больше углекислого газа. Меньше всего кислорода и больше всего углекислого газа в альвеолярном воздухе. Различие в составе альвеолярного и выдыхаемого воздуха объясняется тем, что последний является смесью воздуха мертвого пространства и альвеолярного воздуха.
Альвеолярный воздух является внутренней газовой средой организма. От его состава зависит газовый состав артериальной крови. Регуляторные механизмы поддерживают постоянство состава альвеолярного воздуха. Состав альвеолярного воздуха при спокойном дыхании мало зависит от фаз вдоха и выдоха. Например, содержание углекислого газа в конце вдоха всего на 0,2-0,3% меньше, чем в конце выдоха, так как при каждом вдохе обновляется лишь 1/7 часть альвеолярного воздуха. Кроме того, газообмен в легких протекает непрерывно, при вдохе и при выдохе, что способствует выравниванию состава альвеолярного воздуха. При глубоком дыхании зависимость состава альвеолярного воздуха от вдоха и выдоха увеличивается.
Таблица 1. Состав воздуха (в %)
Название газа
Воздух
вдыхаемый
выдыхаемый
альвеолярный
Газообмен в легких осуществляется в результате диффузии кислорода из альвеолярного воздуха в кровь (около 500 л в сутки) и углекислого газа из крови в альвеолярный воздух (около 430 л в сутки). Диффузия происходит вследствие разности парциального давления этих газов в альвеолярном воздухе и их напряжений в крови.
Парциальное давление газа: понятие и формула
Парциальное давленые газа в газовой смеси пропорционально процентному содержанию газа и общему давлению смеси:
Для воздуха: Ратмосферное = 760 мм рт. ст.; Скислорода = 20,95%.
Оно зависит от природы газа. Всю газовую смесь атмосферного воздуха принимают за 100%, она обладает давлением 760 мм рт. ст., а часть газа (кислорода — 20,95%) принимают за х. Отсюда парциальное давление кислорода в смеси воздуха равно 159 мм рт. ст. При расчете парциального давления газов в альвеолярном воздухе необходимо учитывать, что он насыщен водяными парами, давление которых составляет 47 мм рт. ст. Следовательно, на долю газовой смеси, входящей в состав альвеолярного воздуха, приходится давление не 760 мм рт. ст., а 760 — 47 = 713 мм рт. ст. Это давление принимается за 100%. Отсюда легко вычислить, что парциальное давление кислорода, который содержится в альвеолярном воздухе в количестве 14,3%, будет равно 102 мм рт. ст.; соответственно, расчет парциального давления углекислого газа показывает, что оно равно 40 мм рт. ст.
Парциальное давление кислорода и углекислого газа в альвеолярном воздухе является той силой, с которой молекулы этих газов стремятся проникнуть через альвеолярную мембрану в кровь.
Диффузия газов через барьер подчиняется закону Фика; так как толщина мембраны и площадь диффузии одинакова, диффузия зависит от диффузионного коэффициента и градиента давления:
Qгаза — объем газа, проходящего через ткань в единицу времени; S — площадь ткани; DK-диффузионный коэффициент газа; (Р1, — Р2) — градиент парциального давления газа; Т — толщина барьера ткани.
Если учесть, что в альвеолярной крови, притекающей к легким, парциальное напряжение кислорода составляет 40 мм рт. ст., а углекислого газа — 46-48 мм рт. ст., то градиент давления, определяющий диффузию газов в легких, будет составлять: для кислорода 102 — 40 = 62 мм рт. ст.; для углекислого газа 40 — 46(48) = минус 6 — минус 8 мм рт. ст. Поскольку диффузный коэффициент углекислого газа в 25 раз больше, чем у кислорода, то углекислый газ более активно уходит из капилляров в альвеолы, чем кислород в обратном направлении.
В крови газы находятся в растворенном (свободном) и химически связанном состоянии. В диффузии участвуют только молекулы растворенного газа. Количество газа, растворяющегося в жидкости, зависит:
- от состава жидкости;
- объема и давления газа в жидкости;
- температуры жидкости;
- природы исследуемого газа.
Чем выше давление данного газа и температура, тем больше газа растворяется в жидкости. При давлении 760 мм рт. ст. и температуре 38 °С в 1 мл крови растворяется 2,2% кислорода и 5,1 % углекислого газа.
Растворение газа в жидкости продолжается до наступления динамического равновесия между количеством растворяющихся и выходящих в газовую среду молекул газа. Сила, с которой молекулы растворенного газа стремятся выйти в газовую среду, называется напряжением газа в жидкости. Таким образом, в состоянии равновесия напряжение газа равно парциальному давлению газа в жидкости.
Если парциальное давление газа выше его напряжения, то газ будет растворяться. Если парциальное давление газа ниже его напряжения, то газ будет из раствора выходить в газовую среду.
Парциальное давление и напряжение кислорода и углекислого газа в легких приведены в табл. 2.
Таблица 2. Парциальное давление и напряжение кислорода и углекислого газа в легких (в мм рт. ст.)
Название газа
Венозная кровь
Альвеолярный воздух
Источник
Нахождение парциального давления газов и общего давления смеси
Задача 47.
0,350г металла вытеснили из кислоты 209 мл водорода, собранного над водой при 20 °С и давлении 104,3 кПа. Давление насыщенного пара воды при этой температуре составляет 2,3кПа. Найти эквивалентную массу металла.
Решение:
Парциальное давление кислорода равно разности общего давления и парциального давления паров воды:
Обозначив искомый объём через и, используя объединённое уравнение закона Бойля- Мариотта и Гей-Люссака, находим V:
где Р и V — давление и объём газа при температуре T = 293К (273 +20 = 293); P = 101,325кПа; T = 273К; = 102кПа; V — объём газа при н.у..
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 22,4 : 2 = 11,2л или 11200мл. Тогда, используя формулу закона эквивалентов, рассчитаем эквивалентную массу металла:
Ответ: m(Э) = 20г/моль.
Задача 48.
250 мл водорода собраны над водой при 26°С и давлении 98,7кПа. Давление насыщенного пара воды при 26°С составляет 3,4кПа. Вычислить объем водорода при нормальных условиях и его массу.
Решение:
Парциальное давление кислорода равно разности общего давления и парциального давления паров воды:
где P и V — давление и объём газа при температуре T = 299К (273 +26 = 299); P = 101,325кПа; T = 273К; V = 95,3кПа; — объём газа при н.у..
Учитывая, что 1г Н2 занимает 11200 мл рассчитаем массу водорода, содержащуюся в 214,97мл, составив пропорцию:
Ответ:
Задача 49.
0,604г двухвалентного металла вытеснили из кислоты 581мл водорода, собранного над водой при 18°С и давлении 105,6 кПа. Давление насыщенного пара воды при 18°С составляет 2,1кПа. Найти относительную атомную массу металла.
Решение:
Парциальное давление кислорода равно разности общего давления и парциального давления паров воды.
где P и V — давление и объём газа при температуре T = 291K (273 + 18 = 291); T = 273К; P = 101,325 Kпа; V -объём газа при н.у.
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 22,4 : 2 = 11,2л или 11200мл. Тогда, используя формулу закона эквивалентов, рассчитаем эквивалентную массу металла:
M(Me) = mЭ(Me). B, где B — валентность металла. Тогда M(Me) = 12,16 . 2 = 24,32г/моль.
Ответ: M(Me) = 24,32г/моль.
Задача 50.
Сосуд наполнен смесью кислорода и азота. При каком соотношении парциальных давлений массы газов будут одинаковы:
Решение:
Парциальным давлением любого газа в смеси называется давление, которое производил бы газ, занимая при тех же условиях объём всей газовой смеси.
Так как 1моль любого газа занимает одинаковый объём при одинаковых физических условиях (например, 22,4л при н.у.), следовательно, и парциальные давления 1-го моля любого газа при тех же физических условиях будут одинаковы.
Молекулярная масса кислорода больше молекулярной массы азота в 1,14 раза (32/!4 = 1,14), то при одинаковых массах данных газов, соответственно, парциальное давление азота будет в 1,14 раза меньше, чем у кислорода, т. е.:
Ответ: б).
Задача 51.
Парциальное давление кислорода в воздухе равно 22 кПа. Чему равно содержание кислорода в процентах по объему: а) 42%; 6) 21%; в) 10,5%?
Решение:
Воздух представляет собой, в основном, смесь азота и кислорода. Для нахождения приведённого объёма кислорода, входящего в состав воздуха, приведённый к давлению смеси (Рвозд.) и температуре (Т) необходимо воспользоваться законом Бойля-Мариотта:
где
— объём кислорода; Vвозд. — объём воздуха; Рвозд. — общее давление смеси кислорода и азота (н.у.), 101,325кПа; — парциальное давление кислорода, 22кПа.
Сумма приведённых объёмов отдельных газов в смеси равняется общему объёму смеси, т. е.:
Отношение приведённых объёмов кислорода и азота к общему объёму воздуха называется объёмной долей и обозначается через r. Тогда:
Следовательно, содержание кислорода в процентах по объёму в воздухе с учётом закона Бойля-Мариотта, равно:
Ответ: б)
Задача 52.
Водород собирали в одном случае над водой, в другом над ртутью при одинаковых условиях. В обоих случаях объем газа оказался одинаковым. Одинаковы ли количества собранного водорода: а) одинаковы; б) количество водорода, собранного над ртутью, больше; в) количество водорода, собранного над водой, больше?
Решение:
Водород собирали над водой и над ртутью при одинаковых условиях при этом объёмы обеих систем оказались одинаковы. Учитывая, что ртуть имеет большую плотность, чем вода, то можно предположить, что количество водорода, собранное над ртутью будет больше, чем собранное над водой.
В обоих случаях объём газовой смеси будет складываться из определённого объёма водорода и паров жидкости, над которой собран газ. Так как температура кипения ртути и её плотность значительно выше, чем у воды, то в равных объёмах газов водорода будет содержаться больше над ртутью, так как ртути (её паров) будет в смеси значительно меньше, чем паров воды.
Таким образом, вследствие малой испаряемости ртути по отношению к воде парциальное давление паров ртути над жидкой ртутью будет меньше, чем парциальное давление паров воды над жидкой водой при одинаковых условиях и, следовательно, парциальное давление водорода над ртутью будет больше, чем над водой. Отсюда вытекает, что количество водорода, собранного над ртутью, больше, чем над водой.
Источник
Определение парциального давления газов в атмосфере
С уменьшением барометрического давления снижается и парциальное давление основных газов, входящих в состав атмосферы. Количественный же состав воздушной смеси в тропосфере остается практически неизменным. Так атмосферный воздух в нормальных условиях (на уровне моря) содержит 21% кислорода, 78% азота, 0,03% углекислого газа и почти % приходится на инертные газы: гелий, ксенон, аргон и т.д.
Парциа́льное давление (лат. partialis — частичный, от лат. pars — часть) — давление отдельно взятого компонента газовой смеси. Общее давление газовой смеси является суммой парциальных давлений её компонентов.
Парциальное давление газа в атмосферном воздухе определяется по формуле:
, (1.1)
где α — содержание газа в атмосферном воздухе в %;
Рh – барометрическое давление на фактической высоте.
Решающую роль в поддержании жизнедеятельности человека играет газовый обмен между организмом и внешней средой. Газовый обмен осуществляется за счет дыхания и кровообращения: в организм непрерывно поступает кислород, а из организма выделяется углекислый газ и другие продукты обмена веществ. Чтобы этот процесс не нарушался необходимо поддерживать парциальное давление кислорода во вдыхаемом воздухе на уровне близком к земному.
Парциальным давлением кислорода (О2) в воздухе называется часть общего давления воздуха, приходящаяся на долю О2.
Так, на уровне моря (Н=0м), в соответствии с (1.1), парциальное давление кислорода составит:
, (1.2)
где αО2 = 21% — содержание газа в атмосферном воздухе в %;
Рh=0 – барометрическое давление на высоте уровня моря
При увеличении высоты суммарное давление газов падает, однако парциальное давление таких составных частей, как углекислого газа и водяных паров в альвеолярном воздухе, практически остается без изменений.
И равно, при температуре тела человека 37 0 С примерно:
· для водяных паров РН2О=47мм рт.ст.;
· для углекислого газа РСО2=40 мм рт.ст.
При этом значительно изменяется скорость падения давления кислорода в альвеолярном воздухе.
Атмосферное давление и температура воздуха на высотах
По международному стандарту
Таблица 1.4
| № п/п | Высота, м | Барометрическое давление, мм рт.ст. | Температура воздуха, 0 С |
| 1. | |||
| 2. | 715,98 | 11,75 | |
| 3. | 674,01 | 8,5 | |
| 4. | 634,13 | 5,25 | |
| 5. | 596,17 | ||
| 6. | 560,07 | -1,25 | |
| 7. | 525,8 | -4,5 | |
| 8. | 493,12 | -7,15 | |
| 9. | 462,21 | -11,0 | |
| 10. | 432,86 | -14,25 | |
| 11. | 405,04 | -17,5 | |
| 12. | 378,68 | -20,5 | |
| 13. | 353,73 | -24,0 | |
| 14. | 330,12 | -27,25 | |
| 15. | 307,81 | -30,5 | |
| 16. | 286,74 | -33,75 | |
| 17. | 266,08 | -37,0 | |
| 18. | 248,09 | -40,25 | |
| 19. | 230,42 | -43,5 | |
| 20. | 213,76 | -46,75 | |
| 21. | 198,14 | -50,0 | |
| 22. | 183,38 | -50,25 | |
| 23. | 169,58 | -56,5 | |
| 24. | 156,71 | -56,5 | |
| 25. | 144,82 | -56,5 | |
| 26. | 133,83 | -56,5 | |
| 27. | 123,68 | -56,5 | |
| 28. | 114,30 | -56,5 | |
| 29. | 105,63 | -56,5 | |
| 30. | 97,61 | -56,5 | |
| 31. | 90,21 | -56,5 | |
| 32. | 83,86 | -56,5 |
Альвеолярный воздух — смесь газов (главным образом кислорода, углекислого газа, азота и паров воды), содержащаяся в лёгочных альвеолах, непосредственно участвующий в газообмене с кровью. Поступление кислорода в кровь, протекающую по лёгочным капиллярам, и удаление из неё углекислого газа, а также регуляция дыхания зависят от состава, поддерживаемого у здоровых животных и человека в определённых узких границах благодаря вентиляции лёгких (у человека в норме содержит 14-15% кислорода и 5-5,5% углекислого газа). При недостатке кислорода во вдыхаемом воздухе и некоторых болезненных состояниях возникают изменения состава, что может привести к гипоксии.
Парциальное давление кислорода во вдыхаемом воздухе (под маской и в верхних дыхательных путях) рассчитывается по формуле:
, (1.3)
А в альвеолярном воздухе по формуле:
, (1.4)
где αО2 — содержание газа в атмосферном воздухе в %;
Рh – барометрическое давление на определенной высоте;
РН2О=47мм рт.ст. – парциальное давление водяных паров;
РСО2=40 мм рт.ст.– парциальное давление углекислого газа
В соответствии с (1.3), парциальное давление вдыхаемого кислорода (под маской и в верхних дыхательных путях) в нормальных условиях должно быть:
, (1.5)
И парциальное давление в альвеолярном воздухе, в соответствие с (4), в нормальных условиях должно быть:
(1.6)
По оценкам ученых установлено, что нижним пределом РО2, при котором человек еще работоспособен, является РО2 = 98 мм рт.ст. Это соответствует высоте Н=3000 м, которая называется безопасной высотой.
Источник
Источник