Число фаз в сосуде
Штейнберг А. Правило фаз Гиббса //Квант. — 1989. — № 2. — С. 23-29.
По специальной договоренности с редколлегией и редакцией журнала “Квант”
Просто удивительно, сколько интересных вопросов может возникнуть при наблюдении самых обычных явлений. Ну, например… Почему лед и вода, не превращаясь друг в друга, существуют только при 0 °С? Чуть изменится температура — и либо лед начнет таять, либо вода начнет замерзать. Для нас это, конечно, счастливое обстоятельство, ведь иначе слякоть и гололед случались бы значительно чаще. И все же: почему это так? Сразу, разумеется, не ответишь, зато первый вопрос вызывает цепочку других. Услужливая память подсказывает, что у воды существует и третье «обличье» — водяной пар. Так вот, могут ли вода, пар и лед существовать в одном сосуде одновременно, не превращаясь друг в друга? Скорее всего, ответ на этот вопрос вы знаете. Но возьмите любой элемент из таблицы Менделеева. Почти каждый может существовать и в жидком, и в твердом, и в газообразном состоянии. А одновременно, в одном сосуде?
Как вы уже догадались, в этой статье мы попытаемся ответить на эти и многие другие вопросы. Для этого давайте попробуем пройти узкой тропинкой удивительных выводов, которую более 100 лет назад открыл великий американский физик Джозайя Виллард Гиббс.
Что такое фаза?
Слово «фаза» имеет множество значений. Интересующее нас введено в практику Гиббсом. Чтобы понять, что же такое фаза по Гиббсу, начнем с примеров.
При 0 °С в уличных лужах появляются кусочки льда. Первоначально однородная система — жидкая вода — распадается на две части. Их называют двумя разными фазами химического соединения Н2О. То же самое соединение может существовать и в виде третьей фазы — водяного пара.
Жидкость, кристалл и пар — самые привычные примеры разных фаз одного вещества. Однако фазы не обязательно различаются между собой именно агрегатным состоянием. Хорошо известны две твердые фазы углерода — графит и алмаз. Они имеют разные кристаллические решетки, и это приводит к колоссальному различию их свойств. Фазы могут отличаться друг от друга и по своему химическому составу, и по магнитным характеристикам (магнитная и немагнитная), и по электрической проводимости (нормальная и сверхпроводящая), и по другим свойствам.
Теперь попытаемся ввести понятие фазы более строго. За основу возьмем лаконичное определение академика М. А. Леонтовича: «В термодинамике фазой называется всякая однородная система, т. е. тело, физические свойства которого во всех точках одинаковы». Здесь надо отметить несколько тонкостей.
Во-первых, говоря о «теле», мы всегда подразумеваем, что оно состоит из большого количества микрочастиц — атомов или молекул. Как правило, мерой «большого количества» служит число Авогадро — 6·1023.
Фигурирующую в определении «однородность» тоже надо понимать на уровне «большого числа» частиц, а не отдельных атомов или молекул. Воздух — однороден и является однофазной системой, хотя и состоит из разных молекул.
В многофазной системе однородность теряется, как это было в случае льда и воды. Между разными фазами одной системы обычно существует четко выраженная поверхность раздела. Приведем здесь еще один пример. Возьмите емкость с подсолнечным маслом и накапайте туда воду. Жидкости не смешаются. Вода в масле образует свою отдельную фазу. Поверхность раздела между двумя фазами будет отчетливо видна.
Не всегда неоднородность системы и поверхность раздела видны невооруженным глазом. Сталь, например, выглядит вполне однородно, и лишь с помощью микроскопа убеждаешься в ее многофазности.
Фотографии фазовых структур стали и бронзы, сделанные с помощью микроскопа
При изменении внешних условий (температуры, давления, электрического или магнитного полей) фазы могут превращаться друг в друга (это вполне понятно уже на примере воды, пара и льда). Эти процессы так и называются — фазовые превращения.
Знакомство с фазовыми диаграммами
Начнем изучение фазовых превращений все с той же чистой воды. Для этого заключим ее в герметичный сосуд с поршнем, где ее состоянием легко управлять, меняя внешнее давление на поршень и нагревая или охлаждая сосуд. Важно понять, что никаких других способов воздействовать на фазовое состояние воды в сосуде, его при этом не открывая, у нас нет[1]. Поэтому все «события», связанные с фазовыми превращениями в замкнутом сосуде, должны быть функцией только р и Т.
Обратим внимание на одно обстоятельство: если во внешней среде поддерживается постоянная температура Т, то через некоторое время такая же температура установится во всех фазах системы. Это положение подтверждается нашим каждодневным опытом — при наличии контакта температуры разных тел выравниваются.
То же самое справедливо и в отношении давления, но с одной оговоркой: давление в разных фазах одинаково и равно внешнему, если все поверхности раздела между фазами плоские[2]. Тогда равенство давлений сразу следует из механического равновесия поверхности раздела. Если же поверхности раздела имеют конечный радиус закругления, то приходится принимать во внимание и силы поверхностного натяжения. Однако в дальнейшем мы будем предполагать, что границы фаз всегда плоские. С учетом этих замечаний состояние системы характеризуется общими для всех фаз значениями давления и температуры.
Прежде всего желательно выяснить, при каких внешних условиях происходит фазовое превращение. Для определенности остановимся на испарении воды. Если зафиксировать нормальное атмосферное давление, то вода в нашем сосуде начнет испаряться при 100 °С. При более низких температурах поршень в сосуде будет «лежать» на воде, и пара в системе не будет.
Рис. 1
Изменив давление, мы изменим и температуру начала испарения. Можно свести все данные о фазовом превращении в таблицу из двух колонок: в одной указывать давление, а в другой — температуру начала испарения. Но еще удобнее изобразить данные таблицы графически в виде зависимости температуры от давления (рис. 1). Точно так же можно в виде графиков представить данные и о двух других фазовых превращениях, которые могут происходить в системе,— превращениях вода ⇔ лед и лед ⇔ пар. В результате получим такую диаграмму, как на рисунке 2.
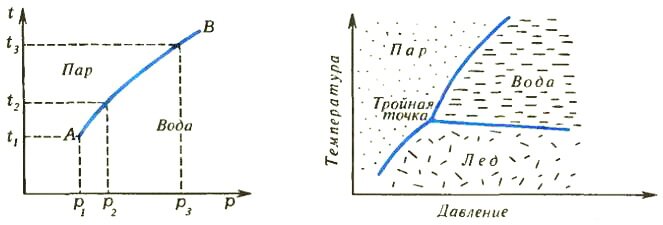
Рис. 2
Подчеркнем одно важное обстоятельство. Линии на диаграмме отделяют друг от друга области устойчивого существования соответствующих фаз. Это отнюдь не означает, будто каждая фаза «живет» только в своей области и не может «залезать» в чужую. Разумеется, может. Мы регулярно наблюдаем это, скажем, весной, когда уже при положительной температуре реки еще полны льдин. Но такое состояние не является устойчивым — лед в реке тает. Этот процесс происходит не мгновенно, а с какой-то конечной скоростью. Через несколько дней (если вновь не ударят морозы) лед обязательно растает весь, до конца. А вот вода при тех же условиях уже никогда снова не станет льдом.
Если состояние системы перестает меняться во времени, говорят, что в ней установилось равновесие. Диаграмма на рисунке 2 предсказывает только равновесное состояние системы.
Подобные диаграммы называют фазовыми. Ими очень удобно пользоваться: зная температуру и давление, сразу определяем, из каких фаз система будет состоять в равновесии. Определенным значениям давления и температуры на диаграмме соответствует точка. Если она попадает в области устойчивого существования пара, льда или жидкости, то в равновесии система будет состоять из одной соответствующей фазы. Если точка оказывается на линии диаграммы, система в равновесии будет состоять из двух фаз. Из каких именно? Совершенно очевидно: если, например, это — линия раздела «водной» и «ледяной» областей, то из льда и воды. И наконец, при единственном сочетании давления и температуры в равновесии будут находиться все три фазы.
Правило фаз в однокомпонентных системах
Не почувствовали вы по диаграмме воды, что имеются какие-то законы, регламентирующие «условия жизни» фаз? Посудите сами: в однофазном состоянии система может существовать в широком диапазоне давлений и температур, в двухфазном — только при их определенных комбинациях, а трехфазная область на диаграмме вообще стягивается в точку. Так и хочется представить фазы в роли жильцов коммунальной квартиры: чем больше жильцов, тем меньше свободы у каждого из них. Впрочем, нельзя делать выводы на основании диаграммы одного-единственного вещества. А вдруг в другом все по-другому?
И все-таки закон совместного существования фаз действительно есть. По имени своего первооткрывателя он называется правилом фаз Гиббса.
Во всех биографиях американского физика-теоретика Дж. Гиббса (1839 – 1903) подчеркивается, что жизнь этого человека была внешне бедна событиями. Все его силы были сконцентрированы на получении научных результатов, блеск которых не потускнел и сегодня. Со времени опубликования последней работы Гиббса прошло более 80 лет, а результаты его исследований продолжают использоваться в практически неизменном виде.
Правило фаз всегда считалось одним из самых значительных достижений Гиббса. Строгий вывод правила достаточно сложен. Мы приведем его в существенно упрощенном виде.
Начнем рассмотрение все с той же воды, находящейся в замкнутом сосуде[3]. Предположим, что при данных значениях р и Т в равновесии находятся жидкая фаза и пар. Молекулы Н2О в паре и в жидкости находятся в непрестанном тепловом движении. В результате некоторые из них покидают свою «родную» фазу и попадают в соседнюю. Среднее количество молекул, которые улетают за единицу времени через единицу площади из жидкости, обозначим qж. От чего может зависеть это число? Как уже отмечалось, положение дел в замкнутом сосуде зависит лишь от устанавливаемых извне давления и температуры. Поэтому величина qж также должна зависеть только от них:
qж = qж(p, T).
И совершенно аналогично для пара
qп = qп(p, T).
Явный вид этих зависимостей нам неизвестен. Он различен для разных веществ, а мы пытаемся установить общие закономерности. Вода выбрана только в качестве удобного примера, но никаких ее конкретных свойств использовано не будет. Для нашего рассмотрения важно лишь существование зависимостей, а не их явная форма.
Итак, молекулы, покидающие пар, переходят в жидкость, и наоборот. Если
qж(p, T) > qп(p, T),
то паровая фаза будет расти за счет жидкой — преобладает процесс испарения. Если же
qж(p, T) < qп(p, T),
то жидкая фаза будет «съедать» паровую — преимущества за конденсацией. Наконец, когда число молекул в каждой из фаз не меняется со временем, т. е. когда
qж(p, T) = qп(p, T),
жидкая и паровая фазы находятся в равновесии.
На фазовой диаграмме последнему уравнению соответствует линия равновесия жидкость — пар. Если бы явный вид зависимостей qж(p, T) и qп(p, T) был известен, то с помощью этого уравнения можно было бы производить практические расчеты фазовой диаграммы. Например, подставив в уравнение значение нормального атмосферного давления и решив его, получили бы для температуры равновесия значение 100 °С.
Теперь пора ввести новое понятие — число степеней свободы. Так в термодинамике принято называть количество внешних параметров, которые в некоторых пределах можно независимо друг от друга менять, не меняя при этом фазового состояния системы. В изучаемом нами случае внешних параметров всего два — давление и температура. А теперь взгляните еще раз на фазовую диаграмму воды (рис. 2). Каждому однофазному состоянию соответствует некоторая площадь, в пределах которой можно свободно варьировать оба параметра. Например, воду как таковую (жидкую) можно нагреть или приложить к ней внешнее давление, или сделать то и другое одновременно (все это, конечно, в некоторых пределах), и при этом фазовое состояние системы в сосуде не изменится — вода так и останется водой. То же самое справедливо в случае льда или пара. Можно сделать вывод, что однофазная система имеет две степени свободы.
Совсем другая ситуация при двухфазном равновесии. Имеется уравнение, связывающее оба внешних параметра. В случае равновесия жидкость — пар мы его уже записывали: qж(p, T) = qп(p, T). Поэтому свободно менять можно уже только один параметр, а другой надо «подстраивать» к нему в соответствии с уравнением. Если же мы станем менять оба параметра независимо друг от друга, то «соскочим» с линии фазового равновесия и одна из фаз исчезнет — фазовое состояние системы изменится. Поэтому состояние двухфазного равновесия имеет всего одну степень свободы.
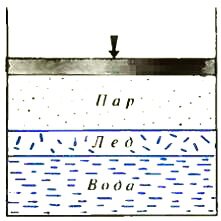
Рис. 3
Перейдем теперь к трехфазному равновесию, добавив к воде и пару лед. Предположим, что фазы в сосуде расположены так, как показано на рисунке 3. Учтем, что число молекул, покидающих за единицу времени через единицу площади лед, также будет функцией давления и температуры — qл = qл(p, T), и запишем условие равновесия фаз:
для равновесия пар — лед —
qп(p, T) = qл(p, T),
для равновесия лед — вода —
qж(p, T) = qл(p, T).
Легко понять, что аналогичные равенства можно записать для любого взаимного расположения фаз. Обычно их сразу записывают в сокращенной форме
qп(p, T) = qл(p, T) = qж(p, T).
Решение последней системы из двух уравнений с двумя неизвестными определит то сочетание давления и температуры, при котором в равновесии могут находиться все три фазы. Ясно, что число степеней свободы трехфазного равновесия равно нулю.
Если бы мы стали рассматривать четырехфазное равновесие однокомпонентной системы, уравнений стало бы уже три —
qI(p, T) = qII(p, T) = qIII(p, T) = qIV(p, T),
а неизвестных по-прежнему осталось бы два. Система из трех уравнений с двумя неизвестными в общем случае решения не имеет. Поэтому максимальное число фаз, которые могут находиться в равновесии в однокомпонентной системе, равно трем.
Содержание этих закономерностей и составляет суть правила фаз Гиббса: в однокомпонентной системе число степеней свободы C просто связано с числом фаз Ф, находящихся в равновесии,—
C = 3 – Ф (C > 0).

Рис. 4
Взгляните на три диаграммы состояния однокомпонентной системы, приведенные на рисунке 4. Не вдаваясь в рассмотрение конкретных веществ, для которых они построены, можно сразу утверждать их ошибочность. На первой диаграмме существует точка четырехфазного равновесия. На второй трехфазное равновесие имеет две степени свободы. На третьей — две степени свободы имеет двухфазное равновесие. Говоря словами одного из персонажей А. П. Чехова, «этого не может быть, потому что этого не может быть никогда». Правило фаз категорически запрещает такие ситуации.

Рис. 5
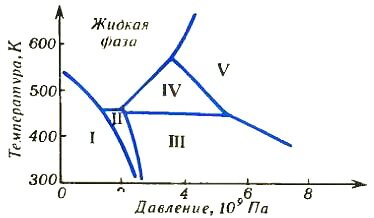
А теперь посмотрите на рисунок 5, где изображена диаграмма состояния висмута. Римскими цифрами обозначены его пять различных кристаллических фаз. Можете сами убедиться, что несмотря на довольно сложный вид диаграммы, ни один из ее участков не противоречит правилу фаз.
Правило фаз для многокомпонентных систем
Чистая вода, чистый висмут или какое-либо иное чистое вещество встречаются сравнительно редко. Значительно чаще приходится иметь дело с различными многокомпонентными системами. Например, с растворами. Простейший пример раствора — сладкая вода, состоящая из двух компонентов — сахара и воды, каждый из которых представлен своим типом молекул.
Чтобы описать состояние раствора, нужно, помимо температуры и давления, указать относительное содержание всех компонентов, т. е. их концентрации. Понятно, что в системе, состоящей из К компонентов, следует указать значение (К – 1) концентрации.
Для фаз, находящихся в равновесии, температура и давление — общие (одинаковые) параметры. А вот равенство концентраций ниоткуда не следует. Более того, легко привести пример противоположного толка. Если в чай положить слишком много сахара, то он не размешается даже при длительной и интенсивной работе ложечкой. Установится двухфазное равновесие жидкого сладкого чая и лежащего на дне твердого сахара. Понятно, что концентрации компонентов в каждой из двух фаз совершенно различны. Учтя это обстоятельство, попробуем описать ситуацию математически.
Предположим, что в системе из К компонентов в равновесии находятся Ф фаз. Теперь условия равновесия следует записать для каждого компонента :
q(1)I = q(1)II = q(1)III = … = q(1)Ф,
q(2)I = q(2)II = q(2)III = … = q(2)Ф,
…
q(K)I = q(K)II = q(K)III = … = q(K)Ф
(нижний индекс обозначает номер фазы, а верхний — номер компонента). Эта система равенств является непосредственным обобщением условий равновесия в однокомпонентной системе.
Каждая из величин q должна зависеть от общих давления и температуры — от р и Т — и от (К – 1) концентрации в своей фазе. Таким образом, общее число параметров, которые надо указать, чтобы описать равновесие, равно 2 + (К – 1)Ф. А теперь подсчитаем общее число уравнений в последней системе. Для каждого компонента оно равно (Ф – 1), а всего компонентов К. Итак, получаем К(Ф – 1).
Каждое из уравнений дополнительно связывает между собой параметры, описывающие состояние системы, и тем самым понижает число степеней свободы. Так что в многокомпонентной системе число степеней свободы равно общему числу параметров минус количество уравнений:
С = 2 + (К – 1)Ф – К(Ф – 1) = 2 – Ф + К.
(Для К= 1 (однокомпонентная система) получим уже известное нам равенство С = 3 – Ф).
Поскольку число степеней свободы по смыслу должно быть неотрицательным, из правила фаз сразу следует, что максимальное количество фаз, которые могут находиться в равновесии в К-компонентной системе, равно 2 + К.
Правило фаз выводилось для замкнутой системы. Но, строго говоря, такого почти никогда не бывает. Система обычно находится в контакте с внешней средой, с которой может происходить обмен атомами или молекулами. Иногда с этим приходится считаться. Однако в подавляющем большинстве случаев этим обстоятельством можно безболезненно пренебречь.
Из правила фаз следует очень много интересных выводов. Наверное, вы теперь без труда объясните, почему температура равновесия вода — лед строго фиксирована. Но если мы имеем дело не с чистой водой, а с каким- нибудь водным раствором, то равновесие вода — лед (не чистые!) при фиксированном внешнем давлении «захватит» целый диапазон температур. Почему это так, постарайтесь объяснить сами на основании правила фаз. Еще один пример того же рода: чистые металлы плавятся при фиксированных температурах, а их сплавы — в некотором температурном интервале. В частности, чистая медь плавится при 1083 °С. А сплав, состоящий на 95 % из меди и на оставшиеся 5 % из мышьяка, плавится (т. е. существует в виде смеси жидкого расплава и кристалла) от 800 до 1050 °С.
* * *
На примере правила фаз можно понять исключительные возможности, которые предоставляет исследователю теория. Не используя практически никакой информации о конкретных веществах, нам удалось узнать некоторые общие закономерности фазовых превращений. А это интересно не только для физиков. Фазовые превращения имеют огромное значение с точки зрения практики. Вызывая или, наоборот, тормозя их, можно управлять свойствами вещества.
Арсенал орудий труда у Гиббса был очень скромный — перо да бумага. Но ими он сумел сделать немало. Здесь уместно вспомнить крылатые слова Людвига Больцмана: «Нет ничего практичнее хорошей теории». На рубеже XIX и XX веков абстрактные идеи Гиббса о равновесиях в сложных системах (в том числе и правило фаз) были восприняты широким кругом ученых и инженеров и материализовались в промышленных процессах химии и металлургии. Происходило это бурно, иногда драматично. Но… это уже другой рассказ.
Примечания
- ↑ Сосуд можно помещать в электрическое поле, в магнитное, но эти случаи в дальнейшем рассматриваться не будут.
- ↑ В жидкой (да и в газообразной) фазе существует гидростатическое давление, но мы будем вести разговор о ситуации, когда оно много меньше общего для системы давления р.
- ↑ Хотя вода состоит из водорода и кислорода, это — пример однокомпонентной системы, так как элементы находятся в соединенном состоянии (молекулы Н2О).
Источник


