Что такое кальциевые каналы в сосудах
Автор Руслан Хусаинов На чтение 4 мин. Опубликовано 13.11.2019 16:56
Обновлено 13.11.2019 13:48
Блокаторы кальциевых каналов — это тип лекарственных средств, которые увеличивают приток крови и кислорода к сердцу. Врачи назначают блокаторы кальциевых каналов для лечения гипертонии или различных заболеваний сердца.
Что такое блокаторы кальциевых каналов?
Кальций необходим организму для мышечных сокращений. Этот минерал поступает в мышечные клетки через ионные каналы, которые представляют собой крошечные поры на поверхности клетки. Блокаторы кальциевых каналов уменьшают количество кальция, который может проникать в мышечные клетки сердца и стенки кровеносных сосудов через эти каналы. При этом они снижают давление в кровеносных сосудах и на сердце.
Врачи обычно используют блокаторы кальциевых каналов для лечения гипертонической болезни. Их также используют при:
- боли в груди, или стенокардии
- ишемической болезни сердца
- нерегулярном сердцебиении, или аритмии
- мигрени
Ученые в настоящее время изучают другие потенциальные применения блокаторов кальциевых каналов. Ученые считают, что снижая высокое кровяное давление, блокаторы кальциевых каналов могут снизить риск развития болезни Альцгеймера.
Другие типы препаратов имеют эффект, подобный эффекту блокаторов кальциевых каналов.
Бета-блокаторы
Бета-блокаторы замедляют сердечную деятельность, ограничивая действие гормонов стресса, таких как адреналин и норадреналин. Эти препараты эффективны в снижении артериального давления. Примеры бета-блокаторов включают Атенолол (Тенормин) и Метопролол (Лопрессор). Ученые обнаружили, что бета-блокаторы и блокаторы кальциевых каналов эффективны в снижении артериального давления, что делает их полезными для лечения различных заболеваний, которые влияют на сердце, включая стенокардию и аритмию.
Однако врачи рекомендуют блокаторы кальциевых каналов в качестве первой линии фармакологического лечения гипертонии, а бета-блокаторы — в качестве второй линии выбора.
Ингибиторы АПФ
Ингибиторы ангиотензинпревращающего фермента (АПФ) являются еще одним типом препаратов для лечения высокого кровяного давления и различных заболеваний сердца. Они расслабляют кровеносные сосуды и облегчают работу сердца. Ингибиторы АПФ блокируют ферменты, которые сужают кровеносные сосуды, что позволяет крови продвигаться по сосудам, не оказывая на них большого давления. Примеры ингибиторов АПФ включают Лизиноприл (Принивил, Зестрил), Эналаприл (Вазотек) и Беназеприл (Лотензин). Перечисленные выше препараты могут вызвать некоторые побочные эффекты, такие как кашель или раздражение кожи. Врачи иногда назначают ингибитор АПФ с блокатором кальциевых каналов.
Разновидности блокаторов кальциевых каналов
Существует два различных типа блокаторов кальциевых каналов, которые называются дигидропиридинами и недигидропиридинами.
Дигидропиридины направлены на определенный тип кальциевых каналов в организме, заставляя кровеносные сосуды расширяться, снижая кровяное давление. Примеры дигидропиридинов включают:
- Амлодипин (Норваск)
- Фелодипин (Плендил)
- Никардипин (Карден)
- Нифедипин (Адалат, Прокардия)
- Нимодипин (Нимотоп)
Иногда эти препараты могут слишком сильно расширить кровеносные сосуды, что может приводить к отекам на ногах. Врачи могут минимизировать этот риск, уменьшая дозу или назначая блокаторы кальциевых каналов с расширенным высвобождением. Организм поглощает эту форму препарата в течение длительного периода, что предотвращает чрезмерное расширение кровеносных сосудов.
Недигидропиридины расширяют кровеносные сосуды так же, как и дигидропиридины. Тем не менее, они имеют дополнительные эффекты на сердце, которые могут контролировать быстрый сердечный ритм. В настоящее время существует только два недигидропиридиновых препарата: Верапамил (Калан, Изоптин) и Дилтиазем (Кардизем). Врачи используют Верапамил для уменьшения боли в груди, поскольку препарат расслабляет кровеносные сосуды и уменьшает количество кислорода, необходимое сердцу. Верапамил также полезен для замедления аномально быстрых и потенциально опасных сердечных ритмов, таких как суправентрикулярная тахикардия.
Дилтиазем — это препарат для контроля аритмии сердца (быстрого или нерегулярного сердечного ритма) и снижения артериального давления. По сравнению с верапамилом, он оказывает менее значительное влияние на частоту сердечных сокращений.
Побочные эффекты и риски блокаторов кальциевых каналов
Общие побочные эффекты блокаторов кальциевых каналов включают:
- усталость
- изжогу
- покраснение лица
- отеки в области живота, лодыжек и стоп
Реже эти препараты могут вызвать:
- запор
- головокружение
- нарушение сердцебиения, которое становится слишком быстрым или медленным
- покалывание или онемение в руках и ногах
- одышку
- хрипы
- расстройство желудка
- затрудненное глотание
- кашель
К редчайшим побочным эффектам блокаторов кальциевых каналов относятся:
- кровоточивость десен
- головная боль
- боль в груди
- обморок
- лихорадка
- желтый оттенок глаз и кожи, называемый желтухой
- сыпи
Если человек испытывает какие-либо из этих побочных эффектов от приема блокаторов кальциевых каналов, он должен обратиться к врачу.
Научная статья по теме: Снижение риска развития деменции добились путем применения антигипертензивных препаратов.
Источник
21 декабря, 2017  Кардиология
Кардиология 

Кальциевые каналы — это трансмембранные белки сложного строения, состоящие из нескольких субъединиц. Через эти каналы поступают также ионы натрия, бария и водорода. Различают потенциал-зависимые и рецептор-зависимые кальциевые каналы. Через потенциал-зависимые каналы ионы Са2+ проходят сквозь мембрану, как только ее потенциал снижается ниже определенного критического уровня. Во втором случае поток ионов кальция через мембраны регулируется специфическими агонистами (ацетилхолин, катехоламины, серотонин, гистамин и др.) при их взаимодействии с рецепторами клетки.
В настоящее время выделяют несколько типов кальциевых каналов (L, T, N, P, Q, R), обладающих разными свойствами (в т.ч. проводимость, длительность открытия) и имеющих разную тканевую локализацию.
Каналы L-типа (long-lаsting large-capacitance, от англ. long-lаsting — долгоживущий, large — большой; имеется в виду проводимость канала) медленно активируются при деполяризации клеточной мембраны и обусловливают медленный вход ионов Са2+ в клетку и формирование медленного кальциевого потенциала, например в кардиомиоцитах. Каналы L-типа локализованы в кардиомиоцитах, в клетках проводящей системы сердца (синоаурикулярном и AV узлах), гладкомышечных клетках артериальных сосудов, бронхов, матки, мочеточников, желчного пузыря, ЖКТ, в клетках скелетных мышц, тромбоцитах.
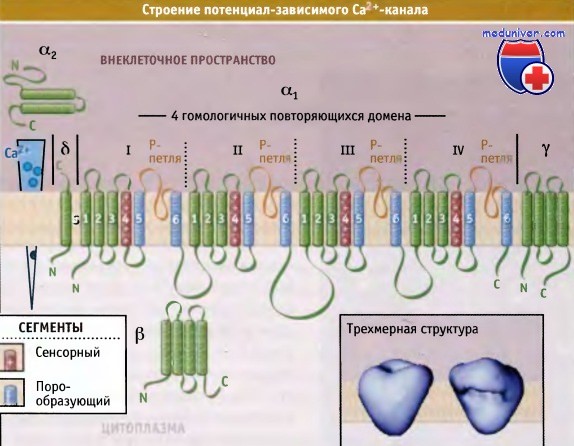
Медленные кальциевые каналы образованы крупной α1-субъединицей, формирующей собственно канал, а также более мелкими дополнительными субъединицами — α2, β, γ, δ. Альфа1-субъединица (молекулярная масса 200–250 тыс.) соединена с комплексом субъединиц α2β (молекулярная масса около 140 тыс.) и внутриклеточной β-субъединицей (молекулярная масса 55–72 тыс.). Каждая α1-субъединица состоит из 4-х гомологичных доменов (I, II, III, IV), а каждый домен — из 6 трансмембранных сегментов (S1–S6). Комплекс субъединиц α2β, и β-субъединица могут влиять на свойства α1-субъединицы.
Каналы T-типа — транзиторные (от англ. transient — скоротечный, кратковременный; имеется в виду время открытия канала), быстро инактивируются. Каналы Т-типа называют низкопороговыми, т.к. они открываются при разности потенциалов 40 мВ, тогда как каналы L-типа относят к высокопороговым — они открываются при 20 мВ. Каналы Т-типа играют важную роль в генерации сердечных сокращений; кроме того, они принимают участие в регуляции проводимости в предсердно-желудочковом узле. Кальциевые каналы Т-типа обнаружены в сердце, нейронах, а также в таламусе, различных секреторных клетках и др. Каналы N-типа (от англ. neuronal — имеется в виду преимущественное распределение каналов) обнаружены в нейронах. N-каналы активируются при переходе от очень отрицательных значений мембранного потенциала к сильной деполяризации и регулируют секрецию нейромедиаторов. Ток ионов Са2+ через них в пресинаптических окончаниях ингибируется норадреналином через α-рецепторы. Каналы P-типа, выявленные первоначально в клетках Пуркинье мозжечка (отсюда и происходит их название), обнаружены в гранулярных клетках и в гигантских аксонах кальмара. Каналы N-, P-, Q- и недавно описанного R-типов, видимо, регулируют секрецию нейромедиаторов.
В клетках сердечно-сосудистой системы расположены преимущественно медленные кальциевые каналы L-типа, а также T- и R-типов, причем в гладкомышечных клетках сосудов содержатся каналы трех типов (L, T, R), в клетках миокарда — в основном L-типа, а в клетках синусного узла и нейрогормональных клетках — каналы Т-типа.
Источник
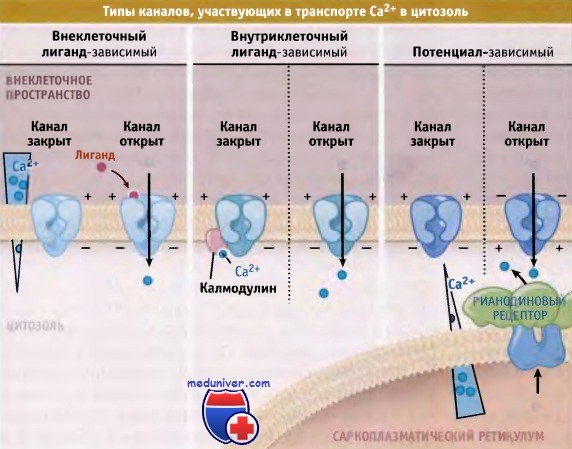
Кальциевые каналы мембраны клетки• Са2+-каналы, расположенные на поверхности клетки, переводят сигналы, получаемые мембраной, во внутриклеточные Са2+-сигналы • Потенциал-зависимые Са2+-каналы представляют собой асимметричные белковые комплексы, состоящие из пяти различных субъединиц • Подобно К+-каналу, а-субъединица потенциал-зависимых Са2+-каналов образует пору и содержит структуру поровой петли • Селективный фильтр Са2+-канала образует электростатическую ловушку • Са2+-канал стабилизируется в закрытом состоянии с помощью блокаторов канала Ионы Са2+ представляют собой вторичный мессенджер и контролируют многие клеточные функции, такие как сокращение сердечной и скелетных мышц, зрительный процесс в сетчатке глаза, иммунный ответ Т-клеток, возбудимость нервных клеток и поведенческие реакции, а также секрецию инсулина b-клетками поджелудочной железы. Активация клеточных функций наступает в ответ на изменения концентрации Са2+ в цитозоле покоящейся клетки, которая примерно в 10 000 раз ниже, чем его концентрация во внеклеточной среде. Запасы Са2+ в эндоплазматическом (ЭПР) и в саркоплазматическом ретикулуме (СР) достигают таких же величин, как его содержание во внеклеточной среде. Уровень Са2+ в цитозоле регулируется за счет совместного функционирования различных растворимых Са2+ связывающих белков, а также белков, осуществляющих его трансмембранный перенос. Например, различные типы Са2+-каналов в плазматической мембране, в ЭПР и СР катализируют селективный транспорт ионов в цитозоль в направлении их электрохимического градиента. Различные типы каналов характеризуются различными воротными механизмами с участием внеклеточных лигандов, электрического потенциала, или же самих ионов Са2+. При закрытии Са2+-каналов плазматической мембраны прерывается передача сигнала, и ионы Са2+ начинают выходить из цитозоля при участии специальных транспортных белков. Закрытие Са2+-каналов плазматической мембраны, которое предотвращает попадание в клетку избытка ионов Са2+, происходит с участием двух основных механизмов: Са2+-зависимой и потенциал-зави-симой инактивации. При активации белка калмодули-на, который связывается с внутриклеточным доменом Са2+-канала в ответ на поступление Са2+ в клетку, происходит инактивация многих типов Са2+-каналов по механизму отрицательной обратной связи. В настоящем разделе мы рассмотрим предполагаемый механизм транспорта ионов через Са2+-каналы, основное внимание уделив потенциал-зависимым Са2+-каналам, и сравним механизмы их функционирования с работой К+-каналов.
Потенциал-зависимые Са2+-каналы обеспечивают транспорт Са2+ в клетки в тех случаях, когда значения мембранного потенциала изменяются в положительную сторону за счет деполяризации. Эти каналы переводят электрический сигнал плазматической мембраны во внутриклеточный сигнал. Поступление в клетку ионов Са2+ приводит к увеличению его концентрации до определенного уровня и тем самым к запуску различных процессов, таких, как, например, мышечное сокращение, высвобождение гормонов и нейромедиаторов, активация Са2+-зависимых каскадных процессов и транскрипция генов. Существуют различные типы потенциалзависимых Са2+-каналов, которые классифицируются в соответствии с их электрофизиологическими и фармакологическими свойствами. В данной статье мы рассмотрим Са2+-каналы L-типа, которые были клонированы первыми и остаются наиболее изученными. Каналы этого типа находятся в плазматической мембране скелетных мышц, миокарда и гладких мышц, а также нейронов. Активация их происходит при деполяризации мембраны. Эти каналы называются каналами L-типа потому, что они в течение долгого времени могут оставаться в открытом состоянии. В клетках скелетных и гладких мышц, миокарда, в нейронах, эндокринных клетках и сетчатке они представлены основными Cavl.X изоформами. Са2+-каналы L-типа представляют собой гетероолигомерные белковые комплексы, состоящие из пяти субъединиц: а1, а2, δ, b и γ. Функционирование канала и его позиционирование на мембране требуют участия всех субъединиц. Присутствие гидрофобных и гидрофильных последовательностей в составе a1-субъединицы позволяет предполагать существование четырех порообразующих структур, каждая из которых состоит из трансмембранных сегментов 5 и 6 и из поровой петли, входящей в состав селективного фильтра. Также предполагается существование четырех сенсорных сегментов, каждый из которых состоит из трансмембранных сегментов 1-4. Такой тип трансмембранной организации напоминает потенциал-зависимые Na+-каналы. Субъединица b участвует в инактивации и закрытии канала. Вместе с а-субъединицей она может контролировать воротный механизм за счет взаимодействия с порообразующим трансмембранным сегментом S6 домена I. При использовании метода электронной криомикроскопии были получены данные, позволившие предложить трехмерную структуру, описывающую строение потенциал-зависимого Са2+-канала L-типа. Как показано на рисунке ниже, канал представляет собой асимметричный белок, по форме напоминающий сердце и в широкой части снабженный подобием ручки. Большая часть локализована вне клетки и включает структуру наподобие ручки, а2-субъединицу, N-терминальный участок субъединицы δ и внеклеточные петли субъединиц а1 и у.
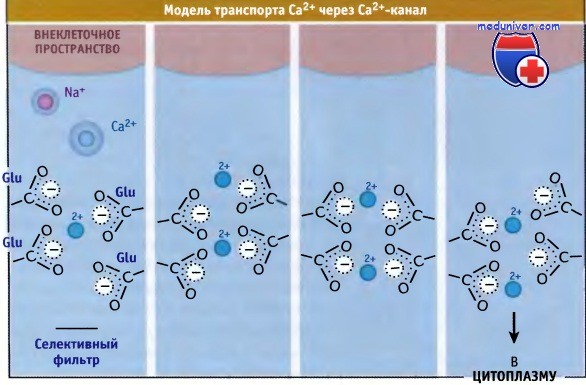
Са2+-каналы обладают высокой селективностью по отношению к ионам Са2+ и осуществляют транспорт ионов с высокой скоростью. Ионы Na+ относятся к числу самых распространенных внеклеточных катионов, и их концентрация почти в 100 раз превышает концентрацию ионов Са2+. Диаметр ионов Na+ близок к диаметру ионов Са2+ (2,0 А). Поэтому посредством простого молекулярного сита разделить их невозможно. Каким же образом Са2+-каналы достигают высокой селективности в отношении ионов Са2+ и в то же время обеспечивают их быстрый транспорт? Поры К+-каналов обладают селективными фильтрами, которые имитируют водное окружение, стабилизирующее транспортируемые ионы. При прохождении через фильтр ионы подвергаются дегидратации. Например, селективные фильтры К+-каналов обладают четырьмя Р-петлями, образующими довольно жесткую структуру, изнутри облицованную атомами кислорода карбонильной группы. Этим достигается определенное расположение ионов К+ на пути транспорта. Селективный фильтр потенциалзависимых Са2+-каналов, вероятно, также образован четырьмя Р-петлями. Однако полагают, что он представляет собой более гибкую структуру, каждая Р-петля которой содержит глутаминовый остаток, причем транспортный путь ионов облицован атомами кислорода не от карбонильных, а от карбоксильных групп. (Такая конструкция напоминает EF руку сайта связывания Са2+, когда ион располагается в полости, содержащей атомы кислорода, многие из которых относятся к карбоксильным группам.) Четыре глутаминовых остатка образуют т. н. локус ЕЕЕЕ, консервативную структуру, характерную для Са2+-каналов. Локус ЕЕЕЕ контролирует предпочтительный транспорт ионов Са2+ по сравнению с другими катионами. Замещение любого из четырех остатков глутамата другими аминокислотами резко снижает селективность канала в отношении ионов Са2+. Предполагается, что специфическое связывание именно ионов Са2+ в области устья поры обеспечивается боковыми цепями глутаминовой кислоты. Это подтверждается данными in vitro электрофизиологических измерений, которые демонстрируют, что в отсутствие ионов Са2+ через Са2+-каналы начинают проходить ионы Na+. Ионы Na+ проходят через канал быстрее ионов Са2+. Более низкая скорость транспорта ионов Са2+ позволяет предполагать, что они прочнее связываются с порами канала. Это препятствует входу в пору ионов натрия, несмотря на то что во внеклеточном пространстве их содержится больше, чем ионов Са2+. Сродство каналов к ионам Са2+ составляет около 10-6 М. Однако скорость транспорта, рассчитанная на основании этих данных, получается в 1000 раз ниже, чем измеренная, которая составляет 106 в 1 с. Для разрешения этого противоречия была предложена специальная модель. Согласно этой модели, локус ЕЕЕЕ способен связывать несколько ионов Са2+, и входящий в пору ион, благодаря возникающим силам электростатического отталкивания, вызывает высвобождение с внутренней стороны связанного иона Са2+. Таким образом, электростатическое отталкивание помогает преодолеть силу сродства связывания Са2+, которая бы замедлила его транспорт. Эта модель напоминает предложенную для К+-каналов, которые, как показано, обладают несколькими сайтами связывания катиона. Потенциал-зависимые Са2+-каналы являются основными клиническими мишенями для лекарственных препаратов, используемых при лечении гипертонии и других заболеваний. К числу наиболее часто применяемых лекарственных средств относятся фенилалкиламины, бензотиазепины и дигидропиридины, которые обычно называют кальциевыми антагонистами. Первоначально, Са2+-антагонисты были введены в клиническую практику для лечении гипертонии как сосудорасширяющие средства. Они уменьшали уровень Са2+ в гладких мышцах, например в стенке кровеносных сосудов, приводя к снижению тонуса и кровяного давления. Эксперименты по сайт-направленному мутагенезу и по связыванию лекарств позволили идентифицировать сайты, связывающие лечебные препараты. Они находятся в сегментах S5 и S6 III домена и в сегменте S6 IV домена, расположены с цитоплазматической стороны селективного фильтра. Ингибиторы ряда фенилалкиламина блокируют Са2+-каналы за счет прямого взаимодействия с остатками глутамата Р-петли селективного фильтра, которые находятся со стороны цитоплазмы, а дигидропиримидины и бензотиазепины проникают в пору канала со стороны наружного устья.
– Также рекомендуем “Хлоридные каналы мембраны клетки” Оглавление темы “Переносчики ионов через мембрану клетки”:
|
Источник