Что такое васкуляризация сосудов
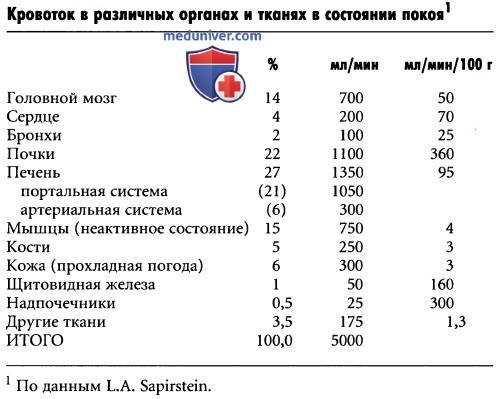
Васкуляризация тканей. Формирование и рост новых кровеносных сосудовОсновным механизмом долговременной регуляции местного кровотока является изменение количества кровеносных сосудов в тканях. Так, длительная активизация метаболических процессов в данной ткани вызывает усиленную васкуляризацию ткани; если же уровень метаболизма снижается, количество кровеносных сосудов в ткани уменьшается. Так происходит изменение васкуляризации тканей в зависимости от их метаболических потребностей. Эта реконструкция сосудистой системы развивается быстро (через несколько дней) у очень молодых животных, а также в быстрорастущих тканях зрелого организма (например, в рубцовой ткани или в растущей опухоли). И наоборот, в зрелых, высокодифференцированных тканях подобный процесс протекает медленно. Таким образом, на долговременную регуляцию кровотока требуется всего несколько дней у новорожденных, и более месяца – у лиц старшего возраста. Кроме того, результат перестройки сосудистого русла оказывается гораздо лучшим в молодых тканях. Так, у новорожденных сосудистая сеть способна практически полностью удовлетворять возросшие потребности тканей, в то время как в зрелых тканях васкуляризация зачастую намного отстает от потребностей ткани. Роль кислорода в долговременной регуляции. Кислород имеет большое значение не только в быстрой краткосрочной регуляции местного кровотока, но и в долговременной регуляции. Одним из примеров является усиленная васкуляризация тканей у животных, обитающих на больших высотах, где содержание кислорода в атмосфере низкое. Другим примером может быть наблюдение за куриными зародышами, развивающимися в условиях гипоксии, у которых число кровеносных сосудов в 2 раза превышает нормальную плотность сосудов в тканях. Подобный эффект может иметь самые неблагоприятные последствия у недоношенных детей, помещенных в кислородную палатку с лечебными целями. Избыток кислорода немедленно прекращает рост сосудов сетчатки глаза у недоношенного ребенка и даже вызывает дегенерацию уже имеющихся сосудов. Затем, когда ребенка извлекают из кислородной палатки, начинается бурный рост сосудов в тканях глазного яблока, и кровеносные сосуды прорастают в стекловидное тело глаза, что приводит к слепоте. Такое явление называют ретроленталъной фиброплазией.
Формирование и рост новых кровеносных сосудовОбнаружены более 10 факторов, которые усиливают рост новых кровеносных сосудов. Почти все они являются короткими пептидами, из них 3 фактора изучены лучше других: сосудистый эндотелиальный фактор роста, фактор роста фибробластов и ангиогенин. Каждый из них был выделен из тканей с неадекватно низким кровоснабжением. По-видимому, дефицит кислорода или питательных веществ (или и того, и другого) приводит к образованию сосудистых факторов роста (так называемых ангиогенных факторов). В сущности, все ангиогенные факторы вызывают рост новых сосудов одинаковым способом: они способствуют появлению новых сосудов путем разрастания и ветвления старых сосудов. Первым этапом этого процесса является растворение базальной мембраны эндотелия в точке ветвления. Затем начинается быстрое образование новых эндотелиальных клеток, которые мигрируют через сосудистую стенку, образуя сосудистый росток, направленный к источнику ангиогенных факторов. Клетки продолжают быстро делиться и свертываются в трубку. Трубка соединяется с другой такой же, формирующейся от другого сосуда (артериолы или венулы), – и появляется капиллярная петля, в которой начинается кровоток. Если кровоток достаточно велик, в стенку нового сосуда переселяются гладкомышечные клетки, сосуд становится артериолой или венулой, а иногда и более крупным сосудом. Так, ангиогенез объясняет механизм, с помощью которого метаболические факторы тканей способствуют росту новых сосудов. Ряд других веществ, таких как некоторые стероидные гормоны, оказывают на мелкие кровеносные сосуды противоположное действие. При этом происходит разрушение сосудистых клеток и исчезновение сосудов. Следовательно, количество кровеносных сосудов может уменьшаться, когда необходимость в них отпадает.
Васкуляризация зависит от максимальной потребности тканей в кровоснабжении, а не от среднего уровня кровоснабжения. Исключительно важной характеристикой долговременной регуляции кровоснабжения является то, что васкуляризация тканей обусловлена главным образом максимальным уровнем кровотока, необходимого тканям, а не средним уровнем их потребностей. Необходимость в таком максимальном кровотоке может возникать не более чем на несколько минут в день. Тем не менее, даже такой кратковременной предельной нагрузки достаточно для выделения эндотелиальных факторов роста в мышечной ткани, чтобы усилить ее васкуляризацию. Если этого не происходит, каждый раз, когда человеку приходится выполнять тяжелую физическую нагрузку, его мышцы не могут развить необходимую силу сокращения, т.к. они не получают достаточного количества кислорода и питательных веществ. Однако если избыточная васкуляризация произошла, большая часть кровеносных сосудов обычно пребывает в состоянии сужения. Они открываются только под действием местных факторов, таких как недостаток кислорода, влияние сосудорасширяющих нервов и других факторов, свидетельствующих о необходимости резко увеличить кровоток. Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021 – Также рекомендуем “Коллатеральное кровообращение. Гуморальная регуляция кровообращения” Оглавление темы “Регуляция кровоснабжения”: 1. Различия в кровоснабжении разных органов и тканей. Механизмы регуляции кровотока 2. Вазодилататорная и гипоксическая теория регуляции кровотока в органах и тканях 3. Реактивная гиперемия. Активная гиперемия 4. Метаболическая и миогенная регуляция кровотока. Краткосрочная регуляция кровотока 5. Эндотелиальный сосудорасширяющий фактор. Долговременная регуляция местного кровотока 6. Васкуляризация тканей. Формирование и рост новых кровеносных сосудов 7. Коллатеральное кровообращение. Гуморальная регуляция кровообращения 8. Ангиотензин II и вазопрессин. Эндотелин и брадикинин 9. Влияние ионов на сосуды. Нервная регуляция кровообращения 10. Парасимпатическая регуляция кровообращения. Сосудодвигательный центр головного мозга |
Источник
10.02.2021 43313
За здоровьем сосудов нужно следить в любом возрасте. Но бывают ситуации, когда иммунная система по ошибке воспринимает клетки сосудов как чужеродные и атакует их. Так развиваются геморрагические васкулиты, повреждения сосудов.
Иммунная система – это надзорный орган тела, который распознает чужеродные объекты (инфекции, раковые клетки, опасные белки) и удаляет их. Собственные клетки при любых иммунных реакциях затрагиваться не должны, они работают в штатном режиме. Но иногда возникают сбои, может развиваться системный васкулит.
Это аутоиммунное заболевание, которое вызывает воспаление и сужение кровеносных сосудов (артерий, вен и капилляров).
Эти сосуды переносят кровь к сердцу и органам и от них. Это редкое заболевание заставляет иммунную систему атаковать кровеносные сосуды, из-за чего страдает кровообращение. В тяжелых случаях состояние может привести к повреждению органов или смерти.
Васкулит: классификация и диагностика
Поражения больших, крупных сосудов вплоть до аорты. Это ревматическая полимиалгия, артериит Такаясу, височный артериит (гигантоклеточный артериит).
Повреждения средних сосудов, артериаол и венул. Это болезнь Бюргера, кожный васкулит, болезнь Кавасаки, узелковый полиартериит.
Могут страдать мелкие сосуды – капилляры. Это синдром Бехчета, синдром Чарджа-Стросса, кожный васкулит, пурпура Геноха-Шенлейна, микроскопический полиангиит, гранулематоз с полиангиитом, васкулит Гольфера, криоглобулинемия
Симптомы васкулита могут возникать один или несколько раз в течение нескольких лет. Заболевание поражает людей любого возраста, расы и пола. Есть отдельные данные, что женщины чаще болеют им, как и любыми другими аутоиммунными патологиями.
Почему развивается поражение сосудов
Васкулит у взрослых возникает, когда иммунная система ошибочно воспринимает кровеносные сосуды как инородного захватчика и атакует их. Причины, по которым это происходит, до конца не изучены. Эти состояния могут возникать сами по себе или параллельно с другими ревматическими заболеваниями.
Нередко заболевание сопровождает ревматоидный артрит, системную красную волчанку (СКВ) или синдром Шегрена. Другие возможные триггеры включают инфекцию (гепатит B или C) или побочный эффект от некоторых лекарств. Он также может быть связан с некоторыми видами рака крови, например, лейкемией и лимфомой.
Симптомы васкулита
Признаки сильно различаются от легких, едва заметных до опасных для жизни. Они зависят от типа заболевания, конкретных пораженных органов и насколько тяжелое общее состояние. У некоторых людей может быть всего несколько признаков и симптомов. Другие люди могут страдать от общего недомогания. Иногда симптомы развиваются медленно, в течение месяцев, в то время как в других случаях признаки и симптомы проявляются быстро, в течение нескольких дней или недель.
Общие признаки
Высокая температура
Потеря аппетита
Потеря веса
Усталость и постоянное недомогание с резкой слабостью
Общие боли и дискомфорт в теле.
Поражение органов и систем организма
Кожа: пурпурные, красные пятна или шишки; скопления мелких точек, пятен, синяков или крапивница; зуд.
Суставы: боль или признаки артрита в одном или нескольких суставах.
Легкие: одышка; кровохарканье.
Желудочно-кишечный тракт: язвочки во рту; боль в животе; в тяжелых случаях – блокировка кровотока в кишечнике, что может вызвать непроходимость или разрыв кишечника.
Придаточные пазухи, нос, горло и уши: частые инфекции придаточных пазух (синуситы) или хронические инфекции среднего уха; язвочки в носу; в некоторых случаях потеря слуха.
Глаза: краснота, зуд, жжение в глазах; светочувствительность; помутнение зрения; редко слепота.
Мозг: головные боли; проблемы с ясным мышлением; изменения психической функции; симптомы инсульта, такие как мышечная слабость и паралич.
Нервы: онемение, покалывание и слабость в различных частях тела; потеря чувствительности или силы в руках и ногах; стреляющие боли в руках и ногах.
В тяжелых случаях васкулит может вызвать полное закрытие кровеносных сосудов, в результате чего кровь не может проходить через них, или они вздуваются (образуются аневризмы) и, возможно, лопаются (разрывы аневризм).
Диагностика васкулита
Происходит на основании признаков и симптомов, истории болезни, медицинского осмотра и результатов анализов. Лабораторные тесты – анализы крови и мочи могут показать аномальные уровни определенных клеток крови и антител (белков) в крови.
Биопсия – часто наилучший способ поставить точный диагноз васкулита. Во время биопсии врач берет небольшой образец пораженного кровеносного сосуда или органа для изучения под микроскопом, ищет признаки воспаления или повреждения тканей.
Другие возможные тесты и обследования (зависят от симптомов)
Ангиография.
Общий анализ мочи.
Эхокардиограмма.
Рентгенограмма грудной клетки.
Функциональные тесты легких.
УЗИ брюшной полости.
Компьютерная томография (КТ).
Магнитно-резонансная томография (МРТ).
Измерение артериального давления.
Электрокардиограммя (ЭКГ).
Лечение васкулита
Это зависит от типа заболевания, пораженных органов и степени тяжести состояния. Основная цель – уменьшить воспаление в пораженных кровеносных сосудах. Люди с тяжелым васкулитом лечатся строго под контролем врача. Людям с легким васкулитом могут помочь безрецептурные обезболивающие или противовоспалительные препараты, такие как парацетамол, аспирин, ибупрофен или напроксен.
Обычные рецептурные лекарства – это кортикостероиды и противоревматические препараты, модифицирующие заболевание (DMARD). Кортикостероиды помогают уменьшить воспаление кровеносных сосудов. Врачи могут назначить модифицирующие заболевание противоревматические препараты, такие как азатиоприн, метотрексат и циклофосфамид, если васкулит тяжелый или если кортикостероиды не работают. Эти препараты атакуют источник воспаления.
Рекомендации врача
Соблюдение здоровой диеты.
Проведение плановых прививок.
Регулярные занятия спортом.
Периодические визиты к врачу и анализы.
Источник: ( Ссылка )
Специальное предложение по медизделиям приютам для животных
Подробнее
Вакансия: Юрист, помощник юриста
Подробнее
Источник
Опыт раннего выявления рака большинства локализаций (шейка матки, губа, кожа), соответствуя экспериментальным данным, подтверждает, что злокачественная опухоль возникает преимущественно на фоне предраковых состояний. Возникновение эпителиальных опухолей denovo, которое описано в литературе, едва ли возможно, так как многие переходные этапы становления опухоли могут протекать латентно и быстротечно, сопровождаясь слабыми морфологическими и клиническими проявлениями. По мере углубления инвазии опухоли вероятность метастазирования увеличивается.
Сопоставляя структурные проявления различных стадий канцерогенеза, можно выделить следующие этапы формирования опухоли
предопухолевые пролифераты (гиперплазия);
доброкачественные опухоли;
дисплазия;
carcinoma in situ;
инвазивный рак.
При росте опухоли и при формировании метастазов исключительно важную роль играет образование сосудов – ангиогенез. Образование сосудов является одним из важных факторов, регулирующих процессы пролиферации опухолевых клеток, влияющих на прогрессию и спонтанную регрессию злокачественных новообразований. В 1971 г. J. Folkman выделил белковый фактор, который стимулирует деление клеток эндотелия, вызывает пролиферацию капилляров и способствует их врастанию из прилежащей неопухолевой ткани в опухоль. В настоящее время выделены и другие ангиогенные факторы белковой природы, которые могут продуцироваться опухолями, как ускоряющие, так и ингибирующие образование сосудов.
К позитивным факторам, способствующим ангиогенезу, относят: ангиогенин, трансформирующий ростовой фактор, фактор роста эндотелия сосудов, фактор роста фибробластов, эпидермальный фактор роста, гранулярно-макрофагальный колониестимулирующий фактор, фактор некроза опухоли, IL-8. Эти факторы вызывают образование сосудов в опухолевом очаге за счет миграций в него эндотелиальных клеток из прилегающей соединительной ткани и последующего их деления. К негативным регуляторам, подавляющим образование сосудов, относятся: ангиостатин – компонент плазминогена, ингибитор хрящевой ткани, гепариназа, тканевой ингибитор протеиназ и др.
Уже с началом ангиогенеза, появляется возможность метастазирования опухоли, что в принципе возможно после того, как количество клеток достигнет 106, а размеры опухоли превысят 1-2 мм. В новообразованиях меньших размеров питательные вещества и кислород поступают в опухоль из окружающей ткани в ограниченном количестве посредством диффузии. Дальнейший рост опухоли зависит от образования сосудов, через которые клетки могли бы получать кислород и питательные вещества. Сразу после васкуляризации опухоли начинается быстрое, экспоненциальное размножение клеток. Питание васкуляризированной опухоли осуществляется за счет механизмов перфузии, что способствует ее росту и повышает возможность инвазии и метастазирования. Считается, что метастазирование возможно только начиная с этой фазы развития опухоли, и уже с момента сосудообразования раковые клетки могут попадать в кровеносное русло. Прекращение по тем или иным причинам образования сосудов в опухоли может на время остановить ее рост и перевести в «дремлющее» состояние, что может быть использовано для лечения опухолей.
Опухолевый рост и на сегодняшний день остается одним из самых загадочных явлений природы. Несмотря на множество предложенных определений, ни одно из них не может дать исчерпывающего представления об опухоли. Можно выделить лишь 3 основные группы признаков, свойственных новообразованиям:
приобретение клетками свойства «бессмертия» (иммортальности), способности делиться в бесконечном количестве генераций;
автономность клеточного роста;
атипия – своеобразие морфологических и функциональных свойств.
В какой-то мере опухолевый рост можно определить как извращенную регенерацию, при которой клетки могут делиться неограниченное количество раз, приобретая свойство «бессмертия». Все опухоли происходят из камбиальных или герминативных клеток, служащих источником регенерации тканей, которые некоторые авторы называют еще стволовыми. В процессе дифференцировки опухолевые клетки приобретают сходство с тканями, из которых они развились. Практически все ткани организма могут быть источниками опухолевого роста.
Особенностью опухолевого роста является атипия – комплекс отличительных признаков от нормальных тканей. Выделяют структурную и функциональную атипию. Функциональная атипия опухолевых клеток выражается в усилении анаэробного гликолиза – расщеплении глюкозы до лактата в присутствии кислорода. В опухолевых клетках активируется расщепление глюкозы по пентозофосфатному шунту и/или анаэробному пути. Гликолиз протекает не только в отсутствие снабжения кислородом клетки, но и в его присутствии, что создает известную устойчивость опухолевых клеток к гипоксии. В опухолевой ткани гликолитические процессы преобладают над окислительными. Клетки новообразований содержат мало аэробных ферментных систем: цитохрома, каталазы. осе перестройки метаболизма в опухоли направлены на приспособление клеток к дефициту кислорода, который всегда сопровождает ее рост.
Гликолиз сопровождается накоплением молочной кислоты в тканях, что делает их сходными с эмбриональной тканью. По составу опухолевая клетка отличается от неопухолевой большим содержанием воды, ионов натрия и кальция в меньшей степени – калия, значительно снижается концентрация магния. По сравнению с неопухолевой клеткой цитоплазма опухолевой клетки более богата белками, нейтральными жирами и фосфолипидами, холестерином, гликогеном нуклеиновыми кислотами, недоокисленными продуктами обмена.
Структурная, или морфологическая, атипия опухоли выражается в нарушении гистотипической, цитотипической и ультраструктурной дифференцировок. Выраженность структурной атипии бывает различной не только в гистогенетически разных новообразованиях, но и в пределах одной и той же опухоли.
Тканевая атипия характеризуется нарушением порядка расположения клеток, свойственного для данной ткани и органа. Опухолевые клетки и их комплексы располагаются в виде беспорядочных, хаотично ориентированных комплексов и скоплений. Бесспорным признаком злокачественной опухоли является инвазия опухолевых клеток (от лат. in vaza – в сосуд, что означает первоначальный смысл слова «инвазия») за пределы органа, проникновение клеток в лимфатические и кровеносные сосуды и рост по периневральным щелям.
Клеточный, или цитологический, атипизм – это морфологические проявления опухолевого роста на уровне клетки. Он выражается в полиморфизме – изменении размеров и формы клеток. В ряде случаев злокачественной опухоли, наоборот, свойственна мономорфность клеток. Одним из проявлений клеточного атипизма является ядерный атипизм, который характерен преимущественно для злокачественных опухолей. Ядерная атипия выражается в увеличении относительных размеров ядер, что проявляется увеличением ядерно-цитоплазматического соотношения, многочисленными фигурами деления и наличием патологических митозов. Полиморфизм ядер характеризуется разнообразием формы и размеров, изменением плотности окраски по сравнению с нормальным клеточным прототипом. Клеточный атипизм может быть различной степени выраженности, иногда он так значителен, что опухолевые клетки становятся непохожими на клетки исходной ткани и органа. При крайней степени морфологической катаплазии строение опухоли упрощается, и она становится монотонной по клеточному составу.
В клетках новообразований увеличивается количество свободных рибосом, не связанных с эндоплазматической сетью. Цитоскелет опухолевых клеток характеризуется дезорганизацией всех компонентов. В клетках неоплазмы, как правило, уменьшено количество митохондрий. Преобладают полиморфные, уродливые, крупные и гигантские формы этих органелл с нарушенной ориентацией и хаотичным расположением крист. Электронно-микроскопически ядра опухолевых клеток, как правило, имеют крайне сложную и причудливую конфигурацию, выглядят сегментированными и окружены большим количеством инвагинатов, которые имеют вид трубок и карманов, содержащих элементы цитоплазмы. В некоторых случаях они имеют пористый вид и напоминают по строению губку. В ядрах обнаруживается своеобразная дольчатость и изрезанность мембраны.
Несмотря на сходство всех признаков опухолевого роста, он настолько разнообразен, что дать общую схему строения опухолей, в которую укладывалось бы все разнообразие форм существующих новообразований, практически невозможно. Поэтому в клинико-анатомическом и клинико-физиологическом плане нельзя говорить об опухоли вообще. Своеобразие конкретной формы новообразования зависит от особенностей этиологии, гисто- и морфогенеза, локализации опухоли, ее распространенности.
По течению процесса и прогнозу опухоли, в основном, подразделяются на доброкачественные и злокачественные. К категории доброкачественных относят новообразования, имеющие благоприятный прогноз. Для них характерен медленный рост, отсутствие способности к метастазированию, инфильтрирующему росту, рецидивированию. Нередко они вообще могут прекращать свой рост, претерпевая инволюционные изменения.
Однако понятие доброкачественности является относительным. Например, доброкачественные опухоли тонкой кишки – лейомиомы больших размеров, сдавливающие петли, могут вызывать инвагинацию и некроз кишечника. Угрожать жизни больного также могут и доброкачественные опухоли, вызывающие эндокринные нарушения. Примером тому служат гормонально-активные аденомы надпочечников, паращитовидных желез.
Для злокачественных новообразований характерны относительно быстрый рост, способность к метастазированию и диссеминации, инвазия опухолевых клеток в прилежащие органы. В финале своего развития опухоль может разрушать жизненно важные органы и целые системы организма. Но понятие злокачественности, как и доброкачественности, также относительное. Некоторые злокачественные новообразования при том, что они способны к метастазированию, имеют более доброкачественное течение, обладая более низким метастатическим потенциалом и инвазивными свойствами. Так, аденокарциномы эндометрия имеют лучший прогноз по сравнению с плоскоклеточным раком шейки матки. Плоскоклеточный рак легкого – более медленно развивающаяся форма, чем мелкоклеточный рак, который имеет очень агрессивное течение и рано метастазирует. Фолликулярный и папиллярный раки щитовидной железы даже при наличии отдаленных метастазов успешно лечатся радиоактивным иодом и обладают лучшим прогнозом по сравнению с другими типами рака этого органа – медуллярным и недифференцированным.
Источник

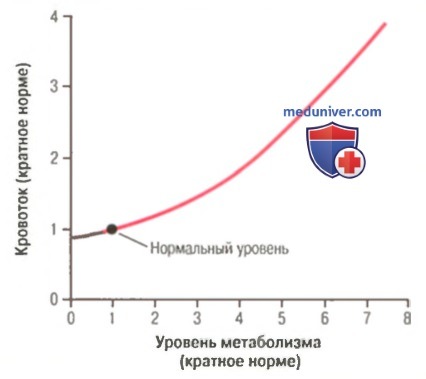 Влияние уровня метаболизма на местный тканевой кровоток
Влияние уровня метаболизма на местный тканевой кровоток