Давление аргона в сосуде
Аргон (обозначается как Ar) — наиболее часто встречающийся в воздухе инертный газ. Он отличается полной химической инертностью. Это свойство позволяет широко применять газ в таких областях, как сварка, упаковка, производство материалов высокой чистоты, а также для тушения пожаров.
Инертный газ аргон
История открытия
Предыстория открытия Ar началась в 1785 году. Выдающийся ученый и естествоиспытатель из Великобритании Генри Кэвендиш исследовал состав воздуха. Он подвергал азот окислению и взвешивал получившиеся окислы. По окончании опыта в сосуде оставался газ. Кэвендиш определил его объем в 0,8% от начального объема воздуха.
Состав этого газа ученый определить не смог. Спустя столетие к проблеме вернулись сэры Джон Рэлей и Уильям Рэмзи. В ходе проведенных опытов они обнаружили, что азот, выделенный из воздуха, имеет большую плотность, нежели азот, получаемый в ходе реакции разложения нитрита аммония.
в 1884 году им удалось выделить из воздуха некий газ, более плотный, чем азот. Это вещество имело одноатомную молекулярную структуру и было крайне инертным — т.е. не реагировало с другими веществами.
На заседании Королевского Общества новому газу было присвоено название «аргон», что в переводе с древнегреческого значило «спокойный, ленивый»
Аргон в природе
Ввиду практически полной инертности Ar представлен в естественной среде исключительно в несвязанном виде. Его процентная доля в различных частях Земли равна приблизительно:
- земная кора — 0,00012%;
- морская вода — 0,00045%;
- атмосфера — 0,926%.
Доля Ar в воздухе выше, чем суммарная доля всех остальных инертных газов. Основным источником для его добычи служит наша атмосфера.
Содержание газов в атмосфере
В коре Земли аргон содержится также в виде радиоактивного изотопа Аргон-40 и появляется в ходе реакции распада изотопов Калия.
Современная наука вместе с остальными инертными газообразными элементами относит Ar к VIII группе периодической системы.
Как добывают аргон
Благодаря значительному с промышленной точки зрения содержанию аргона в воздухе его получают в качестве дополнительного продукта криогенной ректификации O2 и N2.
Технология основана на том факте, что температура кипения (или сжижения) Ar лежит между температурами N2 и O2.
Перед началом процесса воздух подвергается тщательной очистке от пыли в многоступенчатых фильтрах, осушается от водяных паров, а далее мощными компрессорами сжимается до тех пор, пока не перейдет в жидкое состояние. Жидкость перегоняют в ректификационной колонне, чтобы разделить ее на отдельные вещества.
Установка для добычи аргона
Первым испаряется азот при -195 °С, его пары собираются на соответствующей тарелке ректификатора и отводятся в отдельный резервуар. Следующим по высоте (и при температуре кипения -185 °С) отбирается аргонная фракция, содержащая 12% Ar, менее полпроцента азота и кислород. Она подается в следующую ректификационную колонну, в которой процентная доля Ar доводится до 85, оставшееся приходится на кислород со следами азота. Такое вещество называется сырым аргоном, исходным материалом для получения очищенного газа.
В промышленности применяется несколько методов очистки сырого аргона от примесей.
Водород, добавляемый в состав сырья, окисляется на катализаторе и нагреве до 500 °С, таким образом, из состава смеси выводится кислород. Образовавшийся на катализаторе водяной пары удаляют при посредстве влагоотделителя. Газ после этого осушают. Аргон с оставшимся в нем азотом вновь ректифицируют.
Применяются и альтернативные методы получения Ar. Во время синтеза аммиака из азота и водорода в химических реакторах Ar получают как сопутствующий продукт производства. Технологический компонент это синтеза — продувочный газ — содержит до 20% Ar. Из этого газа и извлекают самый спокойный элемент. Стоимость производства, складывающаяся в основном из затрат на охлаждение и нагрев компонентов, делится между аммиаком и аргоном, и получается существенно ниже.
Качество газа, получаемого любым методом, определяется технологией очистки его от небольших количеств остаточного N2, O2, водяных паров и H2.
Аппарат, получающий ионные пучки аргона
Общая характеристика Ar
Ar входит в группу инертных газов. Заряд его ядра — 18, под таким же номером элемент располагается в таблице Менделеева.
Из всех участников VIIIA группы он является наиболее часто встречающимся в природе. Объемная доля Ar в атмосфере -0,93%, массовая доля составляет 1,28%.Элемент является газом без цвета, вкуса и запаха. Химически не активен – аргон не вступает в реакцию и практически не соединяется ни с какими элементами или веществами, за исключением CU(Ar)O, и гидрофторида аргона.
Весьма плохо растворим водой, чуть большая растворимость наблюдается при взаимодействии с органическими растворителям.
Виды аргона
Говоря о видах, или сортах Ar, надо понимать, что это одно и то же химическое вещество. Виды различаются по степени очистки от примесей.
- Высший сорт. Содержание Ar не менее 99,99% . Этот сорт особо высокой чистоты применяется для ответственных сварочных работ, таких, как сварка материалов, химически активных в нагретом состоянии: некоторые цветные сплавы, прежде всего титановые, нержавеющая сталь и др. Используется также для сварки высоконагруженных изделий из конструкционной стали.
- Первый сорт. Содержание Ar не менее 99,98%, Применяется при сварке сплавов на основе алюминия с другими металлами и сплавами, для менее активных цветных металлов.
- Второй сорт. Содержание Ar не менее 99,95%. Используется при сваривании деталей из жаростойких стальных сплавов, алюминия и конструкционных сталей. Применение чистого Ar в этих случаях нежелательно, поскольку приводит к повышенной пористости материала шва и не позволяет защитить сварочную ванну от повышенной влажности и других загрязнений. Во избежание возникновения такого дефекта в состав смеси защитных газов добавляют углекислый газ и кислород, связывающие выделяющийся при сварке водород и другие примеси. Образующиеся в ходе этих реакций шлаки всплывают на поверхность сварочной ванны и после застывания удаляются вместе с окалиной.
Физические и химические свойства
Свойства аргона типичны для члена VIII группы.
При обычной температуре Ar пребывает в газообразном состоянии. Молекула включает в себя единственный атома, химическая формула весьма простая: Ar. Температура кипения весьма низка : -185,8 °С при атмосферном уровне давления.
Растворимость в воде низкая — всего 3,29 мл на 100 мл жидкости
Плотность аргона при нормальных условиях составляет 1,78 кг/м3. Молярная теплоемкость газа- 20,7 Дж/Кмоль.
Характеристики аргона и других инертных газов
Газ практически полностью инертен. На сегодняшний день ученым удалось получить лишь два его соединения — CU(Ar)O, и гидрофторид аргона. Соединения существуют лишь при сверхнизких температурах. Предполагается, что Ar может входить в состав неустойчивых в нормальном состоянии молекул эксимерного типа. Такие молекулы могут существовать лишь в возбужденном состоянии, например, в ходе электроразряда высокой интенсивности. Такие соединения возможны с ртутью, кислородом и фтором.
Электроотрицательность по шкале Полинга равна 4,3.
Как степень окисления, так и электродный потенциал имеют нулевое значение, что характерно для инертного газа.
Ионный радиус составляет 154, радиус ковалентности — 106 Пм. Ионизационный порог- 1519 кдж/моль
Атомная и молекулярная масса
Такие важные параметры, как атомная и молекулярная массы, показывают, насколько масса молекулы вещества и масса его атома соответственно превышают значение, равное одной двенадцатой доле массы атома водорода.
Ввиду того, что молекула Ar состоит из единственного атома, молекулярная и атомная масса аргона идентичны и составляют 39,984.
Структура аргона и его свойства
Изотопы
В природных условиях Ar встречается в качестве трех устойчивых изотопов
- 36Ar– процентная доля этого изотопа составляет 0,337% в ядре 18 протонов и 18 нейтронов;
- 38Ar- его доля всего 0,063%, в ядре 18 протонов и 20 нейтронов;
- 40Ar – наиболее распространен, его доля составляет 99,6%, в ядре так же 18 протонов, но уже 22 нейтрона.
Искусственным путем удавалось получать изотопы с массовым индексом от 32 до 55, наиболее стабильным из них оказался 39Ar, период полураспада которого составляет 268 лет.
Большая процентная доля 40Ar среди изотопов, встречающихся в природе, вызвана постоянным образованием его в ходе реакции распада изотопа калий-40. На 1000 кг калия в ходе таких реакций за год образуется не более 3100 атомов 40Ar. Но, поскольку эти реакции идут постоянно в течение сотен миллионов лет, изотоп накопился в природе в существенных объемах.
Доминирование тяжелого изотопа в природе обуславливает тот факт, что атомный вес Ar превышает атомный вес калия, находящегося в таблице следом за ним. При создании Периодической системы такого противоречия не было, поскольку аргон был обнаружен и свойства его были исследованы значительно позже, в первом десятилетии XX века. Первоначально Ar был помещен в первую группу таблицы, восьмая группа была выделена позднее.
Ионы
Как и другие инертные газы (такие, как He и Ne), Ar подвержен ионизации. При возбуждении атомов и сообщении им высоких энергий возникают молекулярные ионы Ar2+.
Молекула и атом
Для инертных газов эти понятия идентичны, поскольку эти элементы не желают вступать в химическую связь даже с себе подобными. Молекула включает в себя один атом, химическая формула газа не отличается от обозначения элемента: Ar.
Молярная масса
Молярная масса аргона составляет 39,95 г/моль.
Существуют несколько методов ее вычисления:
- С применением относительной атомной массы M и коэффициента пропорциональности к, выражающего соотношение между относительной массой и молярной. Этот коэффициент является универсальной константой и равен для всех элементов. Молярная масса M выражается как произведение коэффициента пропорциональности на относительную массу.
- С использованием молярного объема. Потребуется найти объем, занимаемый при обычных условиях некоторой массой газа, далее рассчитать массу 22,4 литров вещества при таких же условиях.
- С применением уравнения Менделеева-Клапейрона, моделирующего идеальный газ.
pV = mRT / M,
проведя преобразования, получим выражение для молярной массы:
M=mRT/pV
где
- p – давление в паскалях,
- V –объем в кубометрах
- m – масса в граммах,
- Т — температура в Кельвинах,
- R – константа, значение которой 8,314 Дж/(моль×К).
Область применения
Шире всего аргон применяется при сварочных работах. Он используется для создания защитной атмосферы вокруг сварочной ванны, вытесняя из рабочей зоны O2 и N2, содержащиеся в атмосфере. Особенно важно это для сварки цветных металлов, многие из которых, к примеру, Ti, отличаются высокой химической активностью в нагретом состоянии. Незаменим инертный газ также для неразъемного соединения нержавеющих и высоколегированных сплавов.
Также широко применяется при монтаже высоконагруженных строительных конструкций, таких, как каркасы высотных зданий, фермы мостов и многих других. Здесь его применение обеспечивает высокое качество, однородность и долговечность ответственных соединений. В строительной индустрии аргонная сварка доминирует среди других методов.
Не менее широко применяется аргонная сварка в машиностроении, прежде всего химическом и пищевом. Швы получаются долговечные и надежные, даже в условиях воздействия агрессивных сред.
Нефтяная и газовая отрасли также применяют аргонная сварку при монтаже трубопроводов, газоперекачивающих станций и нефтеперегонных комбинатов.
Используется метод также в атомной промышленности, в транспортном машиностроении и в аэрокосмической отрасли.
В домохозяйствах аргонная сварка распространена не так широко. Это объясняется:
- высокой стоимостью оборудования и расходных материалов;
- необходимостью достаточной квалификации сварщика;
- меньшими нагрузками, испытываемыми домашними конструкциями;
- более низкими требованиями к прочности и долговечности сварных соединений.
Если в домохозяйстве возникает эпизодическая потребность в таких сварочных работах, то дешевле, быстрее и надежнее пригласить сварщика-специалиста.
Характерным свойством Ar является его более высокая плотность по сравнению с воздухом. Поэтому максимальная эффективность аргонной сварки достигается при нижнем сварочном положении. В этом случае инертный раз растекается по поверхности детали и образует защитное облако значительной протяженности, позволяя вести сварку, как большими токами, так и на большой скорости. При сварке в наклонном и верхнем положении приходится учитывать «проваливание» аргона сквозь воздух. Чтобы компенсировать это явление, либо увеличивают подачу газа, либо проводят работы в герметичном помещении, заполненным инертным газом. В обоих случаях себестоимость работ возрастает.
Поскольку потенциал ионизации Ar невысок, его использование обеспечивает идеальные геометрических характеристик сварочного шва, прежде всего, профиля. Возбужденная электродуга в аргоновой атмосфере также отличается высокой стабильностью своих параметров. С другой стороны, низкое значение потенциала ионизации обуславливает и более низкое напряжение розжига и поддержания дуги. Это сокращает ее тепловыделение и усложняет провар толстых листов металла.
Более высокая температура дуги в аргоновой атмосфере существенно повышает проплав сварочного шва. Это позволяет проводить сварку за один проход при условии точного соблюдения параметров зазора между заготовками.
В случае применения TIG-метода сварочных работ аргоновая атмосфера защищает от коррозионного влияния не только зону сварки, но и окончание неплавкого электрода.
В ряде специфических случаев в состав защитной газовой смеси добавляют гелий.
Кроме применения при сварочных работах, аргон используется:
- Как плазмоообразующее веществона установках плазменного раскроя металла.
- Для создания инертной среды в упаковках пищевых продуктов. Он вытесняет из пакетов и контейнеров кислород воздуха и водяные пары, пагубно влияющие на срок годности продуктов. Продукты в защитной атмосфере хранятся в несколько раз дольше, чем в обычной упаковке. Применяется этот метод и для упаковки медицинских изделий и препаратов, позволяя сохранить их в должной стерильности и химической чистоте.
- В качестве активного агента в противопожарных установках. Аргон вытесняет кислород (или другой газ) из очага горения, прекращая его.
- Для создания защитной среды в технологических установках при обработке полупроводниковых устройств, создании микросхем и других электронных компонентов или материалов высоких степеней чистоты.
- Наполнитель электроламп.
- В рекламных люминесцентных трубках.
Зависимость давления аргона в баллоне от температуры
По мере нагрева давление газообразного вещества в замкнутом объеме повышается. В таблице приведены примерные значения давления в баллоне в зависимости от температуры окружающего воздуха.
| T, °C | P, Мегапаскаль |
| -40 | 10,45 |
| -30 | 11,33 |
| -20 | 12,21 |
| -10 | 12,92 |
| 13,74 | |
| +10 | 14,62 |
| +20 | 15,33 |
| +30 | 16,03 |
Следует учитывать, что баллонное давление изменяется не мгновенно, а по мере его прогрева или охлаждения.
Техника безопасности при работе с аргоном
Сам по себе не являясь ядовитым, аргон при неправильном использовании может нанести серьезный вред здоровью или даже создать угрозу жизни.
Аргон замещает кислород воздуха и создает смесь, непригодную для дыхания. Человек может пострадать или даже погибнуть от удушья. Сжиженный аргон имеет очень низкую температуру и при контакте с незащищенной кожей приводит к тяжелым обморожениям.
Газоразрядная трубка с аргоном
Во избежание неприятных последствий при работе с газом следует неукоснительно соблюдать следующие правила:
- При работе в атмосфере аргона обязательно использовать изолирующий противогаз.
- При работе на полуавтоматах с подачей аргона обеспечить вентиляцию рабочей зоны.
- Использовать газоанализатор, содержание кислорода в воздухе должно быть не ниже 19%.
- Спецодежда должна полностью закрывать коду, быть чистой и целой.
Перед началом работы также следует осмотреть баллоны, шланги и запорную арматуру на предмет отсутствия механических повреждений и утечек газа.
Источник
11. МКТ и Термодинамика (объяснение явлений)
1. Вспоминай формулы по каждой теме
2. Решай новые задачи каждый день
3. Вдумчиво разбирай решения
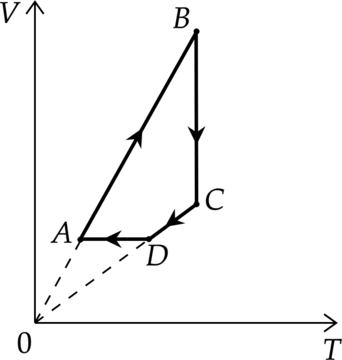
На рисунке показана зависимость давления газа (p) от его плотности (rho) в циклическом процессе, совершаемом 2 моль идеального газа в идеальном тепловом двигателе. Цикл состоит из двух отрезков прямых и четверти окружности.
На основании анализа этого циклического процесса выберите два верных утверждения.
1) В процессе 1−2 температура газа уменьшается.
2) В состоянии 3 температура газа максимальна.
3) В процессе 2−3 объём газа уменьшается.
4) Отношение максимальной температуры к минимальной температуре в цикле равно 8.
5) Работа газа в процессе 3−1 положительна.
“Демоверсия 2017”
1) По уравнению Клапейрона – Менделеева: [p=dfrac{rho}{mu}RT,] где (T) – температура, (mu) – молярная масса газа.
Давление уменьшилось в 4 раза, а плотность увеличилась в 2 раза, следовательно, температура уменьшилась в 8 раз.
Утверждение 1 – (color{green}{small text{Верно}})
2) Аналогично предыдущему пункту [p=dfrac{rho}{mu}RT] Максимальная температура будет в состоянии 1 (давление максимально, плотность минимальна)
Утверждение 2 – (color{red}{small text{Неверно}})
3) В процессе 2 – 3 плотность меньшается, а по формуле: [rho =dfrac{m}{V}] Объем увеличивается
Утверждение 3 – (color{red}{small text{Неверно}})
4) Аналогично пункту 2, минимальность температуры будет достигнута в точке с наименьшим давлением и наибольшей плотностью (т. 2), а отношение температур действительно равно 8
Утверждение 4 – (color{green}{small text{Верно}})
5) В процессе 2 – 3 плотность постоянна, следовательно, объем постоянен и газ не совершает работу.
Утверждение 5 – (color{red}{small text{Неверно}})
Ответ: 14
Сосуд разделён на две равные по объёму части пористой неподвижной перегородкой. В начальный момент времени в левой части сосуда содержится 4 моль гелия, в правой – 40 г аргона. Перегородка может пропускать молекулы гелия и является непроницаемой для молекул аргона. Температура газов одинаковая и остаётся постоянной. Выберите два верных утверждения, описывающих состояние газов после установления равновесия в системе.
1) Концентрация гелия в правой части сосуда в 2 раза меньше, чем аргона.
2) Отношение давления газов в правой части сосуда к давлению газа в левой части равно 1,5.
3) В правой части сосуда общее число молекул газов меньше, чем в левой части.
4) Внутренняя энергия гелия и аргона одинакова.
5) В результате установления равновесия давление в правой части сосуда увеличилось в 3 раза.
“Демоверсия 2020”
Перегородка проницаема только для молекул гелия, поэтому в результате установления равновесия парциальное давление гелия в левой части будет равно парциальному давлению гелия в правой части. Давление газа можно вычислить по формуле: [p=dfrac{nu R T}{V}] Парциальные давления гелия в левой и правой части одинаковы, одинаковы температуры и объёмы частей, следовательно, одинаковы и количества вещества гелия в левой и правой частях сосуда, то есть в левой и правой части сосуда будет содержаться по 2 моля гелия.
Найдём связь концентрации и количества вещества: [n=dfrac{N}{V}=dfrac{nu N_A}{V}] То есть концентрации и количества вещества зависят прямо пропорционально друг от друга, также заметим, что чем больше количество вещества, тем больше и количество молекул.
Найдём количество вещества аргона: [nu_{Ar}=dfrac{m_{Ar}}{mu_{Ar}}=dfrac{40text{ г}}{40text{ г/моль}}=1text{ моль}]
Используя полученное выше, рассмотрим данные в задании утверждения.
Концентрация гелия в два раза больше концентрации аргона в правой части сосуда
1) (color{red}{small text{Неверно}})
Концентрация гелия в два раза больше концентрации аргона в правой части сосуда
2) (color{green}{small text{Верно}})
Отношение давлений: [dfrac{p_text{ п}}{p_text{ л}}=dfrac{nu_text{ г.п}+nu_{Ar}}{nu_text{ г.л}}=dfrac{2text{ моль}+1text{ моль}}{2text{ моль}}=1,5] Где (nu_{text{ г.п.}},nu_{text{ г.л.}}) – количество вещества гелия в правой части, количество вещества гелия в левой части соответственно.
3) (color{red}{small text{Неверно}})
Количество вещества газов в правой части сосуда больше количества вещества газа в левой части сосуда, следовательно, в правой части сосуда общее число молекул газа больше, чем в левой части сосуда.
4) (color{red}{small text{Неверно}})
Внутренняя энергия одноатомного идеального газа может быть вычислена по формуле: [U=dfrac{3}{2}nu R T] Температура газов одинакова. Количество вещества гелия больше количества вещества аргона, следовательно, внутренняя энергия гелия больше внутренней энергии аргона.
5) (color{green}{small text{Верно}})
айдём отношение конечного давления в правой части сосуда к начальному давлению в правой части сосуда: [dfrac{p_{k}}{p_text{ н}}=dfrac{nu_{text{ г.п.}}+nu_{Ar}}{nu_{Ar}}=dfrac{2text{ моль}+1text{ моль}}{1text{ моль}}=3]
Ответ: 25
В цилиндрическом сосуде под поршнем находится газ. Поршень может перемещаться в сосуде без трения. На дне сосуда лежит стальной шарик (см. рисунок). Газ нагревают.
Выберите из предложенного перечня два верных утверждения, верно описывающие данный процесс, и укажите их номера.
1) Объём газа в этом процессе остаётся неизменным.
2) Давление газа в сосуде остаётся неизменным.
3) Плотность газа в этом процессе увеличивается.
4) Сила Архимеда, действующая на шарик, уменьшается.
5) Концентрация молекул газа в сосуде увеличивается.
1) Так как поршень подвижный (не закреплен), то процесс будет происходить при постоянном давлениии.
Уравнение состояния газа: [pV=nu RT] где (nu) — количество вещества, (T) — температура в Кельвинах, (p) — давление газа, (V) — объем, занимаемый газом, (R) — универсальная газовая постоянная. Выразим объем [V=dfrac{nu RT}{p}] При нагревании газа объем увеличивается.
Утверждение 1 — (color{red}{smalltext{Неверно }})
2) Утверждение 2 — (color{green}{smalltext{Верно }})
3) Плотность газа: [rho=dfrac{m}{V}] При нагревании объем увеличивается, значит плотность уменьшается.
Утверждение 3 — (color{red}{smalltext{Неверно }})
4) Сила Архимеда: [F_{text{Арх}}=rho gV] где (rho) — плотность газа, (V) — объем шарика, (g) — ускорение свободного падения. Плотность уменьшается, значит, сила Архимеда уменьшается.
Утверждение 4 — (color{green}{smalltext{Верно }})
5) Концентрация: [n=dfrac{N}{V}] При нагревании газа объем увеличивается, концентрация уменьшается.
Утверждение 5 — (color{red}{smalltext{Неверно }})
Ответ: 24
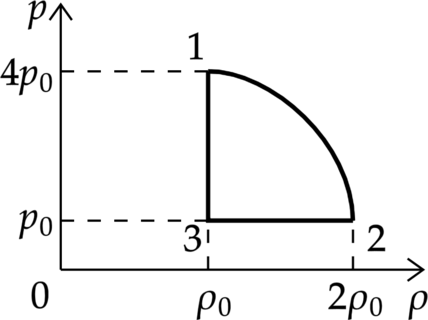
На (pV)—диаграмме отображена последовательность трёх процессов (1 — 2 — 3) изменения состояния 2 моль идеального газа. 
Из предложенного перечня утверждений выберите два правильных и укажите их номера.
1) В процессе 1 газ отдаёт положительное количество теплоты.
2) Процесс 2 является изотермическим.
3) В процессе 3 газ совершает работу.
4) В процессе 2 происходит расширение газа при постоянной температуре.
5) В процессе 1 происходит сжатие газа при постоянной температуре.
Работа газа находится как площадь под графиком 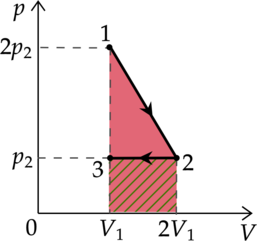
1) Первое начало термодинамики: [Q=Delta U+A] где (Delta U) — изменение внутренней энергии, (A) — работа газа, (Q) — количество теплоты, полученное газом. (Delta U=0), так как температура в процессе 1 не изменяется. При увеличении давления в изотермическом процессе объём уменьшается. (Delta V<0), следоватлеьно, (A<0). Таким образом, (Q<0), то есть газ отдает кол-во теплоты в данном процессе.
Утверждение 1 — (color{green}{smalltext{Верно }})
2) В процессе 2 температура увеличивается.
Утверждение 2 — (color{red}{smalltext{Неверно }})
3) (p=const), следовательно (Vsim T)
Температура уменьшается, то есть объем тоже уменьшается, (Delta V<0), (A<0)
Утверждение 3 — (color{red}{smalltext{Неверно }})
4) В процессе 2 температура увеличивается.
Утверждение 4 — (color{red}{smalltext{Неверно }})
5) Температура в процессе 1 не изменяется. По закону Бойля-Мариотта (p V=const) так как давление увеличивается объём уменьшается.
Утверждение 5 —(color{green}{smalltext{Верно }})
Ответ: 15
На рисунке показан график циклического процесса, проведённого с одноатомным идеальным газом, в координатах (V-T), где (V) — объём газа, (T) — абсолютная температура газа. Количество вещества газа постоянно. 
Из приведённого ниже списка выберите два правильных утверждения, характеризующие процессы на графике, и укажите их номера.
1) В состоянии (B) концентрация газа максимальна.
2) В процессе (AB) газ отдаёт некоторое количество теплоты.
3) В процессе (BC) внутренняя энергия газа увеличивается.
4) Давление газа в процессе (CD) постоянно, при этом внешние силы совершают над газом положительную работу.
5) В процессе (DA) давление газа изохорно уменьшается.
1) В точке (B) объем максимален, а концентрация минимальна:
Утверждение 1 —(color{red}{smalltext{Неверно }})
2) Первое начало термодинамики: [Q=Delta U+A] где (Delta U) — изменение внутренней энергии, (A) — работа газа, (Q) — количество теплоты, полученное газом. В процессе (AB) работа равна (0), температура увеличивается, то есть (Delta U>0), значит (Q>0), то есть газ получает тепло
Утверждение 2 — (color{red}{smalltext{Неверно }})
3) Процесс (BC) — изотермический. Внутренняя энергия не меняется.
Утверждение 3 — (color{red}{smalltext{Неверно }})
4) Процесс (СD) — изобарное сжатие. При уменьшении объема внешние силы совершают положительную работу.
Утверждение 4 — (color{green}{smalltext{Верно }})
5) Процесс (DA) — изохорное охлаждение ((psim T)). Следовательно, при уменьшении температуры давление уменьшается.
Утверждение 5 — (color{green}{smalltext{Верно }})
Ответ: 45
Идеальный газ перевели из состояния 1 в состояние 3 так, как показано на графике зависимости давления р газа от объёма V. Количество вещества газа при этом не менялось. 
Из приведённого ниже списка выберите два правильных утверждения, характеризующие процессы на графике.
1)Абсолютная температура газа минимальна в состоянии 2.
2)В процессе 1-2 абсолютная температура газа уменьшилась в 2 раза.
3)В процессе 2-3 абсолютная температура газа уменьшилась в 1,5 раза.
4)Плотность газа максимальна в состоянии 1.
5)В ходе процесса 1-2-3 средняя квадратичная скорость теплового движения молекул газа увеличилась в (sqrt{3}) раза.
1) Уравнение состояния газа: [pV=nu RT] где (p) — давление газа, (V) — объем, занимаемый газом, (nu) — количество вещеста, (R) — универасальная газовая постоянная, (T) — температура. Температура максимальна там, где максимально произведение (pV), поэтому из графика видно, что (T_1 – min), (T_3 – max), (T_1<T_2<T_3)
Утверждение 1 — (color{red}{smalltext{Неверно }})
2) Процесс 1-2 — изобарное расширение ((Vsim T)). Объем увеличился в 2 раза, то есть температура тоже увеличилась в 2 раза.
Утверждение 2 — (color{red}{smalltext{Неверно }})
3) Процесс 2-3 — изохорное нагревание. (V=const), следовательно (psim T) Давление увеличивается в 1,5 раза, то есть температура тоже увеличивается в 1,5 раза.
Утверждение 3 — (color{red}{smalltext{Неверно }})
4) В точке 1 — объем минимален, следовательно, плотность там максимальна.
Утверждение 4 — (color{green}{smalltext{Верно }})
5) [E_{k}=dfrac{3}{2}kT] [dfrac{m_0 v^2}{2}=dfrac{3}{2}kT] где (m_0) — масса газа, (v^2) средняя квадратичная скорость [v^2sim T] [vsim sqrt{T}] Температура в процессе 1-2-3 увеличилась в 3 раза, значит средняя квадратичная скорость увеличилась в (sqrt{3}) раз
Утверждение 5 — (color{green}{smalltext{Верно }})
Ответ: 45
Сосуд разделён на две равные по объёму части пористой неподвижной перегородкой. В левой части сосуда содержится 40 г неона, в правой — 2 моль гелия. Перегородка может пропускать молекулы гелия и является непроницаемой для молекул неона. Температура газов одинакова и остаётся постоянной.
Выберите два верных утверждения, описывающих состояние газов после установления равновесия в системе.
1) Внутренняя энергия гелия в сосуде меньше, чем внутренняя энергия неона.
2) Концентрация гелия в левой части сосуда в 2 раза больше концентрации неона.
3) В левой части сосуда общее число молекул газов в 3 раза больше, чем в правой части.
4) Внутренняя энергия гелия в сосуде в конечном состоянии меньше, чем в начальном.
5) В конечном состоянии давление в левой части сосуда в 3 раза больше, чем в правой.
1) Молярная масса неона (M=20) г/моль. Количество неона: [nu=dfrac{m}{M}=dfrac{40text{ г}}{20text{ г/моль}}=2 text{ моль}] Гелий займет все пространство сосуда, значит в левой части будет 3 моля вещества (1 моль гелия и 2 моль неона).
В правой части будет тоже 1 моль гелия.
Внутренняя энергия газа: [U=dfrac{i}{2}nu RT] Газы находятся при одинаковой температуре, количество гелия равно количеству неона. Внутренняя энергия гелия равна внутренней энергии неона
Утверждение 1 — (color{red}{smalltext{Неверно }})
2) В левой части сосуда количество гелия в два раза меньше количества неона. Следовательно, концентрация гелия в два раза меньше концентрации неона.
Утверждение 2 — (color{red}{smalltext{Неверно }})
3) Так как количество вещества в левой части сосуда больше в 3 раза, чем в правой, то и количество молекул также больше в 3 раза.
Утверждение 3 — (color{green}{smalltext{Верно }})
4) Так как температура гелия и общее количество гелия в сосуде не изменилось, то и внутреннняяя энергия не поменялась.
Утверждение 4 — (color{red}{smalltext{Неверно }})
5) Давление газа: [p=nkT] Так как кол-во вещества в левой части сосуда больше в 3 раза, чем в правой, температуры одинаковые, то давление в конечном состоянии больше в левой части в 3 раза, чем в правой.
Утверждение 5 — (color{green}{smalltext{Верно }})
Ответ: 35
Источник
