Давление азота в закрытом сосуде

Задача 28.
При 17°С некоторое количество газа занимает объем 580 мл. Какой объем займет это же количество газа при 100°С, если давление его останется неизменным?
Решение:
По закону Гей – Люссака при постоянном давлении объём газа изменяется прямо пропорционально абсолютной температуре (Т):

V2 – искомый объём газа;
T2 – соответствующая V2 температура;
V1 – начальный объём газа при соответствующей температуре Т1.
По условию задачи V1 = 580мл; Т1 = 290К (273 + 17 = 290) и Т2 = 373К (273 + 100 = 373). Подставляя эти значения в выражение закона Гей – Люссака, получим:

Ответ: V2 = 746мл.
Задача 29.
Давление газа, занимающего объем 2,5л, равно 121,6 кПа (912мм рт. ст.). Чему будет равно давление, если, не изменяя температуры, сжать газ до объема в 1л?
Решение:
Согласно закону Бойля – Мариотта, при постоянной температуре давление, производимое данной массой газа, обратно пропорционально объёму газа:

Обозначив искомое давление газа через Р2, можно записать:

Ответ: Р2 = 304кПа (2280мм.рт.ст.).
Задача 30. На сколько градусов надо нагреть газ, находящийся в закрытом сосуде при 0 °С, чтобы давление его увеличилось вдвое?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально температуре:

По условию задачи Т1 = 0 °С + 273 = 273К; давление возросло в два раза: Р2 = 2Р1.
Подставляя эти значения в уравнение, находим:

Ответ: Газ нужно нагреть на 2730С.
Задача 31.
При 27°С и давлении 720 мм.рт. ст. объем газа равен 5л. Кой объем займет это же количество газа при 39°С и давлении 104кПа?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 5л; Т = 298К (273 + 25 = 298); Р = 720 мм.рт.ст. (5,99 кПа); Р0 = 104 кПа; Т = 312К (273 + 39 = 312); Т = 273К. Подставляя данные задачи в уравнение, получим:

Ответ: V0 = 4,8л
Задача 32.
При 7°С давление газа в закрытом сосуде равно 96,0 кПа. Каким станет давление, если охладить сосуд до —33 °С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:

Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 96,0 кПа; Т1 = 280К (273 + 7 = 280); Т2 = 240К (273 – 33 = 240). Подставляя эти значения в уравнение, получим:

Ответ: Р2 = 82,3кПа.
Задача 33.
При нормальных условиях 1г воздуха занимает объем 773 мл. Какой объем займет та же масса воздуха при 0 °С и )и давлении, равном 93,3 кПа (700мм. рт. ст.)?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V0 = 773мл; Т0 = 298К (273 + 25 = 298); Т = 273К; Р = 93,3кПа. Подставляя данные задачи и преобразуя уравнение, получим:

Ответ: V = 769, 07 мл.
Задача 34.
Давление газа в закрытом сосуде при 12°С равно 100 кПа (750мм рт. ст.). Каким станет давление газа, если нагреть сосуд до 30°С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:

Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 100 кПа; Т1 = 285К (273 + 12 = 285); Т2 = 303К (273 + 30 = 303). Подставляя эти значения в уравнение, получим:

Ответ: Р2 = 106,3кПа.
Задача 35.
В стальном баллоне вместимостью 12л находится при 0°С кислород под давлением 15,2 МПа. Какой объем кислорода, находящегося при нормальных условиях можно получить из такого баллона?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 12л; Т = 273К (273 + 0 = 2273); Р =15,2МПа); Р0 = 101,325кПа; Т0 = 298К (273 + 25 = 298). Подставляя данные задачи в уравнение, получим:

Ответ: V0 = 1,97м3.
Задача 36.
Температура азота, находящегося в стальном баллоне под давлением 12,5 МПа, равна 17°С. Предельное давление для баллона 20,3МПа. При какой температуре давление азота достигнет предельного значения?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:

Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 12,5МПа; Т1 = 290К (273 + 17 = 290); Р2 = 20,3МПа. Подставляя эти значения в уравнение, получим:

Ответ: Т2 = 1980С.
Задача 37.
При давлении 98,7кПа и температуре 91°С некоторое количество газа занимает объем 680 мл. Найти объем газа при нормальных условиях.
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V = 680мл; Т0 = 298К (273 + 25 = 298); Т = 364К (273 + 91 = 364); Р = 98,7кПа. Подставляя данные задачи и преобразуя уравнение, получим:
<

Ответ: V0 = 542,3мл.
Задача 38.
При взаимодействии 1,28г металла с водой выделилось 380 мл водорода, измеренного при 21°С и давлении 104,5кПа (784мм рт. ст.). Найти эквивалентную массу металла.
Решение:
Находим объём выделившегося водорода при нормальных условиях, используя уравнение:

где Р и V – давление и объём газа при температуре Т = 294К (273 +21 = 294); Р0 = 101,325кПа; Т0 = 273К; Р = 104,5кПа. Подставляя данные задачи в уравнение,
получим:

Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):

Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 22,4 : 2 = 11,2л или 11200 мл. Тогда, используя формулу закона эквивалентов, рассчитаем эквивалентную массу металла:

Ответ: mЭ(Ме) = 39,4г/моль.
Задача 39.
Как следует изменить условия, чтобы увеличение массы данного газа не привело к возрастанию его объема: а) понизить температуру; б) увеличить давление; в) нельзя подобрать условий?
Решение:
Для характеристики газа количеством вещества (n, моль) применяется уравнение РV = nRT, или – это уравнение Клапейрона-Менделеева. Оно связывает массу (m, кг); температуру (Т, К); давление (Р, Па) и объём (V, м3) газа с молярной массой (М, кг/моль).
Тогда из уравнения Клапейрона-Менделеева объём газа можно рассчитать по выражению:

Отсюда следует, что V = const, если при увеличении массы (m) газа на некоторую величину будет соответственно уменьшена температура (T) системы на некоторое необходимое значение. Объём системы также не изменится при постоянной температуре, если при увеличении массы (m) газа на некоторую величину будет соответственно увеличено давление (P) системы на необходимую величину.
Таким образом, при увеличении массы газа объём системы не изменится, если понизить температуру системы или же увеличить давление в ней на некоторую величину.
Ответ: а); б).
Задача 40.
Какие значения температуры и давления соответствуют нормальным условиям для газов: а) t = 25 °С, Р = 760 мм. рт. ст.; б) t = 0 °С, Р = 1,013 • 105Па; в) t = 0°С, Р = 760 мм. рт. ст.?
Решение:
Состояние газа характеризуется температурой, давлением и объёмом. Если температура газа равна 0 °С (273К), а давление составляет 101325 Па (1,013 • 105) или 760 мм. рт. ст., то условия, при которых находится газ, принято считать нормальными.
Ответ: б); в).
Источник
Общие вопросы
Чем может быть опасен жидкий азот в помещении?
При испарении жидкого азота образуется газообразный азот с низкой температурой, при этом плотность его больше, чем у воздуха. Поэтому азот после испарения может накапливаться вначале на нижнем уровне помещения и затем постепенно создавать повышенную концентрацию во всем помещении. Это приводит к понижению концентрации кислорода в воздухе и когда ее величина становится ниже 18%, человек в таком помещении подвергается серьезной опасности – происходит нарушение ритма дыхания, учащается пульс, затем – нарушение сознания, снижение чувствительности, теряется способность двигаться, появляется тошнота и рвота, отключается сознание, и через несколько минут наступает смерть. Особая опасность заключается в том, что это происходит безболезненно и человек не осознает свое состояние.
В помещениях с естественной вентиляцией допускается работа с открытыми криогенными сосудами в том случае, если объем помещения в м3 превышает объем жидкости, находящейся в сосудах Дьюара в литрах, не менее чем в 7 раз.
Что делать, если жидкий азот попадет или прольется на руки?
Кратковременное соприкосновение кожи с жидким азотом не опасно, так как при этом на коже образуется воздушная подушка с низкой теплопроводностью, которая предохраняет кожу от непосредственного контакта с жидким азотом. Длительный контакт жидкого азота или материала, охлажденного жидким азотом, с кожей или глазами может вызвать серьезные повреждения. Обращайтесь с жидким азотом осторожно! При проливе жидкого азота проветрите помещение.
Вопросы по жидкому азоту и сосудам Дьюара
Как быстро испаряется жидкий азот из сосуда Дьюара?
Это зависит от типа сосуда Дьюара и его объема, а также производителя. Сосуды Дьюара американских и европейских производителей имеют наилучшие характеристики по части испаряемости жидкого азота и находятся в диапазоне от 0,10 до 0,20 л/сутки для сосудов объемом от 2 до 50 литров. Сосуды Дьюара большинства других производителей как правило имеют испаряемость в диапазоне от 0,15 до 0,40 л/сутки.
Обычно данные о величине испарения указываются в паспорте или инструкции по эксплуатации на сосуд Дьюара.
Среднее время хранения жидкого азота до полного его испарения может составлять от нескольких недель до года.
Чем отличаются украинские сосуды Дьюара от французских?
Прежде всего испаряемостью. Например, сосуд СДС35Bio60 производства Украины держит азот 210 суток, а его французский аналог В2036 – 360 суток. Так же немаловажным отличием является более привлекательный внешний вид французских сосудов Дьюара.
Нужно ли закрывать сосуд Дьюара, чтобы азот не испарялся?
Запрещается плотно закрывать горловину сосуда какими-либо посторонними пробками. Следует использовать только штатные пробки и крышки, которые, помимо прочего, предотвращают образование наледи в горловине сосуда Дьюара из-за конденсации влаги из атмосферы. При появлении механических повреждений и/или «снеговой шубы» на внешней поверхности сосуда (тем более, при его полном обмерзании!) необходимо освободить сосуд от жидкого азота, поставить сосуд на отогрев и связаться с нами для консультаций.
Почему нельзя опускать палочку с ватой в сосуд Дьюара?
Посторонние предметы в сосуде с жидким азотом могут создать ледяную пробку и вызвать разрушение
сосуда.
Можно ли курить в машине при перевозке сосуда Дьюара с жидким азотом?
Нет.
Необходимы ли какие-то документы на перевозку жидкого азота в машине?
Согласно Правил «Европейского соглашения о международной перевозке опасных грузов (ДОПОГ) жидкий азот в количестве до 333 кг может перевозиться без соблюдения ограничений, установленных для опасных грузов. Это правило подтверждено Приказом Минтранса РФ от 08.08.1995 г. № 73.
Допускается к перевозке в одной транспортной единице без соблюдения вышеуказанных Правил сосудов Дьюара YDS-15L (емкостью 16 л), заполненных жидким азотом, в количестве до 15 шт.
Можно ли заказать доставку азота на завтра? На определенный день?
Доставка азота осуществляется в течение двух рабочих дней с момента заказа.
Подключается ли переливное устройство к электрической сети?
Нет.
Каков принцип действия переливного устройства? Есть ли помпа?
Действие переливного устройства основано на повышении давления в криогенном сосуде при введении в жидкость «теплой» массы и использовании эффекта газ-лифт. Испарившаяся часть жидкости после герметизации горловины сосуда создает в нем избыточное давление, которое заставляет жидкость по сифону устройства переливается в заполняемую емкость.
Никаких дополнительных устройств для перелива жидкости не требуется.
Почему переливное устройство подходит не ко всем сосудам Дьюара?
Часть переливного устройства, вставляемая в сосуд Дьюара, является жесткой конструкцией и приспособлена только к сосуду определенной высоты.
Использование переливного устройства для сосудов Дьюара с горловинами разного диаметра возможно применением дополнительного уплотнителя.
Какой сосуд Дьюара лучше заказать для заправки КриоИнея и почему?
Сосуды Дьюара YDS-15L (емкость 16 л) или YDS-20L (емкость 20 л). в зависимости от потока пациентов. Криохирургический аппарат КриоИней необходимо периодически заправлять, поэтому нужно выбирать сосуды, к которым есть переливное устройство. Переливать через воронку будет неудобно и тяжело.
Вопросы по сосудам Дьюара и криоаппаратам
Где лучше хранить сосуд Дьюара с жидким азотом?
Во избежание повышенного испарения жидкого азота не рекомендуется располагать сосуд Дьюара вблизи отопительных приборов. Храните и используйте жидкий азот только в проветриваемых помещениях. В закрытых помещениях повышенное содержание газообразного азота снижает концентрацию кислорода и может привести к асфиксии. Более подробно читайте Правила безопасности при работе с криогенным оборудованием и жидким азотом.
Есть ли в продаже универсальные криодеструкторы?
Нет. Практика показала, что врачи не любят передавать свои криодеструкторы другим коллегам.
Какие насадки входят в комплект?
10 насадок разного размера и формы для разных целей.
Можно ли удалять бородавки при помощи КриоСкин?
Можно. Для этого нужно использовать дополнительный набор контактных зондов.
Для чего нужен КриоСтик и по какому принципу он работает?
КриоСтик удобен для удаления небольших новообразований – бородавок, папиллом, родинок. Тонкий металлический стержень охлаждается в жидком азоте и прикладывается к зоне воздействия.
Какой сосуд Дьюара лучше использовать в кабинете косметолога?
Сосуды Дьюара YDS-6L (емкостью 6 л) и YDS-15L (емкостью 16 л) в зависимости от потока клиентов.
Может ли использоваться биососуд Дьюара для хранения спермы собак, любых других животных?
Да, можно.
Источник
Задача 41.
Смешивают 0,04м3 азота, находящегося под давлением 96кПа (720мм. рт. ст.), с 0,02м3 кислорода. Общий объем смеси 0,06м3, а общее давление 97,6кПа (732мм. рт. ст.). Каким было давление взятого кислорода?
Решение:
По условию задачи объём азота увеличился в 1,5 раза (0,06/0,04 = 1,5), а объём кислорода – в 3 раза (0,06/0,02 = 3). Во столько же раз уменьшились парциальные давления газов.
Следовательно,
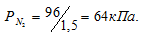
Согласно закону парциальных давлений, общее давление смеси газов, не вступающих во взаимодействие друг с другом, равно сумме парциальных давлений газов, составляющих систему (смесь). Отсюда Исходя из того, что объём кислорода до смешения был в три раза больше, чем после смешения, рассчитаем давление кислорода до смешения:
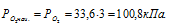
Ответ: Робщ. = 100,8кПа.
Задача 42.
Газовая смесь приготовлена из 2л Н2 (Р = 93,3 кПа) и 5л CH4 (Р = 112 кПа). Объем смеси равен 7л. Найти парциальные давления газов и общее давление смеси.
Решение:
По условию задачи объём водорода увеличился в 3,5 раза (7/2 = 3,5), а объём метана – в 1,4 раза (7/5 = 1,4). Во столько же раз уменьшились парциальные давления газов.
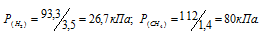
Согласно закону парциальных давлений, общее давление смеси газов, не вступающих во взаимодействие друг с другом, равно сумме парциальных давлений газов, составляющих систему (смесь).
Отсюда:
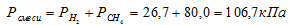
Ответ: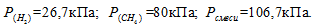
Задача 43.
Газовая смесь состоит из NO и СО2. Вычислить объемное содержание газов в смеси (в %), если их парциальные давления равны соответственно 36,3 и 70,4 кПа (272 и 528мм. рт. ст.).
Решение:
Согласно закону Дальтона парциальное давление данного газа прямо пропорционально его мольной доли на общее давление смеси газов:
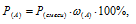
где Р(смеси) – общее давление смеси; Р(А) – парциальное давление данного газа; (A) – мольная доля данного газа.
Согласно закону парциальных давлений, общее давление смеси газов, не вступающих во взаимодействие друг с другом, равно сумме парциальных давлений газов, составляющих систему (смесь).
Отсюда:
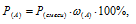
Ответ: 34,02%NO; 65,98%CO.
Задача 44.
В закрытом сосуде вместимостью 0,6м3 находится при 0 °С смесь, состоящая из 0,2кг СО2, 0,4кг 02 и 0,15кг СН4. Вычислить: а) общее давление смеси; б) парциальное давление каждого из газов; в) процентный состав смеси по объему.
Решение:
Вычислим общее количество газов в смеси по уравнению:
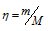 , где
, где
 – количество газа, кмоль; m – масса газа, кг; М – молекулярная масса газа, кг/моль. Тогда:
– количество газа, кмоль; m – масса газа, кг; М – молекулярная масса газа, кг/моль. Тогда:
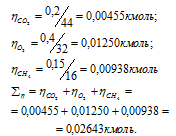
а) Общее давление смеси газов определяем по уравнению:
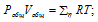
Тогда:
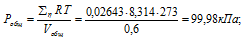
б) Парциальные давления газов рассчитываем по уравнению:
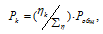
где Rk и  k , соответственно, парциальное давление, и количество газа в смеси.
k , соответственно, парциальное давление, и количество газа в смеси.
Тогда
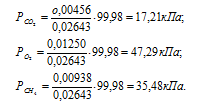
в) Парциальные объёмы газов рассчитаем по уравнению:
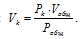
Тогда
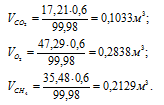
Отношение парциальных (приведённых) объёмов отдельных газов к общему объёму смеси называется объёмной долей и определяется по формуле:
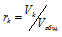
Тогда
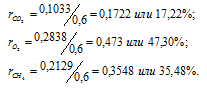
Ответ: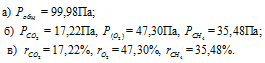
Задача 45.
Газовая смесь приготовлена из 0,03м3 СН4, 0,04м3 Н2 и 0,01м3 СО. Исходные давления СН4, Н2 и СО составляли ответственно 96, 84 и 108,8 кПа (720, 630 и 816мм рт. ст.). Объем смеси равен 0,08м3. Определить парциальные давления газов и общее давление смеси.
Решение:
По условию задачи объём метана увеличился после смешения в 2,67 раза (0,08/0,03 = 2,67), объём водорода – в 2 раза (0,08/0,04 = 2), а объём угарного газа – в 8 раз (0,08/0,01 = 8). Во столько же раз уменьшились парциальные давления газов. Следовательно,
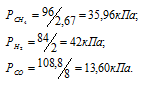
Согласно закону парциальных давлений, общее давление смеси газов, не вступающих во взаимодействие друг с другом, равно сумме парциальных давлений газов, составляющих систему (смесь).
Отсюда:
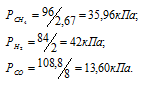
Ответ: 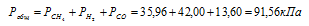
Задача 46.
В газометре над водой находятся 7,4л кислорода при 23 °С и давлении 104,1 кПа (781 мм. рт. ст.). Давление насыщенного водяного пара при 23 °С равно 2,8 кПа (21мм. рт. ст.). Какой объем займет находящийся в газометре кислород при нормальных условиях?
Решение:
Парциальное давление кислорода равно разности общего давления и парциального давления паров воды:
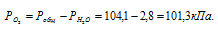
Обозначив искомый объём через и, используя объединённое уравнение закона Бойля- Мариотта и Гей-Люссака, находим:
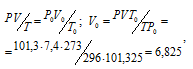
где Р и V – давление и объём газа при температуре Т = 296К (273 +23 = 296); Р0 = 101,325кПа; Т0 = 273К; Р = 104,1кПа; – объём газа при н.у.
Ответ: V0 =6,825л.
Источник
