Давление газа на стенки сосуда возникает за счет

Анонимный вопрос
30 января 2018 · 5,2 K
Люблю фантастику, вязание, начинающий садовод
Давление газа на стенки сосудов вызывается ударами молекул газа.
У газов нет ни формы ни постоянного объема. Они могут заполнить любой объем.
Количество молекул в каждом кубическом сантиметре увеличивается при сжатии (уменьшается при расширении) от этого число ударов о стенки сосуда увеличивается (уменьшается). Поэтому чем больший сосуд газ заполняет, тем меньше давление и наоборот.
Газ одинаково давит по всем направлениям, как пример -когда надуваешь воздушный шар, то он надувается равномерно.
Если газ находиться в маленьком объеме, то давление на стенки становится огромным, поэтому газ удобнее и безопаснее заключать в специальные прочные стальные баллоны.
Люблю простые слова для вещей, toki pona.
Давление газа вызывается ударами молекул о стенки сосуда, т.к. молекулы хаотически движутся и постоянно соударяются друг с другом и со всеми встреченным препятствиями.
Что происходит с сжиженным газом при нормальном атмосферном давлении?
Автономная газификация и системы отопления. Лучшее предприятие России 2017 и…
Сжиженный углеводородный газ (СУГ) — это смесь пропана и бутана. СУГ может находиться в жидкой и газообразной фазе.
При нормальном давлении 1.839 кг/кв. м и температуре +20°С сжиженный газ переходит в парообразное состояние. Он не имеет цвета и запаха, поэтому в него добавляют вещество с резким запахом — одорант. Примесь помогает обнаружить утечки.
Если давление увеличить и/или понизить температуру, углеводородные газы переходят в жидкое состояние. В газгольдере СУГ хранится в жидкой фазе под давлением 5-6 атм. Для сравнения: в газовой зажигалке давление 3-4 атм.
Прочитать ещё 2 ответа
Что находится между ядром атома и электроном? Вакуум? А что такое вакуум? Что он из себя представляет? Невозможно что “ничего”. Должна быть какая то энергия.?
Сусанна Казарян, США, Физик
Пространство внутри атома (между наиболее удаленной орбиталью и ядром) заполнено огромным электростатическим полем, удерживающим электроны на орбиталях. И вы правы — всё это пространство заполнено энергией — электростатической энергией связи электронов с ядром. Эта энергия квантована. Каждой орбитали электронов соответствует свой уровень энергии. В самом грубом квази-классическом приближении, электрон делает в секунду ~10¹⁶ оборотов вокруг ядра. Вы представляете себе сколь велико это число и какой энергии это соответствует? Каково численное значение электростатического поля внутри ядра оценено мной здесь и оно более чем в 100000 раз больше электростатического поля в атмосфере во время грозы прямо перед разрядом молнии.
Это легко можно и увидеть. Посмотрите на спираль включённой лампочки. Откуда этот свет? Это свет прямо изнутри атомов вольфрама, рождённый от квантовых переходов возбуждённых электронов. А чтобы ощутить энергию, скрытую в ядрах атомов, найдите в интернете видео взрыва ядерной бомбы.
Мир заполнен энергией. Надо только её с умом использовать.
Прочитать ещё 4 ответа
Сколько лет Солнцу? Когда оно только сформировалось из газов?
Любитель физики, вообще разносторонняя личность).
Солнцу примерно 4 600 000 000 лет. Кстати, Солнце сформировалось только из водорода, который сконцентрировавшись в одном месте под действием гравитации сжалось в звезду. После из-за большой массы, гравитация заставляла сильно нагреваться термически, и пошла термоядерная реакция, которая противостоит гравитции. Баланс из гм, гм и палок
Разгоняется ли гелиевый воздушный шарик при взлете вверх или движется с постоянной скоростью? И как с помощью законов физики можно объяснить ваш ответ?
О том что бывает с гелиевым шаром можно прочесть, например, здесь
https://ru.wikipedia.org/wiki/Метеозонд
Или тут (это история с Олимпийским Мишкой в 1980 году)
https://rg.ru/2015/06/26/rodina-mishka.html
Если Вы хотите понять физику процесса, то можно почитать здесь
https://online.mephi.ru/courses/physics/osnovi_mehaniki/data/lecture/9/p4.html
Если совсем уж на “пальцах”, то подъёмная силой тут будет сила Архимеда. Могут быть так-же и восходящие потоки воздуха (у поверхности Земли он теплее чем на высоте).
Против “ускорения” играют сила тяжести шарика и сила сопротивления воздуха, которая для шара пропорциональна квадрату скорости. Когда подъёмная сила сравнивается с силами тяжести и сопротивления, скорость подъёма станет постоянной.
На какой-то высоте плотность атмосферы станет настолько низкой, что сила Архимеда сравняется с силой тяжести, и сила сопротивления постепенно сведёт скорость подъёма к нулю. Возможно, что на этой стадии движение шара будет некоторое время иметь характер колебательных движений вверх-вниз, но эти колебания рано или поздно (скорее всего рано) затухнут, и шар будет двигаться на одной и той, же высоте.
Дальнейшее движение шара будет зависеть от того как быстро гелий будет истекать из него сквозь оболочку.
Прочитать ещё 2 ответа
Источник
Давление газа
Подробности
Категория: О давлении
Опубликовано 02.12.2014 16:18
Просмотров: 11229

Где бы ни находился газ: в воздушном шаре, автомобильной шине, или металлическом баллоне – он заполняет собой весь объём сосуда, в котором находится.
Давление газа возникает совсем по другой причине, нежели давление твёрдого тела. Оно образуется в результате ударов молекул о стенки сосуда.
Давление газа на стенки сосуда

Двигаясь хаотично в пространстве, молекулы газа сталкиваются между собой и со стенками сосуда, в котором находятся. Сила удара одной молекулы мала. Но так как молекул очень много, и сталкиваются они с большой частотой, то, действуя сообща на стенки сосуда, они создают значительное давление. Если в газ помещено твёрдое тело, то оно также подвергается ударам молекул газа.
Проведём несложный опыт. Под колокол воздушного насоса поместим завязанный воздушный шарик, не полностью наполненный воздухом. Так как воздуха в нём мало, шарик имеет неправильную форму. Когда же мы начнём откачивать воздух из-под колокола, шарик станет раздуваться. Через некоторое время он примет форму правильного шара.
Что же произошло с нашим шариком? Ведь он был завязан, следовательно, количество воздуха в нём осталось прежним.
Всё объясняется довольно просто. Во время движения молекулы газа сталкиваются с оболочкой шарика снаружи и внутри него. Если воздух откачивается из колокола, молекул становится меньше. Уменьшается плотность, а значит и частота ударов молекул о наружную оболочку также уменьшается. Следовательно, давление снаружи оболочки падает. А так как внутри оболочки число молекул осталось прежним, то внутреннее давление превышает наружное. Газ давит изнутри на оболочку. И по этой причине она постепенно раздувается и принимает форму шара.
Закон Паскаля для газов

Молекулы газа очень подвижны. Благодаря этому давление они передают не только в направлении действия силы, вызывающей это давление, но и равномерно по всем направлениям. Закон о передаче давления сформулировал французский учёный Блез Паскаль: «Давление, производимое на газ или жидкость, передаётся без изменений в любую точку по всем направлениям». Этот закон называют основным законом гидростатики – науки о жидкости и газе в состоянии равновесия.
Закон Паскаля подтверждается опытом с прибором, который называют шаром Паскаля. Этот прибор представляет собой шар из твёрдого вещества с проделанными в нём крошечными отверстиями, соединённый с цилиндром, по которому двигается поршень. Шар заполняется дымом. При сжатии поршнем дым выталкивается из отверстий шара одинаковыми струйками.
Давление газа вычисляют по формуле:

где еlin– средняя кинетическая энергия поступательного движения молекул газа;
n – концентрация молекул
Парциальное давление. Закон Дальтона

На практике чаще всего нам приходится встречаться не с чистыми газами, а с их смесями. Мы дышим воздухом, являющимся смесью газов. Выхлопные газы автомобилей – тоже смесь. При сварке уже давно не применяется чистый углекислый газ. Вместо него также используют газовые смеси.
Газовой смесью называют смесь газов, не вступающих в химические реакции между собой.
Давление отдельного компонента газовой смеси называется парциальным давлением.
Если предположить, что все газы смеси являются идеальными газами, то давление смеси определяется законом Дальтона: «Давление смеси идеальных газов, не взаимодействующих химически, равно сумме парциальных давлений».
Его величина определяется по формуле:

Каждый газ в смеси создаёт парциальное давление. Его температура равна температуре смеси.
Давление газа можно изменить, меняя его плотность. Чем больше газа будет закачано в металлический баллон, тем больше в нём будет молекул, ударяющихся о стенки, и тем выше станет его давление. Соответственно, откачивая газ, мы разрежаем его, и давление снижается.
Но давление газа также можно изменить, изменив его объём или температуру, то есть, сжав газ. Сжатие проводят, воздействуя силой на газообразное тело. В результате такого воздействия уменьшается занимаемый им объём, повышается давление и температура.
Газ сжимается в цилиндре двигателя при движении поршня. На производстве высокое давление газа создают, сжимая его с помощью сложных устройств – компрессоров, которые способны создать давление до нескольких тысяч атмосфер.
Источник
Давление является одним из трех основных термодинамических макроскопических параметров любой газовой системы. В данной статье рассмотрим формулы давления газа в приближении идеального газа и в рамках молекулярно-кинетической теории.
Идеальные газы
Каждый школьник знает, что газ является одним из четырех (включая плазму) агрегатных состояний материи, в котором частицы не имеют определенных положений и движутся хаотичным образом во всех направлениях с одинаковой вероятностью. Исходя из такого строения, газы не сохраняют ни объем, ни форму при малейшем внешнем силовом воздействии на них.
В любом газе средняя кинетическая энергия его частиц (атомов, молекул) больше, чем энергия межмолекулярного взаимодействия между ними. Кроме того, расстояния между частицами намного превышают их собственные размеры. Если молекулярными взаимодействиями и размерами частиц можно пренебречь, тогда такой газ называется идеальным.
В идеальном газе существует лишь единственный вид взаимодействия – упругие столкновения. Поскольку размер частиц пренебрежимо мал в сравнении с расстояниями между ними, то вероятность столкновений частица-частица будет низкой. Поэтому в идеальной газовой системе существуют только столкновения частиц со стенками сосуда.
Все реальные газы с хорошей точностью можно считать идеальными, если температура в них выше комнатной, и давление не сильно превышает атмосферное.
Причина возникновения давления в газах
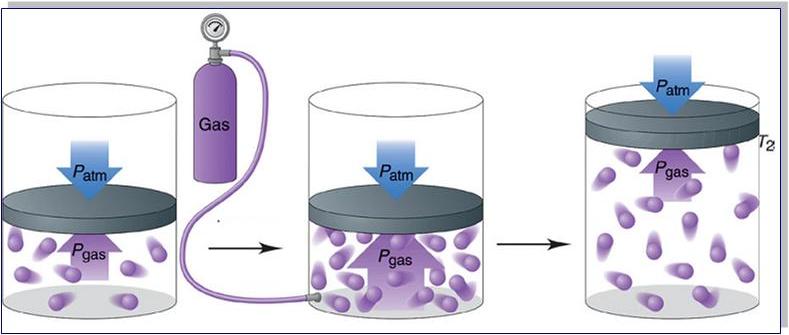
Прежде чем записать формулы расчета давления газа, необходимо разобраться, почему оно возникает в изучаемой системе.
Согласно физическому определению, давление – это величина, равная отношению силы, которая перпендикулярно воздействует на некоторую площадку, к площади этой площадки, то есть:
P = F/S
Выше мы отмечали, что существует только один единственный тип взаимодействия в идеальной газовой системе – это абсолютно упругие столкновения. В результате них частицы передают количество движения Δp стенкам сосуда в течение времени соударения Δt. Для этого случая применим второй закон Ньютона:
F*Δt = Δp
Именно сила F приводит к появлению давления на стенки сосуда. Сама величина F от столкновения одной частицы является незначительной, однако количество частиц огромно (≈ 1023), поэтому они в совокупности создают существенный эффект, который проявляется в виде наличия давления в сосуде.
Формула давления газа идеального из молекулярно-кинетической теории
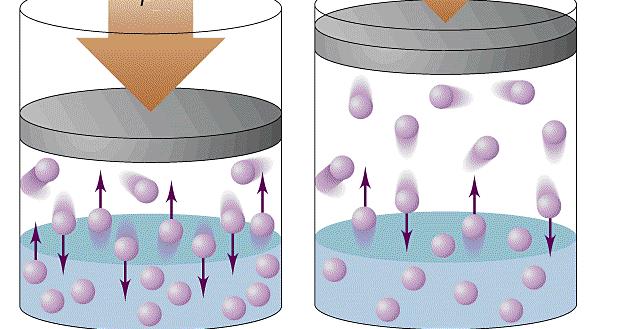
При объяснении концепции идеального газа выше были озвучены основные положения молекулярно-кинетической теории (МКТ). Эта теория основывается на статистической механике. Развита она была во второй половине XIX века такими учеными, как Джеймс Максвелл и Людвиг Больцман, хотя ее основы заложил еще Бернулли в первой половине XVIII века.
Согласно статистике Максвелла-Больцмана, все частицы системы движутся с различными скоростями. При этом существует малая доля частиц, скорость которых практически равна нулю, и такая же доля частиц, имеющих огромные скорости. Если вычислить среднюю квадратичную скорость, то она примет некоторую величину, которая в течение времени остается постоянной. Средняя квадратичная скорость частиц однозначно определяет температуру газа.
Применяя приближения МКТ (невзаимодействующие безразмерные и хаотично перемещающиеся частицы), можно получить следующую формулу давления газа в сосуде:
P = N*m*v2/(3*V)
Здесь N – количество частиц в системе, V – объем, v – средняя квадратичная скорость, m – масса одной частицы. Если все указанные величины определены, то, подставив их в единицах СИ в данное равенство, можно рассчитать давление газа в сосуде.
Формула давления из уравнения состояния

В середине 30-х годов XIX века французский инженер Эмиль Клапейрон, обобщая накопленный до него экспериментальный опыт по изучению поведения газов во время разных изопроцессов, получил уравнение, которое в настоящее время называется универсальным уравнением состояния идеального газа. Соответствующая формула имеет вид:
P*V = n*R*T
Здесь n – количество вещества в молях, T – температура по абсолютной шкале (в кельвинах). Величина R называется универсальной газовой постоянной, которая была введена в это уравнение русским химиком Д. И. Менделеевым, поэтому записанное выражение также называют законом Клапейрона-Менделеева.
Из уравнения выше легко получить формулу давления газа:
P = n*R*T/V
Равенство говорит о том, что давление линейно возрастает с температурой при постоянном объеме и увеличивается по гиперболе с уменьшением объема при постоянной температуре. Эти зависимости отражены в законах Гей-Люссака и Бойля-Мариотта.
Если сравнить это выражение с записанной выше формулой, которая следует из положений МКТ, то можно установить связь между кинетической энергией одной частицы или всей системы и абсолютной температурой.
Давление в газовой смеси
Отвечая на вопрос о том, как найти давление газа и формулы, мы ничего не говорили о том, является ли газ чистым, или речь идет о газовой смеси. В случае формулы для P, которая следует из уравнения Клапейрона, нет никакой связи с химическим составом газа, в случае же выражения для P из МКТ эта связь присутствует (параметр m). Поэтому при использовании последней формулы для смеси газов становится непонятным, какую массу частиц выбирать.
Когда необходимо рассчитать давление смеси идеальных газов, следует поступать одним из двух способов:
- Рассчитывать среднюю массу частиц m или, что предпочтительнее, среднее значение молярной массы M, исходя из атомных процентов каждого газа в смеси;
- Воспользоваться законом Дальтона. Он гласит, что давление в системе равно сумме парциальных давлений всех ее компонентов.
Пример задачи
Известно, что средняя скорость молекул кислорода составляет 500 м/с. Необходимо определить давление в сосуде объемом 10 литров, в котором находится 2 моль молекул.
Ответ на задачу можно получить, если воспользоваться формулой для P из МКТ:
P = N*m*v2/(3*V)
Здесь содержатся два неудобных для выполнения расчетов параметра – это m и N. Преобразуем формулу следующим образом:
m = M/NA;
n = N/NA;
m*N = M*n;
P = M*n*v2/(3*V)
Объем сосуда в кубических метрах равен 0,01 м3. Молярная масса молекулы кислорода M равна 0,032 кг/моль. Подставляя в формулу эти значения, а также величины скорости v и количества вещества n из условия задачи, приходим к ответу: P = 533333 Па, что соответствует давлению в 5,3 атмосферы.
Источник
Макеты страниц
Стенки сосуда, в котором заключен газ, подвергаются непрерывной бомбардировке молекулами. В результате элементу стенки сообщается за секунду некоторый импульс, который равен силе, действующей на . Отношение этой силы к величине дает давление, оказываемое газом на стенки сосуда. Вследствие хаотичности движения молекул давление газа на различные участки стенок сосуда одинаково (разумеется, при условии, что газ находится в равновесном состоянии).
Если предположить, что молекулы отскакивают от стенки по закону зеркального отражения величина скорости молекулы не изменяется, то импульс, сообщаемый при ударе стенке молекулой, будет равен (рис. 96.1; — масса молекулы). Этот импульс направлен по нормали к площадке. Каждая из молекул (см. (95.2)) сообщает стенке импульс а все эти молекулы — импульс
Просуммируем полученное выражение по направлениям в пределах телесного угла (отвечающего изменениям Ф от 0 до и изменениям от 0 до .
Рис. 96.1.
В результате получим импульс, сообщаемый молекулами, скорости которых имеют величину от v до
(мы подставили выражение (94.4) для Интегрирование по дает интеграл по равен 1/3. Следовательно,
Проинтегрировав это выражение по скоростям от 0 до получим полный импульс, сообщаемый площадке за время
Выражение
представляет собой среднее значение квадрата скорости молекул. Заменив в (96.1) интеграл произведением получим, что
есть число молекул в единице объема). Наконец, разделив это выражение на и получим давление газа на стенки сосуда:
Масса всех молекул по предположению одинакова. Поэтому ее можно внести под знак среднего. В результате выражение (96.2) примет вид
где — среднее значение кинетической энергии поступательного движения молекул.
Получим выражение для давления, исходя из упрощенных представлений, которые привели нас к формуле (95.7). Согласно этим представлениям каждая молекула сообщает стенке при ударе импульс Умножив этот импульс на число ударов (см. (95.7)), получим импульс, сообщаемый единичной площадке в единицу времени, т. е. давление.
Таким образом, получается формула
Эта формула отличается от (96.2) тем, что вместо среднего квадрата скорости стоит квадрат средней скорости Впоследствии (см. § 97) мы убедимся в том, что эти две величины отличаются друг от друга, т. е.
При более аккуратном подсчете нужно число молекул, определяемое формулой (95.8), умножить на и затем произвести суммирование по всем V. В результате получится импульс, сообщаемый площадке за время
Разделив это выражение на и получим для давления формулу (96-2). Таким образом, исходя из упрощенного представления о движении молекул вдоль трех взаимно перпендикулярных направлений, мы получили точное выражение для давления. Это объясняется тем, что указанное упрощение приводит, с одной стороны, к занижению числа ударов молекул о стенку вместо см. (95.6) и (95.7)), а с другой — к завышению импульса, передаваемого стенке при каждом ударе. При упрощенном выводе мы принимали, что при каждом ударе стенке сообщается импульс, равный . В действительности же величина сообщаемого стенке импульса зависит от угла вследствие чего средний импульс, сообщаемый при одном ударе, равен . В итоге обе неточности взаимно компенсируют друг друга и, несмотря на упрощенность рассмотрения, получается точное выражение для давления.
Источник

