Давление в сосуде химия
Давление является одним из трех основных термодинамических макроскопических параметров любой газовой системы. В данной статье рассмотрим формулы давления газа в приближении идеального газа и в рамках молекулярно-кинетической теории.
Идеальные газы
Каждый школьник знает, что газ является одним из четырех (включая плазму) агрегатных состояний материи, в котором частицы не имеют определенных положений и движутся хаотичным образом во всех направлениях с одинаковой вероятностью. Исходя из такого строения, газы не сохраняют ни объем, ни форму при малейшем внешнем силовом воздействии на них.
В любом газе средняя кинетическая энергия его частиц (атомов, молекул) больше, чем энергия межмолекулярного взаимодействия между ними. Кроме того, расстояния между частицами намного превышают их собственные размеры. Если молекулярными взаимодействиями и размерами частиц можно пренебречь, тогда такой газ называется идеальным.
В идеальном газе существует лишь единственный вид взаимодействия – упругие столкновения. Поскольку размер частиц пренебрежимо мал в сравнении с расстояниями между ними, то вероятность столкновений частица-частица будет низкой. Поэтому в идеальной газовой системе существуют только столкновения частиц со стенками сосуда.
Все реальные газы с хорошей точностью можно считать идеальными, если температура в них выше комнатной, и давление не сильно превышает атмосферное.
Причина возникновения давления в газах
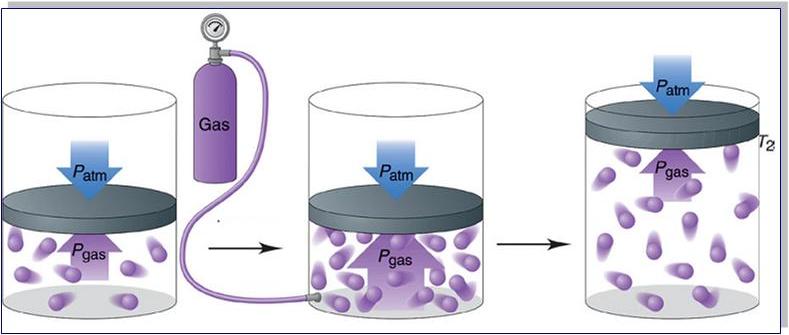
Прежде чем записать формулы расчета давления газа, необходимо разобраться, почему оно возникает в изучаемой системе.
Согласно физическому определению, давление – это величина, равная отношению силы, которая перпендикулярно воздействует на некоторую площадку, к площади этой площадки, то есть:
P = F/S
Выше мы отмечали, что существует только один единственный тип взаимодействия в идеальной газовой системе – это абсолютно упругие столкновения. В результате них частицы передают количество движения Δp стенкам сосуда в течение времени соударения Δt. Для этого случая применим второй закон Ньютона:
F*Δt = Δp
Именно сила F приводит к появлению давления на стенки сосуда. Сама величина F от столкновения одной частицы является незначительной, однако количество частиц огромно (≈ 1023), поэтому они в совокупности создают существенный эффект, который проявляется в виде наличия давления в сосуде.
Формула давления газа идеального из молекулярно-кинетической теории
При объяснении концепции идеального газа выше были озвучены основные положения молекулярно-кинетической теории (МКТ). Эта теория основывается на статистической механике. Развита она была во второй половине XIX века такими учеными, как Джеймс Максвелл и Людвиг Больцман, хотя ее основы заложил еще Бернулли в первой половине XVIII века.
Согласно статистике Максвелла-Больцмана, все частицы системы движутся с различными скоростями. При этом существует малая доля частиц, скорость которых практически равна нулю, и такая же доля частиц, имеющих огромные скорости. Если вычислить среднюю квадратичную скорость, то она примет некоторую величину, которая в течение времени остается постоянной. Средняя квадратичная скорость частиц однозначно определяет температуру газа.
Применяя приближения МКТ (невзаимодействующие безразмерные и хаотично перемещающиеся частицы), можно получить следующую формулу давления газа в сосуде:
P = N*m*v2/(3*V)
Здесь N – количество частиц в системе, V – объем, v – средняя квадратичная скорость, m – масса одной частицы. Если все указанные величины определены, то, подставив их в единицах СИ в данное равенство, можно рассчитать давление газа в сосуде.
Формула давления из уравнения состояния

В середине 30-х годов XIX века французский инженер Эмиль Клапейрон, обобщая накопленный до него экспериментальный опыт по изучению поведения газов во время разных изопроцессов, получил уравнение, которое в настоящее время называется универсальным уравнением состояния идеального газа. Соответствующая формула имеет вид:
P*V = n*R*T
Здесь n – количество вещества в молях, T – температура по абсолютной шкале (в кельвинах). Величина R называется универсальной газовой постоянной, которая была введена в это уравнение русским химиком Д. И. Менделеевым, поэтому записанное выражение также называют законом Клапейрона-Менделеева.
Из уравнения выше легко получить формулу давления газа:
P = n*R*T/V
Равенство говорит о том, что давление линейно возрастает с температурой при постоянном объеме и увеличивается по гиперболе с уменьшением объема при постоянной температуре. Эти зависимости отражены в законах Гей-Люссака и Бойля-Мариотта.
Если сравнить это выражение с записанной выше формулой, которая следует из положений МКТ, то можно установить связь между кинетической энергией одной частицы или всей системы и абсолютной температурой.
Давление в газовой смеси

Отвечая на вопрос о том, как найти давление газа и формулы, мы ничего не говорили о том, является ли газ чистым, или речь идет о газовой смеси. В случае формулы для P, которая следует из уравнения Клапейрона, нет никакой связи с химическим составом газа, в случае же выражения для P из МКТ эта связь присутствует (параметр m). Поэтому при использовании последней формулы для смеси газов становится непонятным, какую массу частиц выбирать.
Когда необходимо рассчитать давление смеси идеальных газов, следует поступать одним из двух способов:
- Рассчитывать среднюю массу частиц m или, что предпочтительнее, среднее значение молярной массы M, исходя из атомных процентов каждого газа в смеси;
- Воспользоваться законом Дальтона. Он гласит, что давление в системе равно сумме парциальных давлений всех ее компонентов.
Пример задачи
Известно, что средняя скорость молекул кислорода составляет 500 м/с. Необходимо определить давление в сосуде объемом 10 литров, в котором находится 2 моль молекул.
Ответ на задачу можно получить, если воспользоваться формулой для P из МКТ:
P = N*m*v2/(3*V)
Здесь содержатся два неудобных для выполнения расчетов параметра – это m и N. Преобразуем формулу следующим образом:
m = M/NA;
n = N/NA;
m*N = M*n;
P = M*n*v2/(3*V)
Объем сосуда в кубических метрах равен 0,01 м3. Молярная масса молекулы кислорода M равна 0,032 кг/моль. Подставляя в формулу эти значения, а также величины скорости v и количества вещества n из условия задачи, приходим к ответу: P = 533333 Па, что соответствует давлению в 5,3 атмосферы.
Источник
Секретная шпаргалка по химии. 4.2. Состав смеси газов
Команда «Газы!» была объявлена еще две недели назад. И что?! Легкие задачи порешали и расслабились?! Или вы думаете, что задачи на газы касаются только 28-х заданий ЕГЭ?! Как бы не так! Если газов пока еще не было в 34-х заданиях, это ничего не значит! Задач на электролиз тоже не было в ЕГЭ до 2018 года. А потом как врезали, мама не горюй! Обязательно прочитайте мою статью » Тайны задач по химии? Тяжело в учении — легко в бою!». В этой статье очень подробно рассказывается о новых фишках на электролиз. Статья вызвала шквал самых разных эмоций у преподавателей химии. До сих пор мне и пишут, и звонят, и благодарят, и бьются в конвульсиях. Просто цирк с конями, в котором я — зритель в первом ряду.
Однако, вернемся к нашим баранам, вернее, Газам. Я прошла через огонь и воду вступительных экзаменов и знаю точно — хочешь завалить абитуриента, дай ему задачу на Газы. Почитайте на досуге сборник задач И.Ю. Белавина. Я процитирую одну такую «мозгобойню», чтобы вам жизнь медом не казалась. Попробуйте решить.
И.Ю. Белавин, 2005, задача 229
«Два из трех газов (сероводород, водород и кислород) смешали и получили газовую смесь, плотность которой оказалась равной плотности оставшегося газа. Полученную газовую смесь вместе с равным ей объемом третьего газа под давлением поместили в замкнутый сосуд емкостью 4 л, содержавший азот при н.у. и нагревали при 600 С до окончания химических реакций, затем постепенно охладили. Определите массы веществ, содержавшихся в сосуде после охлаждения, если плотность газовой смеси в сосуде перед нагреванием равнялась 9,25г/л. (Ответ: m(S) = 7,5 г, m(SO2) = 15 г, m(Н2О) = 9 г)»
Ну как, решили? Нет?! А ваши репетиторы?! Извините, это был риторический вопрос. Кстати, мои ученики, абитуриенты 2003-2008 гг. такие задачи щелкали, как семечки, на экзаменах во 2-й медицинский (теперь РНИМУ им. Н.И. Пирогова). Надеюсь, вам понятно, что 34-м задачам ЕГЭ еще есть куда усложняться, perfectio interminatus est (нет предела совершенству), с газами нужно работать, работать и работать. Поэтому команду «Газы!» отменять рано. Итак, поехали!
Сегодня мы поговорим о газовых смесях, затронем понятие плотности газа (абсолютной и относительной), средней молярной массы, решим задачи: определение средней молярной массы и плотности газа по компонентам смеси и наоборот.
• Газовая смесь — смесь отдельных газов НЕ вступающих между собой в химические реакции. К смесям газов относятся: воздух (состоит из азота, кислорода, углекислого газа, водяного пара и др.), природный газ (смесь предельных и непредельных углеводородов, оксида углерода, водорода, сероводорода, азота, кислорода, углекислого газа и др.), дымовые газы (содержат азот, углекислый газ, пары воды, сернистый газ и др.) и др.
• Объемная доля — отношение объема данного газа к общему объему смеси, показывает, какую часть общего объема смеси занимает данный газ, измеряется в долях единицы или в процентах.
• Мольная доля — отношение количества вещества данного газа к общему количеству вещества смеси газов, измеряется в долях единицы или в процентах.
• Плотность газа (абсолютная) — определяется как отношение массы газа к его объему, единица измерения (г/л). Физический смысл абсолютной плотности газа — масса 1 л, поэтому молярный объем газа (22,4 л при н.у. t° = 0°C, P = 1 атм) имеет массу, численно равную молярной массе.
• Относительная плотность газа (плотность одного газа по другому) — это отношение молярной массы данного газа к молярной массе того газа, по которому она находится
• Средняя молярная масса газа — рассчитывается на основе молярных масс составляющих эту смесь газов и их объемных долей
Настоятельно рекомендую запомнить среднюю молярную массу воздуха Мср(в) = 29 г/моль , в заданиях ЕГЭ часто встречается.
ВАНГУЮ: чует мое сердце, что ЕГЭ по химии 2019 года устроит нам газовую атаку, а противогазы не выдаст!
Определить плотность по азоту газовой смеси, состоящей из 30% кислорода, 20% азота и 50% углекислого газа.
Вычислите плотность по водороду газовой смеси, содержащей 0,4 моль СО2, 0,2 моль азота и 1,4 моль кислорода.
5 л смеси азота и водорода имеют относительную плотность по водороду 12. Определить объем каждого газа в смеси.
Плотность по водороду пропан-бутановой смеси равна 23,5. Определите объемные доли пропана и бутана
Газообразный алкан объемом 8 л (н.у.) имеет массу 14,28 г. Чему равна его плотность по воздуху
Плотность паров альдегида по метану равна 2,75. Определите альдегид
Ну как? Пошло дело? Если туго, вернитесь к задачам и решайте их самостоятельно до тех пор, пока не щелкнет! А для стимуляции — десерт в виде еще одной задачи И.Ю. Белавина на газы. Наслаждайтесь ее решением самостоятельно!
И.Ю. Белавин, 2005, задача 202
«Сосуд емкостью 5,6 л при н.у. заполнили метаном, затем нагрели до высокой температуры, в результате чего произошло частичное разложение метана. Определите массу образовавшейся сажи, если известно, что после приведения к нормальным условиям объем полученной газовой смеси оказался в 1,6 раза больше объема исходного метана, эта газовая смесь обесцвечивает бромную воду и имеет плотность по воздуху 0,2931. (Ответ: m(C) = 0,6 г)»
Задачи И.Ю. Белавина — это крутой драйв! Попробуйте порешать, и вы откажетесь от просмотра любых ужастиков, поскольку запасетесь адреналином надолго! Но нам нужно спуститься на землю к ЕГЭ, простому и надежному, как первый советский трактор. Кстати, у меня в коллекции припасено немало сюрпризов с газовыми фишками, собранными за все годы работы и бережно хранимыми. Думаю, пришло время сказать им: «И снова здравствуйте!», поскольку ЕГЭ с каждым годом становится «все чудесатее и чудесатее». Но это уже совсем другая история. Читайте мои статьи — и вы подстелите соломку под свою ЕГЭшную попу.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии https://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Позвоните мне +7(903)186-74-55, приходите ко мне на курс, на бесплатные Мастер-классы «Решение задач по химии». Я с удовольствием вам помогу.
Репетитор по химии и биологии кбн В.Богунова
Источник
Урок 24. Давление газа
В уроке 24 «Давление газа» из курса «Химия для чайников» рассмотрим устройство и принцип действия ртутного барометра, а также дадим определение давлению и рассмотрим его единицы измерения. Не пройдите мимо вводного урока в главу «Законы газового состояния», если вы его еще не читали.
Ртутный барометр
Если стеклянную трубку, закрытую с одного конца, наполнить ртутью (Hg), а затем перевернуть открытым концом в сосуд с ртутью, как показано на рисунке 3-1 (а), уровень ртути в трубке будет опускаться до тех пор, пока высота ртутного столбика над поверхностью ртути в сосуде не достигнет приблизительно 760 миллиметров (мм).
Давление, оказываемое на поверхность ртути в сосуде весом ртутного столбика в трубке, в точности уравновешивается давлением окружающей атмосферы. Вследствие равенства этих давлений, действующих в противоположных направлениях, ртуть больше не выливается из трубки. Подобное устройство называется ртутным барометром. Его изобрел и впервые протестировал итальянский математик и физик Эванджелиста Торричелли для измерения атмосферного давления. Торричелли показал, что высота столбика ртути в барометрической трубке НЕ зависит от формы и размеров трубки, а потому, определяется не весом ртутного столбика, а давлением у его основания. Атмосферное давление на уровне моря поддерживает столбик ртути высотой 760 мм (в среднем). Поскольку в старину для измерения давления пользовались именно ртутными барометрами, то в качестве единицы измерения давления применялся «миллиметр ртутного столба«.
Единицы измерения давления
Давление определяется как сила, действующая на единицу площади (P = F/A), и поэтому в системе СИ единицей давления является паскаль (Па), определяемый как сила в 1 ньютон, действующая на площадь в 1 квадратный метр (Н/м 2 ). Для тех, кто плохо учил физику, напоминаю, что ньютон представляет собой силу, которая придает телу массой 1 кг ускорение 1 м/c 2 .
Пример 1. Плотность жидкой ртути равна 13,596 г/см 3 . Чему будет равен 1 мм ртутного столба (1 мм Hg) в паскалях?
Представим себе разлитый на столе слой ртути площадью 1 м 2 и толщиной 1 мм. Переведем сначала все размеры этого слоя в сантиметры; тогда его объем выразится как:
- 0,100 см × 100 см × 100 см = 1000 см 3
Плотность жидкой ртути равна 13,596 г/см 3 , т.е масса 1 кубического сантиметра ртути составляет 13,596 г, а зная это, нетрудно установить, что масса слоя равна:
- 1000 см 3 × 13,596 г/см 3 = 13 596 г =13,596 кг
Вес этого слоя можно найти как произведение его массы на ускорение силы тяжести, которое равно g = 9,8 м/c 2 ; таким образом, сила, с которой рассматриваемый слой ртути давит на стол, равна:
- F = m·g = 13,596 кг × 9,806 м/c 2 = 133,32 кг·м·с 2 = 133,32 Н
Поскольку площадь слоя ртути равна равна 1 м 2 , оказываемое им на стол давление определяется как :
- P = F/A = 133,32 Н / 1 м 2 = 133,32 Н/м 2 = 133,32 паскаля (Па)
Пример 2. Стандартное давление на уровне моря считается равным точно 760 мм Hg. Выразите это давление в паскалях.
Из примера 1 мы уже знаем, что давление 1 мм Hg эквивалентно 133,32 Па. Следовательно:
- 760 мм Hg × 133,32 Па/мм = 101 323 Па
Паскаль — слишком маленькая единица для измерения давлений газов, подобно тому как кубический метр — слишком неудобная единица для измерения объемов жидкостей в лабораторных условиях. Поэтому обычно давление газов измеряют в стандртных атмосферах:
- 1 атмосфера (атм) = 101 325 Па = 760 мм Hg
Пример 3. В горах, высота которых составляет около 2500 м над уровнем моря, атмосферное давление приблизительно равно 3/4 давления на уровне моря. Выразите это давление в стандартных атмофсерах, паскалях и миллиметрах ртутного столба.
Ответ: давление равно 0,750 атм, 76 000 Па или 570 мм Hg
Надеюсь урок 24 «Давление газа» помог создать некоторое представление о понятии давления и его единицах измерения. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Источник
Химия ЕГЭ. Равновесие в химических процессах
Согласно спецификации в 24 задании проверяют Ваши знания: обратимых и необратимых химических реакций, химическое равновесие, смещение равновесия под действием различных факторов.
Давайте разберем эту тему по пунктам.
Сначала, приведу определения обратимой и необратимой реакций.
Необратимой называется реакция, которая идет практически до конца в одном направлении.
Условия необратимости реакции:
- образование осадка: BaCl2 + H2SO4 = BaSO4↓ + 2HCl
- выделение газа: K2S + 2HCl = 2KCl + H2S↑
- образование слабого электролита: HCl + NaOH = NaCl + H2O.
Обратимой называется реакция самопроизвольно протекающая как в
прямом, так и в обратном направлении.
Некоторые обратимые реакции:
NH4Cl(тв) ⇄ NH3(г) + HCl(г)
СН3СООН ⇄ СН3СОО(-) + Н(+)
Исходя из определения обратимой реакции, можем представить себе, что начиная с какого-то момента, параллельно проходят обе реакции, как прямая, так обратная. Образующиеся в результате прямой реакции продукты реагируют между собой, превращаясь в исходные вещества, а исходные, в свою очередь, продолжают реагировать с образованием продуктов реакции. Понятно, что на начальном этапе скорость прямой реакции значительно больше скорости обратной, только по тому, что концентрации исходных веществ несоизмеримо больше концентраций продуктов реакции. Но, через некоторое время, концентрации продуктов увеличиваются, и скорость их взаимодействия между собой также увеличивается, а концентрации исходных веществ – уменьшаются, как и скорость их взаимодействия. В некоторый момент скорости прямой и обратной реакции уравниваются V(пр.) = V(обр.) (на рисунке, линии, описывающие скорость прямой и обратной реакции, сливаются в одну) и система приходит к состоянию химического равновесия. То есть, к состоянию с минимумом энергии в котором система может находиться неограниченно долгое время.
Химическое равновесие — состояние системы, в котором скорость прямой реакции равна скорости обратной.
О том, что система достигла состояния химического равновесия можно судить по тому, что концентрации всех веществ, участвующих в процессе, на протяжении достаточно долгого времени будут постоянны (не равны между собой, но постоянны во времени), как это видно на рисунке. Такие концентрации называются равновесными.
Для смещения равновесия, например для получения большего количества продуктов реакции, нужно целенаправленно повлиять на систему.
О влиянии на равновесную систему внешних факторов: температуры, давления, концентрации веществ говорит принцип Ле-Шателье (принцип «наоборот» ):
Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменив температуру, давление или концентрации веществ), то положение равновесия сместится таким образом, чтобы ослабить внешнее воздействие.
Разберем влияние каждого из факторов.
Изменение температуры
Повышение температуры смещает равновесие в сторону эндотермической реакции (реакции проходящей с поглощением теплоты):
Понижение температуры смещает равновесие в сторону экзотермической реакции (реакции проходящей с выделением теплоты):
Изменение давления
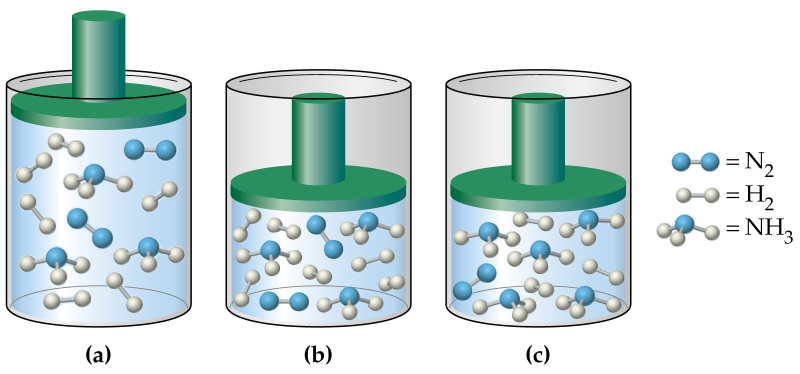
Повышение давления смещает равновесие в сторону меньшего количества моль газа :
Понижение давления смещает равновесие в сторону большего количества моль газ ообразных веществ:
Изменение концентрации
Увеличение концентрации реагентов или продуктов смещает равновесие в сторону той реакции, которая приводит к уменьшению их концентраций:
где С – концентрация вещества.
Уменьшение концентрации реагентов или продуктов смещает равновесие в сторону той реакции, которая приводит к увеличению их концентраций:
Хочу отметить, что ни добавление твердых веществ, ни их измельчение не приводит к смещению равновесия, так как равновесная реакция проходит на границе раздела фаз (твердое-газ, твердое- жидкость) и увеличивая поверность раздела фаз мы ускоряем как прямую, так и обратную реакции.
Влияние других веществ, не участвующих в реакции
- Прибавление веществ не участвующих в реакции, но взаимодействующих с реагентами или продуктами реакции:
добавление Н2SO4(конц.) (сильное водоотнимающее средство) снижает концентрацию Н2О(ж). Равновесие смещается вправо.
Добавление NaOH снижает концентрацию CH3COOH(ж), так как образуется соль — ацетат натрия. Равновесие смещается влево.
- Прибавление веществ, несущих одноименный ион.
добавление НCl увеличивает концентрацию ионов H(+). Равновесие
Разбавление усиливает диссоциацию слабых электролитов (закон разбавления Оствальда).
Ниже приведен график зависимости степени диссоциации слабого электролита от его концентрации.
Как видно из графика, с увеличением концентрации степень диссоциации уменьшается и наоборот с уменьшением концентрации, разбавлением — степень диссоциации увеличивается.
Рассмотрим это на примере уксусной кислоты:
для уксусной кислоты концентрацией 0,1 моль/л — степень диссоциации составляет 1,42%, а при разведении ее в 10 раз до концентарции 0,01 моль/л — степень диссоциации уже увеличится до 4,2%.
- Добавление инертного газа к газовой смеси
Здесь инертным можно считать любой газ, не реагирующий с веществами входящими в уравнение реакции.
- При условии сохранения постоянного объема ( V — const ) – равновесие не смещается, так как не изменяются концентрации газообразных веществ.
- При условии постоянного давления ( Р -const ) увеличивается объем смеси, что равносильно уменьшению давления в системе и смещению равновесия в сторону образования большего числа моль газа.
Добавление катализатора (ингибитора)
Катализаторы (ингибиторы) не приводят к смещению равновесия, а только ускоряют (замедляют) достижение состояния равновесия.
А теперь давайте рассмотрим некоторые примеры тестовых заданий:
А — повышение давления смещает равновесие в сторону образования меньшего количества моль газов. Смотрим на уравнение реакции и видим, что у нас слева 3 моль газа (Н2) и справа 3 моль газа (Н2О (г)), поэтому равновесие практические не смещается. ( ответ 3 )
Б — добавление катализатора не смещает равновесие. ( ответ 3 )
В — увеличение концентрации паров воды приводит к увеличению концентрации одного из продуктов, поэтому равновесие сместиться в сторону их расходования, то есть в сторону обратной реакции. ( ответ 2 )
Г — измельчение железа, твердого вещества — не смещает равновесие. ( ответ 3 )
А — повышение давления не влияет на смещение равновесия в растворе. ( ответ 3 ).
Б — добавление твердого гидроксида натрия в раствор приведет к его растворению. В растворе гидроксид натрия прореагирует с соляной кислотой. Таким образом равновесие сместится в сторону прямой реакции, так как уменьшается концентрация одного из продуктов реакции. ( ответ 1 )
В — увеличение температуры приводит к усилению гидролиза. ( ответ 1 )
Для реакций гидролиза тепловой эффект реакции могут не указывать, но Вы должны помнить, что гидролиз это эндотермический процесс.
Г — разбавление или увеличение концентрации воды приводит к смещению равновесия в сторону прямой реакции. ( ответ 1)
Третий и последний пример:
А — введение инертного газа при постоянном объеме не влияет на смещение равновесия. ( ответ 3 )
Б — уменьшение концентрации бутадиена смещает равновесие в сторону прямой реакции, так как уменьшается концентрация одного из продуктов. ( ответ 1 )
В — увеличение температуры приводит к смещению равновесия в сторону эндотермической реакции, то есть в сторону прямой реакции. ( ответ 1 )
Г — понижение давления смещает равновесие в сторону образования большего числа моль газа, то есть в сторону прямой реакции, в ходе которой образуется 3 моль газа. ( ответ 1)
А вот некоторые задания для самостоятельного решения:
Источник
Источник
