Давление в сосуде и упругость паров
Всякая жидкость способна испаряться при любой температуре. Вода, налитая в блюдце, испаряется, если даже ее температура будет низкой. Известно, что испаряться способны и твердые тела (испарение воды из смерзшегося белья, испарение йода и т. д.).
Процесс испарения жидкости будет продолжаться до тех пор, пока газовое пространство над ее поверхностью не будет насыщено парами этой жидкости. Таким образом, во влажной атмосфере, в тумане вода не испаряется.
Для насыщения замкнутого объема сухого воздуха парами жидкости при различных температурах необходимо тем большее количество паров, чем выше температура поверхностного слоя жидкости.
Известно, что при понижении внешнего давления (например, при восхождении на высокие горы, при полете в открытой кабине самолета) процесс кипения воды может наблюдаться при температурах значительно ниже 100 0С; при температуре 1000С вода кипит (т.е. неограниченно испаряется) только при внешнем давлении 760 мм. рт. столба. Все эти явления находят стройное объяснение, если ввести понятие об упругости паров жидкости.
Всем капельным жидкостям свойственна испаряемость, однако интенсивность испарения у различных жидкостей различна и зависит от условий, в которых они находятся. Характеристикой испаряемости является давление (упругость) насыщенных паров.
Упругостью паров жидкости называют парциальное давление паров над поверхностью жидкости, при котором пары находятся в равновесии с жидкостью (т. е. жидкость не испаряется, а пары не конденсируются). Иначе, давление насыщенных паров – это такое давление, при котором жидкость перестает кипеть, если давление в сосуде в процессе кипения повышается, или начинает кипеть, если давление в сосуде понижается.
Давление насыщенных паров зависит от рода жидкости ее температуры. Для всех жидкостей (не освобожденных от воздуха и других газов, обычно находящихся в жидкости в механической смеси или в растворенном виде) давление насыщенных паров лежит в пределах между давлением в пустоте и атмосферным давлением. Таким образом, чем больше давление насыщенных паров при данной температуре, тем больше испаряемость жидкости.
Упругость паров жидкости зависит от температуры и при достижении так называемой «температуры кипения» упругость паров становится равной внешнему давлению. Таким образом, испарение жидкости происходит тогда, когда парциальное давление паров данной жидкости в окружающей атмосфере меньше, чем упругость ее паров.
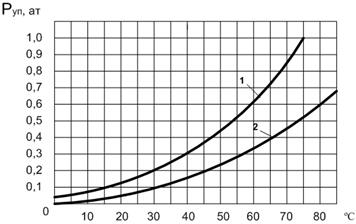
Кривая зависимости упругости паров от температуры дает возможность определить условия, соответствующие равновесному состоянию паровой и жидкой фаз (рис.1.5). Так, например, если абсолютное давление над водой будет равно 32 мм рт. столба (0,0435 кг/см2), то вода будет интенсивно превращаться в пар (кипеть) уже при температуре + 300С. Отсюда следует, что заставить жидкость закипеть можно не только путем ее подогрева до температуры кипения, но и путем понижения давления до величины, равной упругости ее паров при данной температуре.

Рис.1.5. Кривые упругости паров воды и авиабензина
Давление насыщенных паров различных жидкостей в значительной степени зависит от температуры и, как правило, увеличивается с ее повышением. Давление насыщенного водяного пара при температурах от –20 до 100 °С приведены в табл. 1.7.
Таблица 1.7
Давление насыщенного водяного пара
при температурах от –20 до 100 °С
Пересчет в СИ: 1 мм рт. ст. = 133,3 Па
| t, °С | p, мм рт.мт. | t, °С | p, мм рт.мт. | t,°С | p, мм рт.мт. | t, °С | p, мм рт.мт. | t, °С | p, мм рт.мт. |
| –20 | 0,772 | 6,54 | 31,82 | 118,0 | 355,1 | ||||
| –19 | 0,850 | 7,01 | 33,70 | 123,8 | 369,7 | ||||
| –18 | 0,935 | 7,51 | 35,66 | 129,8 | 384,9 | ||||
| –17 | 1,027 | 8,05 | 37,73 | 136,1 | 400,6 | ||||
| –16 | 1,128 | 8,61 | 39,90 | 142,6 | 416. 8 | ||||
| –15 | 1,238 | 9,21 | 42,18 | 149,4 | 433,6 | ||||
| –14 | 1,357 | 9,84 | 44,56 | 156,4 | 450,9 |
Продолжение табл. 1.7
| –13 | 1,486 | 10,52 | 47,07 | 163,8 | 468,7 | |
| –12 | 1,627 | 11,23 | 49,65 | 171,4 | 487,1 | |
| –11 | 1,780 | 11,99 | 52,44 | 179,3 | 506,1 | |
| –10 | 1,946 | 12,79 | 55,32 | 187,5 | 525,8 | |
| –9 | 2,125 | 13,63 | 58,34 | 196,1 | 546,1 | |
| –8 | 2,321 | 14,53 | 61,50 | 205,0 | 567,0 | |
| –7 | 2,532 | 15,48 | 64,80 | 214,2 | 588,6 | |
| –6 | 2,761 | 16,48 | 68,26 | 223. 7 | 610,9 | |
| –5 | 3,008 | 17,54 | 71,88 | 233,7 | 633,9 | |
| –4 | 3,276 | 18,65 | 75,65 | 243,9 | 657,6 | |
| –3 | 3,566 | 19,83 | 79,60 | 254,6 | 682,1 | |
| –2 | 3,879 | 21,07 | 83,71 | 265,7 | 707,3 | |
| –1 | 4,216 | 22,38 | 88,02 | 277,2 | 733,2 | |
| 4,579 | 23,76 | 92,51 | 289,1 | 760,0 | ||
| +1 | 4,93 | 25,21 | 97,20 | 301,4 | ||
| +2 | 5,29 | 26,74 | 102,1 | 314,1 | ||
| +3 | 5,69 | 28,35 | 107,2 | 327,3 | ||
| +4 | 6,10 | 30,04 | 112,5 | 341,0 |
Давление насыщенных паров можно определить так же как давление, соответствующее точке кипения жидкости при данной температуре. Поэтому, например, если жидкость находится в каком-либо сосуде (резервуар, трубопровод), абсолютное давление в котором равно давлению насыщенных паров, жидкость будет кипеть, а сосуд заполняться её парами
Давление насыщенных паровРsдля нефтепродуктов в интервале температур (-30÷100) 0С при температуре t с достаточной точностью определяется по формуле Рыбакова
Рst= Р38 · 10 (4,6 – 1430/t), (1.6)
где Р38 – давление насыщенных паров нефтепродукта по Рейду.
Источник
Упругость паров
Всякая жидкость способна испаряться при любой температуре. Вода, налитая в блюдце, испаряется, если даже ее температура будет низкой. Известно, что испаряться способны и твердые тела (испарение воды из смерзшегося белья, испарение йода и т. д.).
Процесс испарения жидкости будет продолжаться до тех пор, пока газовое пространство над ее поверхностью не будет насыщено парами этой жидкости. Таким образом, во влажной атмосфере, в тумане вода не испаряется.
Для насыщения замкнутого объема сухого воздуха парами жидкости при различных температурах необходимо тем большее количество паров, чем выше температура поверхностного слоя жидкости.
Известно, что при понижении внешнего давления (например, при восхождении на высокие горы, при полете в открытой кабине самолета) процесс кипения воды может наблюдаться при температурах значительно ниже 100 0 С; при температуре 100 0 С вода кипит (т.е. неограниченно испаряется) только при внешнем давлении 760 мм. рт. столба. Все эти явления находят стройное объяснение, если ввести понятие об упругости паров жидкости.
Всем капельным жидкостям свойственна испаряемость, однако интенсивность испарения у различных жидкостей различна и зависит от условий, в которых они находятся. Характеристикой испаряемости является давление (упругость) насыщенных паров.
Упругостью паров жидкости называют парциальное давление паров над поверхностью жидкости, при котором пары находятся в равновесии с жидкостью (т. е. жидкость не испаряется, а пары не конденсируются). Иначе, давление насыщенных паров — это такое давление, при котором жидкость перестает кипеть, если давление в сосуде в процессе кипения повышается, или начинает кипеть, если давление в сосуде понижается.
Давление насыщенных паров зависит от рода жидкости ее температуры. Для всех жидкостей (не освобожденных от воздуха и других газов, обычно находящихся в жидкости в механической смеси или в растворенном виде) давление насыщенных паров лежит в пределах между давлением в пустоте и атмосферным давлением. Таким образом, чем больше давление насыщенных паров при данной температуре, тем больше испаряемость жидкости.
Упругость паров жидкости зависит от температуры и при достижении так называемой «температуры кипения» упругость паров становится равной внешнему давлению. Таким образом, испарение жидкости происходит тогда, когда парциальное давление паров данной жидкости в окружающей атмосфере меньше, чем упругость ее паров.
Кривая зависимости упругости паров от температуры дает возможность определить условия, соответствующие равновесному состоянию паровой и жидкой фаз (рис.1.5). Так, например, если абсолютное давление над водой будет равно 32 мм рт. столба (0,0435 кг/см 2 ), то вода будет интенсивно превращаться в пар (кипеть) уже при температуре + 30 0 С. Отсюда следует, что заставить жидкость закипеть можно не только путем ее подогрева до температуры кипения, но и путем понижения давления до величины, равной упругости ее паров при данной температуре.
Рис.1.5. Кривые упругости паров воды и авиабензина
Давление насыщенных паров различных жидкостей в значительной степени зависит от температуры и, как правило, увеличивается с ее повышением. Давление насыщенного водяного пара при температурах от –20 до 100 °С приведены в табл. 1.7.
Давление насыщенного водяного пара
при температурах от –20 до 100 °С
Пересчет в СИ: 1 мм рт. ст. = 133,3 Па
| t, °С | p, мм рт.мт. | t, °С | p, мм рт.мт. | t,°С | p, мм рт.мт. | t, °С | p, мм рт.мт. | t, °С | p, мм рт.мт. |
| –20 | 0,772 | 6,54 | 31,82 | 118,0 | 355,1 | ||||
| –19 | 0,850 | 7,01 | 33,70 | 123,8 | 369,7 | ||||
| –18 | 0,935 | 7,51 | 35,66 | 129,8 | 384,9 | ||||
| –17 | 1,027 | 8,05 | 37,73 | 136,1 | 400,6 | ||||
| –16 | 1,128 | 8,61 | 39,90 | 142,6 | 416. 8 | ||||
| –15 | 1,238 | 9,21 | 42,18 | 149,4 | 433,6 | ||||
| –14 | 1,357 | 9,84 | 44,56 | 156,4 | 450,9 |
Продолжение табл. 1.7
| –13 | 1,486 | 10,52 | 47,07 | 163,8 | 468,7 |
| –12 | 1,627 | 11,23 | 49,65 | 171,4 | 487,1 |
| –11 | 1,780 | 11,99 | 52,44 | 179,3 | 506,1 |
| –10 | 1,946 | 12,79 | 55,32 | 187,5 | 525,8 |
| –9 | 2,125 | 13,63 | 58,34 | 196,1 | 546,1 |
| –8 | 2,321 | 14,53 | 61,50 | 205,0 | 567,0 |
| –7 | 2,532 | 15,48 | 64,80 | 214,2 | 588,6 |
| –6 | 2,761 | 16,48 | 68,26 | 223. 7 | 610,9 |
| –5 | 3,008 | 17,54 | 71,88 | 233,7 | 633,9 |
| –4 | 3,276 | 18,65 | 75,65 | 243,9 | 657,6 |
| –3 | 3,566 | 19,83 | 79,60 | 254,6 | 682,1 |
| –2 | 3,879 | 21,07 | 83,71 | 265,7 | 707,3 |
| –1 | 4,216 | 22,38 | 88,02 | 277,2 | 733,2 |
| 4,579 | 23,76 | 92,51 | 289,1 | 760,0 | |
| +1 | 4,93 | 25,21 | 97,20 | 301,4 | |
| +2 | 5,29 | 26,74 | 102,1 | 314,1 | |
| +3 | 5,69 | 28,35 | 107,2 | 327,3 | |
| +4 | 6,10 | 30,04 | 112,5 | 341,0 |
Давление насыщенных паров можно определить так же как давление, соответствующее точке кипения жидкости при данной температуре. Поэтому, например, если жидкость находится в каком-либо сосуде (резервуар, трубопровод), абсолютное давление в котором равно давлению насыщенных паров, жидкость будет кипеть, а сосуд заполняться её парами
Давление насыщенных паровРsдля нефтепродуктов в интервале температур (-30÷100) 0 С при температуре t с достаточной точностью определяется по формуле Рыбакова
где Р38 – давление насыщенных паров нефтепродукта по Рейду.
Источник
Упругость насыщенных паров
Упругость давление насыщенного пара углеводородов характеризует то давление, при котором газ начинает конденсироваться и переходить в жидкое состояние.У индивидуальных углеводородов в чистом виде упругость паров (Qi) есть функция только температуры: Qi =ƒ(Т).
Величина упругости насыщенных паров углеводородов повышается с ростом температуры. Это повышение тем выше, чем ниже плотность углеводорода. Аналогично с ростом молекулярной массы углеводорода величина упругости насыщенный паров углеводородов уменьшается при равных температурах (рис. 2.14).
Анализ зависимостей, представленных ниже (рис. 2.14) свидетельствует, что давление паров метана наибольшее. При нормальных условиях метан нельзя превратить в жидкость (пунктирная линия), так как его критическая температура (Ткр) = –82,4 о С (190,75 К).
Зависимости изменения объёма жидкого и парообразного пропана от давления при конкретной температуре (рис. 2.15 а) имеют гиперболическую форму. При сжатии
Рис. 2.14. Кривые упругости насыщенных паров чистых углеводородов:
1 – метан; 2 – этан; 3 – пропан; 4 – изобутан; 5 – бутан;
6 – изопентан; 7 – пентан; 8 – изогексан; 9 – гексан;
10 – изогептан; 11 – гептан; 12 – октан; 13 – нонан; 14 – декан
пропана от точки М до точки А он находится в состоянии перегретого (ненасыщенного) пара. Ненасыщенными (перегретыми) парами называются пары, которые при данной температуре и давлении образуют только однофазную паровую систему.
Рис. 2.15. Зависимости объёма жидкости от давления и температуры (а) и кривая упругости насыщенных паров (б) при температурах К:
1 – 283; 2 – 293; 3 – 303; 4 – 313; 5 – 323
Ненасыщенные пары могут существовать при данном давлении, если их температура выше температуры насыщенных паров, или при данной температуре, если их давление меньше давления насыщенных паров.
В точке А пар становится насыщенным, а при дальнейшем изменении объёма (участок АВ) он постепенно переходит в жидкость при неизменном давлении. В точке В заканчивается переход пара в жидкость. При дальнейшем сжатии пара будет резко повышаться давление при почти неизменном объёме. Горизонтальный участок АВ соответствует неизменности давления в процессе конденсации паровой фазы в жидкую фазу. Величина этого давления называется упругостью насыщенных паров природного газа при температуре опыта и обозначается Q. Чем ближе значение температуры, при которой измеряется упругость насыщенного пара газового компонента к значению критической температуры, тем короче горизонтальный участок. На основе полученных данных строят кривые упругости насыщенных паров, представляющие зависимости давления от температуры испарения данной жидкости (рис. 2. 15 б).
Насыщенным называется пар (газ), находящийся в равновесии с жидкостью. Для однокомпонентной системы условия равновесного сосуществования фаз определяются температурой и давлением. Между этими параметрами при равновесии существует взаимно однозначное соответствие: чем выше температура системы, тем выше давление, при котором находится данная равновесная система (рис. 2.16).
Рис. 2.16. Общий вид зависимости давления насыщенных паров от температуры:
АК – кривая давления насыщенных паров; I – область жидкой фазы; II – область перегретых (ненасыщенных) паров
Каждая точка кривой АК (рис. 2.16), например точка С, связывает давление насыщенных паров с температурой кипения жидкости.
Состояние вещества, при котором исчезает различие между его жидкой и газообразной фазами, называется критическим.
Критическая температура (Ткр) – максимальная температура, при которой газ и жидкость могут ещё сосуществовать в равновесии.
Выше температуры, равной критической, газ ни каким повышением давления нельзя перевести в жидкость.
Источник
Источник
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: насыщенные и ненасыщенные пары, влажность воздуха.
Если открытый стакан с водой оставить на долгое время, то в конце концов вода полностью улетучится. Точнее — испарится. Что такое испарение и почему оно происходит?
Испарение и конденсация
При данной температуре молекулы жидкости обладают разными скоростями. Скорости большинства молекул находятся вблизи некоторого среднего значения (характерного для этой температуры). Но попадаются молекулы, скорости которых значительно отличаются от средней как в меньшую, так и большую сторону.
На рис. 1 изображён примерный график распределения молекул жидкости по скоростям. Голубым фоном показано то самое большинство молекул, скорости которых группируются около среднего значения. Красный «хвост» графика — это небольшое число «быстрых» молекул, скорости которых существенно превышают среднюю скорость основной массы молекул жидкости.

Рис. 1. Распределение молекул по скоростям
Когда такая весьма быстрая молекула окажется на свободной поверхности жидкости (т.е. на границе раздела жидкости и воздуха), кинетической энергии этой молекулы может хватить на то, чтобы преодолеть силы притяжения остальных молекул и вылететь из жидкости. Данный процесс и есть испарение, а молекулы, покинувшие жидкость, образуют пар.
Итак, испарение — это процесс превращения жидкости в пар, происходящий на свободной поверхности жидкости (при особых условиях превращение жидкости в пар может происходить по всему объёму жидкости. Данный процесс вам хорошо известен — это кипение).
Может случиться, что через некоторое время молекула пара вернётся обратно в жидкость.
Процесс перехода молекул пара в жидкость называется конденсацией. Конденсация пара — процесс, обратный испарению жидкости.
Динамическое равновесие
А что будет, если сосуд с жидкостью герметично закрыть? Плотность пара над поверхностью жидкости начнёт увеличиваться; частицы пара будут всё сильнее мешать другим молекулам жидкости вылетать наружу, и скорость испарения станет уменьшаться. Одновременно начнёт увеличиваться скорость конденсации, так как с возрастанием концентрации пара число молекул, возвращающихся в жидкость, будет становиться всё больше.
Наконец, в какой-то момент скорость конденсации окажется равна скорости испарения. Наступит динамическое равновесие между жидкостью и паром: за единицу времени из жидкости будет вылетать столько же молекул, сколько возвращается в неё из пара. Начиная с этого момента количество жидкости перестанет убывать, а количество пара — увеличиваться; пар достигнет «насыщения».
Насыщенный пар — это пар, который находится в состоянии динамического равновесия со своей жидкостью. Пар, не достигший состояния динамического равновесия с жидкостью, называется ненасыщенным.
Давление и плотность насыщенного пара обозначаются и . Очевидно, и — это максимальные давление и плотность, которые может иметь пар при данной температуре. Иными словами, давление и плотность насыщенного пара всегда превышают давление и плотность ненасыщенного пара.
Свойства насыщенного пара
Оказывается, что состояние насыщенного пара (а ненасыщенного — тем более) можно приближённо описывать уравнением состояния идеального газа (уравнением Менделеева — Клапейрона). В частности, имеем приближённое соотношение между давлением насыщенного пара и его плотностью:
(1)
Это весьма удивительный факт, подтверждаемый экспериментом. Ведь по своим свойствам насыщенный пар существенно отличается от идеального газа. Перечислим важнейшие из этих отличий.
1. При неизменной температуре плотность насыщенного пара не зависит от его объёма.
Если, например, насыщенный пар изотермически сжимать, то его плотность в первый момент возрастёт, скорость конденсации превысит скорость испарения, и часть пара конденсируется в жидкость — до тех пор, пока вновь не наступит динамическое равновесие, в котором плотность пара вернётся к своему прежнему значению.
Аналогично, при изотермическом расширении насыщенного пара его плотность в первый момент уменьшится (пар станет ненасыщенным), скорость испарения превысит скорость конденсации, и жидкость будет дополнительно испаряться до тех пор, пока опять не установится динамическое равновесие — т.е. пока пар снова не станет насыщенным с прежним значением плотности.
2. Давление насыщенного пара не зависит от его объёма.
Это следует из того, что плотность насыщенного пара не зависит от объёма, а давление однозначно связано с плотностью уравнением (1).
Как видим, закон Бойля — Мариотта, справедливый для идеальных газов, для насыщенного пара не выполняется. Это и не удивительно — ведь он получен из уравнения Менделеева — Клапейрона в предположении, что масса газа остаётся постоянной.
3. При неизменном объёме плотность насыщенного пара растёт с повышением температуры и уменьшается с понижением температуры.
Действительно, при увеличении температуры возрастает скорость испарения жидкости.
Динамическое равновесие в первый момент нарушается, и происходит дополнительное испарение некоторой части жидкости. Пара будет прибавляться до тех пор, пока динамическое равновесие вновь не восстановится.
Точно так же при понижении температуры скорость испарения жидкости становится меньше, и часть пара конденсируется до тех пор, пока не восстановится динамическое равновесие — но уже с меньшим количеством пара.
Таким образом, при изохорном нагревании или охлаждении насыщенного пара его масса меняется, поэтому закон Шарля в данном случае не работает. Зависимость давления насыщенного пара от температуры уже не будет линейной функцией.
4. Давление насыщенного пара растёт с температурой быстрее, чем по линейному закону.
В самом деле, с увеличением температуры возрастает плотность насыщенного пара, а согласно уравнению (1) давление пропорционально произведению плотности на температуру.
Зависимость давления насыщенного пара от температуры является экспоненциальной (рис. 2). Она представлена участком 1–2 графика. Эту зависимость нельзя вывести из законов идеального газа.

Рис. 2. Зависимость давления пара от температуры
В точке 2 вся жидкость испаряется; при дальнейшем повышении температуры пар становится ненасыщенным, и его давление растёт линейно по закону Шарля (участок 2–3).
Вспомним, что линейный рост давления идеального газа вызван увеличением интенсивности ударов молекул о стенки сосуда. В случае нагревания насыщенного пара молекулы начинают бить не только сильнее, но и чаще — ведь пара становится больше. Одновременным действием этих двух факторов и вызван экспоненциальный рост давления насыщенного пара.
Влажность воздуха
Воздух, содержащий водяной пар, называется влажным.Чем больше пара находится в воздухе, тем выше влажность воздуха.
Абсолютная влажность — это парциальное давление водяного пара, находящегося в воздухе (т. е. давление, которое водяной пар оказывал бы сам по себе, в отсутствие других газов). Иногда абсолютной влажностью называют также плотность водяного пара в воздухе.
Относительная влажность воздуха — это отношение парциального давления водяного пара в нём к давлению насыщенного водяного пара при той же температуре. Как правило, это отношение выражают в процентах:
Из уравнения Менделеева-Клапейрона (1) следует, что отношение давлений пара равно отношению плотностей. Так как само уравнение (1), напомним, описывает насыщенный пар лишь приближённо, мы имеем приближённое соотношение:
Одним из приборов, измеряющих влажность воздуха, является психрометр. Он включает в себя два термометра, резервуар одного из которых завёрнут в мокрую ткань. Чем ниже влажность, тем интенсивнее идёт испарение воды из ткани, тем сильнее охлаждается резервуар «мокрого» термометра, и тем больше разность его показаний и показаний сухого термометра. По этой разности с помощью специальной психрометрической таблицы определяют влажность воздуха.
Источник
