Действие цамф на сосуды
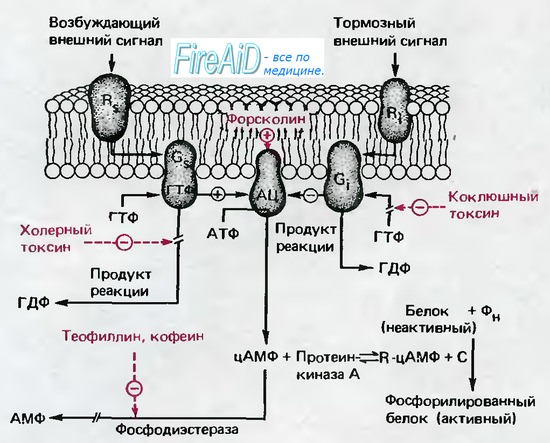
Оглавление темы “Эндоцитоз. Экзоцитоз. Регуляция клеточных функций.”: Циклический аденозинмонофосфат, цАМФ. цАМФ в регуляции функции клетки.В последнее время доказано, что циклический аденозинмонофосфат (цАМФ), производное основного источника энергии в организме- АТФ, является важным вторым посредником. Сложная цепь реакций, показанная на рис. 1.15, начинается с рецептора Rs на наружной поверхности плазматической мембраны, который может служить местом специфического связывания для различных медиаторов и гормонов. После связывания со специфической «стимулирующей» молекулой Rs изменяет свою конформацию; эти изменения влияют на белок Gs на внутренней поверхности мембраны таким образом, что становится возможной активация последнего внутриклеточным гуанозинтрифосфатом (ГТФ). Активированный белок Gs, в свою очередь, стимулирует фермент на внутренней поверхности мембраны-аденилатциклазу (АЦ), которая катализирует образование цАМФ из АТФ. Водорастворимый цАМФ и является посредником, передающим эффект стимуляции внеклеточного рецептора Rs к внутренним структурам клетки. Параллельно со стимуляторной цепью реакций с участием Rs возможно связывание тормозных медиаторов и гормонов с соответствующим рецептором Ri, который опять-таки через ГТФ-активи-руемый белок Gi; ингибирует АЦ и, таким образом, продукцию цАМФ. Диффундируя в клетку, цАМФ реагирует с аденилаткиназой (А-киназа); при этом высвобождается субъединица С, которая катализирует фосфорилирование белка Р. Это фосфорилирование переводит белки в активную форму, и теперь они могут проявить свое специфическое регулирующее действие (например, вызвать деградацию гликогена). Эта сложная регуляторная система чрезвычайно эффективна, так как конечным результатом является фосфорилирование множества белков, т. е. регуляторный сигнал проходит цепь с большим коэффициентом усиления. Наружные медиаторы, которые связываются с рецепторами Rs и Ri, специфическими для каждого из них, чрезвычайно разнообразны. Адреналин, связываясь с Rs или Ri, участвует в регуляции метаболизма липидов и гликогена, а также в усилении сокращения сердечной мышцы и в других реакциях. Тиреотропный гормон, активируя Rss, стимулирует выделение щитовидной железой гормона тироксина, а простагландин I тормозит агрегацию кровяных пластинок. Ингибиторные эффекты, в том числе адреналина, опосредованные через Ri, выражаются в замедлении липолиза. Таким образом, система цАМФ-это многофункциональная внутриклеточная регуляторная система, которая может точно контролироваться внеклеточными стимуляторными и ингибиторными сигнальными веществами. – Также рекомендуем “Инозитолфосфат «ИФ3». Инозитолтрифосфат. Диацилглицерол.” |
Источник
Преферанская Нина Германовна
Доцент кафедры фармакологии образовательного департамента Института фармации и трансляционной медицины Мультидисциплинарного центра клинических и медицинских исследований Международной школы “Медицина будущего” Первого МГМУ им. И.М. Сеченова (Сеченовский университет), к.фарм.н.
Головной мозг человека занимает 2% от массы тела человека. Каждую минуту мозг получает до 800 мл крови, с которой доставляется 20% кислорода от всего поступающего в организм. Поэтому даже временное уменьшение поступления кислорода может привести к патологическим изменениям в клетках и тканях мозга.
Кроме этого, комплекс нарушений мозгового кровообращения приводит к патологии венозного кровотока, возникновению отеков, нарушается выведение продуктов обмена, изменяются реологические свойства крови и микроциркуляция. Этот тип нарушений мозгового кровообращения является предвестником более тяжелых осложнений, и если не принять меры, то высока вероятность развития инсульта.
Во многих странах мира острые нарушения мозгового кровообращения являются одним из самых частых причин смертности и одной из наиболее распространенных причин инвалидизации населения. В России ежегодно регистрируется более 450 тыс. новых инсультов, чаще регистрируется ишемический инсульт (70%) и с летальным исходом — 35%.
Среди всех причин инвалидизации постинсультная занимает первое место и составляет 3,2 на 10 000 населения. К труду возвращаются только 20% лиц, перенесших инсульт, при этом 35% заболевающих инсультом люди трудоспособного возраста. Тенденцию к возникновению «помолодевшего» инсульта связывают с несоблюдением здорового образа жизни, несвоевременно поставленным диагнозом сопутствующих заболеваний и отсутствием полноценной профилактики. Наиболее часто инсульт поражает людей, страдающих атеросклерозом, артериальной гипертонией и аневризмой сосудов головного мозга.
Введение в терапевтическую практику высокоэффективных и новых лекарственных средств обеспечит наилучший исход лечения больных с острыми нарушениями мозгового кровообращения. Напомним, что ишемический инсульт возникает вследствие нарушения притока крови к участку мозга, в результате закупорки артерии, питающей этот участок, тромбом или атеросклеротической бляшкой. Геморрагический инсульт обусловлен кровоизлиянием в мозг, обычно связан с разрывом артерии, в которой произошли глубокие изменения в связи с атеросклеротическим процессом. Таким образом, атеросклероз является основной причиной большинства нарушений мозгового кровообращения. При инсульте погибает участок мозга, и функции, которые контролируют этот участок, становятся невозможными. Лечение и профилактика инсульта сводятся к устранению нарушений мозгового кровообращения.
Решающее значение принадлежит первичной профилактике антиагрегантными, ноотропными и антиатеросклеротическими средствами. При острых и хронических нарушениях мозгового кровообращения: инфаркте мозга, черепно-мозговых травмах, атеросклеротических изменениях, в т.ч. и дисциркуляторной энцефалопатии, транзиторных спазмах мозговых сосудов и сильных головных болях (в т.ч. при мигренях), применяют препараты, улучшающие мозговое кровообращение, укрепляющие стенки сосудов, насыщающие кислородом, питательными веществами клетки мозга.
Данная группа препаратов обладает способностью к вазодилатации, уменьшает сопротивление мозговых сосудов, восстанавливает эластичность мембран эритроцитов, ингибирует агрегацию активированных тромбоцитов, улучшает микроциркуляцию, текучесть крови и нормализует метаболические процессы в нервной ткани. Полноценная доставка кислорода к регенерирующим тканям улучшает переносимость гипоксии.
В базисную терапию с целью профилактики и лечения недостаточности мозгового кровообращения входят следующие группы лекарственных средств:
I. Блокаторы “медленных” кальциевых каналов L–типа — Нимодипин (Нимопин, Нимотоп), Циннаризин (Стугерон) (см. МА №1/18).
II. Блокаторы α–адренорецепторов — Ницерголин (Сермион).
III. Спазмолитики миотропного действия, ингибирующие фосфодиэстеразу, — Винпоцетин (Кавинтон), Пентоксифиллин(Трентал).
IV. Лекарственные препараты, содержащие никотиновую кислоту, — Ксантинола никотинат (Компламин), Никотиноил — γ–аминомасляная кислота (Пикамилон).
V. Ноотропные препараты — Ноотропил (Пирацетам), Гопантеновая кислота /Гопантенат кальция (Пантогам), Пиритинол (Энцефобол), Идебенон (Нобен) и др.
VI. Антиоксидантные лекарственные средства — Метилэтилпиридинол гидрохлорид (Эмоксипин), Этилметилгидроксипиридина сукцинат (Мексидол).
VII. Комбинированные препараты — Винпоцетин + Ноотропил (Винпотропил), Антитела к мозгоспецифическому белку S-100 + Антитела к эндотелиальной NO-синтазе (Диваза), Этамиван + Гексобендин + Этофиллин (Инстенон), Мексидол + Пиридоксин (МексиВ6), Дротаверин + Никотиновая кислота (Нишкопан), Пирацетам + Циннаризин (Фезам).
VIII. Препараты животного происхождения — Церебролизин, Кортексин, Актовегин.
IX. Препараты растительного происхождения — Гинкго двулопастного листьев экстракт (Гинкго Билоба, Танакан и др.).
X. Гомеопатические препараты — Мемория.
Фармакологический эффект этих препаратов складывается из однонаправленных эффектов, потенцированно воздействующих на различные звенья патогенеза ишемического и гипоксического поражения ЦНС.
БЛОКАТОРЫ α–АДРЕНОРЕЦЕПТОРОВ
Ницерголин (Сермион,табл., покрытые обол., 0,01 г и амп. — лиофилизированное сухое вещество 4 мг д/инъекционного р-ра в комплекте с растворителем) — по химической структуре является аналогом алкалоидов спорыньи, содержащий помимо эрголинового ядра бромзамещенный остаток никотиновой кислоты. Не избирательно блокирует α-адренорецепторы, действуя на периферические адренергические процессы. Обладает миотропной спазмолитической активностью на резистивные сосуды, особенно выраженной в отношении сосудов мозга, повышает проницаемость для глюкозы, ингибирует агрегацию тромбоцитов. Препарат мало влияет на артериальное давление. При применении (показания к применению читать внимательно в инструкции) эффект развивается постепенно, лечение проводят длительно, иногда в течение нескольких месяцев. Таблетки принимают 3 раза в день за 1 час до еды.
Важно! Возможны побочные эффекты при применении препарата — головокружение, покраснение кожи лица, нарушение сна или сонливость, артериальная гипотония. После инъекционного введения во избежание ортостатической гипотензии больному необходимо находиться в горизонтальном положении в течение 30 мин. Одновременный прием с другими гипотензивными средствами повышает вероятность развития коллапса. Противопоказанием служит выраженная артериальная гипотония, инфаркт миокарда, выраженный атеросклероз периферических сосудов, беременность.
СПАЗМОЛИТИКИ МИОТРОПНОГО ДЕЙСТВИЯ, ИНГИБИРУЮЩИЕ ФОСФОДИЭСТЕРАЗУ
Препараты обладают комплексом различных и вместе с тем взаимодополняющих фармакологических эффектов. Препараты оказывают прямое сосудорасширяющее действие на миофибриллы сосудов, ингибируют фосфодиэстеразу и повышают концентрацию цАМФ, АТФ в тканях и в гладкой мускулатуре сосудов. За счет ингибирования фосфодиэстеразы III и накопления внутриклеточного медиатора цАМФ снижается внутриклеточный кальций, блокируются тормозные аденозиновые рецепторы на мембранах структур мозга и тормозится реабсорбция аденозина в эритроциты. Понижается тонус сосудов, улучшается кровоток в зоне ишемии и периинфарктной зоне, нормализуется метаболизм в мозговой ткани и трансмембранный транспорт глюкозы.
Воздействие на патологически измененную деформируемость эритроцитов снижает повышенную вязкость крови, способность тромбоцитов к образованию комплексов, тормозит агрегацию тромбоцитов. Под влиянием препаратов увеличивается сродство эритроцитов к кислороду крови, их способность к передаче кислорода в ткани, повышается эластичность стенки красных кровяных телец, улучшаются реологические свойства и текучесть крови. Препараты повышают усвояемость кислорода и глюкозы на тканевом и клеточном уровнях, улучшают микроциркуляторные процессы в ЦНС.
Винпоцетин (Кавинтон,табл. 0,005 г и 0,5% р-р д/инъекций — амп. 2 мл) — этиловый эфир аповинкаминовой кислоты, производное алкалоида девинкана, содержащегося в барвинке малом. Препарат оказывает селективно–церебральное, антивазоспастическое, стресспротективное, антиоксидантное действие. При приеме препарата не возникает синдрома обкрадывания, т.к. он действует только на те сосуды, которые находятся в состоянии патологически повышенного тонуса.
Из побочных эффектов наблюдается преходящее небольшое снижение системного артериального давления и тахикардия. Противопоказанием служат тяжелые формы ишемической болезни сердца (ИБС), тяжелые аритмии, беременность.
Пентоксифиллин (Трентал, табл./драже 0,1 г; табл., покрытые обол., 0,1 г, ретард 0,4 и 0,6 г; 2% р-р д/инъекций — амп. 5 мл) — препарат является производным диметилксантина (пурина), обладает вазодилатирующим, антигипоксическим, ангиопротекторным, антиагрегантным и антиангинальным действием. Применяется в основном при атеросклеротических поражениях сосудов, ишемическом инсульте, постинсультных состояниях, сосудистой импотенции, цереброваскулярной недостаточности и при нарушениях периферического кровообращения.
Важно! При применении препарата возможно появление головокружения, головной боли, тревожности, желудочно–кишечных нарушений, крайне редко — приступы тахикардии и падение АД. При внутривенном введении усиливается коллатеральное кровообращение, повышается объем крови, протекающей через единицу сечения. После приема внутрь быстро и почти полностью всасывается.
Противопоказанием служит повышенная склонность к кровоточивости, тяжелые нарушения функции почек и печени, острый инфаркт миокарда, беременность, кормление грудью. Курение снижает терапевтическую эффективность препарата.
ПРЕПАРАТЫ, СОДЕРЖАЩИЕ НИКОТИНОВУЮ КИСЛОТУ
Никотиновая кислота является коэнзимом, участвует в метаболизме белков, жиров и углеводов, регулирует окислительно-восстановительные процессы в организме. Введение никотиновой кислоты в молекулы препаратов позволяет оказать прямое сосудорасширяющее действие, получить вазодилатирующий эффект, уменьшить сопротивление мозговых сосудов, подавить агрегацию тромбоцитов, увеличить скорость мозгового кровотока и нормализовать микроциркуляцию в зоне ишемии. Никотиновая кислота способна усиливать иммунологическую реактивность организма путем выраженного стимулирующего влияния на процессы фагоцитоза и способствует защите организма от токсичных продуктов апоптоза.
Ксантинола никотинат, табл. 0,15 г, 15% р–р — амп. 2 мл) — производное ксантина, сочетает свойства теофиллина и никотиновой кислоты, расширяет периферические сосуды, улучшает коллатеральное кровообращение, улучшает окислительное фосфорилирование и синтез АТФ. Уменьшает периферическое сопротивление и усиливает сокращения миокарда, препарат способствует увеличению минутного объема. Ксантинола никотинат усиливает мозговое кровообращение и снимает явления церебральной аноксемии (гипоксии).
Применяют у взрослых при острых артериальных тромбозах, ретинопатии, остром тромбофлебите поверхностных и глубоких вен, посттромбофлебическом синдроме, мигрени, при наличии показаний для усиления мозгового кровообращения. Таблетки принимают после еды, не разжевывая. Курс лечения продолжается обычно не менее 2 месяцев. Или же препарат вводят в виде раствора внутримышечно или внутривенно. Длительность введения 2–3 недели.
Важно! При применении препарата может возникать головокружение, ощущение жара, покалывание и покраснение кожи верхней части тела, особенно головы и шеи. Эти симптомы обычно исчезают через 10–20 мин., не требуют специального лечения или отмены лечения, об этом врачу необходимо предупредить больного перед началом лечения. При возникающих тошноте и диспептических явлениях дозу следует уменьшить. Применение противопоказано при сердечной недостаточности II–III стадии.
Никотиноил гамма–аминомасляная кислота (Пикамилон, табл. 0,02 г, 0,05 г, 5% и 10% р-р д/инъек. — амп. 2 мл) — производное аминомасляной кислоты, ноотропное средство, психоаналептик, улучшает мозговой кровоток и обмен веществ, восстанавливает умственную и физическую работоспособность. Обладает транквилизирующим, психостимулирующим, антиагрегантным и антиоксидантным действием. Улучшает функциональное состояние мозга за счет нормализации метаболизма тканей и влияния на кровообращение. Показаниями для применения препарата являются острые и хронические нарушения мозгового кровообращения, цереброваскулярная недостаточность, в составе комплексной терапии мигрени, при состояниях, сопровождающиеся страхом, тревогой, повышенной раздражительностью, эмоциональной лабильностью.
При хронических нарушениях мозгового кровообращения вводят внутривенно или внутримышечно. Курс лечения — от 15 до 30 дней.
Никотиновая кислота + Дротаверин — комбинированный препарат, содержит: 22 мг никотиновой кислоты + 78 мг дротаверина гидрохлорида — оказывает сосудорасширяющее, гиполиподемическое действие, улучшает микроциркуляцию и коллатеральный кровоток.
Преферанская Н.Г.
Источник
— [ Страница 2 ] —
Принципиально важно было выяснить, действительно ли действие активаторов Epac (8-pMeOPT-2′-O-Me-cAMP и 8-CPT-2′-O-Me-cAMP) специфично и не опосредовано активацией протеинкиназы А. Специфичность действия активаторов белков Epac доказывают опыты, проведенные на тромбоцитах. Известно, что в тромбоцитах повышение уровня цАМФ блокирует увеличение концентрации цитоплазматического Са2+ и подавляет их агрегацию (Авдонин и соавт., 1985). Установлено, что цАМФ-зависимое подавление агрегации тромбоцитов происходит при участии протеинкиназы А. Действительно, как видно из приведенных в таблице данных, активация эндогенной протеинкиназы A Sp-8-Br-cAMPS полностью блокировала АДФ – индуцированную агрегацию тромбоцитов человека (таблица). В отличие от этого, активатор белков Epac 8-pMeOPT-2′-O-Me-cAMP в концентрации 200 мкМ не влиял на данный процесс. Аналогичные результаты были получены и в опытах на тромбоцитах крысы. Следовательно, белки Epac не ингибируют АДФ-индуцированную агрегацию тромбоцитов. Второй вывод, который следует из этих результатов – это то, что активатор белков Epac 8-pMeOPT-2′-O-Me-cAMP даже в концентрации 200 мкМ не вызывает активацию протеинкиназы A, то есть является специфичным по отношению к белкам Epac.
Из этого следует, что расслабляющее действие активатора белков Epac на сосуды также не связано с активацией протеинкиназы А, поскольку использованная в этом случае концентрация 8-pMeOPT-2′-O-Me-cAMP была как минимум в два раза ниже, чем в экспериментах с тромбоцитами.
Таблица
Влияние активаторов белков Epac (8-p-MeOPT-2′-O-cAMP) и протеинкиназы А (Sp-8-Br-cAMPS) на агрегацию тромбоцитов человека, индуцированную АДФ
| Условия экспериментов | Степень агрегации |
| 5 мкМ АДФ | 100 + 14 % |
| 200 мкМ Sp-8-Br-cAMPS, 5 мкМ АДФ | -3,3 + 0,5 % |
| 200 мкМ 8-p-MeOPT-2′-O-cAMP, 5 мкМ АДФ | 99 + 4 % |
Для каждого значения приведены данные 3-х измерений и стандартные ошибки среднего.
Дополнительным подтверждением вышесказанного являются опыты с ингибитором протеинкиназы A Rp-8-Br-cAMPS, добавление которого в концентрации 100 мкМ не предотвращало расслабление аорты под действием 100 мкМ 8-pMeOPT-2′-O-Me-cAMP (данные не приводятся). Следует

Рис.5. Оценка влияния ингибитора протеинкиназы G Rp-8Br-cGMPS (100 мкМ) на расслабляющее действие активатора белков Epac 8-pCPT-2′-O-Me-cAMP (100 мкМ) и нитроглицерина. Нитроглицерин использовали в концентрациях 11, 22, 44, 110 нМ и 4,4 мкМ. Добавление нитроглицерина обозначено тонкими стрелками. Аорту предсокращали путем добавления 0,1 мкМ фенилэфрина (ФЭ).
отметить, что данный ингибитор протеинкиназы А в концентрации 100 мкМ уменьшал релаксирующее действие форсколина (рис.2).
Важнейший механизм релаксации сосудов реализуется через NO/цГMФ-сигнальный путь. Если расслабление при участии белков Epac каким-то образом сопряжено с этим сигнальным путем, то эффект активаторов Epac на сосуды можно заблокировать при помощи селективного ингибитора цГМФ-активируемой протеинкиназы G. Для проверки этой гипотезы нами было исследовано влияние ингибитора цГМФ-активируемой протеинкиназы Rp-8-бромогуанозин-3′,5′-циклического монофосфоротиоата (Rp-8-Br-cGMPS) на вызываемое активатором белков Epac 8-CPT-2′-O-Me-cAMP расслабление аорты. Как видно на рисунке 5, в присутствии ингибитора протеинкиназы G расслабление аорты под влиянием 8-CPT-2′-O-Me-cAMP было таким же, как в контрольном эксперименте. Для того, чтобы проверить, эффективен ли используемый ингибитор протеинкиназы G в условиях нашего эксперимента, было определено его действие на эффект донора NO – нитроглицерина. Оказалось, что ингибитор цГМФ-активируемой протеинкиназы подавлял действие нитроглицерина, делая его эффект обратимым (рис.5). Полученные результаты говорят о том, что расслабление аорты при действии активаторов белков Epac не связано с NO/цГМФ-сигнальным путем.
Таким образом, поставленные нами контрольные эксперименты доказывают, что действие 8-pMeOPT-2′-O-Me-cAMP и 8-CPT-2′-O-Me-cAMP специфично, и именно один из белков или оба белка Epac вызывают расслабление аорты. Вопрос о том, каков механизм действия этих белков, остается пока открытым. Можно предположить, что они действуют непосредственно в гладкомышечных клетках, подавляя вызванный вазоконстрикторными гормонами или нейротрансмиттерами подъем [Ca2+]цит, вызывают эндотелий-зависимое расслабление сосудов или ингибируют Са-независимый механизм сокращения гладких мышц сосудов.
Исследование влияния цАМФ на повышение концентрации кальция в гладкомышечных клетках сосудов под действием серотонина
Расслабление сосудов, предсокращенных гормонами или другими вазоактивными веществами, может происходить в результате ингибирования подъема уровня цитоплазматического кальция ([Ca2+]цит), вызванного вазоконстрикторами в гладкомышечных клетках (ГМК). Известно, что серотонин является мощным индуктором, повышающим уровень цитоплазматического кальция в ГМК. Мы оценивали влияние цАМФ на уровень повышения кальция под действием серотонина, регистрируя изменение концентрации [Ca2+]цит при помощи флуоресцентного зонда Fura-2. В контрольном эксперименте повторное добавление серотонина через 20 минут после первой добавки практически не снижало амплитуду кальциевого сигнала (рис. 6А). Однако после преинкубации клеток в течение 10 минут с 10 мкМ форсколина перед повторным добавлением серотонина амплитуда кальциевого сигнала уменьшалась более, чем в два раза (рис. 6 Б,В)


Рис.6. Влияние форсколина на повышение концентрации цитоплазматического кальция вызванной серотонином. А,Б – кинетика изменения [Ca2+]цит. В гладкомышечных клетках без преинкубации (А) и с преинкубацией с форсколином (Б). В- изменения реакции клеток при повторном добавлении в отсутствии и в присутствие форсколина. Концентрация серотонина составляла 10 мкМ, концентрация форсколина -10 мкМ. n – количество клеток.
Таким образом, можно предположить, что одним из механизмов действия цАМФ приводящим к расслаблению сосудов является ингибирование повышения концентрации цитоплазматического кальция в гладкомышечных клетках аорты крысы.
Исследование механизмов действия цАМФ на сократимость сердца
Влияние форсколина на сокращение сердца виноградной улитки
Для изучения цАМФ-зависимых механизмов регуляции сократимости сердца и роли белков Epac мы выбрали хорошо охарактеризованный в нашей лаборатории объект – сердце виноградной улитки Helix pomatia. Сердце улитки является чрезвычайно удобным объектом для проведения физиологических экспериментов, поскольку оно способно часами стабильно самопроизвольно сокращаться, а при хранении при 4оС сохраняет жизнеспособность в течение нескольких суток. В отличие от млекопитающих, у моллюсков активацию сократимости сердца вызывает серотонин, а не катехоламины. В активации сокращений сердца серотонином участвует цАМФ (Wollemann and Rozsa, 1975), однако детали этого процесса и механизмы действия цАМФ не исследованы. Влияние возрастающих концентраций серотонина на сокращения сердца виноградной улитки показано на рис. 7. Серотонин влияет на амплитуду сокращений и, как правило, не приводит к изменению частоты сокращения сердца.

Рис.7. Активация серотонином (5-HT) сокращения сердца виноградной улитки H.pomatia.
R-раствор Рингера. Концентрацию серотонина увеличивали путем смены раствора в канюле, к которой был прикреплен изолированный желудочек сердца улитки.
Мы убедились что серотонин активирует синтез цАМФ в мембранах, выделенных из сердца виноградной улитки (рис.8). Для того, чтобы оценить влияние цАМФ на сократимость сердца улитки, был использован активатор аденилатциклазы форсколин. Он оказывает значительно более сильный, по


Рис.8. Влияние серотонина и форсколина на активность аденилатциклазы в мембранах сердца виноградной улитки.
Рис.9. Влияние форсколина (А) и серотонина (Б) на амплитуду сокращений желудочка сердца виноградной улитки.
сравнению с серотонином, стимулирующий эффект на аденилатциклазу в мембранах, выделенных из сердца улитки (рис.8). Однако при сравнении влияния серотонина и форсколина на сократимость изолированного сердца улитки оказалось, что действие последнего значительно слабее (рис.9).
Исследование роли протеинкиназы А и белков Epac в проявлении активирующего действия цАМФ на сократимость сердца
Возникает вопрос о том, какова функция цАМФ в регуляции сократимости сердца. Из приведенных ранее данных (рис.9) видно, что просто повышение уровня цАМФ в сердце не приводит к сильному увеличению сократимости: эффект форсколина значительно слабее эффекта серотонина. Мы предположили, что в сердце моллюсков при воздействии серотонина реализуются цАМФ-зависимый и цАМФ-независимый механизмы активации сократимости. Для оценки влияния цАМФ на сократимость сердца улитки и выяснения механизмов его действия были использованы проникающие через мембрану аналоги цАМФ, селективно активирующие протеинкиназу А и белки Epac, Sp-8-Br-cAMPS и 8-CPT-2′-O-Me-cAMP, соответственно. На рис.10 показано, что преинкубация изолированного сердца с каждым из этих соединений достоверно увеличивает амплитуду реакции сердца на серотонин. Ни одно из них в отсутствие серотонина не увеличивает амплитуду сокращения сердца.

Рис.10. Влияние 8-CPT-2′-O-Me-cAMP и 8-Br-cAMPS на вызываемое серотонином увеличение амплитуды сокращения сердца виноградной улитки. Зависимости амплитуды сокращения сердца от концентрации серотонина определяли в контрольных условиях (нижние кривые) и в присутствии 8-pMeOPT-2′-O-Me-cAMP и Sp-8-Br-cAMPS в концентрациях 100 мкМ и 200 мкМ, соответственно. Данные соединения добавляли к сердцу за 20 минут до серотонина. Дозовые зависимости от серотонина (5-НТ) в контрольных условиях определяли за 40 минут до преинкубации сердец с аналогами цАМФ. В отдельных экспериментах показано, что без преинкубации с активаторами протеинкиназы А и белков Epac реакция на серотонин не изменяется.
Причина этого пока не установлена. Можно предполагать, что для усиления сократимости при действии цАМФ необходима одновременная стимуляция протеинкиназы А и белков Epac.
Активация сокращения сердца улитки серотонином через рецепторы, не сопряженные с аденилатциклазой

Приведенные выше данные говорят о том, что цАМФ не является основным фактором, регулирующим сердечную деятельность у виноградной улитки. При действии серотонина реализуется также другой, независимый от цАМФ механизм активации сократимости сердца. Мы предположили что в сердце виноградной улитки существует несколько видов рецепторов серотонина, активирующих сердце. О существовании более чем одного вида рецепторов серотонина в сердце улитки говорит тот факт, что зависимость амплитуды сократимости сердца от концентрации серотонина при анализе в координатах Скетчарда представляет из себя вогнутую двухфазную кривую (рис.11).
Рис. 11. Зависимость амплитуды сокращения сердца от концентрации серотонина представленная в координатах Скетчарда. По оси абцисс отложена величина амплитуды сокращений, выраженная в процентах от максимальной. По оси ординат отложено отношение амплитуды сокращения (%) к концентрации серотонина в нМ.
Для млекопитающих показано наличие 7 типов серотониновых рецепторов, большинство из которых сопряжены с G белками и влияют на активность аденилатциклазы и фосфолипазы С. Из этих семи типов 5НТ-рецепторов только 5HT3-рецепторы не сопряжены с G-белками и являются ионными каналами, через которые осуществляется транспорт катионов (Aghajanian and Sanders-Bush, 1999). Серотониновые рецепторы улитки не изучены, но, по аналогии с млекопитающими, мы предположили, что в реализации действия серотонина на сердце принимают участие различные типы серотониновых рецепторов, включая 5НТ3. В связи с этим было исследовано действие агониста серотониновых рецепторов третьего типа 5-HTQ (иодида N,N,N-триметил-серотонина). Оказалось, что действие 5-HTQ на сердце улитки вызывает дозозависимое увеличение амплитуды сокращения сердца (рис.12). Помимо этого, специфический антагонист 5HT3-рецепторов 3-тропонил-3,5-дихлорбензоат при концентарции 50 мкМ подавляет реакцию сердца на серотонин. Эти данные доказывают, что в сердце виноградной улитки имеются рецепторы, родственные 5HT3-рецепторам млекопитающих, которые, в отличие от всех остальных рецепторов серотонина, не сопряжены с G-белками и относятся к типу ионотропных рецепторов. Таким образом, существует путь регуляции сократимости сердца который не зависит от цАМФ.

Рис. 12. Увеличение амплитуды сокращения сердца под действием агониста 5HT3 рецепторов 5-HTQ (А) и ингибирование эффекта серотонина блокатором 5HT3-рецепторов 3-тропонил-3,5-дихлорбензоатом (Тр) (Б). Слева приведены контрольные зависимости амплитуды сокращений от концентрации серотонина. При определении действия блокатора 5НТ3-рецепторов его добавляли в концентрации 50 мкМ в отсутствие серотонина, а затем добавляли возрастающие концентрации серотонина одновременно с блокатором (Б, правая часть). R – раствор Рингера.
цАМФ независимый механизм регуляции сократимости сердца улитки тромбином
Так как действие цАМФ на сократимость сердца имеет, судя по всему, модулирующий характер, возникает закономерный вопрос о наличии полностью независимых от цАМФ механизмов регуляции сердечной деятельности. Мы обнаружили, что тромбин увеличивает амплитуду сокращений сердца (рис.13). Частота сокращений сердца до добавления тромбина составляла 40 ударов в минуту и не изменялась под действием тромбина. Вызванная тромбином активация сокращений сердца была обратимой – после его отмывания амплитуда сокращений быстро опускалась до исходного уровня.
При последующем после отмывания добавлении тромбина прирост амплитуды уменьшался не сильно. Это свидетельствует об избыточном содержании рецепторов тромбина и отсутствии существенной десенситизации. Характерная для лиганд-рецепторного взаимодействия зависимость эффекта тромбина от его концентрации свидетельствует, что тромбин связывается со специфичными для него рецепторами. В такой же области концентраций тромбин вызывает увеличение концентрации ионов Са2+ в цитоплазме гладкомышечных клеток аорты крысы и человека (Yufu et al, 2005).

Рис.13. Влияние тромбина на амплитуду сокращений желудочка сердца улитки H.pomatia
Источник
