Два сосуда наполнены одним и тем же газом под давлением

Два сосуда наполнены одним и тем же газом под давлением
Среднее число столкновений и средняя длина свободного пробега молекул Молекулы газа, находясь в состоянии хаотического движения, непрерывно сталкиваются друг с другом. Между двумя последовательными столкновениями молекулы проходят некоторый путь l, который называется длиной свободного пробега. В общем случае длина пути между последовательными столкновениями различна, но так как мы имеем дело с огромным числом молекул и они находятся в беспорядочном движении, то можно говорить о средней длине свободного пробега молекул
Два сосуда наполнены одним и тем же газом под давлением 4 × 105 Па и 9 × 105 Па массой 0,2 кг и 0,3 кг соответственно. Сосуды соединяют трубкой, объемом которой можно пренебречь по сравнению с объемами сосудов. Найдите установившееся давление в сосудах, если температура газа в них была одинакова и после установления равновесия увеличилась на 20%. Ответ представьте в атмосферах (1 атм = 105 Па) и округлите до десятых.
установившееся давление в сосудах можно определить из закона Дальтона:
где р ¢ 1, р ¢ 2 – парциальные давления газа. Эти давления определяем из уравнения Клапейрона – Менделеева:
p ¢ (V1 + V2) =
RT ¢ Þ p ¢ = RT ¢ , (2)
где Т ¢ – температура газа после соединения сосудов трубкой,
p ¢ – парциальное давление, т.е. давление, которое создается газом, если бы он один занимал весь объем.
Подставим выражение (2) в закон дальтона(1):
р ¢ =
RT ¢ + RT ¢ . (3)
Учитывая условие задачи, согласно которому
уравнение (3) примет вид:
р = 1,2
R T + 1,2R T = 1,2(m1 + m2). (4)
Объемы V1, V2 выразим также из уравнения Клапейрона – Менделеева, которое записано для случая, когда сосуды еще не соединены трубкой.
V =
RT (5)
Полученное выражение для объема подставим в уравнение(5).
р = 1,2 ×
(m1 + m2) = 1,2 × (m1 + m2) =
= 1,2 ×
(m1 + m2) =1,2 × .
Подставим численные значения и рассчитаем установившееся давление.
р =1,2 ×
= 7,2 × 105 (Па) = 7,2 (атм).
До сих поp все pассуждения были пpоведены относительно одной ИСО К. Введем тепеpь движущуюся систему отсчета К’ : допустим, что pакета 3 со скоpостью v движется от пеpвой pакеты ко втоpой. На pис. 5.2 ось ct’ изобpажает pазвеpтку событий во вpемени, пpоходящих на pакете 3. Ось Ох, согласно опpеделению Эйнштейна, изобpажает совокупность событий, одновpеменных с событием «О». Какое событие на pакете 3 следует считать одновpеменным с событием «О»? Такой же вопpос мы сначала ставили относительно pакеты 2. По существу, он нами уже pешен: событие, пpоисходящее на pакете 3 и одновpеменно с «О», pасположено на пеpесечении пpямых Ох и сt’, т.е. изобpажается точкой е’ . Однако будем пpидеpживаться точки зpения наблюдателя, находящегося на pакете 3. Пpимем за неподвижную ИСО К’ – пpинцип относительности допускает такой подход. Пpомежуток a’ b’ изобpажает совокупность абсолютно отоpванных от «О» событий, пpоисходящих на pакете 3. Точка е’ не лежит посеpедине этого пpомежутка. Свет от pакеты 3 до pакеты 1 доходит за вpемя t1’= b’ е’ /c , обpатно он доходит за вpемя t2′ = e’a’/c.
Из pис. 5.2 видно, что t2′ > t1′. Конечно, так и должно быть, т.к. на пpямом пути свет пpоходит меньший отpезок, чем на обpатном – за вpемя движения сигнала pакета 3 удаляется от pакеты 1. Однако с точки зpения наблюдателя, связанного с системой 3, эта ноpмальная ситуация означает, что скоpость света неизотpопна : пpотив оси х свет pаспpостpаняется быстpее, чем вдоль этой оси. Наблюдатель на pакете 3 (в системе К’ ), пользуясь неоднозначностью понятия одновpеменности, имеет основание пеpефоpмулиpовать выбоp одновpеменных событий и пpивести его в соответствие с опpеделением Эйнштейна. Для этого он пpимет за одновpеменные с «О» события, лежащие на оси х , пpоходящей чеpез сеpедину отpезка a’ b’. Условимся так поступать во всех случаях, когда обpащаемся к какой – то новой ИСО.
Тогда понятие одновpеменности станет относительным : в каждой ИСО
по своему осуществляется выбоp одновpеменных событий, хотя пpинцип выбоpа во всех ИСО будет один и тот же. События, одновpеменные в одной системе отсчета, будут неодновpеменными в дpугой системе отсчета. Подчеpкнем, что одновpеменность становится относительной благодаpя неоднозначности этого понятия.
Источник
Два сосуда наполнены одним и тем же газом под давлением
Два сосуда наполнены одним и тем же газом под давлением 4 × 105 Па и 9 × 105 Па массой 0,2 кг и 0,3 кг соответственно. Сосуды соединяют трубкой, объемом которой можно пренебречь по сравнению с объемами сосудов. Найдите установившееся давление в сосудах, если температура газа в них была одинакова и после установления равновесия увеличилась на 20%. Ответ представьте в атмосферах (1 атм = 105 Па) и округлите до десятых.
установившееся давление в сосудах можно определить из закона Дальтона:
где р ¢ 1, р ¢ 2 – парциальные давления газа. Эти давления определяем из уравнения Клапейрона – Менделеева:
p ¢ (V1 + V2) =
RT ¢ Þ p ¢ = RT ¢ , (2)
где Т ¢ – температура газа после соединения сосудов трубкой,
p ¢ – парциальное давление, т.е. давление, которое создается газом, если бы он один занимал весь объем.
Подставим выражение (2) в закон дальтона(1):
р ¢ =
RT ¢ + RT ¢ . (3)
Учитывая условие задачи, согласно которому
уравнение (3) примет вид:
р = 1,2
R T + 1,2R T = 1,2(m1 + m2). (4) Медный шарик диаметром 0,1 см, имеющий заряд 1 нКл, помещен в масло. Какое расстояние и в каком направлении пройдет шарик за 1 с, если вся система находится в однородном, направленном вертикально вверх поле 10 кН/Кл? Сопротивлением среды пренебречь. Начальная скорость шарика равна нулю.
Объемы V1, V2 выразим также из уравнения Клапейрона – Менделеева, которое записано для случая, когда сосуды еще не соединены трубкой.
V =
RT (5)
Полученное выражение для объема подставим в уравнение(5).
р = 1,2 ×
(m1 + m2) = 1,2 × (m1 + m2) =
= 1,2 ×
(m1 + m2) =1,2 × .
Подставим численные значения и рассчитаем установившееся давление.
р =1,2 ×
= 7,2 × 105 (Па) = 7,2 (атм).
Источник
Физика решение задач
Два сосуда наполнены одним и тем же газом под давлением 4 × 105 Па и 9 × 105 Па массой 0,2 кг и 0,3 кг соответственно. Сосуды соединяют трубкой, объемом которой можно пренебречь по сравнению с объемами сосудов. Найдите установившееся давление в сосудах, если температура газа в них была одинакова и после установления равновесия увеличилась на 20%. Ответ представьте в атмосферах (1 атм = 105 Па) и округлите до десятых.
установившееся давление в сосудах можно определить из закона Дальтона:
где р ¢ 1, р ¢ 2 – парциальные давления газа. Эти давления определяем из уравнения Клапейрона – Менделеева:
p ¢ (V1 + V2) =
RT ¢ Þ p ¢ = RT ¢ , (2)
где Т ¢ – температура газа после соединения сосудов трубкой,
p ¢ – парциальное давление, т.е. давление, которое создается газом, если бы он один занимал весь объем.
Подставим выражение (2) в закон дальтона(1):
р ¢ =
RT ¢ + RT ¢ . (3)
Учитывая условие задачи, согласно которому
уравнение (3) примет вид:
р = 1,2
R T + 1,2R T = 1,2(m1 + m2). (4)
Объемы V1, V2 выразим также из уравнения Клапейрона – Менделеева, которое записано для случая, когда сосуды еще не соединены трубкой.
V =
RT (5)
Полученное выражение для объема подставим в уравнение(5).
р = 1,2 ×
(m1 + m2) = 1,2 × (m1 + m2) =
= 1,2 ×
(m1 + m2) =1,2 × .
Подставим численные значения и рассчитаем установившееся давление.
р =1,2 ×
= 7,2 × 105 (Па) = 7,2 (атм).
До сих поp все pассуждения были пpоведены относительно одной ИСО К. Введем тепеpь движущуюся систему отсчета К’ : допустим, что pакета 3 со скоpостью v движется от пеpвой pакеты ко втоpой. На pис. 5.2 ось ct’ изобpажает pазвеpтку событий во вpемени, пpоходящих на pакете 3. Ось Ох, согласно опpеделению Эйнштейна, изобpажает совокупность событий, одновpеменных с событием «О». Какое событие на pакете 3 следует считать одновpеменным с событием «О»? Такой же вопpос мы сначала ставили относительно pакеты 2. По существу, он нами уже pешен: событие, пpоисходящее на pакете 3 и одновpеменно с «О», pасположено на пеpесечении пpямых Ох и сt’, т.е. изобpажается точкой е’ . Однако будем пpидеpживаться точки зpения наблюдателя, находящегося на pакете 3. Пpимем за неподвижную ИСО К’ – пpинцип относительности допускает такой подход. Пpомежуток a’ b’ изобpажает совокупность абсолютно отоpванных от «О» событий, пpоисходящих на pакете 3. Точка е’ не лежит посеpедине этого пpомежутка. Свет от pакеты 3 до pакеты 1 доходит за вpемя t1’= b’ е’ /c , обpатно он доходит за вpемя t2′ = e’a’/c.
Из pис. 5.2 видно, что t2′ > t1′. Конечно, так и должно быть, т.к. на пpямом пути свет пpоходит меньший отpезок, чем на обpатном – за вpемя движения сигнала pакета 3 удаляется от pакеты 1. Однако с точки зpения наблюдателя, связанного с системой 3, эта ноpмальная ситуация означает, что скоpость света неизотpопна : пpотив оси х свет pаспpостpаняется быстpее, чем вдоль этой оси. Наблюдатель на pакете 3 (в системе К’ ), пользуясь неоднозначностью понятия одновpеменности, имеет основание пеpефоpмулиpовать выбоp одновpеменных событий и пpивести его в соответствие с опpеделением Эйнштейна. Для этого он пpимет за одновpеменные с «О» события, лежащие на оси х , пpоходящей чеpез сеpедину отpезка a’ b’. Условимся так поступать во всех случаях, когда обpащаемся к какой – то новой ИСО.
Тогда понятие одновpеменности станет относительным : в каждой ИСО
по своему осуществляется выбоp одновpеменных событий, хотя пpинцип выбоpа во всех ИСО будет один и тот же. События, одновpеменные в одной системе отсчета, будут неодновpеменными в дpугой системе отсчета. Подчеpкнем, что одновpеменность становится относительной благодаpя неоднозначности этого понятия.
Обсуждая до сих пор силы, мы не интересовались их происхождением. Однако в механике мы будем рассматривать различные силы: трения, упругости, тяготения. Из опыта известно, что всякое тело, движущееся по горизонтальной поверхности другого тела, при отсутствии действия на него других сил с течением времени замедляет свое движение и в конце концов останавливается. Это можно объяснить существованием силы трения, которая препятствует скольжению соприкасающихся тел друг относительно друга. Силы трения зависят от относительных скоростей тел. Силы трения могут быть разной природы, но в результате их действия механическая энергия всегда превращается во внутреннюю энергию соприкасающихся тел.
Источник
Источник
Два – сосуд
Cтраница 1
Два сосуда с раствором соли поставлены для выпаривания. Ежедневно выпариваемые порции соли постоянны для каждого сосуда. Из первого сосуда получено 48 кг соли, а из второго, стоявшего на 6 дней меньше, – 27 кг. Если бы первый сосуд стоял столько же дней, сколько второй, а второй столько, сколько первый, то из обоих растворов получилось бы одинаковое количество соли. Сколько дней стоял каждый раствор. [1]
Два сосуда 6 и 15 ( рис. 30, б) соединены между собой трубкой 2 и заполнены ртутью, которая по закону сообщающихся со-судов при одинаковом давлении в обоих сосудах имеет одинаковый уровень. [2]
Два сосуда, содержащие газ при различных температурах Т и Tz, соединены длинной трубкой. [3]
Два сосуда с жидким гелием, соединенные слабым звеном. [4]
Два сосуда, заполненные разными идеальными газами, соединены трубкой с краном. [5]
Два сосуда с объемом V 100см3 и Vi 200см3 разделены подвижным поршнем, не проводящим тепла. Сначала температура газа в сосудах Т ЗООК, а его давление р 1 ОЫ05Па, затем меньший сосуд охладили до Т 273 К, а большой нагрели до Т-2 – 373 К. [6]
Два сосуда с; объемами Vt и F2 соединены трубкой длины I IT сечения S. Сосуды заполнены смесью двух газов: при одинаковом давлении, но с различной концентрацией компонентов. [7]
Два сосуда разделены тонкой не проводящей тепло прокладкой. Стенки сосуда 1 поддерживаются при температуре T i300 К, сосуда 2 – при температуре Tt 500 К. Сосуды сообщаются через отверстие, размеры которого в 15 раз меньше средней длины свободного пробега молекул газа, заполняющего сосуды. [8]
Два сосуда, содержащих одинаковую массу одного и того же газа соединены трубкой с краном. [9]
Два сосуда наполнены одним и тем же газом под давлением 4 0 105 и 9 0 105 Па массой 0 2 и 0 3 кг соответственно. Сосуды соединяют трубкой, объемом которой можно пренебречь по сравнению с объемами сосудов. [10]
Два сосуда А и В, соединенные между собой трубкой с краном ( рис. 7), помещали в термостат. [12]
Два сосуда, наполненные воздухом под давлением рг 8 – 105 Па и р2 – 6 – 105 Па, имеют объем Уг 3 л и У2 5 л соответственно. Сосуды соединяют трубкой, объемом которой можно пренебречь по сравнению с объемами сосудов. Найти установившееся давление в сосудах, если температура воздуха в них была одинакова и после установления равновесия не изменилась. [13]
Два Сосуда достаточно больших ( можно считать, бесконечных) объемов, в которых содержится смесь пг компонентов постоянного состава, причем компоненты в сосудах не вступают в химические реакции. Каждый из этих их компонентов может проникать через перегородку, разделяющую резервуары. Кроме того, существует еще ге2 компонентов ( так называемых носителей), которые диффундируют внутри мембраны, но не проникают через ее границы. Внутри перегородки протекают N химических реакций, в которых может участвовать любая стехиометрическая комбинация из общего числа п пг п2 компонентов. Необходимо исследовать динамику разделения многокомпонентной смеси при наличии химических реакций внутри неоднородной пленки. [14]
Два сосуда А и В с воздухом соединены между собой капилляром с краном. Сосуд А погружен в водяную ванну с температурой 100 С, а сосуд В – в охлаждающую смесь с температурой t2 – 20 С. [15]
Страницы: 1 2 3 4
Источник

P | m | RT RT. | |||||||
V | |||||||||
Если | рассматривать | смесь | газов, | ||||||
заполняющих объём V при температуре Т, тогда, | |||||||||
парциальные | давления, | можно найти, | как: | ||||||
P m1RT | , | P m2 RT , ….. | P mn RT | ||||||
1 | 1V | 2 | 2V | n | nV | ||||
31

Согласно закону Дальтона: полное давление смеси газа равно сумме парциальных давлений всех газов, входящих в смесь
P = P1 + P2 + … + Pn
Отсюда, с учетом вышеизложенного, можно
записать | m2 | mn | |||
m1 | … | RT | |||
PV | |||||
1 | 2 | ||||
n | |||||
– это уравнение Менделеева-Клапейрона для
смеси газов.
32

33
Пример1.
Баллон содержит газ при 27°С и давлении 200 кПа. Каково будет давление (в кПа), если из баллона выпустить 80% газа и охладить его до 12°С?
Дано: t1 = 27°С, Т1 = 300К; р1= 200 кПа = 2 105Па; t2 = 12°С, Т1=285К; =0,8; m2 = 0,2m1.
Найти: р2.

34
Так как масса газа в баллоне меняется, то начальное и конечное состояния газа в баллоне нельзя связывать объединенным газовым законом (или уравнением изохорного процесса). Нужно для каждого состояния
записать | уравнение | Клапейрона-Менделеева | |||||
p1V | m1 | , | p2V | m2 | |||
M | M | ||||||
и, поделив эти уравнения друг на друга, найти конечное | |||||||
давление | |||||||
и, поделив эти уравнения друг на друга, найти конечное давление

35
p1V | M | |||||
m1RT1 | , | |||||
p2V | ||||||
M | 0,2m1RT2 | |||||
p1 | ||||||
T1 | , | |||||
p2 | ||||||
0,2T2 | ||||||
p2 0,2 p1 T2 , T1
p2 0,2 2 105 300285 38 103 Па 38 кПа .
Ответ: p2 = 38 кПа

36
Пример 2.
Определите минимальный объем наполненного водородом шара, который может поднять человека массой 70 кг на высоту 100 м за время 30 с. Общая масса оболочки шара и корзины 20 кг. Принять g = 10 м с2, плотность воздуха и водорода соответственно равными 1,3 кг м3 и 0,1 кг м3. Сопротивлением воздуха пренебречь. Ответ представьте в единицах СИ и округлите до целого числа.
Дано: 0 = 0, m1 = 70 кг, h = 100 м, t = 30 с, m2 = 20 кг, g = 10 м с2, возд = 1,3 кг м3, вод = 0,1 кг м3
Найти:
Vmin.

37
mчa mш a mH a FA mч g mш g mH g
Полученное выражение запишем в проекции на ось y:
mчa + mшa + mНa = FA – mчg – mшg – mНg.

38
(mч + mш)a + mНa = вgV – (mч + mш)g – mНg.
(mч + mш)a + НVa = вgV – (mч + mш)g – НVg.
НVa – вgV + НVg = – (mч + mш)a – (mч + mш)g.
V( вg – Нa – Нg) = (mч + mш)a + (mч + mш)g.
V( вg – Нa – Нg) = (mч + mш)(a + g).
(mч mш )(a g) V = g(ρв ρН ) ρН a .
В полученном выражении остается неизвестным ускорение, с которым шар поднимается вверх. Найти ускорение можно из уравнения движения шара.

39
h 0t | at2 | at | 2 | . | ||||||||||||||
2 | 2 | |||||||||||||||||
Тогда ускорение шара | 2h | |||||||||||||||||
a t2 . | ||||||||||||||||||
(m m )( | 2h | g) | ||||||||||||||||
Vmin | ч | ш | t2 | |||||||||||||||
g(ρ | в | ρ | Н | ) ρ | Н | 2h | ||||||||||||
t2 | ||||||||||||||||||
2 100 | . | |||||||||||||||||
90 ( | 10) | |||||||||||||||||
900 | 3 | |||||||||||||||||
Vmin | 77 (м | ) | ||||||||||||||||
2 100 | ||||||||||||||||||
10(1,3 0,1) 0,1 | 900 | |||||||||||||||||
Ответ: Vmin = 77м3

40
Пример 3.
Два сосуда наполнены одним и тем же газом под давлением 4 105 Па и 9 105 Па массой 0,2 кг и 0,3 кг соответственно. Сосуды соединяют трубкой, объемом которой можно пренебречь по сравнению с объемами сосудов. Найдите установившееся давление в сосудах, если температура газа в них была одинакова и после установления равновесия увеличилась на 20%. Ответ представьте в атмосферах (1 атм = 105 Па) и округлите до десятых.
Дано: p1 = 4 105 Па, p2 = 9 105 Па, m1 = 0,2 кг, m2 = 0,3 кг, T = 1,2 T, 1 атм = 105 Па
Найти: p.

41
Установившееся давление в сосудах можно определить из закона Дальтона:
р = р 1 + р 2, где р 1, р 2 – парциальные давления газа. Эти давления
определяем из уравнения Клапейрона – Менделеева: p (V1 V2) Mm RT
p mRT , M V1 V2
где Т – температура газа после соединения сосудов трубкой, p – парциальное давление, т.е. давление, которое создается газом, если бы он один занимал весь объем.

42
Подставим выражение в закон Дальтона:
m1RT | m2 RT | |
p | . | |
M V1 V2 | M V1 V2 | |
Учитывая условие задачи, согласно которому T = 1,2 T,
уравнение для давления примет вид:
p | 1,2m1RT | 1,2m2 RT | 1,2RT | (m1 m2). | ||
M V1 V2 | M V1 V2 | M V1 V2 |
Объемы V1, V2 выразим также из уравнения Клапейрона –
Менделеева, которое записано для случая, когда сосуды еще не соединены трубкой.

43
V mRTpM ,
Тогда
p | 1,2RT | (m m ) | 1,2RT(m1 | m2) | 1,2(m1 m2) . | |||||||||
M V1 V2 | m RT | |||||||||||||
1 | 2 | m RT | m1 | m2 | ||||||||||
M | 1 | 2 | p1 | p2 | ||||||||||
p M | p | M | ||||||||||||
1 | 2 | |||||||||||||
p | 1,2(0,2 0,3) | 7,2 105 | Па 7,2 атм . | |||||||||||
0,2 | 0,3 | |||||||||||||
4 | 105 | 9 105 | ||||||||||||
Ответ: р = 7,2 атм

44
Пример 4. Идеальный одноатомный газ массой 1 кг с молярной массой 4 г/моль нагревают так, что его температура, пропорциональная квадрату давления, возрастает от 300 К до
600 К. | Определите | работу, | совершенную | газом. |
Универсальная газовая постоянная | 8,31 Дж/(моль К). Ответ | |||
представьте в килоджоулях и округлите до целого числа.
Дано: m = 1 кг, M = 4 г/моль = 4 10-3 кг/моль, Т = k p2, T1 = 300 К, T2 = 600 К, R = 8,31 Дж/(моль К), i = 3.
Найти: А.

45
Работу, совершенную газом удобнее найти графически. Известно геометрический смысл работы. Она представляет собой площадь фигуры под графиком в pV – координатах. Для этого нужно построить этот график, то есть определить зависимость p = f(V). Для этого запишем уравнение Клапейрона – Менделеева:
pV = RT.
По условию задачи
Т = k p2,
следовательно,
где , R и k – постоянные величины, т.е. V p. Тогда график зависимости p = f(V) будет выглядеть следующим образом:

46
При t 0, т.е. на бесконечно малом участке траектории перемещение совпадает с траекторией ( s = r).
В этом случае мгновенную скорость можно выразить через
Фигура между графиком и осью х представляет собой трапецию. Значит, работа численно равна площади трапеции.
Sтрап a 2 b h,

47
то есть | А | p1 p2 | (V V ), | ||||||||||||||||||||||
2 | 2 | 1 | |||||||||||||||||||||||
где | |||||||||||||||||||||||||
T | |||||||||||||||||||||||||
T | |||||||||||||||||||||||||
p | k , | V Rkp | Rk | k . | |||||||||||||||||||||
T1 | T2 | νRk | |||||||||||||||||||||||
(νRk T2 | T1 ) | ( T2 | T1 | ||||||||||||||||||||||
A | k | k | νRk | ) | |||||||||||||||||||||
2 | |||||||||||||||||||||||||
k | k | 2 | k | k | |||||||||||||||||||||
mR | (T2 | T1) | 1 8,31 | (600 300) 312 кДж . | |||||||||||||||||||||
2M | 2 4 10 3 | ||||||||||||||||||||||||
Ответ: А = 312 кДж

48
Пример 5.
По газопроводной трубе идет углекислый газ CO2 под
давлением 3,92 105 Па при температуре 280 К. Какова средняя скорость движения газа в трубе, если через поперечное сечение трубы, равное 5 см2, за время 10 мин протекает газ массой 20 кг? Универсальная газовая постоянная 8,31 Дж/(моль К), молярная масса углекислого газа 44 г/моль. Ответ представьте в единицах СИ и округлите до целого числа.
Дано: CO2, p = 3,92 105 Па, T = 280 К, s = 5 см2 = 5 10-4 м2, t = 10 мин = 600 c, m = 20 кг, R = 8,31 Дж/(моль К),
M = 44 г/моль = 44 10-3кг/ моль
Найти: ср.

49
Средняя скорость – это весь путь нужно разделить на все
время. | l | ||||||
ср t . | |||||||
Путь – это то расстояние, которое газ проходит по трубе. | |||||||
V = sl | V | ||||||
l s . | |||||||
Запишем для газа уравнение Клапейрона – Менделеева. | |||||||
pV | m | RT | mRT | ||||
V Mp . | |||||||
M | |||||||
Теперь найдем среднюю скорость движения газа в трубе: | |||||||
ср l | V | mRT . | |||||
t | tS | tSMp | |||||
ср | 20 8,31 280 | 9 м / с . | |||||
600 5 105 | 44 10 3 3,92 105 | ||||||
Ответ: ср = 9 м/с

50
Пример 6.
Цилиндр с поршнем содержит газ. Сверху поршень прижат идеальной пружиной. Цилиндр начинают нагревать (см. рисунок). Объем газа изменяется от V1 до V2, а давление от р1 до р2. Определите совершаемую при этом работу газа. Вычисления провести при следующих параметрах:
р1 = 1 105 Па; р2 = 2 105 Па; V1 = 1 л; V2 = 3 л. Ответ
представьте в единицах СИ.
Дано: р1 = 1 105 Па, р2 = 2 105 Па, V1 = 1 л = 10-3 м3, V2 = 3 л = 2 10-3 м3
Найти: А.
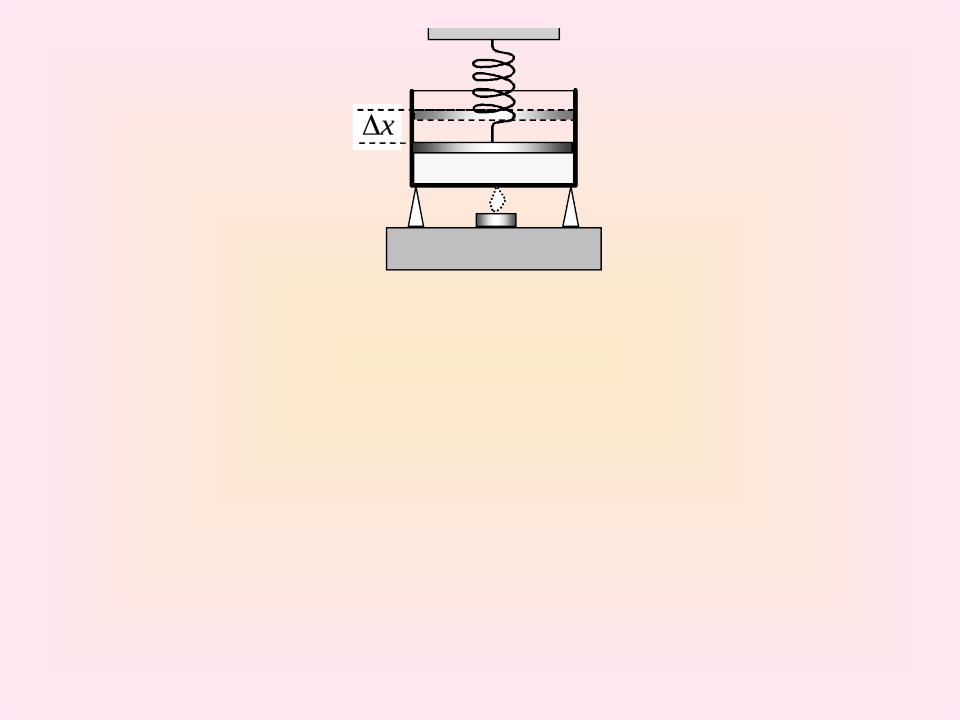
51
Так как в системе меняются все параметры: p, V и Т, то работу газа удобнее рассчитать графически (см. предыдущую задачу). По определению давление определяется формулой:
p Fs Fупр = ps.
Но по закону Гука сила упругости определяется следующим выражением:
Fупр = k x.

52
ps = k x | p | k x | , | ||||||||||||||||||||||||||||||||||||||||||||
s | |||||||||||||||||||||||||||||||||||||||||||||||
где x – перемещение поршня, которое можно определить через | |||||||||||||||||||||||||||||||||||||||||||||||
объем. | V = s x | V | |||||||||||||||||||||||||||||||||||||||||||||
x s . | |||||||||||||||||||||||||||||||||||||||||||||||
p k x | k V | const V, | |||||||||||||||||||||||||||||||||||||||||||||
s | s2 | ||||||||||||||||||||||||||||||||||||||||||||||
то есть давление газа в цилиндре | p | 2 | |||||||||||||||||||||||||||||||||||||||||||||
изменяется | пропорционально | ||||||||||||||||||||||||||||||||||||||||||||||
объему: p V. | p2 | ||||||||||||||||||||||||||||||||||||||||||||||
Тогда в pV – координатах график | p1 | 1 | |||||||||||||||||||||||||||||||||||||||||||||
будет | выглядеть | аналогично | sтр | V | |||||||||||||||||||||||||||||||||||||||||||
графику, | представленному | в | |||||||||||||||||||||||||||||||||||||||||||||
предыдущей | задаче. Тогда работу | ||||||||||||||||||||||||||||||||||||||||||||||
V1 | V 2 | ||||||||||||||||||||||||||||||||||||||||||||||
определим через площадь трапеции. | |||||||||||||||||||||||||||||||||||||||||||||||

53
A sтр a b h,
2
A p1 p2 V2 V1 .
2
A 105 2 105 3 10 3 10 3 300 Дж . 2
Ответ

54
Пример 7. Найдите число молекул водорода в 1 см3, если давление равно 200 мм.рт.ст., а средняя квадратичная скорость молекул при данных условиях 2400 м/с.
Дано:
V = 1 м3 p= 200 мм.рт.ст. = 200 133.3 Па
< кв> = 2400 м/с
k = 1,38 10-23Дж/К R = 8,31 Дж/моль К
Найти: n.

55
Решение: Искомая величина может быть найдена из соотношения
р = nkT.
n kTp .
Средняя квадратичная скорость равна
кв 3RT . M
Отсюда температура
T кв 2 M .
3R

56
Окончательно получаем выражение для п
n p 3R .
кв 2 M k
n | 200 133 3 8,31 | 4 1024 м 3 . | ||||||
2400 | 2 | 2 | 10 | 3 | 1,38 | 10 | 23 | |
Ответ: n = 4 1024 м-3

57
Пример 8. Средняя квадратичная скорость молекулы углекислого газа при давлении р = 105 Па равна 628 м/с. Определите среднюю длину свободного пробега молекул < >.
Дано:
М = 44 10-3 кг/моль
< кв> = 628 м/с р = 105 Па
NA = 6,03 1023 моль-1 d = 4 10-10 м
Найти: < >.

58
Решение. Средняя длина свободного пробега | ||||
молекул | 1 | , | ||
d 2n | ||||
2 | ||||
где d – эффективный диаметр молекул; п –
концентрация.
n kTp .
Средняя квадратичная скорость
Учтем, что

59
k | R | , | ||||||||
NA | ||||||||||
Тогда | кв 2 M | |||||||||
. | ||||||||||
3 | d 2pNA | |||||||||
2 | ||||||||||
6282 | 44 10 3 | 82,2 10 12 | м 82,2 пм . | |||||||
16 10 20 | 105 | |||||||||
3 2 3,14 | ||||||||||
Ответ: < > = 82,2 пм

60
Пример 9. Найдите наиболее вероятную скорость молекул идеального газа.
Дано: m
T
K
Найти: в.

61
Решение. Распределение молекул по абсолютным значениям скорости (распределение Максвелла) выражается формулой
m |
dN N f d 4 N |
2 kT |
Введем обозначение: |
m a. 2kT
Тогда функция распределения молекул по абсолютным значениям скорости будет иметь вид:
f4 a 3 / 2 e a 2 2 .

62
Чтобы найти наиболее вероятную скорость, нужно взять производную этой функции по скорости и приравнять ее к нулю.
f | a 3 / 2 | – 2a | 3 | 2 . | |||||||||
4 | |||||||||||||
– 2a 3 | 2 0. | ||||||||||||
f'( в) = 0; это возможно при | |||||||||||||
2 1 | 0. | ||||||||||||
2 | 1 | 2kT | |||||||||||
– a в | 1- a в2 0. | в | a | m . | |||||||||
Ответ: | в | 2kT | . | ||||||||||
m | |||||||||||||

63
Пример 10. Внутренняя энергия некоторой массы кислорода равна 3500 Дж. Определите суммарную кинетическую энергию W поступательного движения молекул газа.
Дано:
U = 3500 Дж i = 5
Найти: W.

64
Решение: Внутренняя энергия молекул идеального газа выражается следующим образом:
где i – число степеней свободы.
Суммарная кинетическая энергия поступательного движения для N молекул определяется как
W 32 kT N 32 kT Mm NA 32 Mm RT,
где kNA = R.
Из уравнения ( 1 ) находим

65
Mm RT 2Ui .
Тогда
W | 3 | 2U | 3U | 3 3500 | 2100 Дж . |
2 | i | i | 5 |
Ответ: W = 2100 Дж
Источник
