Двойное отхождение сосудов от желудочка
Определение
Двойное отхождение сосудов от правого желудочка, далее ДОСПЖ (частичная транспозиция, двойной выход из правого желудочка, аномалия Тауссиг – Бинга), – группа врожденных пороков сердца, чаще генетически обусловленных (мутации генов GDF1 (19p13.11) и CFC1 (2q21.2) кардиальных клеток-предшественников), характеризующаяся аномальным типом вентрикуло-артериальной связи, при которой аорта и легочный ствол полностью или преимущественно происходят от правого желудочка, возникающей вследствие нарушения ротации конуса и его вклинения между атриовентрикулярными клапанами и сопровождающейся нарушением формирования выхода из левого желудочка.
Код по МКБ-10 Q20.1 – Удвоение выходного отверстия правого желудочка.
Код по МКБ-11 LA85.2 – Double outlet right ventricle.
Эпидемиология
Клинически частота встречаемости данного порока составляет 0,7 %, что довольно редко, а вот по патологоанатомическим – 2,7 %, что говорит о низкой частоте выявления и ранней смертности лиц с данным заболеванием. Если взять все врожденные пороки сердца в Российской Федерации, то лишь у 1,5 % больных проводится оперативная коррекция данного порока, при средней летальности, составляющей почти 10 %. Прогноз течения порока во многом зависит от его типа и, соответственно, варианта гемодинамики.
Продолжительность жизни выше у больных с гемодинамически более благоприятным течением, а именно с обструкцией выхода из правого желудочка. В целом, время, в течении которого умирают 50 % пациентов с данной аномалией, не превышает и 5 лет, и лишь 17 % больных со всеми типами порока доживают до 15 лет.
Классификация
– ДОСПЖ типа тетрады Фалло ДМЖП в данном случае расположен подаортально или подартериально, сочетаясь с обструкцией выхода из правого желудочка;
– ДОСПЖ типа ДМЖП характеризуется тем же, но при условии отсутствия обструкции выхода из правого желудочка;
– ДОСПЖ типа транспозиции магистральных сосудов характеризуется отсутствием обструкции выхода из правого желудочка, а ДМЖП располагается подлегочно;
– ДОСПЖ с некоммитированным ДМЖП проявляется наличием ДМЖП в синусном или трабекулярном отделе перегородки, может сочетаться с обструкцией выхода из правого желудочка.
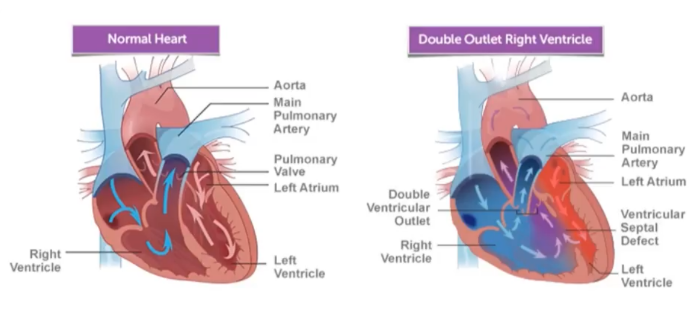
Рис. 1
Гемодинамика при анатомически нормальном строении сердца (слева), и при ДОСПЖ (справа).
Диагностика
Диагностика данного заболевания складывается из характерных симптомов сердечной недостаточности, которые проявляются с рождения. Золотым стандартом выявления данного порока является ЭхоКГ, которая позволяет оценить анатомическую структуру сердца и его гемодинамику. Пренатальная диагностика возможна, однако ее выполнение очень затруднительно.
Клинический случай
В отделение кардиологии БСМП поступил больной И., 18 лет, с жалобами на одышку смешанного характера, возникающей при подъеме на второй этаж, при прохождении около 100 метров, на периодический сухой приступообразный кашель, на повышенную утомляемость.
Из анамнеза: с детства отмечались низкая скорость роста, низкая прибавка в весе и толерантность к физической нагрузке. В возрасте двух лет установлен диагноз: ВПС, ДОСПЖ. От предложенного оперативного лечения родители отказались, боясь того, что ребенок не перенесет операцию. В возрасте 17 лет стал отмечать нарастание одышки, снижение толерантности к физической нагрузке. Обратился к кардиологу, назначена терапия ХСН.
Заочно консультирован кардиохирургом Научного центра сердечно-сосудистой хирургии, где по предоставленным данным «у больного сложный врожденный порок сердца, который в отсутствии коррекции в детском возрасте привел к высокой легочной гипертензии со значительной дилатацией легочной артерии, недостаточности клапана легочной артерии III ст. Выполнить оперативное лечение не представляется возможным. Рекомендована консервативная терапия».
При осмотре обращает на себя внимание астеничность телосложения, цианоз носогубного треугольника. В легких дыхание с жестким оттенком, единичные застойные хрипы в нижних отделах. При аускультации сердца выслушивается акцент II тона над легочной артерией, систолический шум над всеми точками аускультации, ЧСС 80 ударов в минуту. Артериальное давление симметричное на обеих руках, с тенденцией к гипертензии, 135 и 85 мм.рт.ст.
Из лабораторных данных обращает на себя внимание общий анализ крови, где отмечается компенсаторная полицитемия за счет роста числа эритроцитов 7,8×1012/л повышение уровня гемоглобина до 173 г/л и гематокрита.
При инструментальном обследовании:
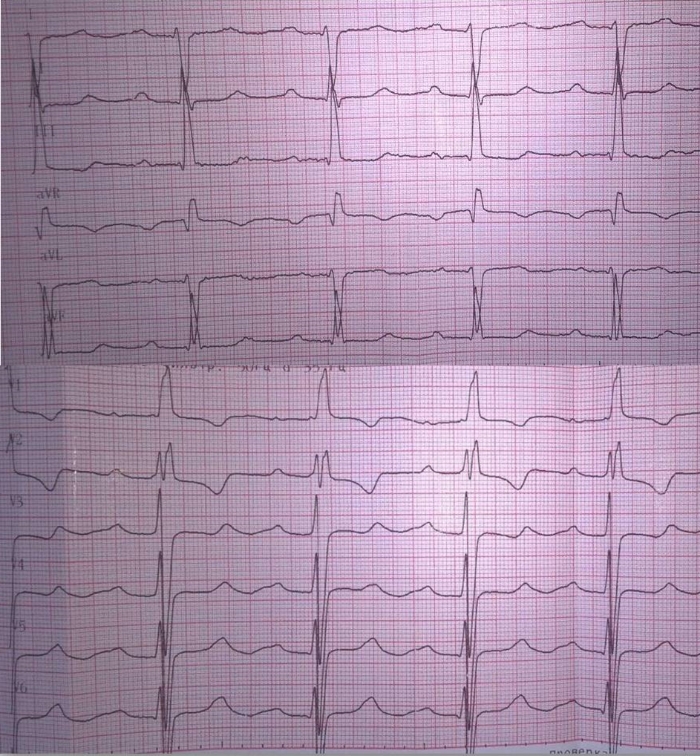
Рис. 2
Электрокардиограмма пациента при поступлении. На фоне синусового ритма с ЧСС 85 ударов в минуту отмечаются признаки гипертрофии левого желудочка и неполной блокады правой ножки пучка Гиса.
При проведении ЭхоКГ: Большой высокий дефект межжелудочковой перегородки. Фиброзные изменения створок аортального клапана, умеренный стеноз устья аорты, аортальная недостаточность II-III ст. Фиброз створок клапана легочной артерии. Недостаточность клапана легочной артерии II-III ст. Концетрическая значительная гипертрофия миокарда правого желудочка. Умеренная дилатация правого предсердия. Относительная трикуспидальная недостаточность II степени. Значительная дилатация ствола и ветвей легочной артерии. Значительная легочная гипертензия.
По рентгенографии органов грудной клетки отмечается расширение тени сердца влево. Признаки гиперволемии по малому кругу кровообращения.
Пациенту была скорректирована терапия ХСН с учетом выраженной легочной гипертензии с последующей титрацией дозы препаратов на амбулаторном этапе.
Лечение
Больным с ДОСПЖ при явлениях сердечной недостаточности на этапе предоперационной подготовки рекомендуются диуретики, иАПФ, сердечные гликозиды, β-адреноблокаторы, катехоламины.
Больным с ДОСПЖ типа тетрады Фалло рекомендуются β-адреноблокаторы и бензодиазепины при приступе гипоксии.
Больным с ДОСПЖ для лечения легочной гипертензии рекомендуются антагонисты кальция, блокаторы эндотелиновых рецепторов (например, Бозентан, Амбризентан), ингибиторы фосфодиэстеразы типа 5 (например, Силденафил, Варденафил), аналоги простагландинов (например, Илопрост).
Вид оперативной коррекции определяется размерами левого желудочка и, соответственно, локализацией дефекта межжелудочковой перегородки. Многие пациенты перед выполнением реконструктивной коррекции данного порока подвергаются паллиативным операциям, особенно если левый желудочек гипоплазирован или имеет пограничный размер.
Паллиативные операции строятся из шунта Блелока-Тауссинга (анастомоз между подключичной и легочной артерий) и бандинга легочной артерии (сужения легочной артерии), а иногда вначале выполняется резекция коарктации аорты либо первая стадия процедуры Норвуда (коррекция гемодинамики, путем уменьшения нагрузки на легочную артерию, вызванную повышенным кровотоком).
Учитывая то, что обструктивное поражение сосудов легких развивается столь же быстро, как и при ДМЖП, пациентов с ДОГПЖ следует оперировать рано в младенческом возрасте (до 6 месяцев). В настоящее время ранний возраст не следует рассматривать как фактор госпитальной летальности. Предпочительным методом операции является создание внутрижелудочкового туннеля с помощью заплаты из дакрона либо ткани Гортекс, соединяющего ЛЖ с аортой. Некоторым детям предварительно производится бандинг легочной артерии, однако не следует считать это правилом – гораздо важнее ранняя коррекция порока.
При рестриктивном дефекте межжелудочковой перегородки (когда размер менее диаметра аортального клапана), его расширяют при помощи антеросептального разреза либо иссечением в этой области межжелудочкового гребня. Создающие обструкцию в выводном тракте мышечные пучки иссекают с целью формирования прямого туннеля между аортой и ДМЖП.
Заключение
По частоте встречаемости данный порок весьма редок. По данным некоторых авторов данная аномалия встречается у 2-3 % детей, родившихся с врожденными пороками сердца. Однако редкость возникновения данного порока не исключает вероятности встречи с ним. Следует помнить, что данная патология требует оперативного лечения в раннем возрасте (до 6-ти месяцев), а медикаментозная терапия является поддерживающей и лишь отдаляет исход неизбежно нарастающей ХСН.
Источники:
- Клинические рекомендации ассоцииации сердечно-сосудистых хирургов России, «Двойное отхождение сосудов от правого желудочка» 2016 г.
- Бокерия Л.А., Лекции по сердечно-сосудистой хирургии. В 2-х томах. Москва, 2001, Т. 1, стр 482-490.
- Смирнов Н.Н. Двойное отхождение сосудов от правого желудочка: особенности пренатальной диагностики. Пренатальная диагностика, 2009.-N 1.-С.37-40
- The portal for rare diseases and orphan drugs. Double outlet right ventricle.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
Отхождение обоих магистральных сосудов, выносящих кровь из сердца не от соответствующих («своих») левого и правого желудочков, а только от одного правого – большая группа нарушений нормального развития сердца, это целый спектр аномалий, объединенных одним общим названием. Если вы читаете только эту главу, потому что у вашего ребенка именно такой диагноз, то мы советуем вам вернуться немного назад и просмотреть разделы, касающиеся изолированных больших дефектов межжелудочковой перегородки, легочной гипертензии и тетрады Фалло, потому что все, что сказано там о клиническом проявлении порока, симптомах, осложнениях и последствиях, можно в полной мере отнести и к этому пороку.
Главное нарушение формирования сердца заключается в том, что аорта, которая на 5-й неделе от момента зачатия должна «повернуться» против часовой стрелки и соединиться с левым желудочком, этого не делает, а остается «сидеть» над правым желудочком целиком. Выход крови из левого желудочка осуществляется только через большой дефект межжелудочковой перегородки и хотя потоки крови в правом желудочке, естественно, смешиваются, все же остается их частичное разделение, и артериальная кровь поступает, в основном, в аорту, которая отделена от левого желудочка мышечным валиком межжелудочковой перегородки, а венозная идет преимущественно в легкие.
Иными словами, в типичных случаях и структурное нарушение, и клинические проявления имеют черты больших дефектов межжелудочковой перегородки и – соответствующие последствия. Если же к этому добавить сужение выводного тракта правого желудочка, то картина будет напоминать тетраду Фалло.
При первых вариантах ребенок бледный, без выраженных признаков цианоза, и имеется большой сброс «слева-направо», ранние признаки сердечной недостаточности и переполнения кровью сосудов легких со всеми вытекающими отсюда последствиями, которые могут привести к развитию необратимой легочной гипертензии.
При вторых – ребенок синюшный, с выраженным цианозом и большой вероятностью одышечно-цианотических приступов.
Возможности радикального хирургического лечения сегодня существуют практически для всех вариантов порока, но нужно учитывать несколько важных деталей.
Многое зависит от того, какой у ребенка дефект межжелудочковой перегородки, где он расположен в перегородке и какого он размера. Если отверстие большое и находится прямо под устьем аорты, его закрывают, создавая тоннель из продолговатой синтетической заплаты, который соединит стенки дефекта с аортой, и таким образом аорту с левым желудочком.
Но, к сожалению, дефект (а иногда и два-три дефекта) может находится в мышечной части перегородки. Это делает операцию очень травматичной, а подчас и просто невозможной технически.
Наконец, последний вариант – дефект может располагаться под началом, устьем легочной артерии. Тогда просто соединить аорту с левым желудочком внутри сердца невозможно (так называемая аномалия Тауссиг-Бинга).
Выбор способа хирургической помощи, зависит от очень многих обстоятельств. Главное, что вам нужно знать – вы должны обратиться к специалистам как можно раньше, т.е. как только поставлен диагноз. Не надо ждать ухудшения – вы рискуете сделать ситуацию «запущенной». Но не надо и впадать в отчаяние. Ребенка можно и нужно лечить, и для этого есть все средства.
Об операции при «подаортальном» дефекте мы рассказывали. Она – относительно проста и ее можно делать в любом возрасте, т.е. как и при больших дефектах межжелудочковой перегородки, в зависимости от клинических проявлений порока. Но, если дефект нельзя просто превратить в выводной отдел для левого желудочка, что тогда? Если диагноз установлен достаточно рано, а давление в легочной артерии растет, то для защиты сосудов легких от необратимых повреждений нужно сузить легочную артерию, наложив манжетку, как это было описано ранее.
Делая это, мы думаем о будущем, а пока – знаем, что сосуды легких не страдают. Что нас ожидает? Через несколько месяцев или лет, а в данном случае спешить, как правило, не следует, – можно поставить вопрос о возможности радикальной операции. Ребенок подрос, набрал в весе, неплохо развит, и хотя у него может усиливаться цианоз губ, особых опасений это не вызывает – причина цианоза понятна, т.к. создана хирургически. И тут существуют две возможности. Первая и наилучшая – это удалить манжетку и закрыть дефект, создав внутри полости правого желудочка тоннель между дефектом и аортой желудочка. Этот тоннель, однако, будет более длинным, и сделать его намного труднее, чем при «подаортальном» дефекте, – из-за далекого расположения в перегородке. Иногда это технически невозможно. И тогда есть второй путь – «радикальная паллиация», когда, удалив манжетку, нужно закрыть заплатами вход в правый желудочек (т.е. трехстворчатый клапан) и сделать из обоих желудочков один, работающий на большой круг, а в предсердии произвести операцию Фонтена, как это было описано для атрезии трехстворчатого клапана. Второе – не идеальный выход, но все же – выход, когда нет другой возможности. И, надо сказать, что такой путь применяется и при других сложных пороках сердца, о которых мы скажем позже.
При аномалии Тауссиг-Бинга, или отхождении сосудов от правого желудочка и огромном дефекте межжелудочковой перегородки, расположенном под легочной артерией, тактика и стадийность хирургического лечения полностью зависит от времени первого появления ребенка в специализированном хирургическом учреждении. В любом случае, вмешательство следует делать в течение первых месяцев жизни. Не будем подробно останавливаться на существующих методиках лечения этого сложного порока. Достаточно сказать, что при раннем обращении вполне возможно выполнение операции в один этап и восстановление нормального кровообращения в обоих кругах. Но если момент упущен, то не отчаивайтесь, потому что на вооружении сегодняшней хирургии имеется много способов помочь вашему ребенку, и они зависят от типа порока и возраста ребенка. В одном из последних учебников по кардиохирургии врожденных пороков сердца насчитывается 5 вариантов хирургического лечения различных типов отхождения сосудов от правого желудочка. Мы описали только некоторые из них, наиболее типичные. В каждом конкретном случае можно и нужно выбрать наиболее логичный и безопасный метод.
Рецептов, которые были бы одними и теми же для разных детей – нет. Каждый случай индивидуален. Но главное – больные, которые еще 10 лет назад считались неоперабельными, сегодня могут рассчитывать на хирургическую помощь, которая не только продлит жизнь, но и изменит ее качество, сделает их полноценными членами общества.
Источник
Двойное отхождение аорты и легочной артерии от левого желудочка
сердца-сложный
ВПС, при котором обе магистральные артерии отходят от левого желудочка, а правый выбрасывает венозную кровь через ДМЖП.
Первое описание порока принадлежит S. Sakakibara
и со-авг.
(1967), М. Paul и соавт. (1970), а в отечественной
литературе-А.
В. Иваницкому и соавт. (1985). Первое сообщение о радикальной операции при отхождении магистральных сосудов от левого желудочка представлено S. Sakakibara и соавт. в 1967 г. В нашей стране первая успешная радикальная операция выполнена В. П.
Подзол-ковым
в 1983 г. [Зеленикин М. А. и др., 1984].
Частота.
Порок встречается редко. По данным Е. Coto и соавт. (1979), он составляет 0,23% от числа всех ВПС. К 1981 г. D. Murphy и соавт. собрали в литературе сведения о 84 наблюдениях. В ИССХ им. А. Н. Бакулева АМН СССР наблюдалось 7 больных с данным пороком [Бураков-ский В. И. и др., 1985 ].
Этиология и патогенез.
Эмбриогенез порока недостаточно ясен. Существуют две точки зрения, объясняющие причину отхождения магистральных сосудов от левого желудочка.
Согласно первой, которой придерживаются R. Van Praagh и соавт. (1966, 1973), возникновение порока связано с недоразвитием подаортального и подлегочного конусов. В результате аорта и легочная артерия остаются в задней позиции, начинаются от левого желудочка и сохраняется их связь с передней створкой митрального клапана.
Согласно второй, выдвинутой D. Goor и соавт. (1972, 1973) и R. Anderson и соавт. (1974), развитие порока объясняется с точки зрения теории дифференцированной конусной абсорбции, т. е. отхождение магистральных сосудов от левого желудочка является результатом избыточного сдвига влево конуса и артериального ствола. Многообразная морфология выходного отдела, наблюдаемая при данном пороке, объясняется различной степенью абсорбции конуса, в то время как пространственное взаимоотношение магистральных сосудов зависит от различной степени инверсии конуса и артериального ствола (в направлении часовой стрелки или против).
Патологическая анатомия.
Анатомические критерии отхождения магистральных сосудов от левого желудочка до настоящего времени не установлены. М. Paul и соавт. (1970), А. Кегг и соавт. (1971) считают, что аорта и легочный ствол должны располагаться бок о бок, полностью отходить от левого желудочка, а их клапаны находиться на одном уровне, единственным выходом из правого желудочка должен быть ДМЖП. Однако большинство авторов рассматривают отхождение магистральных сосудов от левого желудочка как одну из форм
желудочково-артериальной
связи, при которой обе магистральные артерии или одна из них полностью, а другая более чем на 50% диаметра просвета расположены над левым желудочком. Наличию или отсутствию фиброзного
митрально-полулунного
продолжения или контакта авторы не придают существенного значения [Kirklin J. et al., 1973; Anderson R. et al, 1974; Coto E. et al., 1979]. Недостатком данного определения, по мнению R. Van Praagh и Р. Weinberg (1977), являются трудности установления степени смещения магистральной артерии и принадлежности ее к тому или другому желудочку, которые могут возникать не только во время операции, но и при
патолого-анатомическом
исследовании.
При этом ВПС наблюдаются нормальное
предсердно-желудочковое
соединение (когда анатомически левое и правое предсердия соединяются с соответствующими желудочками) и нарушенная
желудочково-артериальная
взаимосвязь, когда правый желудочек имеет единственный выход через ДМЖП, а из левого желудочка выходят оба магистральных сосуда. Расположение магистральных сосудов
ва-риабельно:
аорта может находиться справа, слева, спереди от легочной артерии, кроме того, оба сосуда могут идти параллельно друг к другу. В зависимости от расположения магистральных сосудов ДМЖП может быть
подаорталь-ным
или подлегочным. Как правило, ДМЖП имеется при двойном отхождении магистральных сосудов от левого желудочка. Морфология артериального конуса также
вариабе-льна.
Наличие фиброзного контакта между митральным и обоими полулунными клапанами не вызывает сомнений в диагнозе двойного отхождения сосудов от левого желудочка, но такой вариант порока редок. При подаортальном ДМЖП аорта «сидит верхом» над ним, имеется
митрально-аортальный
контакт. При этом типе порока очень часто встречается недоразвитие подлегочного конуса с формированием
фиброзно-мышечного
сужения, располагающегося на перегородке артериального конуса.
При подлегочном сужении нередко выявляют двустворчатый клапан легочного ствола или сужение его фиброзного кольца.
При подлегочном ДМЖП, когда легочная артерия находится впереди от аорты, имеется
митрально-аортальный
фиброзный контакт. При этом типе порока имеется или отсутствует гипертрофия подлегочного конуса.
Отхождение магистральных сосудов от левого желудочка встречается как при нормальном расположении внутренних органов, так и при их инверсии. Порок может сочетаться с инверсией желудочков, гипоплазией правого желудочка, аномалией Эбштейна, открытым артериальным протоком,
правосторонней дугой аорты и другими пороками сердца. Наиболее частым сопутствующим пороком является стеноз легочной артерии, который носит клапанный, подклапанный и комбинированный характер.
Расположение проводящей системы сердца при отхождении магистральных сосудов от левого желудочка определяется топографоанатомическими особенностями ДМЖП [BharatiS.etaL, 1978].
Гемодинамика.
Нарушения гемодинамики обусловлены
от-хождением
аорты и легочного ствола от левого желудочка, величиной и локализацией дефекта, наличием или отсутствием стеноза легочной артерии.
Клиника, диагностика.
Специфические клинические признаки, имеющие абсолютное диагностическое значение, отсутствуют.
При большом ДМЖП клиническая картина идентична таковой при обычном большом «дефекте» с уже наступившим обратным сбросом крови и развитием легочной
гипер-тензии.
При стенозе легочного ствола и легочных артерий отмечаются цианоз с рождения ребенка, признаки хронической кислородной недостаточности.
При аускулътации над областью сердца с максимумом вдоль левого края грудины определяется систолический шум, II тон над основанием сердца ослаблен. Акцент II тона, нередко определяемый во втором межреберье слева, обычно связан с хорошим проведением на грудную клетку тона закрытия аортальных клапанов.
На ЭКГ регистрируется отклонение электрической оси сердца вправо, имеются признаки гипертрофии правого желудочка (при стенозе легочного
ствола-обоих
желудочков).
При рентгенологическом исследовании не удается обнаружить характерную форму сердца. Легочный рисунок усилен или обеднен в зависимости от наличия или отсутствия стеноза легочной артерии. У детей с гипертензией в малом круге кровообращения легочные поля приобрегают специфическую картину, характерную для определенной стадии развития легочной гипертензии.
Таким образом, традиционные методы обследования малоинформативны.
Эхокардиография дает возможность получить важную информацию. При исследовании в продольной оси оба магистральных сосуда расположены параллельно и находятся над левым желудочком.
На основании данных эхокардиографии устанавливают диагноз двойного отхождения аорты и легочной артерии от левого желудочка, определяют величину дефекта в перегородке и его расположение, особенности стеноза легочной артерии.
Большое значение в диагностике порока принадлежит катетеризации сердца и ангиокардиографии. У большинства больных отмечаются одинаковые величины давления в правом и левом желудочке. Если давление в правом желудочке выше, чем в левом, то это свидетельствует о затрудненном выбросе крови из правого желудочка вследствие небольшого диаметра дефекта в перегородке. Давление в легочной артерии зависит от степени стеноза легочной артерии. Как правило, наблюдается артериальная гипоксемия, причем в большей степени она выражена у больных со стенозом легочной артерии.
Ангиокардиографическое исследование должно включать правую и левую вентрикулографию, аортографию и по возможности легочную артериографию. При контрастировании правого желудочка отмечаются синдром окклюзии выхода в легочный ствол и поступление контрастного вещества через дефект в перегородке в левый желудочек
и далее-в
магистральные сосуды.
На основании полученных данных определяют диаметр дефекта и его расположение.
Левая вентрикулография позволяет уточнить расположение обоих магистральных сосудов над левым желудочком и их отхождение от последнего. При наличии стеноза легочной артерии определяют его характер.
Без хирургического лечения прогноз неблагоприятный.
Лечение.
У детей, находящихся в тяжелом состоянии, при двойном отхождении аорты и легочного ствола от левого желудочка в сочетании со стенозом легочной артерии показано наложение анастомоза между системной и легочными артериями.
Детям до 2 лет при развивающейся легочной гипертензии (в зависимости от уровня подготовки хирургов) можно сделать операцию сужения легочного ствола.
Радикальная коррекция порока включает в себя закрытие ДМЖП заплатой (доступ к сердцу через правый желудочек) и создание путей оттока из правого желудочка в легочный ствол подшиванием искусственного клапансодержащего легочного ствола «кондуита».
В ИССХ им. А. Н. Бакулева АМН СССР успешно выполнены две операции по описанной выше методике [Подзол-ков В. П. и др., 1986].
У больных с отхождением магистральных сосудов от левого желудочка и сопутствующей гипоплазией правого нельзя выполнить радикальную операцию. В данных условиях теоретически возможна лишь гемодинамическая коррекция по методу Фонтена.
Источник
