Двойной выход магистральных сосудов из левого желудочка

Двойное отхождение аорты и легочной артерии от левого желудочка
сердца-сложный
ВПС, при котором обе магистральные артерии отходят от левого желудочка, а правый выбрасывает венозную кровь через ДМЖП.
Первое описание порока принадлежит S. Sakakibara
и со-авг.
(1967), М. Paul и соавт. (1970), а в отечественной
литературе-А.
В. Иваницкому и соавт. (1985). Первое сообщение о радикальной операции при отхождении магистральных сосудов от левого желудочка представлено S. Sakakibara и соавт. в 1967 г. В нашей стране первая успешная радикальная операция выполнена В. П.
Подзол-ковым
в 1983 г. [Зеленикин М. А. и др., 1984].
Частота.
Порок встречается редко. По данным Е. Coto и соавт. (1979), он составляет 0,23% от числа всех ВПС. К 1981 г. D. Murphy и соавт. собрали в литературе сведения о 84 наблюдениях. В ИССХ им. А. Н. Бакулева АМН СССР наблюдалось 7 больных с данным пороком [Бураков-ский В. И. и др., 1985 ].
Этиология и патогенез.
Эмбриогенез порока недостаточно ясен. Существуют две точки зрения, объясняющие причину отхождения магистральных сосудов от левого желудочка.
Согласно первой, которой придерживаются R. Van Praagh и соавт. (1966, 1973), возникновение порока связано с недоразвитием подаортального и подлегочного конусов. В результате аорта и легочная артерия остаются в задней позиции, начинаются от левого желудочка и сохраняется их связь с передней створкой митрального клапана.
Согласно второй, выдвинутой D. Goor и соавт. (1972, 1973) и R. Anderson и соавт. (1974), развитие порока объясняется с точки зрения теории дифференцированной конусной абсорбции, т. е. отхождение магистральных сосудов от левого желудочка является результатом избыточного сдвига влево конуса и артериального ствола. Многообразная морфология выходного отдела, наблюдаемая при данном пороке, объясняется различной степенью абсорбции конуса, в то время как пространственное взаимоотношение магистральных сосудов зависит от различной степени инверсии конуса и артериального ствола (в направлении часовой стрелки или против).
Патологическая анатомия.
Анатомические критерии отхождения магистральных сосудов от левого желудочка до настоящего времени не установлены. М. Paul и соавт. (1970), А. Кегг и соавт. (1971) считают, что аорта и легочный ствол должны располагаться бок о бок, полностью отходить от левого желудочка, а их клапаны находиться на одном уровне, единственным выходом из правого желудочка должен быть ДМЖП. Однако большинство авторов рассматривают отхождение магистральных сосудов от левого желудочка как одну из форм
желудочково-артериальной
связи, при которой обе магистральные артерии или одна из них полностью, а другая более чем на 50% диаметра просвета расположены над левым желудочком. Наличию или отсутствию фиброзного
митрально-полулунного
продолжения или контакта авторы не придают существенного значения [Kirklin J. et al., 1973; Anderson R. et al, 1974; Coto E. et al., 1979]. Недостатком данного определения, по мнению R. Van Praagh и Р. Weinberg (1977), являются трудности установления степени смещения магистральной артерии и принадлежности ее к тому или другому желудочку, которые могут возникать не только во время операции, но и при
патолого-анатомическом
исследовании.
При этом ВПС наблюдаются нормальное
предсердно-желудочковое
соединение (когда анатомически левое и правое предсердия соединяются с соответствующими желудочками) и нарушенная
желудочково-артериальная
взаимосвязь, когда правый желудочек имеет единственный выход через ДМЖП, а из левого желудочка выходят оба магистральных сосуда. Расположение магистральных сосудов
ва-риабельно:
аорта может находиться справа, слева, спереди от легочной артерии, кроме того, оба сосуда могут идти параллельно друг к другу. В зависимости от расположения магистральных сосудов ДМЖП может быть
подаорталь-ным
или подлегочным. Как правило, ДМЖП имеется при двойном отхождении магистральных сосудов от левого желудочка. Морфология артериального конуса также
вариабе-льна.
Наличие фиброзного контакта между митральным и обоими полулунными клапанами не вызывает сомнений в диагнозе двойного отхождения сосудов от левого желудочка, но такой вариант порока редок. При подаортальном ДМЖП аорта «сидит верхом» над ним, имеется
митрально-аортальный
контакт. При этом типе порока очень часто встречается недоразвитие подлегочного конуса с формированием
фиброзно-мышечного
сужения, располагающегося на перегородке артериального конуса.
При подлегочном сужении нередко выявляют двустворчатый клапан легочного ствола или сужение его фиброзного кольца.
При подлегочном ДМЖП, когда легочная артерия находится впереди от аорты, имеется
митрально-аортальный
фиброзный контакт. При этом типе порока имеется или отсутствует гипертрофия подлегочного конуса.
Отхождение магистральных сосудов от левого желудочка встречается как при нормальном расположении внутренних органов, так и при их инверсии. Порок может сочетаться с инверсией желудочков, гипоплазией правого желудочка, аномалией Эбштейна, открытым артериальным протоком,
правосторонней дугой аорты и другими пороками сердца. Наиболее частым сопутствующим пороком является стеноз легочной артерии, который носит клапанный, подклапанный и комбинированный характер.
Расположение проводящей системы сердца при отхождении магистральных сосудов от левого желудочка определяется топографоанатомическими особенностями ДМЖП [BharatiS.etaL, 1978].
Гемодинамика.
Нарушения гемодинамики обусловлены
от-хождением
аорты и легочного ствола от левого желудочка, величиной и локализацией дефекта, наличием или отсутствием стеноза легочной артерии.
Клиника, диагностика.
Специфические клинические признаки, имеющие абсолютное диагностическое значение, отсутствуют.
При большом ДМЖП клиническая картина идентична таковой при обычном большом «дефекте» с уже наступившим обратным сбросом крови и развитием легочной
гипер-тензии.
При стенозе легочного ствола и легочных артерий отмечаются цианоз с рождения ребенка, признаки хронической кислородной недостаточности.
При аускулътации над областью сердца с максимумом вдоль левого края грудины определяется систолический шум, II тон над основанием сердца ослаблен. Акцент II тона, нередко определяемый во втором межреберье слева, обычно связан с хорошим проведением на грудную клетку тона закрытия аортальных клапанов.
На ЭКГ регистрируется отклонение электрической оси сердца вправо, имеются признаки гипертрофии правого желудочка (при стенозе легочного
ствола-обоих
желудочков).
При рентгенологическом исследовании не удается обнаружить характерную форму сердца. Легочный рисунок усилен или обеднен в зависимости от наличия или отсутствия стеноза легочной артерии. У детей с гипертензией в малом круге кровообращения легочные поля приобрегают специфическую картину, характерную для определенной стадии развития легочной гипертензии.
Таким образом, традиционные методы обследования малоинформативны.
Эхокардиография дает возможность получить важную информацию. При исследовании в продольной оси оба магистральных сосуда расположены параллельно и находятся над левым желудочком.
На основании данных эхокардиографии устанавливают диагноз двойного отхождения аорты и легочной артерии от левого желудочка, определяют величину дефекта в перегородке и его расположение, особенности стеноза легочной артерии.
Большое значение в диагностике порока принадлежит катетеризации сердца и ангиокардиографии. У большинства больных отмечаются одинаковые величины давления в правом и левом желудочке. Если давление в правом желудочке выше, чем в левом, то это свидетельствует о затрудненном выбросе крови из правого желудочка вследствие небольшого диаметра дефекта в перегородке. Давление в легочной артерии зависит от степени стеноза легочной артерии. Как правило, наблюдается артериальная гипоксемия, причем в большей степени она выражена у больных со стенозом легочной артерии.
Ангиокардиографическое исследование должно включать правую и левую вентрикулографию, аортографию и по возможности легочную артериографию. При контрастировании правого желудочка отмечаются синдром окклюзии выхода в легочный ствол и поступление контрастного вещества через дефект в перегородке в левый желудочек
и далее-в
магистральные сосуды.
На основании полученных данных определяют диаметр дефекта и его расположение.
Левая вентрикулография позволяет уточнить расположение обоих магистральных сосудов над левым желудочком и их отхождение от последнего. При наличии стеноза легочной артерии определяют его характер.
Без хирургического лечения прогноз неблагоприятный.
Лечение.
У детей, находящихся в тяжелом состоянии, при двойном отхождении аорты и легочного ствола от левого желудочка в сочетании со стенозом легочной артерии показано наложение анастомоза между системной и легочными артериями.
Детям до 2 лет при развивающейся легочной гипертензии (в зависимости от уровня подготовки хирургов) можно сделать операцию сужения легочного ствола.
Радикальная коррекция порока включает в себя закрытие ДМЖП заплатой (доступ к сердцу через правый желудочек) и создание путей оттока из правого желудочка в легочный ствол подшиванием искусственного клапансодержащего легочного ствола «кондуита».
В ИССХ им. А. Н. Бакулева АМН СССР успешно выполнены две операции по описанной выше методике [Подзол-ков В. П. и др., 1986].
У больных с отхождением магистральных сосудов от левого желудочка и сопутствующей гипоплазией правого нельзя выполнить радикальную операцию. В данных условиях теоретически возможна лишь гемодинамическая коррекция по методу Фонтена.
Источник
Определение
Двойное отхождение сосудов от правого желудочка, далее ДОСПЖ (частичная транспозиция, двойной выход из правого желудочка, аномалия Тауссиг — Бинга), — группа врожденных пороков сердца, чаще генетически обусловленных (мутации генов GDF1 (19p13.11) и CFC1 (2q21.2) кардиальных клеток-предшественников), характеризующаяся аномальным типом вентрикуло-артериальной связи, при которой аорта и легочный ствол полностью или преимущественно происходят от правого желудочка, возникающей вследствие нарушения ротации конуса и его вклинения между атриовентрикулярными клапанами и сопровождающейся нарушением формирования выхода из левого желудочка.
Код по МКБ-10 Q20.1 — Удвоение выходного отверстия правого желудочка.
Код по МКБ-11 LA85.2 — Double outlet right ventricle.
Эпидемиология
Клинически частота встречаемости данного порока составляет 0,7 %, что довольно редко, а вот по патологоанатомическим — 2,7 %, что говорит о низкой частоте выявления и ранней смертности лиц с данным заболеванием. Если взять все врожденные пороки сердца в Российской Федерации, то лишь у 1,5 % больных проводится оперативная коррекция данного порока, при средней летальности, составляющей почти 10 %. Прогноз течения порока во многом зависит от его типа и, соответственно, варианта гемодинамики.
Продолжительность жизни выше у больных с гемодинамически более благоприятным течением, а именно с обструкцией выхода из правого желудочка. В целом, время, в течении которого умирают 50 % пациентов с данной аномалией, не превышает и 5 лет, и лишь 17 % больных со всеми типами порока доживают до 15 лет.
Классификация
– ДОСПЖ типа тетрады Фалло ДМЖП в данном случае расположен подаортально или подартериально, сочетаясь с обструкцией выхода из правого желудочка;
– ДОСПЖ типа ДМЖП характеризуется тем же, но при условии отсутствия обструкции выхода из правого желудочка;
– ДОСПЖ типа транспозиции магистральных сосудов характеризуется отсутствием обструкции выхода из правого желудочка, а ДМЖП располагается подлегочно;
– ДОСПЖ с некоммитированным ДМЖП проявляется наличием ДМЖП в синусном или трабекулярном отделе перегородки, может сочетаться с обструкцией выхода из правого желудочка.
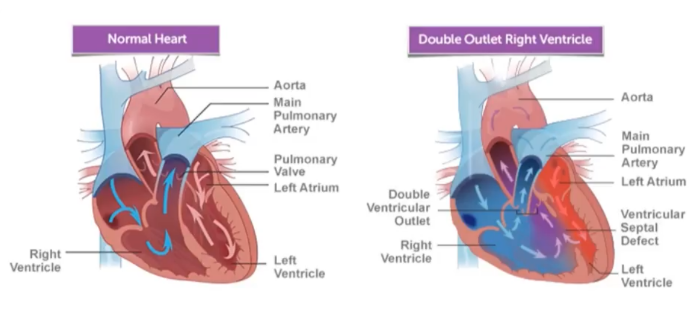
Рис. 1
Гемодинамика при анатомически нормальном строении сердца (слева), и при ДОСПЖ (справа).
Диагностика
Диагностика данного заболевания складывается из характерных симптомов сердечной недостаточности, которые проявляются с рождения. Золотым стандартом выявления данного порока является ЭхоКГ, которая позволяет оценить анатомическую структуру сердца и его гемодинамику. Пренатальная диагностика возможна, однако ее выполнение очень затруднительно.
Клинический случай
В отделение кардиологии БСМП поступил больной И., 18 лет, с жалобами на одышку смешанного характера, возникающей при подъеме на второй этаж, при прохождении около 100 метров, на периодический сухой приступообразный кашель, на повышенную утомляемость.
Из анамнеза: с детства отмечались низкая скорость роста, низкая прибавка в весе и толерантность к физической нагрузке. В возрасте двух лет установлен диагноз: ВПС, ДОСПЖ. От предложенного оперативного лечения родители отказались, боясь того, что ребенок не перенесет операцию. В возрасте 17 лет стал отмечать нарастание одышки, снижение толерантности к физической нагрузке. Обратился к кардиологу, назначена терапия ХСН.
Заочно консультирован кардиохирургом Научного центра сердечно-сосудистой хирургии, где по предоставленным данным «у больного сложный врожденный порок сердца, который в отсутствии коррекции в детском возрасте привел к высокой легочной гипертензии со значительной дилатацией легочной артерии, недостаточности клапана легочной артерии III ст. Выполнить оперативное лечение не представляется возможным. Рекомендована консервативная терапия».
При осмотре обращает на себя внимание астеничность телосложения, цианоз носогубного треугольника. В легких дыхание с жестким оттенком, единичные застойные хрипы в нижних отделах. При аускультации сердца выслушивается акцент II тона над легочной артерией, систолический шум над всеми точками аускультации, ЧСС 80 ударов в минуту. Артериальное давление симметричное на обеих руках, с тенденцией к гипертензии, 135 и 85 мм.рт.ст.
Из лабораторных данных обращает на себя внимание общий анализ крови, где отмечается компенсаторная полицитемия за счет роста числа эритроцитов 7,8×1012/л повышение уровня гемоглобина до 173 г/л и гематокрита.
При инструментальном обследовании:
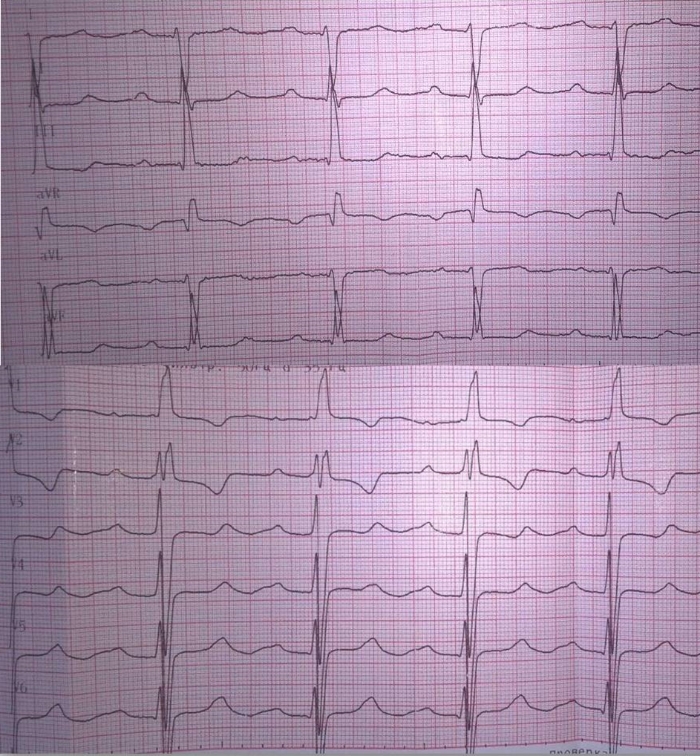
Рис. 2
Электрокардиограмма пациента при поступлении. На фоне синусового ритма с ЧСС 85 ударов в минуту отмечаются признаки гипертрофии левого желудочка и неполной блокады правой ножки пучка Гиса.
При проведении ЭхоКГ: Большой высокий дефект межжелудочковой перегородки. Фиброзные изменения створок аортального клапана, умеренный стеноз устья аорты, аортальная недостаточность II-III ст. Фиброз створок клапана легочной артерии. Недостаточность клапана легочной артерии II-III ст. Концетрическая значительная гипертрофия миокарда правого желудочка. Умеренная дилатация правого предсердия. Относительная трикуспидальная недостаточность II степени. Значительная дилатация ствола и ветвей легочной артерии. Значительная легочная гипертензия.
По рентгенографии органов грудной клетки отмечается расширение тени сердца влево. Признаки гиперволемии по малому кругу кровообращения.
Пациенту была скорректирована терапия ХСН с учетом выраженной легочной гипертензии с последующей титрацией дозы препаратов на амбулаторном этапе.
Лечение
Больным с ДОСПЖ при явлениях сердечной недостаточности на этапе предоперационной подготовки рекомендуются диуретики, иАПФ, сердечные гликозиды, β-адреноблокаторы, катехоламины.
Больным с ДОСПЖ типа тетрады Фалло рекомендуются β-адреноблокаторы и бензодиазепины при приступе гипоксии.
Больным с ДОСПЖ для лечения легочной гипертензии рекомендуются антагонисты кальция, блокаторы эндотелиновых рецепторов (например, Бозентан, Амбризентан), ингибиторы фосфодиэстеразы типа 5 (например, Силденафил, Варденафил), аналоги простагландинов (например, Илопрост).
Вид оперативной коррекции определяется размерами левого желудочка и, соответственно, локализацией дефекта межжелудочковой перегородки. Многие пациенты перед выполнением реконструктивной коррекции данного порока подвергаются паллиативным операциям, особенно если левый желудочек гипоплазирован или имеет пограничный размер.
Паллиативные операции строятся из шунта Блелока-Тауссинга (анастомоз между подключичной и легочной артерий) и бандинга легочной артерии (сужения легочной артерии), а иногда вначале выполняется резекция коарктации аорты либо первая стадия процедуры Норвуда (коррекция гемодинамики, путем уменьшения нагрузки на легочную артерию, вызванную повышенным кровотоком).
Учитывая то, что обструктивное поражение сосудов легких развивается столь же быстро, как и при ДМЖП, пациентов с ДОГПЖ следует оперировать рано в младенческом возрасте (до 6 месяцев). В настоящее время ранний возраст не следует рассматривать как фактор госпитальной летальности. Предпочительным методом операции является создание внутрижелудочкового туннеля с помощью заплаты из дакрона либо ткани Гортекс, соединяющего ЛЖ с аортой. Некоторым детям предварительно производится бандинг легочной артерии, однако не следует считать это правилом — гораздо важнее ранняя коррекция порока.
При рестриктивном дефекте межжелудочковой перегородки (когда размер менее диаметра аортального клапана), его расширяют при помощи антеросептального разреза либо иссечением в этой области межжелудочкового гребня. Создающие обструкцию в выводном тракте мышечные пучки иссекают с целью формирования прямого туннеля между аортой и ДМЖП.
Заключение
По частоте встречаемости данный порок весьма редок. По данным некоторых авторов данная аномалия встречается у 2-3 % детей, родившихся с врожденными пороками сердца. Однако редкость возникновения данного порока не исключает вероятности встречи с ним. Следует помнить, что данная патология требует оперативного лечения в раннем возрасте (до 6-ти месяцев), а медикаментозная терапия является поддерживающей и лишь отдаляет исход неизбежно нарастающей ХСН.
Источники:
- Клинические рекомендации ассоцииации сердечно-сосудистых хирургов России, «Двойное отхождение сосудов от правого желудочка» 2016 г.
- Бокерия Л.А., Лекции по сердечно-сосудистой хирургии. В 2-х томах. Москва, 2001, Т. 1, стр 482-490.
- Смирнов Н.Н. Двойное отхождение сосудов от правого желудочка: особенности пренатальной диагностики. Пренатальная диагностика, 2009.-N 1.-С.37-40
- The portal for rare diseases and orphan drugs. Double outlet right ventricle.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник

УЗИ аппарат HS40
Лидер продаж в высоком классе. Монитор 21,5″ высокой четкости, расширенный кардио пакет (Strain+, Stress Echo), экспертные возможности для 3D УЗИ в акушерско-гинекологической практике (STIC, Crystal Vue, 5D Follicle), датчики высокой плотности.
Введение
Актуальность темы пренатальной диагностики врожденных пороков сердца (ВПС) понятна всем врачам, которые связаны с пренатальной диагностикой, неонатологией, педиатрией, кардиологией, генетикой. ВПС являются одной из ведущих причин перинатальной смертности и регистрируются с частотой 4-13 на 1000 живорожденных [1]. В связи с тем, что профилактические мероприятия по предупреждению ВПС не имеют должного успеха, представляется актуальной и необходимой их пренатальная ультразвуковая диагностика.
В многочисленных исследованиях зарубежных и отечественных коллег неоднократно формулировались и изучались различные группы риска по возникновению ВПС. Это делалось для того, чтобы потенциально сузить группу беременных женщин, которым показана эхокардиография в специализированном центре. Среди этих групп риска выделяли:
- Семьи, имеющие ребенка с ВПС.
- Семьи с ВПС у одного или обоих супругов.
- Женщин, страдающих сахарным диабетом, системными заболеваниями соединительной ткани, гипотиреозом.
- Беременных с тератогенной экспозицией в ранние сроки беременности (герпес ранее 6-7-й недели) [2].
Однако параллельно другими учеными эти группы риска отвергались, потому что большинство ВПС встречались у плодов и детей, матери которых не входили ни в одну из предложенных групп риска. Единственными разумными критериями так называемого селективного отбора были признаны беременные, попавшие в группу риска после проведения скрининга I триместра и беременные с подозрением на ВПС при ультразвуковом исследовании (УЗИ) плода [3].
Неоспоримо, что оптимальными сроками беременности для исследования сердца плода являются 20-22 недели, однако большинство летальных и клинически значимых пороков сердца могут быть диагностированы в конце I триместра беременности. Позволим себе процитировать слова главы Fetal Medicine Foundation Кипраса Николаидеса, высказанные им на страницах сайта FMF (www.fetalmedicine.com): “Специалист ультразвуковой диагностики с 12 недели беременности должен заверить большинство родителей, что у их ребенка нет крупных врожденных пороков сердца. В случае крупных врожденных пороков сердца их раннее выявление может привести к постановке правильного диагноза или хотя бы вызвать подозрение для осуществления ультразвукового мониторинга”.
Главная цель пренатальной диагностики сформулирована специалистами пренатальной диагностики всего мира – это обеспечение женщины максимально возможной информацией о пороке как можно раньше. Мы должны дать право женщине и семье в целом решать вопрос о пролонгировании беременности с грубыми пороками развития у плода [4].
С каждым годом все большее количество публикаций посвящается диагностике ВПС в ранние сроки – в I триместре беременности [5-8]. Практически ни один из выпусков журнала ISUOG (Ultrasound In Obstetrics and Gynecology, или “белого” журнала, как его называют специалисты) не обходит своим вниманием тему ранней диагностики врожденных пороков развития.
На самом знаменитом сайте в мире пренатальной диагностики www.thefetus.net (Philippe Jeanty, USA) опубликовано уже более 30 случаев находок ВПС в I триместре беременности. Однако в отечественной периодике встречаются лишь единичные работы по этой теме. Все они пренадлежат “перу” специалистов пренатальной диагностики Российской ассоциации врачей ультразвуковой диагностики в перинатологии и гинекологии, хотя для многих специалистов как раньше, так и сейчас осмотр сердца плода в сроки 11-14 недель заключается лишь в констатации числа сердечных сокращений.
Цель эхокардиографии в I триместре беременности состоит в выявлении летальных и клинически значимых ВПС. Это исследование не ставит целью выявление стенозов и гипоплазий выносящих трактов, диагностику мелких дефектов перегородок, патологий дуги аорты и артериального протока. Многие из этих пороков не только технически невозможно заподозрить в I триместре, манифестируют они после 30-й недели беременности, т.е. их диагностика является прерогативой исследования III триместра.
Точность пренатальной диагностики ВПС во все сроки беременности варьирует в широком диапазоне. Причинами этого могут быть разный опыт специалистов, ожирение беременной, частота использованных ультразвуковых трансдьюсеров и класс ультразвукового аппарата, перенесенные ранее абдоминальные операции, срок беременности, количество околоплодных вод и положение плода. Однако заметим, что многие из этих факторов теряют свою актуальность именно при проведении трансвагинальной эхокардиографии в I триместре беременности. Своевременная диагностика ВПС позволяет идентифицировать плоды высокого риска по генетическим синдромам, что имеет важное значение при проведении пренатального консультирования и оказывает существенное влияние на акушерскую тактику.
Результаты
С 2006 по 2011 г. пренатально в I триместре беременности были выявлены 125 ВПС. Из них 68 (55%) ВПС сочетались с различными хромосомными аномалиями (ХА) плода, 30 (24%) входили в состав различных множественных врожденных пороков развития (МВПР), 27 (21%) ВПС были изолированными.
При эхокардиографии изучались четырехкамерный срез сердца плода (рис. 1) и срез через три сосуда (рис. 2). УЗИ проводилось трансабдоминальным датчиком, лишь при необходимости (затрудненная визуализация) использовался внутриполостной датчик. Четырехкамерный срез сердца плода при ультразвуковом сканировании трансабдоминальным датчиком визуализировался в 85% случаев, срез через сосуды – в 73%, при использовании трансвагинального датчика эти цифры существенно возрастали до 100 и 91% соответственно. Оптимизация пренатальной диагностики ВПС может быть достигнута путем строгого соблюдения основных методических правил. При оценке четырехкамерного среза плода необходимо оценить нормальное расположение сердца плода, исключив его эктопию (рис. 3), положение оси сердца плода, что не представляет никаких трудностей, нормальные пропорции и размеры камер сердца, движение створок атриовентрикулярных клапанов должно быть свободным, септальная створка трикуспидального клапана должна располагаться ближе к верхушке сердца (рис. 4). При оценке среза через три сосуда необходимо оценить взаиморасположение сосудов и их диаметр.

Рис. 1. Беременность 12 недель. Четырехкамерный срез сердца плода. Отчетливо видны камеры сердца.

Рис. 2. Беременность 12 недель. Срез через три сосуда. Визуализируются аорта, легочной ствол. Сосуды расположены в одну линию и имеют нормальные размеры.

Рис. 3. Беременность 8 недель. Эктопия сердца. Сердце расположено снаружи грудной полости.


Рис. 4. Беременность 13 недель. Четырехкамерный срез сердца плода. Отчетливо видны камеры сердца. Положение атриовентрикулярных клапанов.
Расширенная эхокардиография предполагает применение дополнительных режимов и срезов – среза через дугу аорты (рис. 5), среза через выносящий тракт левого желудочка (рис. 6), режима ЦДК (рис. 7), импульсной допплерометрии, технологии STIC (рис. 8-11). Это обследование проводится при обнаружении аномальных скрининговых проекций сердца плода, маркеров ХА [расширение толщины воротникового пространства – ТВП, гипоплазия/отсутствие носовой кости (рис. 12, 13), регургитации в венозном протоке (рис. 14), трикуспидальной регургитации (рис. 15)] и/или врожденных пороков развития плода.

Рис. 5. Беременность 13 недель. Срез через дугу аорты. Отчетливо видны три плечеголовных сосуда, отходящих от дуги.

Рис. 6. Беременность 12 недель. Тетрада Фалло. Режим ЦДК. Срез через выносящий тракт левого желудочка. Видна “аорта-наездница”, сидящая над ДМЖП. Случай опубликован на сайте www.thefetus.net.

Рис. 7. Беременность 13 недель. Двойной выход сосудов из правого желудочка. Режим ЦДК. Параллельный выход сосудов из правого желудочка.

Рис. 8. Беременность 12 недель. Атриовентрикулярная коммуникация (АВК) при синдроме Дауна. Режим STIC.

Рис. 9. Беременность 12 недель. Тетрада Фалло. Режим STIC. Аорта “наездница”, сидящая над ДМЖП. Случай опубликован на сайте www.thefetus.net.

Рис. 10. Беременность 13 недель. Транспозиция магистральных сосудов. Режим STIC. Виден параллельный ход выносящих сосудов, верхний из которых выходит из левого желудочка и делится на бифуркацию (легочная артерия).

Рис. 11. Беременность 12 недель. Общий артериальный ствол. Режим STIC. Виден единый выносящий сосуд из двух желудочков.

Рис. 12. Беременность 11,4 недель. Множественные маркеры ХА. Синдром Патау (трисомия 13). Увеличение ТВП, аномальный профиль с гипоплазией носовой кости, протуберансом на верхней челюсти (признак расщелины лица), полидактилия. У плода выявлена гипоплазия левых отделов сердца.

Рис. 13. Беременность 12 недель. Множественные маркеры ХА. Синдром Дауна (трисомия 21). Увеличение ТВП, аномальный профиль с гипоплазией носовой кости. У плода выявлена АВК.

Рис. 14. Беременность 12 недель. Реверсный кровоток в венозном протоке у плода с гетеротаксией.

Рис. 15. Беременность 12 недель. Трикуспидальная регургитация у плода с общим артериальным стволом.
Нозология выявленных нами ВПС была следующей:
- синдром гипоплазии левых отделов сердца (СГЛОС) – 29 случаев (рис. 16);
- атриовентрикулярная коммуникация (АВК) – 23 (рис. 17, 18);
- дефект межжелудочковой перегородки (ДМЖП) – 19 (рис. 19);
- патология магистральных сосудов – 19 (из них транспозиция – 3, двойное отхождение сосудов из правого желудочка – 2, тетрада Фалло – 5, общий артериальный ствол – 9);
- патология правых отделов сердца (патология трикуспидального клапана) – 3;
- синдром гетеротаксии – 6;
- единственный желудочек – 4;
- эктопия сердца – 7;
- сочетанные формы ВПС встретились в 15 случаях.

Рис. 16. Беременность 13 недель. Синдром гипоплазии левых отделов сердца у плода с синдромом Тернера (45Х). Единый поток через трикуспидальный клапан. Сброс крови в гипоплазированный левый желудочек через ДМЖП.

Рис. 17. Беременность 11,4 недель. Четырехкамерный срез сердца. Единый атриовентрикулярный клапан. Отсутствует “крест” нормального взаимоотношения атриовентрикулярных клапанов и сердечных перегородок.

Рис. 18. Беременность 11,4 недель. Четырехкамерный срез сердца. Режим ЦДК. Единый атриовентрикулярный клапан.

Рис. 19. Беременность 12 недель. Режим ЦДК. Обширный ДМЖП у плода с синдромом Эдвардса (трисомия 18).
При кариотипировании плодов с пренатально установленным диагнозом ВПС в 11-14 недель было диагностировано 68 хромосомных аномалий:
- трисомия 21 (синдром Дауна) выявлена в 23 (34%) случаях,
- трисомия 18 (синдром Эдвардса) – в 19 (28%);
- трисомия 13 (синдром Патау) – в 7 (10%);
- моносомия Х (синдром Тернера) – в 6 (9%);
- триплоидия – в 8 (12%);
- другие хро?