Если объем реакционного сосуда
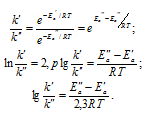
Задача 373.
Как изменится скорость реакции 2NO + O2 ⇔ 2NO2 если объем реакционного сосуда увеличить в 2 раза: а) уменьшится в 4 раза; б) уменьшится в 8 раз; в) возрастет в 4 раза; г) возрастет в 8 раз?
Решение:
Уравнение реакции имеет вид: 2NO + O2 ⇔ 2NO2.
До изменения объёма скорость реакции можно выразить уравнением:
v = k[NO]2. [O2], где
v – скорость реакции, k – константа скорости реакции, [NO] и [O2] – концентрации исходных веществ.
Вследствие увеличения объёма в системе в 2 раза, соответственно концентрация каждого из реагирующих веществ уменьшится в 2 раза. Следовательно, теперь скорость реакции будет равна:
v’ = k(1/2[NO])2. (1/2[O2]) = 1/8k[NO]2. [O2]
Тогда, сравнивая выражения v и v’, находим, что скорость реакции уменьшится в 8 раз
Ответ: б).
Задача 374.
Чем объясняется повышение скорости реакции при введении в систему катализатора: а) уменьшением энергии активации; б) увеличением средней кинетической энергии молекул; в) возрастанием числа столкновений; г)
остом числа активных молекул?
Решение:
Действие катализатора объясняется тем, что при его участии в реакционной системе возникают нестойкие промежуточные соединения (активированные комплексы), распад которых приводит к образованию продуктов реакции. При этом энергия активации реакции значительно понижается и активными становятся некоторые молекулы (реакционные частицы), энергия которых была недостаточна для осуществления реакции в отсутствии катализатора. В результате, при применении катализатора в реакционной системе общее число активных молекул (частиц) и скорость реакции значительно возрастает.
Таким образом, катализатор приводит к уменьшению энергии активации реакции и росту числа активных молекул (частиц).
Ответ: а); г).
Задача 375.
Какие из перечисленных воздействий приведут к изменению константы скорости реакции: а) изменение давления; б) изменение температуры; в) изменение объема реакционного сосуда; г) введение в систему катализатора; д) изменение концентрации реагирующих веществ?
Решение:
а) Согласно закону действующих масс скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Например, для реакции mA + nB ⇔ AmBn зависимость скорости реакции от концентрации реагентов А и В выразится в виде:
V = k[A]m . [B]n, где
А, В – молярные концентрации реагирующих веществ;
m, n – стехиометрические коэффициенты;
k – константа скорости реакции – величина, которая зависит от природы реагирующих веществ и равная единице, когда концентрации реагирующих веществ равны единице.
В случае гетерогенных химических реакций в выражение ЗДМ не входит концентрация веществ находящихся в твёрдой фазе, поскольку процесс протекает лишь на их поверхности.
При изменении давления в реакционной системе, в которой присутствуют газообразные вещества, происходит изменение концентрации газообразных реагентов. Значит, при изменении концентрации изменится значение скорости реакции, а значение константы скорости реакции не изменится.
б) Зависимость скорости реакции (или константы скорости реакции) от температуры может быть выражена уравнением:
Здесь vt и kt – скорость и константа скорости реакции при температуре t°С; vt+ 10 и kt + 10 те же величины при температуре (t + 100C); – температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 – 4 (правило Вант-Гоффа). В общем случае, если температура изменилась на °С, последнее уравнение преобразуется к виду:
Зависимость константы скорости реакции (k) от энергии активации (Ea) выражается уравнением Аррениуса: или , где
Ea – энергия активации, k и k’ – константы скорости реакции, Т – температура в К (298). Учитывая зависимость константы скорости реакции от изменения температуры, получим:
Из чего следует, что чем меньше энергия активации и выше температура, тем больше константа скорости реакции и k’/k.
Таким образом, изменение температуры реакционной среды приводит к изменению константы скорости реакции.
в) Изменение объёма жидкой или газообразной системы приводит к изменению конценрации газообразных веществ и веществ, находящихся в жидкой фазе. Следовательно, при изменении концентрации реагирующих веществ, исходя из выражения ЗДМ реакции, изменится только значение скорости процесса, а величина k останется постоянной. Величина константы скорости реакции зависит от природы реагентов и не зависит от изменения концентрации их в реакционной системе.
г) Введение в систему катализатора приводит к увеличению скорости реакции, но концентрации веществ остаются прежними, значит, изменится и значение константы скорости реакции, оно целочисленно станет больше. Катализатор снижает энергию активации реакции, что можно описать с помощью уравнения Аррениуса: где
Ea’ и Ea” – изменение энергии активации в реакционной системе после введения катализатора.
д) Изменение концентрации реагирующих веществ, исходя из выражения ЗДМ реакции, изменится только значение скорости процесса, а величина k останется постоянной.
Вывод:
Константа скорости реакции – это величина, зависящая от природы реагирующих веществ, от температуры и от присутствия катализаторов, но не зависит от концентрации реагирующих веществ.
Ответ: б); г).
Задача 376.
Какое влияние оказывает перемешивание на скорость протекания гетерогенной химической реакции: а) во всех случаях увеличивает скорость реакции; б) в некоторых случаях увеличивает скорость реакции; в) не влияет на скорость реакции?
Решение:
В ходе гетерогенной реакции можно выделить три стадии:
1. Подвод реагирующего вещества;
2. Химические реакции на поверхности;
3. Отвод продукта реакции то поверхности.
Скорость гетерогенной реакции – это количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы.
При перемешивании системы скорость переноса веществ и отвода продуктов реакции увеличивается, соответственно, должна увеличиваться и скорость реакции. Действительно, при перемешивании, скорость реакции увеличивается, если химическая стадия реакции требует небольшой энергии активации. Так реакция горения угля C(тв) + О2(г) ⇔ СО2(г) протекает тем быстрее, чем интенсивнее идёт конвекция в системе. Однако, есть реакции, скорость которых не увеличивается при перемешивании, например, реакция окисления железа кислородом влажного воздуха не ускоряется при увеличении подачи воздуха к поверхности металла, поскольку здесь энергия активации химической стадии процесса значительна.
Стадия, определяющая скорость протекания реакции, называется лимитирующей стадией. В реакции горения угля лимитирующей стадией является перенос вещества, а в реакции окисления железа собственно химическая реакция. Таким образом, перемешивание (конвекция) в некоторых случаях увеличивает скорость гетерогенной реакции, а именно, если стадия переноса веществ является лимитирующей, т.е. энергия активации стадии подвода и отвода веществ невелика.
Ответ: б).
Задача 377.
Увеличение скорости реакции с повышением температуры, вызывается главным образом: а) увеличением средней кинетической энергии молекул; б) возрастанием числа активных молекул; в) ростом числа столкновений?
Решение:
Зависимость скорости реакции (или константы скорости реакции) от температуры может быть выражена уравнением:
Здесь vt и kt – скорость и константа скорости реакции при температуре t°С; v(t + 10) и k(t + 10) те же величины при температуре (t + 100C); – температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 – 4 (правило Вант-Гоффа). В общем случае, если температура изменилась на °С, последнее уравнение преобразуется к виду:
Естественно, при повышении температуры системы увеличивается и кинетическая энергия молекул (частиц) и возрастает число столкновений молекул (частиц) реагирующих веществ. Но от этого правила наблюдаются отклонения для гетерогенных реакций, так как скорость их мало изменяется с температурой, и для биохимических реакций, для которых при повышении температуры всего лишь на один градус скорость реакции увеличивается в десятки и сотни раз.
Аррениус дал более точное выражение для зависимости константы скорости реакции от температуры:
Как показывает практика, элементарный акт реакции протекает не при всяком столкновении молекул (частиц) реагирующих веществ: реагируют только те молекулы (частицы), которые обладают достаточной энергией, чтобы разорвать или ослабить связи в исходных молекулах (частицах) и тем самым создать возможность образования новых молекул (частиц). Поэтому каждая реакция характеризуется определённым барьером энергии; для преодоления барьера необходима энергия активации – избыточная энергия, которой должны обладать молекулы (частицы) для того чтобы их столкновение было эффективным. С ростом температуры число активных молекул (частиц) быстро увеличивается, что и приводит к резкому возрастанию скорости реакции.
Ответ: б).
Источник
Методические указания
Учение о химическом равновесии является одним из основных разделов курса физической химии. На основе первого и второго закона термодинамики, имеющих общий характер, а также тепловой теоремы Нернста и постулата Планка, называемых третьим законом термодинамики, рассчитывают химическое равновесие, устойчивость веществ и направленность процесса, выясняют оптимальные условия режима в процессе химического превращения, позволяющие добиться максимального выхода желаемых веществ.
Необходимо знать, как, не прибегая к исследованию химического превращения, связанного с затратой больших средств, на основании термических и термохимических данных для исходных веществ и продуктов реакции теоретически предсказать возможность осуществления данного процесса и произвести расчеты выходов при различных условиях его протекания.
Прежде всего, необходимо усвоить особенности состояния химического равновесия:
- – неизменность состава системы (неизменность концентрации участников реакции);
- – подвижность равновесия;
- – динамичность (проявляется в том, что скорость прямой реакции равна скорости обратной);
- – максимальное значение энтропии, минимальное значение энергии Гиббса и неизменность этих термодинамических функций в состоянии равновесия;
- – возможность достижения равновесного состояния путем самопроизвольного и не самопроизвольного процессов.
Состояние химического равновесия характеризуется константой равновесия (Кр – если реакция проходит в газовой фазе, Кс – концентрационная константа, если реакция протекает в жидкой фазе). В условиях равновесия, когда изменение свободной энергии Гиббса равно нулю, при данной температуре имеет место постоянное соотношение произведения равновесных концентраций (парциальных давлений) продуктов реакции к произведению концентраций (парциальных давлений) исходных веществ, взятых в степени, равной их стехиометрическим коэффициентам. Важным является тот факт, что константа равновесия постоянна лишь при определенных условиях проведения реакции и зависит от природы реагирующих веществ, от общего давления, от температуры. Последнюю зависимость определяют уравнения изобары, изохоры.
Необходимо разобраться в принципе смещения равновесия (принцип Ле- Шателье – Брауна), в факторах, влияющих на смещение равновесия, понять и научиться использовать уравнение изотермы Вант-Гоффа при определении направления протекания реакции.
Усвоить этот раздел — значит, не только осмысленно выводить уравнения изотермы, изохоры, изобары химической реакции, понять сущность третьего закона термодинамики, но и уметь производить расчеты констант химического равновесия, выраженных различным образом, и выхода продуктов реакций при различных условиях опыта, тепловых эффектов реакции на основании экспериментальных данных по изучению равновесного состояния реакции. Только при этих условиях можно научиться решать кардинальные вопросы синтеза новых веществ и интенсификации существующих производств.
Решение типовых задач
Задача №1. При температуре Т=2773К вода частично диссоциирует на кислород и водород. При этих условиях 1м3 получившейся смеси весит 0,7757 кг; степень диссоциации равна 4,1%. Определите Кс и Кр для реакции.
Р е ш е н и е.
2Н2О = 2Н2 + О2
Концентрация до реакции
0 0
В состоянии равновесия
,
где – степень диссоциации, а
Подставляем значения равновесных концентраций в выражение константы равновесия:
Задача №2. Рассчитайте константу равновесия Кс реакции А + 4В = D, если объем реакционного сосуда V = 0,05 м3. При достижении равновесия nA =0,025;
nB=8,100; nD=0,975 моль.
Р е ш е н и е.
Задача №3. Определите константу равновесия реакции
Al2O3 + 3SO3 = Al2(SO4)3
при 298 К.
Р е ш е н и е. Вычислим тепловой эффект реакции , изменение энтропии при стандартном давлении и 298К, используя справочные данные о тепловых эффектах образования и об абсолютных энтропиях:
Вещество Al2(SO4)3 Al2O3 SO3
-3434 -1675 -395,2
S0,Дж/моль К 239,2 50,94 256,23
Для реакции получаем :
Изменение стандартной свободной энергии Гиббса определяем по формуле
Константу равновесия определяем по уравнению:
Задача №4. Для реакции СО + Н2О = СО2 + Н2, идущей в газовой фазе при 298 К, Можно ли при повышении температуры сдвинуть равновесие в сторону увеличения выхода водорода?
Р е ш е н и е. Для ответа на вопрос задачи необходимо уравнение изобары:
согласно условию тепловой эффект отрицателен, следовательно температурный коэффициент, т.е. (отрицательный). Это означает, что при повышении температуры константа равновесия уменьшается, следовательно, уменьшается выход водорода. Поэтому нельзя при повышении температуры сдвинуть равновесие в сторону увеличения выхода водорода.
Источник
Задача 378.
При 20°С константа скорости некоторой реакции равна 104 мин-1, а при 50°С – 8 . 104 мин-1. Чему равен температурный коэффициент скорости реакции: а) 2; б) 3; в) 4?
Решение:
Зависимость скорости реакции (или константы скорости реакции) от температуры может быть выражена уравнением:
Здесь vt и kt – скорость и константа скорости реакции при температуре t°С; v(t + 10) и k(t + 10) те же величины при температуре (t + 100C); – температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 – 4 (правило Вант-Гоффа). В общем случае, если температура изменилась на °С, последнее уравнение преобразуется к виду:
Поскольку по условию задачи равно 300С (50 – 20 = 30), то подставив данные задачи, находим значение температурного коэффициента:
Ответ: а).
Задача 379.
Скорость, каких реакций увеличивается с ростом температуры: а) любых; б) протекающих с выделением энергии; в) протекающих с поглощением энергии?
Решение:
При увеличении температуры возрастает кинетическая энергия движения молекул и число столкновений их друг с другом, поэтому при повышении температуры скорость реакции возрастает.
Зависимость скорости реакции (или константы скорости реакции) от температуры может быть выражена уравнением:
Здесь vt и kt – скорость и константа скорости реакции при температуре t°С; vt + 10 и kt + 10 те же величины при температуре (t + 100C); – температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 – 4 (правило Вант-Гоффа). В общем случае, если температура изменилась на °С, последнее уравнение преобразуется к виду:
Более точно зависимость скорости (или константы) реакции от температуры определяется уравнением Аррениуса:
Из этого уравнения вытекает, что константа скорости реакции возрастает при повышении температуры Т.
Таким образом, при повышении температуры возрастает скорость (или константа скорости) химической реакции, главным образом за счёт роста числа активных молекул в реакционной среде.
Ответ: а).
Задача 380.
Если константа скорости одной реакции (k’) больше константы скорости второй реакции (k”), то какое соотношение между энергиями активации этих реакций правильно: а) Ea’ > Ea”; б) Ea’ < Ea”; в) нельзя определить?
Решение:
Зависимость константы скорости реакции (k) от энергии активации (Ea) выражается уравнением Аррениуса:
Из уравнения следует, что величина константы скорости реакции зависит от температуры и энергии активации реакции, причём, чем меньше энергия активации, тем выше значение константы реакции.
Если k’ > k”, то можно записать
Таким образом, при k’ > k”; Ea” > Ea’, т.е. Ea’ < Ea”.
Ответ: б).
Задача 381.
Какие из перечисленных воздействий приведут к изменению значения константы равновесия химических реакций: а) изменение давления; б) изменение температуры; в) замена катализатора; г) изменение концентраций реагирующих веществ?
Решение:
а) При изменении давления в реакционной системе будет изменяться концентрация веществ находящихся в жидком или в газообразном состоянии. Изменение концентрации реагирующих веществ приведёт к смещению равновесия системы вправо или влево. При этом скорости как прямой, так и обратной реакций не изменятся, т.е. константа равновесия данной реакции тоже не изменится, будет иметь прежнее значение.
б) Зависимость константы уравнения реакции выражается уравнением:
Отсюда вытекает, что при изменении температуры реакционной системы изменится значение константы равновесия.
в) Замена катализатора способствует изменению скорости как прямой, так и обратной реакции, потому что катализаторы – вещества, которые увеличивают скорости как прямой, так и обратной реакции, поэтому константа равновесия реакции не изменится.
г) Константу равновесия реакции A + B ⇔ C + D можно описать, согласно закону действия масс, выражением:
Кс – константа равновесия, [C], {D], [A] и [B] – концентрации равновесия реагирующих веществ.
Из этого выражения следует, что при изменении концентраций реагирующих веществ изменяются лишь направление смещения системы, а константа равновесия не меняется.
Таким образом, значение константы равновесия реакции изменяется только при изменении температуры.
Ответ: б).
Задача 382.
Если объем закрытого реакционного сосуда, в котором установилось равновесие 2SO2(г) + O2(г) ⇔ 2SO3(г), уменьшить в 2 раза, то: а) скорости прямой и обратной реакций останутся одинаковыми; б) скорость прямой реакции станет в 2 раза больше скорости обратной реакции; в) равновесие не сместится; г) равновесие сместится вправо; д) равновесие сместится влево?
Решение:
Уравнение реакции имеет вид:
2SO2(г) + O2(г) ⇔ 2SO3(г)
Если объём системы при установившемся равновесии уменьшить в 2 раза, то, соответственно, в 2 раза увеличится концентрации газообразных веществ. Скорости прямой и обратной реакций, соответственно изменятся. Запишем выражения закона действующих масс для прямой и обратной скоростей реакций:
vпр = k[SO2]2. [O2]; Vобр = [SO3]2.
Подставив, полученные изменения значений концентраций реагирующих веществ в выражения закона действующих масс реакций данной системы, получим:
v’пр = k . (2[SO2])2. 2[O2] = k . 22.2 = 8k; V’обр = k . (2[SO3])2 = k . 22 = 4k.
Находим во сколько раз скорость прямой реакции больше, чем обратной:
Таким образом, скорость прямой реакции в 2 раза стала больше, чем обратной.
Из уравнения реакции следует, что данная реакция протекает с уменьшением, как числа молей реагирующих веществ, так и с уменьшением числа молей газообразных веществ, поэтому, согласно принципу Ле Шателье, при уменьшении объёма системы равновесие сместится в вправо, в сторону уменьшения числа молей газообразных веществ.
Ответ: б); г).
Источник
