Газ наполняющий герметичный сосуд

Казалось бы, нет ничего сложного в реализации герметичного пространства для сгорания топлива. До тех пор, пока не задумаешься о том, что как минимум одна “стенка” постоянно движется, а газы внутри должны периодически обновляться.
Устройство камеры сгорания
Камера сгорания “традиционного” двигателя
Выше приведен рисунок из классического, возможно, еще советского пособия по устройству автомобиля. Здесь изображен двигатель как раз в момент, когда поршень находится в крайнем верхнем положении (т.н. “верхняя мертвая точка” – ВМТ). Сверху цилиндра находится свеча зажигания, которая подает искру, а по бокам от нее – впускной и выпускной клапаны. Через впускной клапан в цилиндр впускается топливовоздушная смесь, а через выпускной выходят выхлопные газы.
Камера сгорания двигателя с непосредственным впрыском отличается только тем, что через впускной цилиндр подается только воздух, а внутрь цилиндра “торчит” еще топливная форсунка:
Камера сгорания двигателя с непосредственным впрыском
Итак, что же надо тут герметизировать?
Во-первых, нужно, чтобы на такте сжатия из цилиндра не выходила топливовоздушная смесь (иначе она вся уйдет, и сгорания просто не будет), а на такте рабочего хода – чтобы из цилиндра не уходили выхлопные газы (иначе они не выполнят полезной работы – не будут толкать поршень вниз). То есть, герметичность нужна “газовая” (термин технически не совсем верный, но для простоты употребим его).
Во-вторых, нужно, чтобы в камеру сгорания не попадало масло. Попадание масла в камеру сгорания имеет целую кипу неприятных последствий, о которых лучше рассказать в другой раз. Просто примем как факт – попадать оно в камеру сгорания не должно, поэтому от него тоже надо обеспечить герметичность.
Кроме того, на первом рисунке можно также увидеть, что верхняя и нижняя часть камеры сгорания – раздельные. Именно так устроено подавляющее количество современных моторов. Нижняя часть, с поршнями, называется “блок цилиндров”, а верхняя, со свечой, клапанами и (для непосредственного впрыска) форсунками, называется “головка блока цилиндров” (ГБЦ).
Уплотнения от ухода газов
Газы из цилиндра могут уходить чисто теоретически вообще через любое отверстие: через свечное отверстие, через уплотнение форсунки, через клапаны, в зазор между поршнем и стенкой цилиндра, а также через соединение ГБЦ с блоком цилиндров. И вот как это решается.
Свеча зажигания
Это самое простое место для реализации уплотнения. Она вкручивается в головку блока цилиндров, а заканчивается резьбовая часть свечи мягкой шайбой, которая при затягивании расплющивается и герметизирует соединение.
В качестве экзотики встречается также коническая посадка без прокладки.
Форсунка в двигателях с непосредственным впрыском
Здесь принцип уплотнения еще проще. Ее длинный “носик” вставляется в соответствующее отверстие. Входит он туда и так довольно плотно (непосредственный впрыск – мир высоких технологий и прецизионных решений), да еще и оканчивается тефлоновым колечком для уплотнения. Это решает вопрос герметичности полностью:
Клапаны
Уплотнить клапаны (или, как это принято в околоавтомобильной среде – клапанА) – задача посложнее. Ведь клапан бьет о свое посадочное место тысячи раз в минуту. Никакая резина или тефлон не выдержат этого. Потому здесь не остается никаких других решений, кроме тщательной обработки той поверхности, где тарелка клапана закрывает доступ в камеру сгорания. Это место называется “седло клапана”, и оно притирается до обеспечения полной герметичности:
Поршень-стенка цилиндра
Здесь самое интересное. Это тот случай, когда отсутствие зазора приведет к механическим повреждениям, а наличие зазора приведет к утечкам газов, как следствие – понижению мощности и некоторым другим минусам. Решение разработчиками двигателей было найдено, в общем-то, гениальное. И, конечно же, простое – как всегда после того, как нам уже рассказали, как что-то устроено:
На рисунке изображен поршень автомобиля ЗИЛ-130. На современных легковых двигателях колец всего три – два компрессионных и одно маслосъемное
На поршень надеваются несколько колец. Они подпружинены и в свободном состоянии существенно “выпирают” за размеры поршня. Перед установкой в цилиндр они поджимаются, а после попадания в цилиндр – упираются в его стенки, обеспечивая достаточную герметичность. Верхние кольца – сплошные, и предназначены для герметизации от рабочих газов (топливовоздушной смеси и отработавших, выхлопных газов), они называются “компрессионные” – потому что обеспечивают достижение давления (компрессии) в цилиндре. Нижнее кольца называется маслосъемным, и о нем мы поговорим ниже.
Головка блока цилиндров
Вот так выглядит ГБЦ:
Вот так выглядит блок цилиндров:
Если эти две детали соединить – получится двигатель. Но сначала надо решить несколько задач. Во-первых, не должны уходить газы из камеры сгорания. Во-вторых, и в ГБЦ, и в блоке цилиндров есть каналы, через которые масло подается к трущимся поверхностям – надо, чтобы оно оттуда никуда не делось. В-третьих, аналогичные каналы есть для охлаждающей жидкости.
Чтобы обеспечить такую герметичность, первый шаг – обеспечение высокого качества обработки сопрягаемых поверхностей. Плоскости должны быть “плоскими” с точностью до сотых долей миллиметра. Второй шаг – использование специальной прокладки, которая будет одновременно достаточно мягкой, чтобы компенсировать все имеющиеся неровности и достаточно прочной, чтобы выдержать температуру и давление в камере сгорания. Ну и впридачу – она должна быть стойкой к маслу и антифризу.
Наконец, последний шаг – правильный момент затяжки болтов, крепящих ГБЦ к блоку цилиндров. Если их недотянуть – прокладка будет поджата недостаточно, и не обеспечит герметичность. Если их перетянуть – можно деформировать прокладку, и она не обеспечит герметичность. Если протянуть болты в неправильной последовательности, прокладка тоже может деформироваться – и да, вы совершенно правы, не обеспечит герметичности.
Уплотнения от попадания масла
С маслом ситуация немного проще. В сущности, оно может попадать в камеру сгорания только со стенок цилиндра или со стержней клапанов.
Уплотнение клапанов
Распределительный вал (12) кулачком нажимает на коромысло (10), которое давит на клапан (2). Это происходит с каждым оборотом двигателя, то есть, несколько тысяч раз в минуту Все эти детали постоянно испытывают трение. Поэтому без масла будет моментальный и катастрофический износ. А вот чтобы масло не попадало ниже, в камеру сгорания, на стержень клапана и надевается маслосъемный колпачок. Вот как он выглядит вживую:
Уплотнение поршней
С поршнями ситуация аналогична клапанам. Без масла там никуда. Поэтому и решение принято аналогичное – одно из колец, установленных на поршне, предназначено не для поддержания компрессии, а для снятия масла со стенок цилиндра, за что и называется маслосъемным:
Пара слов о дизелях
Дизели, несмотря на принципиально другой принцип воспламенения топлива, имеют ровно тот же конструктив и те же способы уплотнения. Разве что вместо свечей зажигания там свечи накаливания.
Почему полезно все это знать?
Знания эти – не сухие академичные сведения. Львиная доля неисправностей двигателя связаны именно с нарушением тех или иных уплотнений. Именно этим, например, объясняется повышенный “масложор” в подавляющем большинстве случаев. В следующей публикации мы рассмотрим устройство системы вентиляции картера, а после – типовые причины ухода масла из двигателя.
Источник
Задача по физике – 9549
Вертикальный цилиндрический сосуд закрыт поршнем, на котором лежат две одинаковые гири. Внутри и снаружи сосуда атмосфера находится воздух. Если одну из гирь убрать, то объём под поршнем увеличится в 1,5 раза. Во сколько раз изменится объём под поршнем, если к двум гирям добавить ещё одну такую же? Трения нет. Температуру воздуха считать постоянной.

Подробнее
Задача по физике – 9554
В пустой калориметр поместили очень холодный кусок льда и налили стакан кипятка ($T_{к} = 100^{ circ} С$). При этом весь кипяток превратился в лёд с установившейся температурой $T_{0} = 0^{ circ} С$. Когда в калориметр налили ещё 8 таких же стаканов кипятка, весь лёд превратился в воду с установившейся температурой $T_{0} = 0^{ circ} С$. Найти начальную температуру льда. Теплоёмкость воды $c_{в} = 4,2 кДж/(кг cdot ^{ circ} С)$, теплоёмкость льда $c_{л} = 2,1 кДж/(кг cdot ^{ circ} С)$, теплота плавления льда $lambda = 336 кДж/кг$.
Подробнее
Задача по физике – 9561
Надутый шарик находится внутри замкнутого сосуда, занимая четвёртую часть объёма сосуда. При этом давление газа внутри шарика равно $P_{1}$, а снаружи – $P_{2}$. Систему медленно нагревают. При некоторой критической температуре, когда объём шарика увеличился вдвое по сравнению с первоначальным, а разность давлений газа внутри и снаружи шарика стала равной $Delta P$, шарик лопнул. В дальнейшем температура газа в сосуде поддерживается равной критической. Определите установившееся давление газа в сосуде. Объёмом оболочки шарика пренебречь.

Подробнее
Задача по физике – 9564
Три одинаковые вертикально стоящие замкнутые цилиндрические цистерны соединены последовательно гибкими шлангами на середине высоты и снабжены клапанами для выпуска воздуха. Рабочий начал медленно подавать воду в крайнюю правую цистерну, предварительно открыв её воздушный клапан. Клапаны двух других цистерн остались закрытыми, так что воздух из них не выходил. К моменту, когда крайняя правая цистерна оказалась полностью наполненной, левая оказалась наполненной на 3/11 своего объёма. Какая доля объёма средней цистерны заполнилась водой? Объёмом соединительных шлангов пренебречь.

Подробнее
Задача по физике – 9570
Маленький кубик из железа ставят на массивный кусок льда. До какой минимальной температуры должен быть нагрет кубик из железа, чтобы он полностью погрузился в лед? Температура куска льда $0^{ circ} С$. Удельная теплота плавления льда 340 кДж/кг, удельная теплоемкость железа $460 Дж/(кг cdot град)$. Плотность железа $7800 кг/м^{3}$, плотность льда $900 кг/м^{3}$. Считать, что вода из под кубика может вытекать.
Подробнее
Задача по физике – 9572
Кусок льда, помещенный в теплоизолированный сосуд, нагревают с помощью размещенного внутри сосуда нагревателя.График зависимости температуры $t$ от подводимого количества теплоты $Q$ приведен на рисунке. Считая, что удельная теплоёмкость льда $2,1 кДж/(кг cdot град)$, а начальная температура льда минус $40^{ circ} С$, Найдите с помощью приведенного графика удельную теплоту плавления льда. Теплоемкостью сосуда можно пренебречь. Процесс происходит при нормальном атмосферном давлении.

Подробнее
Задача по физике – 9580
В калориметре находятся два сосуда, разделённые теплопроводящей стенкой. В первый сосуд наливают жидкость массы $m_{1}$ и удельной теплоёмкости $c_{1}$, а во второй жидкость удельной теплоёмкости $c_{2}$. Найдите массу $m_{2}$ жидкости, налитой во второй сосуд, если известно, что после установления теплового равновесия первая жидкость нагрелась на 1/3 от начальной разницы температур.

Подробнее
Задача по физике – 9590
Чернильница представляет собой фигуру вращения, сечение которой изображено на рисунке. Какой объем чернил можно в неё налить? Радиусы внешней и внутренней цилиндрических поверхностей равны $R$ и $r$ соответственно. Чернильница стоит вертикально, наполняют её медленно. Плотность чернил $rho$, ускорение свободного падения $g$ атмосферное давление $P_{0}$, высота чернильницы $H$. Зазор снизу между дном и внутренним цилиндром незначительный. Толщиной стенок пренебречь.

Подробнее
Задача по физике – 9599
Плотность воздуха при постоянном давлении обратно пропорциональна его абсолютной температуре $T$, и при температуре $0^{ circ} С$ равна $1,3 кг/м^{3}$. В Васиной комнате было очень жарко – комнатный термометр показывал $+27^{ circ} С$. Поэтому, придя домой, Вася открыл окно, чтобы проветрить помещение, и отправился гулять. Вернувшись, он увидел, что термометр показывает всего $+10^{ circ} С$. Комната имеет размеры (в длину, ширину и высоту) $3,5 м times 4 м times 3 м$. Насколько увеличилась масса воздуха в комнате после такого проветривания?
Примечание: абсолютная температура $T$ измеряется в Кельвинах (К) и рассчитывается по формуле:
$T = t + 273 град$,
где $t$ – температура, выраженная в градусах Цельсия.
Подробнее
Задача по физике – 9602
Литр воды имеет комнатную температуру $20^{ circ} С$ и находится в открытом сверху тонкостенном сосуде. В воду быстро (за время меньше чем 1 с) опустили разогретую до $800^{ circ} С$ тонкую медную плоскую пластину массой 0,64 кг, удерживая её клещами. Пластина лежит в вертикальной плоскости. Верхний край пластины оказался вровень с уровнем воды в сосуде. Движениями пластины воду перемешали, и сразу же опустили в воду термометр. Что он показал?
Удельная теплоёмкость меди $0,38 кДж/(кг cdot ^{ circ} С)$, воды – $4,2 кДж/(кг cdot ^{ circ} С)$, удельная теплота парообразования воды 2,3 МДж/кг.
Подробнее
Задача по физике – 9603
При нагревании или охлаждении твердые тела, как известно, изменяют свой объем. Коэффициентом объемного расширения $beta$ называется коэффициент пропорциональности между относительным изменением объема $frac{ Delta V}{V}$ тела и изменением температуры этого тела $Delta t$, то есть $frac{ Delta V}{V} = beta Delta t$.
Стеклянный шарик с коэффициентом объёмного расширения $beta_{1}$ полностью погружают в жидкость сначала при температуре $t_{1}$, а затем – при температуре $t_{2}$. Модули сил Архимеда, действующих на шарик в этих случаях, равны, соответственно $F_{1}$ и $F_{2}$. Определите коэффициент объёмного расширения жидкости $beta_{2}$.
Подробнее
Задача по физике – 9609
Аккумулятор массой 5 кг, имеющий ЭДС 5 В, опустили полностью в дистиллированную воду на прочной нити, которая оказалась натянутой с силой 5 Н. Если этому аккумулятору (без воды) сообщить количество теплоты 5 кДж, то он нагреется на 5 градусов. Когда же к этому аккумулятору подключили резистор, через него потек ток силой 5 А, напряжение на выводах аккумулятора уменьшилось на 5%, и через 5 минут аккумулятор немного нагрелся. Найдите:
– среднюю плотность $p$ аккумулятора;
– среднюю удельную теплоёмкость $c$ аккумулятора,
– сопротивление $R$ резистора,
– изменение температуры $Delta t$ аккумулятора после 5 минут работы с нагрузкой, если потерями теплоты можно пренебречь.
Плотность воды $rho_{0} = 1,0 г/см^{3}$, ускорение свободного падения $g = 10 м/с^{2}$.
Подробнее
Задача по физике – 9610
Герметичный теплонепроницаемый вертикальный цилиндрический сосуд разделён массивным теплонепроницаемым горизонтальным тонким поршнем, скользящим вдоль стенок без трения. В обеих частях сосуда находится один и тот же идеальный газ. Известно, что при температуре $T$ в обеих частях сосуда поршень делит сосуд в отношении 2:1, считая от его верхнего торца. Если перевернуть сосуд и нагреть оказавшийся под поршнем газ до температуры $4T$, а температуру второй части оставить неизменной, то поршень вновь разделит сосуд в отношении 2:1, считая от верхнего торца. Чему равно отношение масс газов, разделённых поршнем?
Подробнее
Задача по физике – 9613
С одноатомным идеальным газом проводят циклы 1-2-3-4-1 и 1-2-4-1 , показанные на рисунке. Найдите КПД обоих циклов. КПД какого из циклов больше и на сколько?
Молярная теплоёмкость одноатомного идеального газа при постоянном объёме $C_{V} = frac{3}{2}R$.

Подробнее
Задача по физике – 9618
В медный калориметр массой $m_{1}$ и температурой $t_{1}$ наливают воду массой $m_{2}$ и температурой $t_{2}$ и кладут лед массой $m_{3}$ и температурой $t_{0} = 0^{ circ} С$. Удельные теплоемкости меди, воды и льда равны соответственно $c_{1}, c_{2}$ и $c_{3}$, удельная теплота плавления льда равна $lambda$. Найти температуру системы после установления теплового равновесия для произвольных значений $m_{1}, m_{2}, m_{3}, t_{1}, t_{2}$, если известно, что $t_{1}
Подробнее
Источник
5.4. Практическое применение уравнения состояния идеального газа
5.4.2. Уравнение состояния для газа в закрытом сосуде
При рассмотрении идеального газа, находящегося в закрытом сосуде (баллоне), необходимо учитывать, что изменение термодинамических параметров происходит при постоянной массе газа.
Для идеального газа, находящегося в закрытом сосуде, необходимо учитывать следующее:
- масса газа, находящегося в закрытом сосуде, вследствие изменения его термодинамических параметров не изменяется:
m = const;
- объем газа, заполняющего сосуд определенного объема, также фиксирован: V = const;
- постоянными также остаются следующие параметры газа:
ρ = const; ν = const; n = const;
где ρ — плотность газа; ν — количество вещества (газа); n — концентрация молекул (атомов) газа.
Для идеального газа, находящегося в закрытом сосуде и изменяющего свое состояние, уравнение Менделеева — Клапейрона записывается в виде системы (рис. 5.8):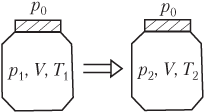
p1V=νRT1,p2V=νRT2,}
где p
1, T
1 — давление и температура газа в начальном состоянии; p
2, T
2 — давление и температура газа в конечном состоянии; V — объем баллона; ν — количество газа; R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К).
Термин избыточное давление, встречающийся в задачах об идеальном газе в закрытом сосуде (баллоне), означает абсолютную разность между давлением газа, находящегося в сосуде, и давлением на стенки сосуда снаружи:
p
изб = |p − p
0|,
где p — давление газа, находящегося внутри сосуда; p
0 — давление (атмосферное либо гидростатическое) на стенки сосуда снаружи.
Пример 13. Баллон рассчитан на максимальное избыточное давление 150 МПа. В него накачали газ при температуре 300 К до давления 120 МПа. Постепенно нагревая газ, баллон погружают в воду плотностью 1000 кг/м3 на глубину 1000 м. До какой максимальной температуры можно нагреть газ в баллоне, чтобы он не взорвался?
Решение. Запишем уравнение Менделеева — Клапейрона для двух состояний газа, находящегося в баллоне:
- в начале нагревания
p
1V = νRT
1;
- в конце нагревания
p
2V = νRT
2;
где p
1 — первоначальное давление газа в баллоне; p
2 — давление газа в баллоне в конце нагревания; V — объем газа (баллона), V = const; ν — количество вещества (газа) в баллоне; R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К); T
1 — температура газа в начале процесса; T
2 — температура газа в конце процесса.
Отношение уравнений
p1Vp2V=νRT1νRT2
позволяет определить давление газа в конце процесса:
p2=p1T2T1.
В условии задачи задано максимальное избыточное давление, определяемое формулой
pизбmax=|p2−p0|,
где p
0 — давление снаружи баллона; p
2 — давление газа внутри баллона.
При погружении баллона в воду с одновременным нагреванием указанные давления снаружи и внутри баллона определяются следующими формулами:
- снаружи (сумма атмосферного и гидростатического давлений) —
p
0 = p
атм + p
гидр = p
атм + ρ0gh,
где p
атм — атмосферное давление; p
гидр — гидростатическое давление, p
гидр = ρ0gh; ρ0 — плотность воды; g — модуль ускорения свободного падения; h — глубина погружения баллона;
- внутри (давление газа) —
p2=p1T2T1,
где T
2 — максимальная температура газа (искомая величина).
Подстановка выражений для давлений внутри и снаружи баллона в формулу для избыточного давления дает
pизбmax=|p1T2T1−ρ0gh−pатм|≈|p1T2T1−ρ0gh|,
так как p
атм << ρ0gh, p
атм << p
2.
Данное уравнение содержит модуль разности, что приводит к двум независимым уравнениям:
pизбmax=p1T2T1−ρ0gh, pизбmax=ρ0gh−p1T2T1,
из которых следуют две формулы для расчета искомой величины:
T2=T1⋅ρ0gh+pизбmaxp1, T2=T1⋅ρ0gh−pизбmaxp1.
Максимальному значению искомой температуры соответствует значение, рассчитанное по первой формуле:
T2=300⋅1000⋅10⋅1000+150⋅106120⋅106=400 К.
Чтобы баллон не взорвался, его можно погрузить на заданную глубину, одновременно нагревая до температуры 400 К.
Пример 14. Бутылка емкостью 0,75 л выдерживает максимальное избыточное давление 150 кПа. Из бутылки откачивают воздух и запечатывают некоторое количество твердого углекислого газа с молярной массой 44,0 г/моль. Атмосферное давление равно 100 кПа. Считая, что объем твердого углекислого газа пренебрежимо мал по сравнению с объемом бутылки, найти его максимальную массу, которая не вызовет взрыва бутылки при температуре 300 К?
Решение. Запишем уравнение Менделеева — Клапейрона для углекислого газа, находящегося в бутылке, после его превращения в газообразное состояние:
pV=mMRT,
где p — давление углекислого газа в бутылке; V — объем газа (бутылки); m — масса углекислого газа в бутылке; M — молярная масса углекислого газа; R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К); T — температура газа.
Записанное уравнение позволяет получить выражение для расчета давления газа внутри бутылки:
p=mRTVM.
В условии задачи задано максимальное избыточное давление, определяемое формулой
pизбmax=|p−p0|,
где p
0 — давление снаружи бутылки.
Указанные давления снаружи и внутри бутылки определяются следующим образом:
- снаружи (атмосферное давление) — p
0; - внутри (давление углекислого газа) —
p=mRTVM,
где m соответствует искомой величине — максимальной массе углекислого газа.
Подстановка выражений для давлений внутри и снаружи баллона в формулу для избыточного давления дает
pизбmax=|mRTVM−p0|.
Данное уравнение содержит модуль разности, что приводит к двум независимым уравнениям:
pизбmax=mRTVM−p0, pизбmax=p0−mRTVM,
из которых следуют две формулы для расчета искомой величины:
m=VM(p0+pизбmax)RT, m=VM(p0−pизбmax)RT.
Максимальному значению искомой массы соответствует значение, рассчитанное по первой формуле:
m=0,75⋅10−3⋅44,0⋅10−3(100+150)⋅1038,31⋅300=3,3⋅10−3 кг=3,3 г.
Чтобы бутылка не взорвалась, в нее можно запечатать не более 3,3 г твердого углекислого газа.
Пример 15. В наличии имеется неограниченное количество баллонов объемом по 4,0 л, заполненных некоторым идеальным газом до давления 500 кПа. Баллоны предназначены для наполнения газом оболочки аэрозонда и их можно соединять между собой. Сколько баллонов с газом необходимо одновременно подсоединить к пустой оболочке аэрозонда объемом 800 дм3, чтобы наполнить ее до давления 100 кПа, равного атмосферному? Температура газа при заполнении оболочки не изменяется.
Решение. Для осуществления процесса, описанного в условии задачи, требуется определенное количество газа ν.
Необходимое количество газа заполняет следующий объем:
- в начале процесса (до заполнения оболочки)
V
1 = NV
бал,
где N — количество баллонов; V
бал — объем одного баллона, V
бал = 4,0 л;
- в конце процесса (после заполнения оболочки)
V
2 = NV
бал + V
обол,
где V
обол — объем оболочки, V
обол = 800 дм3.
Указанное количество газа находится при давлении:
- в начале процесса (до заполнения оболочки) —
p
1 = 500 кПа
и совпадает с давлением газа в каждом из баллонов;
- в конце процесса (после заполнения оболочки) —
p
2 = 100 кПа
и совпадает с давлением в оболочке.
Считая процесс заполнения газом оболочки аэрозонда изотермическим, запишем уравнение Менделеева — Клапейрона следующим образом:
- в начале процесса (до заполнения оболочки) —
p
1V
1 = νRT,
где ν — количество вещества (газа) в оболочке; R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К); T — температура газа (не изменяется в ходе процесса);
- в конце процесса (после заполнения оболочки) —
p
2V
2 = νRT.
Равенство
p
1V
1 = p
2V
2,
записанное в явном виде
p
1NV
бал = p
2(NV
бал + V
обол),
позволяет получить формулу для вычисления искомого числа баллонов:
N=VоболVбал⋅p2p1−p2.
Произведем расчет:
N=800⋅10−34,0⋅10−3⋅100⋅103(500−100)⋅103=50.
Следовательно, для заполнения оболочки до указанного давления необходимо 50 баллонов с газом.
Пример 16. Аэростат, оболочка которого заполнена азотом с молярной массой 28 г/моль, находится в воздухе. Молярная масса воздуха равна 29 г/моль. Массы гондолы и оболочки аэростата пренебрежимо малы. Во сколько раз возрастет подъемная сила аэростата, если азот в его оболочке заменить на водород с молярной массой 2,0 г/моль, не изменяя при этом объем аэростата?
Решение. Силы (сила тяжести mg→ и сила Архимеда F→A), действующие на аэростат, показаны на рисунке.
Подъемная сила — это векторная сумма силы тяжести и силы Архимеда:
F→под=F→A+mg→,
где F→A — сила Архимеда, действующая на оболочку со стороны воздуха; mg→ — сила тяжести; m — масса газа, заполняющего оболочку аэростата; g→ — ускорение свободного падения.
В проекциях на вертикальную ось подъемная сила определяется следующими выражениями:
- при заполнении оболочки азотом —
F
под1 = F
A1 − m
1g,
где F
A1 — модуль силы Архимеда, действующей на оболочку аэростата при заполнении оболочки азотом, F
A1 = ρ0gV
1; ρ0 — плотность воздуха; V
1 — объем оболочки аэростата при заполнении ее азотом (объем воздуха, вытесненного оболочкой); m
1 — масса азота, заполняющего оболочку, m
1 = ρ1V
1; ρ1 — плотность азота;
- при заполнении оболочки водородом —
F
под2 = F
A2 − m
2g,
где F
A2 — модуль силы Архимеда, действующей на оболочку аэростата при заполнении оболочки водородом, F
A2 = ρ0gV
2; V
2 — объем оболочки аэростата при заполнении ее водородом (объем воздуха, вытесненного оболочкой); m
2 — масса водорода, заполняющего оболочку, m
2 = ρ2V
2; ρ2 — плотность водорода.
Искомой величиной является отношение
Fпод2Fпод1=FA2−m2gFA1−m1g.
С учетом записанных выражений для сил Архимеда, масс азота и водорода, а также равенства объемов оболочки при заполнении ее азотом и водородом (V
1 = V
2), указанное отношение принимает вид
Fпод2Fпод1=ρ0gV2−ρ2V2gρ0gV1−ρ1V1g=(ρ0−ρ2)V2g(ρ0−ρ1)V1g=ρ0−ρ2ρ0−ρ1.
Плотности воздуха, азота и водорода определим как отношения:
- для воздуха
ρ0=M0Vμ0,
где M
0 — молярная масса воздуха; V
µ0 — молярный объем воздуха;
- для азота
ρ1=M1Vμ1,
где M
1 — молярная масса азота; V
µ1 — молярный объем азота;
- для водорода
ρ2=M2Vμ2,
где M
2 — молярная масса водорода; V
µ2 — молярный объем водорода.
Молярные объемы (объемы одного моля) воздуха, азота и водорода равны между собой, так как газы находятся при одних и тех же условиях:
V
µ0 = V
µ1 = V
µ2 = V
µ.
Поэтому формула для расчета искомого отношения приобретает вид
Fпод2Fпод1=ρ0−ρ2ρ0−ρ1=M0−M2M0−M1.
Расчет дает значение:
Fпод2Fпод1=29⋅10−3−2,0⋅10−329⋅10−3−28⋅10−3=27.
При замене азота на водород в оболочке аэростата его подъемная сила возрастет в 27 раз.
Пример 17. Воздушный шар с температурой 300 К находится в воздухе при атмосферном давлении 100 кПа. Молярная масса воздуха составляет 29,0 г/моль. Объем воздушного шара равен 830 дм3, а масса его оболочки равна 333 г. На сколько градусов необходимо нагреть газ в оболочке, чтобы шар взлетел? Воздух в оболочке шара сообщается с атмосферой.
Решение. Силы, действующие на воздушный шар, показаны на рисунке:
- сила Архимеда
F
A = ρ0gV,
где ρ0 — плотность воздуха, окружающего шар; g — модуль ускорения свободного падения; V — объем оболочки шара (объем вытесненного оболочкой воздуха);
- сила тяжести
mg = (m
обол + m
возд)g,
где m
обол — масса оболочки; m
возд — масса воздуха в оболочке, m
возд = ρV; ρ — плотность воздуха внутри оболочки.
Шар взлетает, когда выполняется равенство
F→A+mg→=0,
или, в проекции на вертикальную ось, —
F
A − mg = 0.
Преобразуем равенство (условие равновесия шара в воздухе)
F
A = mg
с учетом записанных выше выражений
ρ0gV = (m
обол + m
возд)g, или (ρ0 − ρ)V = m
обол.
Входящие в равенство плотности воздуха не известны, но фигурируют в качестве параметра в уравнении состояния:
- для воздуха снаружи оболочки воздушного шара
p0=ρ0RT1M,
где p
0 — атмосферное давление; ρ0 — плотность воздуха снаружи оболочки; R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К); T
1 — температура окружающего шар воздуха; M — молярная масса воздуха;
- для воздуха внутри оболочки воздушного шара
p=ρRT2M,
где p — давление воздуха внутри оболочки; ρ — плотность воздуха внутри оболочки; T
2 — температура воздуха внутри оболочки.
Давления воздуха внутри и снаружи оболочки воздушного шара одинаковы, так как воздух, находящийся в оболочке, сообщается с атмосферой; поэтому
p = p
0.
Плотности:
- для воздуха снаружи оболочки воздушного шара
ρ0=p0MRT1;
- для воздуха внутри оболочки воздушного шара
ρ=p0MRT2.
Подставим выражения для плотностей в условие равновесия шара в воздухе:
(1T1−1T2)p0MVR=mобол.
Температура воздуха внутри оболочки, при которой шар начинает взлетать, определяется как
T2=p0MVT1p0MV−RT1mобол,
а искомая разность —
ΔT=T2−T1=p0MVT1p0MV−RT1mобол−T1=T1p0MVRT1mобол−1.
Произведем вычисление:
ΔT=300100⋅103⋅29,0⋅10−3⋅830⋅10−38,31⋅300⋅333⋅10−3−1=158 К.
Следовательно, чтобы воздушный шар начал взлетать, воздух в его оболочке необходимо нагреть на 158 К, или 158 °С.
Пример 18. Камеру футбольного мяча объемом 3,00 л накачивают с помощью насоса, забирающего из атмосферы 0,150 л воздуха при каждом качании. Атмосферное давление составляет 100 кПа. Определить давление в камере после 30 качаний, если первоначально она была пустой. Температура постоянна.
Решение. За N качаний насос забирает из атмосферы определенное количество воздуха ν. Это же количество воздуха попадает в камеру футбольного мяча.
Указанное количество воздуха имеет следующий объем:
- воздух, забранный из атмосферы за N качаний насоса, —
V
1 = NV
нас,
где V
нас — объем насоса, V
нас = 0,150 л; N — количество качаний;
- воздух, накачанный в камеру футбольного мяча, —
V
2 = V
мяч,
где V
мяч — объем камеры мяча, V
мяч = 3,00 л.
Данное количество воздуха находится при следующем давлении:
- воздух, забранный из атмосферы за N качаний насоса, —
p
1 = 100 кПа
совпадает с атмосферным давлением;
- воздух, накачанный в камеру футбольного мяча, — p
2 (является искомой величиной).
Считая процесс заполнения воздухом камеры мяча изотермическим, запишем уравнение Менделеева — Клапейрона следующим образом:
- для воздуха, забранного из атмосферы за N качаний насоса, —
p
1V
1 = νRT,
где R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К); T — температура газа (не изменяется в ходе процесса);
- для воздуха, накачанного в камеру футбольного мяча, —
p
2V
2 = νRT.
Равенство
p
1V
1 = p
2V
2,
записанное в явном виде
p
1NV
нас = p
2V
мяч,
позволяет получить формулу для вычисления давления в камере футбольного мяча:
p2=p1NVнасVмяч.
Произведем вычисление:
p2=100⋅103⋅30⋅0,15⋅10−33,00⋅10−3=150⋅103 Па=150 кПа.
Источник


