Газ в цилиндрическом сосуде
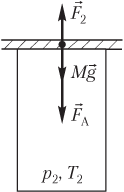
12. МКТ и Термодинамика (изменение физических величин в процессах, установление соответствия)
1. Вспоминай формулы по каждой теме
2. Решай новые задачи каждый день
3. Вдумчиво разбирай решения
В герметичном цилиндрическом сосуде под невесомым и свободно перемещающимся поршнем находится газ. Как изменится его объем (V) и количество вещества (nu), если внутри сосуда начать понижать температуру? Конденсацией пренебречь.
Для каждой величины определите соответствующий характер изменения:
1) увеличилась;
2) уменьшилась;
3) не изменилась.
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
[begin{array}{|c|c|}
hline
text{Объем газа}&text{Количество вещества}\
hline
& \
hline
end{array}]
Количество вещества можно найти по формуле: [nu=dfrac{m}{M}] Т.к. по условию сосуд герметичный, а конденсацией можно пренебречь, масса газа (m) постоянна. Значит, количество вещества также постоянно.
Значит, исследуемый процесс — изобарный.
По закону Гей-Люссака: [dfrac{V}{T}=const~~~Rightarrow~~~Vsim T] Значит, при понижении температуры объем газа также будет уменьшаться.
Ответ: 23
В герметичном цилиндрическом сосуде при постоянной температуре находится газ. Как изменятся количество вещества (nu) и давление газа (p), если объем сосуда (V) начать уменьшать? Конденсацией пренебречь.
Для каждой величины определите соответствующий характер изменения:
1) увеличилась;
2) уменьшилась;
3) не изменилась.
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
[begin{array}{|c|c|}
hline
text{Количество вещества}&text{Давление газа}\
hline
& \
hline
end{array}]
Количество вещества можно найти по формуле: [nu=dfrac{m}{M}] Т.к. по условию сосуд герметичный, а конденсацией можно пренебречь, масса газа (m) постоянна. Значит, количество вещества также постоянно.
Значит, исследуемый процесс — изотермический.
По закону Бойля-Мариотта: [pV=cosnt ~~~Rightarrow~~~ psim dfrac{1}{V}] Значит, если объем (V) уменьшается, то давление (p) будет увеличиваться.
Ответ: 31
В цилиндрическом сосуде под поршнем находится газ. Поршень может перемещаться в сосуде без трения. Газ охлаждают. Как изменится в результате этого давление газа и его объем?
Для каждой величины определите соответствующий характер изменения:
1) увеличилась;
2) уменьшилась;
3) не изменилась.
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
[begin{array}{|c|c|}
hline
text{Давление газа}&text{Объем газа}\
hline
& \
hline
end{array}]
В процессе охлаждения поршень будет перемещаться, но в начальном и конечном состояниях (до и после нагревания) поршень покоится, а значит равнодействующая всех сил, действующих на него, равна 0. Отсюда делаем вывод, что давление до и после нагревания одинаково.
Значит, мы рассматриваем изобарный процесс.
По закону Гей-Люссака: [dfrac{V}{T}=const~~Rightarrow~~Vsim T] Значит, при понижении температуры понижается и объём.
Ответ: 32
Идеальный одноатомный газ постоянной массы переходит из состояния 1 в состояние 2 (см. pT-диаграмму). Как в ходе этого процесса изменятся объём газа и его внутренняя энергия? 
Для каждой величины определите соответствующий характер изменения:
1) увеличилась;
2) уменьшилась;
3) не изменилась.
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
[begin{array}{|c|c|}
hline
text{Объем}&text{Внутренняя энергия}\
text{газа}&text{газа}\
hline
& \
hline
end{array}]
По диаграмме можно определить, что рассматриваемый процесс — изохорный. Значит, объём газа в ходе процесса не изменяется.
Внутреннюю энергию газа можно найти по формуле: [U=dfrac{3}{2}nu RT,] где (nu=const), т.к. масса газа постоянна по условию.
Отсюда (U sim T). По диаграмме находим, что (T) в данном процессе уменьшается, значит и внутренняя энергия газа также уменьшается.
Ответ: 32
На рисунке показан процесс изменения состояния 1 моля одноатомного идеального газа ((U) — внутренняя энергия газа; (V) — занимаемый им объем). Как изменятся в ходе этого процесса давление и абсолютная температура газа? 
Для каждой величины определите соответствующий характер изменения:
1) увеличилась;
2) уменьшилась;
3) не изменилась.
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
[begin{array}{|c|c|}
hline
text{Давление газа}&text{Температура газа}\
hline
& \
hline
end{array}]
Внутреннюю энергию газа можно найти по формуле: [U=dfrac{3}{2}nu RT,] Отсюда (U sim T). По диаграмме находим, что (U) в данном процессе увеличивается, значит и абсолютная температура газа также увеличивается.
Т.к. (U) связано с температурой линейно, то по диаграмме определяем: [dfrac{U}{V}=const~Rightarrow~dfrac{T}{V}=const] Значит рассматриваемый процесс — изобарный. А в изобарном процессе (p=const). Давление в ходе процесса не изменяется.
Ответ: 31
Идеальный одноатомный газ переходит из состояния 1 в состояние 2 (см. диаграмму). Масса газа не изменяется. Как изменяются при этом объём газа и его внутренняя энергия? 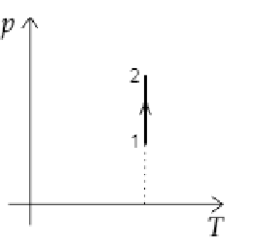
Для каждой величины определите соответствующий характер изменения:
1) увеличилась;
2) уменьшилась;
3) не изменилась.
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
[begin{array}{|c|c|}
hline
text{Объем газа}&text{Внутренняя энергия газа}\
hline
& \
hline
end{array}]
Изменение внутренней энергии газа можно найти по формуле: [Delta U=dfrac{3}{2}nu Delta T,] где (nu=const), т.к. масса газа постоянна по условию.
По диаграмме видно, что температура газа постоянна, т.е. (Delta T=0). Значит внутренняя энергия газа не изменяется.
Т.к. по условию температура и масса газа не изменяются, рассматриваемый процесс является изотермическим.
По закону Бойля-Мариотта: [pV=const~Rightarrow~psimdfrac{1}{V}] По диаграмме определяем, что давление газа увеличивается. Значит, объем газа уменьшается.
Ответ: 23
В цилиндрическом сосуде под массивным поршнем находится газ. Поршень не закреплён и может перемещаться в сосуде без трения (см. рисунок). В сосуд закачивается ещё такое же количество газа при неизменной температуре. Как изменятся в результате этого давление газа и концентрация его молекул? Для каждой величины определите соответствующий характер изменения:
1) увеличится
2) уменьшится
3) не изменится
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.

[begin{array}{|c|c|}
hline
text{Давление газа}&text{Концентрация молекул газа}\
hline
&\
hline
end{array}]
“Демоверсия 2017”
А) Поскольку поршень не закреплён, то давление газа равно сумме атмосферного давления и давления поршня, а значит, оно не зависит от количества вещества газа. Давление газа не изменится.
Б) По условию температура неизменна, значит, из уравнения состояния идеального газа: [p=nkT] концентрация молекул газа тоже не изменится.
Ответ: 33
Источник
5.4. Практическое применение уравнения состояния идеального газа
5.4.3. Уравнение состояния для газа, находящегося в сосуде под поршнем
Для идеального газа, находящегося в сосуде под поршнем, необходимо учитывать следующее:
- масса газа, находящегося в сосуде под поршнем, вследствие изменения термодинамических параметров газа не изменяется:
m = const;
- постоянным остается также количество вещества (газа):
ν = const;
- плотность газа и концентрация его молекул (атомов) изменяются:
ρ ≠ const, n ≠ const.
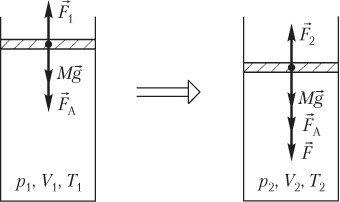
Пусть изменение состояния идеального газа, находящегося в цилиндрическом сосуде под поршнем, вызвано действием на поршень внешней силы F→ (рис. 5.9).
Рис. 5.9
Начальное и конечное состояния газа в сосуде под поршнем описываются следующими уравнениями:
p1V1=νRT1,p2V2=νRT2,}
где p
1, V
1, T
1 — давление, объем и температура газа в начальном состоянии; p
2, V
2, T
2 — давление, объем и температура газа в конечном состоянии; ν — количество вещества (газа); R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К).
Условия равновесия поршня, закрывающего идеальный газ в сосуде (см. рис. 5.9), в начале процесса и в конце процесса выглядят следующим образом:
Mg+FA=F1,Mg+FA+F=F2,}
где M — масса поршня; g — модуль ускорения свободного падения; F
A — модуль силы атмосферного давления, F
A = p
AS; p
A — атмосферное давление; S — площадь сечения поршня; F
1 — модуль силы давления газа на поршень в начале процесса, F
1 = p
1S; p
1 — давление газа в сосуде в начальном состоянии; F — модуль силы, вызывающей сжатие газа; F
2 — модуль силы давления газа на поршень в конце процесса, F
2 = p
2S; p
2 — давление газа в сосуде в конечном состоянии.
Температура идеального газа, находящегося в сосуде под поршнем, может как изменяться, так и оставаться неизменной:
- если процесс движения поршня происходит достаточно быстро, то температура газа изменяется —
T ≠ const;
- если процесс происходит медленно, то температура газа остается постоянной –
T = const.
Давление идеального газа, находящегося в сосуде под поршнем, также может изменяться или оставаться неизменным:
- если в задаче сказано, что поршень является легкоподвижным, то давление газа под поршнем — неизменно (в том случае, когда из условия задачи не следует обратное) — p = const;
- в остальных случаях давление газа под поршнем изменяется — p ≠ const.
Масса поршня, закрывающего газ в сосуде, либо равна нулю, либо имеет отличное от нуля значение:
- если в задаче сказано, что поршень является легким или невесомым, то масса поршня считается равной нулю —
M = 0;
- в остальных случаях поршень обладает определенной ненулевой массой —
M ≠ const.
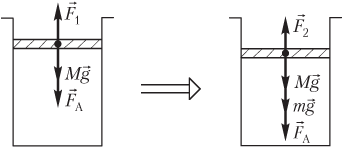
Пример 19. В вертикальном цилиндре под легкоподвижным поршнем сечением 250 мм2 и массой 1,80 кг находится 360 см3 газа. Атмосферное давление равно 100 кПа. На поршень поставили гири, и он сжал газ до объема 240 см3. Температура газа при его сжатии не изменяется. Определить массу гирь.
Решение. На рисунке показаны силы, действующие на поршень:
- сила тяжести поршня Mg→;
- сила атмосферного давления F→A;
- сила давления газа F→1, действующая со стороны газа (до его сжатия);
- сила давления газа F→2, действующая со стороны газа (после его сжатия);
- mg→ — вес гирь.
Условие равновесия поршня запишем в следующем виде:
- до сжатия газа —
F
1 = Mg + F
A,
где F
1 — модуль силы давления газа, F
1 = p
1S; p
1 — давление газа до сжатия; S — площадь поршня; Mg — модуль силы тяжести поршня; M — масса поршня; F
A — модуль силы атмосферного давления, F
A = p
AS; p
A — атмосферное давление; g — модуль ускорения свободного падения;
- после сжатия газа —
F
2 = Mg + F
A
+ mg,
где F
2 — модуль силы давления газа, F
2 = p
2S; p
2 — давление газа после сжатия; mg — вес гирь; m — масса гирь.
Считая процесс сжатия газа изотермическим, запишем уравнение Менделеева — Клапейрона для газа под поршнем следующим образом:
- до его сжатия —
p
1V
1 = νRT,
где V
1 — первоначальный объем газа под поршнем; ν — количество газа под поршнем; R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К); T — температура газа (не изменяется в ходе процесса);
- после его сжатия —
p
2V
2 = νRT,
где V
2 — объем сжатого поршнем газа.
Равенство
p
1V
1 = p
2V
2
и два условия равновесия, записанные в явном виде, образуют полную систему уравнений:
p1S=Mg+pAS,p2S=Mg+pAS+mg,p1V1=p2V2,}
которую требуется решить относительно массы гирь m.
Для этого выразим отношение давлений p
2/p
1 из первой пары уравнений:
p2p1=Mg+pAS+mgMg+pAS
и из третьего уравнения:
p2p1=V1V2,
запишем равенство правых частей полученных отношений:
Mg+pAS+mgMg+pAS=V1V2.
Отсюда следует, что искомая масса определяется формулой
m=(M+pASg)(V1V2−1).
Вычисление дает результат:
m=(1,80+100⋅103⋅250⋅10−610)(360⋅10−6240⋅10−6−1)=2,15 кг.
Указанное сжатие газа вызвано гирями массой 2,15 кг.
Пример 20. Открытый цилиндрический сосуд сечением 10 см2 плотно прикрывают пластиной массой 1,2 кг. Атмосферное давление составляет 100 кПа, а температура окружающего воздуха равна 300 К. На сколько градусов нужно нагреть воздух в сосуде, чтобы он приподнял пластину?
Решение. На рисунке показаны силы, действующие на пластину после нагревания газа:
- сила тяжести пластины Mg→;
- сила атмосферного давления F→A;
- сила давления газа F→2, действующая на пластину со стороны нагретого газа.
Пластина находится в состоянии неустойчивого равновесия; условие равновесия пластины выглядит следующим образом:
F
2 = Mg + F
A,
где F
2 — модуль силы давления нагретого газа, F
2 = p
2S; p
2 — давление нагретого газа; S — площадь сечения сосуда; Mg — модуль силы тяжести пластины; M — масса пластины; g — модуль ускорения свободного падения; F
A — модуль силы атмосферного давления, F
A = p
AS; p
A — атмосферное давление.
Запишем уравнение Менделеева — Клапейрона следующим образом:
- для газа в сосуде до его нагревания
p
1V = νRT
1,
где p
1 — давление газа в сосуде до нагревания (совпадает с атмосферным давлением), p
1 = p
A; V — объем газа в сосуде; ν — количество вещества (газа) в сосуде; R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К); T
1 — температура газа в сосуде до нагревания (совпадает с температурой окружающей среды);
- для газа в сосуде после его нагревания
p
2V = νRT
2,
где p
2 — давление нагретого газа; T
2 — температура нагретого газа.
Два уравнения состояния газа (до и после нагревания) и условие равновесия пластины, записанные в явном виде, образуют полную систему уравнений:
pAV=νRT1,p2V=νRT2,p2S=Mg+pAS;}
систему необходимо решить относительно температуры T
2, до которой следует нагреть газ.
Для этого делением первой пары уравнений
pAVp2V=νRT1νRT2
получим выражение для давления нагретого газа:
p2=pAT2T1
и подставим его в третье уравнение системы:
pAT2ST1=Mg+pAS.
Преобразуем полученное выражение к виду
T2=T1(Mg+pAS)pAS=T1(MgpAS+1),
а затем найдем разность
ΔT=T2−T1=MgT1pAS.
Произведем вычисление:
ΔT=1,2⋅10⋅300100⋅103⋅10⋅10−4=36 К=36 °С.
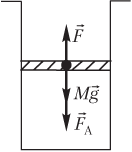
Пример 21. В цилиндрическом сосуде поршень массой 75,0 кг и площадью сечения 50,0 см2 начинает двигаться вверх. Давление газа под поршнем постоянно и равно 450 кПа, атмосферное давление составляет 100 кПа. Считая, что поршень движется без трения, определить модуль скорости поршня после прохождения им 3,75 м пути.
Решение. На рисунке показаны силы, действующие на поршень:
- сила тяжести поршня Mg→;
- сила атмосферного давления F→A;
- сила давления газа F→, действующая на поршень со стороны нагретого газа.
Под действием указанных сил, направленных вверх, поршень движется с ускорением a→:
F→+F→A+Mg→=ma→,
или в проекции на вертикальную ось —
F − F
A − Mg = Ma,
где F — модуль силы давления газа под поршнем, F = pS; p — давление газа; S — площадь поршня; Mg — модуль силы тяжести поршня; M — масса поршня; g — модуль ускорения свободного падения; a — модуль ускорения поршня.
Преобразуем записанное уравнение, выразив модуль ускорения и выполнив подстановку выражений для модулей сил:
a=F−FA−MgM=(p−pA)SM−g.
Скорость поршня, его ускорение и пройденный путь связаны между собой соотношением
l=v22a,
где l — пройденный путь; v — модуль скорости поршня.
Выразим отсюда модуль скорости поршня:
v=2al
и подставим в записанную формулу выражение для модуля ускорения:
v=2l((p−pA)SM−g).
Выполним расчет:
v=2⋅3,75((450−100)⋅103⋅50⋅10−475,0−10)≈10 м/с.
После прохождения 3,75 м пути поршень приобретет скорость, приблизительно равную 10 м/с.
Источник
2017-10-05 ![]()
Расположенный горизонтально цилиндрический сосуд, заполненный идеальным газом, разделен поршнем, который может двигаться без трения. В равновесии поршень находится посредине цилиндра. При малых смещениях из положения равновесия поршень совершает колебания. Найти зависимость частоты этих колебаний от температуры, считая процесс изотермическим.
Решение:
В положении равновесия давление $p$ на поршень слева и справа одинаково. Поскольку объем газа слева и справа одинаков, а температура $T$ постоянна, из уравнения Менделеева — Клапейрона
$pV = nu RT$ (1)
следует, что количество газа $nu$ одинаково по обе стороны от поршня. Отметим, что химический состав газов может быть различным.

рис.1
Пусть поршень сместился из положения равновесия, например влево, на малую величину $x$, так что $Sx ll V$, где $S$ — площадь поршня (рис. 1). Поскольку температура по условию не меняется, то
$(p + Delta p_{1})(V – Sx) = (p – Delta p_{2}) (V + Sx)$.
Раскрыв скобки и приведя подобные члены, получим
$( Delta p_{1} + Delta p_{2}) V – ( Delta p_{1} – Delta p_{2}) Sx = 2pSx$.
Второе слагаемое слева много меньше первого не только потому, что $Sx ll V$, но и вследствие того, что множителем при $V$ стоит сумма двух близких величин $Delta p_{1}$ и $Delta p_{2}$, а множителем при $Sx$ — их разность. Пренебрегая вторым слагаемым, получаем
$Delta p_{1} + Delta p_{2} = frac{2pS}{V} x$.
Результирующая сила, действующая на поршень, равна
$F = – frac{2pS^{2}}{V} x$.
Знак минус означает, что сила направлена в сторону, противоположную направлению смещения поршня, т. е. к положению равновесия. Под действием силы, пропорциональной смещению, поршень массой $M$ будет совершать гармонические колебания с частотой $omega$, определяемой соотношением
$omega^{2} = 2pS^{2}/VM$. (2)
При решении задачи мы молчаливо предполагали, что масса газа много меньше массы поршня, так что кинетической энергией макроскопического движения газа при колебаниях поршня можно пренебречь но сравнению с кинетической энергией поршня. Подумайте, где использовано это условие.
Выразив $p$ из уравнения Менделеева — Клапейрона (1), получим
$omega^{2} = frac{2 nu RS^{2}}{MV^{2}} T$. (3)
Таким образом, частота колебаний поршня пропорциональна $sqrt{T}$, ибо коэффициент при $T$ в формуле (3) не зависит от температуры, если пренебречь тепловым расширением сосуда.
Подумайте теперь, какие условия должны выполняться, чтобы процесс действительно был изотермическим. Для того чтобы температура газа в процессе колебаний не изменялась, необходим хороший тепловой контакт с большим тепловым резервуаром — термостатом, имеющим постоянную температуру. Что значит хороший тепловой контакт? Это значит, что время установления термодинамического равновесия между газом в сосуде и термостатом должно быть много меньше периода колебаний поршня. Тогда можно считать, что газ в каждый момент имеет ту же температуру, что и термостат. Если, наоборот, период колебаний окажется много меньше времени установления термодинамического равновесия между газом и термостатом, то можно считать, что колебания поршня происходят практически без обмена теплотой с термостатом. В этом случае процесс можно считать адиабатическим, несмотря на отсутствие тепловой изоляции сосуда с поршнем. Оказывается, что зависимость частоты колебаний от температуры при этом будет такой же, как и в изотермическом случае, только коэффициент в формуле (3) умножится на число, большее единицы. Увеличение частоты колебаний при адиабатическом процессе можно объяснить, сравнивая $p-V$ – диаграммы изотермического и адиабатического процессов идеального газа.
Отметим, что приведенное решение в обоих случаях имеет смысл, только если время установления теплового равновесия в самом газе много меньше периода колебаний поршня, так как в противном случае вообще теряют смысл такие равновесные макроскопические характеристики газа, как давление и температура. Другими словами, по отношению к самому газу процесс должен быть квазистатическим.
Источник