Гипоксическая вазоконстрикция легочных сосудов
Мы
убедились в том, что в нормальных условиях
сосудистое сопротивление и распределение
легочного кровотока зависят главным
образом от пассивных факторов. Однако
при снижении Ро2 в альвеолярном воздухе
наблюдается очень интересная активная
реакция—сокращение гладких мышц стенок
артериол в гипоксической зоне. Точный
механизм этой реакции неизвестен, но
показано, что она происходит в
изолированных легких, следовательно,
не зависит от центральной нервной
системы. Поскольку даже отдельные
иссеченные сегменты легочной артерии
могут сокращаться при недостатке
кислорода в окружающей их среде, можно
предположить, что гипоксия оказывает
местное действие на сами артерии. Была
высказана гипотеза, согласно которой
в ответ на недостаток кислорода клетки
околососудистых тканей выделяют некие
сосудосуживающие вещества, однако
многочисленные попытки обнаружить
такие вещества оказались безуспешными.
Интересно, что гипоксическая
вазоконстрикция зависит преимущественно
от Ро2
в альвеолярном воздухе, а не в крови
легочных артерий: при перфузии легких
кровью с высоким Ро2
и понижении Рог в альвеолярном воздухе
реакция сохраняется.
Возможно,
гипоксия сосудистой стенки возникает
в результате диффузии кислорода из
нее в альвеолы, которые, как уже говорилось,
очень тесно соприкасаются с мелкими
легочными артериями, т. е. диффузионное
расстояние при этом крайне мало (см.
рис. 4.3). Зависимость стимул—реакция
для гипоксической вазоконстрикции
нелинейна. При изменениях Ро2
в области выше 100 мм рт. ст. сосудистое
сопротивление меняется мало. Если
же Рог в альвеолах падает ниже примерно
70 мм рт. ст.,
сужение сосудов бывает очень заметным,
а при очень низких Ро2
местный кровоток может почти прекращаться.
Благодаря
гипоксической вазоконстрикции уменьшает
кровоснабжение плохо вентилируемых
участков легких, появляющихся, например,
в результате бронхиальной обструкции.
Такое уменьшение улучшает общий
газообмен. На большой высоте может
наступать генерализовапное сужение
легочных сосудов, приводящее к
значительному повышению давления в
легочной артерии и усилению работы
правого сердца. Однако наиболее важна
гипокснческая вазоконстрикция, вероятно,
при рождении. Во время внутриутробного
периода сопротивление легочных
сосудов очень велико и через легкие
протекает лишь около 15 % сердечного
выброса (см. рис. 9.5). Частично это
обусловлено именно гипоксической
вазокон-стрнкцией. Когда после первого
вдоха в альвеолы поступает кислород,
сопротивление легочных сосудов вследствие
расслабления гладких мышц резко
падает и легочный кровоток мгновенно
возрастает.
Обнаружены
и другие активные реакции легочных
сосудов. Так, они суживаются при
низком рН крови—особенно в условиях
альвеолярной гипоксии. Существуют также
данные о слабом влиянии на эти сосуды
вегетативной нервной системы:
возбуждение симпатических нервоз
приводит к повышению тонуса стенок
легочных артерий н вазоконстрикции.
Водный обмен в легких
Альвеолярный
воздух отделен от крови легочных
капилляров слоем ткани толщиной лишь
около 0,5 мкм (рис. 1.1). В связи с этим
чрезвычайно важно предохранить альвеолы
от переполнения жидкостью. Согласно
принятым представлениям, обмен
жидкостей через капитярпую стенку
описывается законом Старлинга. Сила.
под действием которой жидкость стремится
выйти из капилляра, равна разности
гидростатических давлений в нем и
интерстициальной жидкости
(Рс—Pi).
Сила же, под действием которой жидкость
стремится войти в капилляр, соответствует
разности коллоидно-осмотических 1)
давлений белков в плазме крови и
интерстициальной жидкости (лс—лi).
Последняя сила зависит также от
коэффициента отражения (сигма),
показывающего, насколько эффективно
стенка капилляров препятствует
прохождению белков. Следовательно,
результирующий поток жидкости
составит:
К[(Рс-Р)
–
a
(Лc-Лi)],
где
К—константа, называемая коэффициентом
фильтрации.
К
сожалению, на практике использование
этого уравнения ограниченно, так как
нам неизвестны многие входящие в него
величины. Онкотическое давление в
капиллярах составляет около
28 мм
рт. ст. Гидростатическое давление в них,
по-видимому, примерно соответствует
средней величине между давлениями в
легочных артериях и венах, однако у
оснований легких оно значительно выше,
чем у верхушек. Онкотическое давление
интерстициальной жидкости неизвестно.
В лимфе, оттекающей от легких, оно
составляет около 20 мм рт. ст., однако в
тканях, окружающих капилляры, может
быть и меньше. Интерстициальное
гидростатическое давление также
неизвестно, хотя некоторые физиологи
полагают, что оно существенно ниже
атмосферного. Возможно, результирующее
давление в уравнении Старлинга направлено
наружу, что приводит к медленному оттоку
лимфы (у человека в нормальных условиях
его расход, по-видимому, составляет 20
мл/ч).
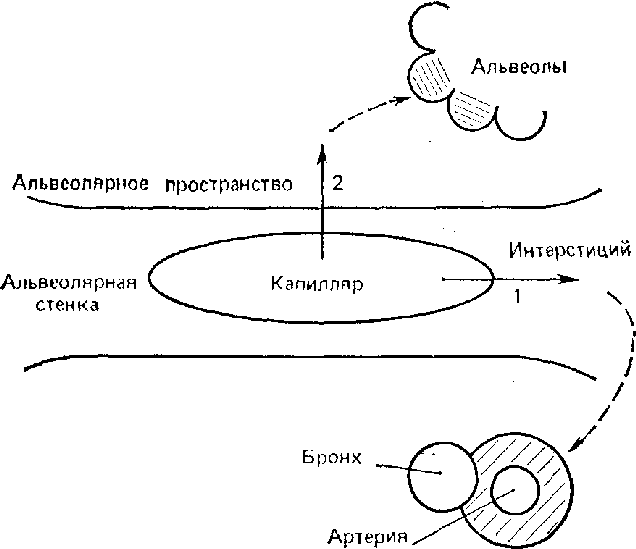
Какова
же судьба вышедшей из капилляров
жидкости? Из рис. 4.11 видно, что, поступив
в интерстиций альвеолярной стенки, она
оттекает по нему к периваскулярным и
перибронхиальным пространствам. Здесь
проходят многочисленные лимфатические
сосуды, по которым жидкость направляется
к лимфатическим узлам ворот легких.
Кроме того, благодаря низкому давлению
в периваскулярных пространствах
возникает как бы естественная
дренажная система для ее оттока (см. для
сравнения рис. 4.2). На ранних стадиях
отека легких2)
переполняются именно перибронхиальные
и периваскулярные пространства (так
называемый интерстициальный отек).
1)
В отечественной литературе чаще
употребляется термин “онкотическое
давление”, который мы и будем использовать
в дальнейшем, — Прим.
перев.
2)
Более подробно отек легких разбирается
в книге
J.
В.
West, Pulmonary Pathophysiology
—
The Essentials, ed.
2,
Baltimore. Williams and Wilkins.
1982.

‘
Околососудистое пространство
Рис.
4.11.
Два возможных пути потери жидкости из
легочных капилляров Прежде всего
она поступает в интерстицпальное
пространство (1), затем — в периваскулярное
и перибронхиальное пространства. Если
же этого пути оттока недостаточно,
жидкость может проходить в альвеолы
через их стенки (2)
На более
поздних стадиях отека легких жидкость
выходит через альвеолярный эпителий в
альвеолы (рис. 4.11), последовательно
заполняя их. Вентиляция в таких альвеолах
прекращается, и проходящая через них
кровь не оксигенируется. Причины
проникновения жидкости в альвеолярные
пространства неясны. Возможно, это
происходит, когда ее поступление в
интерстиций превышает максимально
возможную скорость оттока из него и
давление здесь резко повышается. В норме
лимфоотток от легких составляет всего
несколько миллилитров в час, однако
при длительном повышении давления в
легочных капиллярах он значительно
увеличивается. Альвеолярный отек
значительно опаснее, чем интерстициальный,
поскольку при этом страдает газообмен
в легких.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Гипоксическая вазоконстрикция легких ( ВПЧ ), также известная как механизм Эйлера-Лильестранда , представляет собой физиологическое явление, при котором сужаются мелкие легочные артерии в присутствии альвеолярной гипоксии (низкий уровень кислорода). Перенаправляя кровоток из плохо вентилируемых областей легких в хорошо вентилируемые области легких, считается, что ВПЧ является основным механизмом, лежащим в основе согласования вентиляции / перфузии . Поначалу процесс может показаться нелогичным, поскольку низкий уровень кислорода теоретически может стимулировать усиленный приток крови к легким для увеличения газообмена. Однако цель ВПЧ – распределить кровоток по регионам, чтобы повысить общую эффективность газообмена между воздухом и кровью. В то время как поддержание соотношения вентиляция / перфузия во время региональной обструкции воздушного потока является полезным, ВПЧ может быть вредным во время глобальной альвеолярной гипоксии, которая возникает при воздействии на большую высоту , когда ВПЧ вызывает значительное увеличение общего сопротивления легочных сосудов и давления в легочной артерии, потенциально. приводит к легочной гипертензии и отеку легких . Несколько факторов подавляют ВПЧ, включая повышенный сердечный выброс, гипокапнию , гипотермию , ацидоз / алкалоз , повышенное сопротивление легочных сосудов, ингаляционные анестетики , блокаторы кальциевых каналов, положительное давление в конце выдоха (ПДКВ), высокочастотная вентиляция (ВЧВ), изопротеренол , оксид азота. , и сосудорасширяющие средства .
Молекулярный механизм
Классическое объяснение ВПЧ заключается в подавлении чувствительных к гипоксии потенциалзависимых калиевых каналов в гладкомышечных клетках легочной артерии, что приводит к деполяризации. Эта деполяризация активирует зависимые от напряжения кальциевые каналы , что увеличивает внутриклеточный кальций и активирует сократительный механизм гладких мышц, что, в свою очередь, вызывает сужение сосудов. Однако более поздние исследования сообщили о дополнительных ионных каналах и механизмах, которые вносят вклад в ВПЧ, таких как канонические каналы с временным рецепторным потенциалом 6 (TRPC6) и каналы с временным рецепторным потенциалом ваниллоидных 4 (TRPV4). Недавно было предложено, что гипоксия ощущается на альвеолярном / капиллярном уровне, генерируя электрический сигнал, который передается в легочные артериолы через щелевые соединения в легочном эндотелии, вызывая ВПЧ. Это контрастирует с классическим объяснением ВПЧ, которое предполагает, что гипоксия ощущается в самой гладкой мышечной клетке легочной артерии.
Высокогорный отек легких
Высокогорный альпинизм может вызвать легочную гипоксию из-за пониженного атмосферного давления. Эта гипоксия вызывает сужение сосудов, что в конечном итоге приводит к высокогорному отеку легких (HAPE). По этой причине некоторые альпинисты берут с собой дополнительный кислород, чтобы предотвратить гипоксию, отек и HAPE. Стандартное медикаментозное лечение дексаметазоном не изменяет гипоксию или связанное с этим сужение сосудов, но стимулирует реабсорбцию жидкости в легких, чтобы обратить вспять отек. Кроме того, несколько исследований коренного населения, остающегося на больших высотах, продемонстрировали в различной степени притупление реакции на ВПЧ.
Ссылки
- Фон Эйлер США, Лильестранд Г. (1946). «Наблюдения за артериальным давлением в легочной артерии у кошек». Acta Physiol. Сканд . 12 (4): 301–320. DOI : 10.1111 / j.1748-1716.1946.tb00389.x .
- Völkel N, Duschek W, Kaukel E, Beier W, Siemssen S, Sill V (1975). «Гистамин – важный медиатор механизма Эйлера-Лильестранда?». Пневмонология. Пневмонология . 152 (1–3): 113–21. DOI : 10.1007 / BF02101579 . PMID 171630 . S2CID 27167180 .
- Порселли Р.Дж., Виау А., Демени М., Нафтчи Н.Е., Бергофски Э.Х. (1977). «Связь между гипоксической вазоконстрикцией легких, ее гуморальными медиаторами и альфа-бета-адренорецепторами». Сундук . 71 (2 доп.): 249–251. DOI : 10.1378 / chest.71.2_Supplement.249 . PMID 12924 .
внешние ссылки
- Американское торакальное общество
- Американский журнал физиологии, клеточной и молекулярной физиологии легких
Источник
Этот компенсаторный механизм действует при недостаточной вентиляции альвеол, т.е. тогда, когда VАуменьшается. Он направлен на поддержание отношения VА /Q ≈ 1,0 за счёт адекватного уменьшения Q.
Механизм:
Уменьшение VА
↓
Снижение оксигенации
крови лёгочных капилляров
↓
Гипоксемия до 60-70 мм. рт. ст.
↓
Повышение тонуса гладких мышц лёгочных капилляров за счёт:
а) увеличения проницаемости мембран для Са++;
б) изменения баланса вазоактивных медиаторов (оксид азота и эндотелин), которые выделяются клетками эндотелия;
↓
Спазм лёгочных капилляров
↓
Снижение Q
↓
VА /Q ≈ 1,0
Этот феномен называют рефлекс Эйлера-Лильестралдта (1946).
Этот защитный рефлекс может быть нарушен при в следующих ситуациях:
– лёгочной патология;
– высоком «+» давлении в ВДП;
– артериальной лёгочной гипертензии;
– применении нитратов;
– применении симпатомиметиков.
3. Гипокапническая бронхоконстрикция.Направлен на поддержание VА /Q ≈ 1,0 при уменьшении Q.
Включается при уменьшении перфузии альвеол в условиях закупорки лёгочных сосудов. Механизм (на примере ТЭЛА):
ТЭЛА
↓
Альвеолы не перфузируются
↓
Уменьшение Q
↓
VА /Q увеличивается за счёт снижения Q.
↓
В капилляры малого круга не притекает венозная кровь
↓
Локальная гипокапния в капиллярах малого круга
↓
Рефлекторная бронхоконстрикция
(сужение дыхательных путей)
↓
Уменьшение VА
↓
VА / Q ≈ 1,0
↓
Итак: Уменьшение Q сопровождается немедленным снижением VА , следовательно VА /Q ≈ 1,0.
Этот рефлекс легко подавляется при увеличении дыхательного объёма.
Вывод. В норме VА /Q ≈ 1,0. Этот баланс поддерживается тремя защитными механизмами. При срыве этих механизмов VА / Q ≠ 1,0 и развивается ДН I типа.
Нарушения VА / Q могут быть двух типов:
1. Преобладание вентиляции и недостаток перфузии, как следствие VА > Q, значит VА /Q > 1,0
2. Недостаток вентиляции и преобладание перфузии, как следствие VА < Q, значит VА /Q < 1,0.
Преобладание вентиляции и недостаток перфузии.В норме воздух, выдыхаемый за 1 вдох расходуется на: 1) вентиляцию мёртвого пространства; 2) эффективную вентиляцию альвеол.
Мёртвое пространство включает в себя:
= ВДП (анатомическое мёртвое пространство);
= альвеолы, которые вентилируются, но не перфузируются кровью (физиологическое мёртвое пространство).
Итак, суммарное мёртвое пространство складывается из анатомического и физиологического.
Для эффективной вентиляции лёгких важен не столько объём мёртвого пространства VД , сколько его отношение к дыхательному объёму лёгких Vt (VД / Vt)
VД / Vt ≤ 0,3 в норме
Другими словами, в норме VД должно быть ≤ 30 %, а 70 % идёт на эффективную вентиляцию.
Т.о. эффективная вентиляция = 70 %
не эффективная вентиляция = 30 %
Если альвеолы вентилируются при недостатке перфузии (VА > Q), то этот воздух идёт на увеличение физиологического мёртвого пространства (VД ). Доля эффективной вентиляции уменьшается.
Для поддержания эффективной вентиляции приходится увеличить работу дыхания за счёт: а) возрастания ДО
б) увеличения ЧД (f)
Это и есть компенсация, и она довольно долго может поддерживать газовый состав крови, уберегая его от гипоксемии.
Итак: вентиляция увеличенного мёртвого пространства непосредственно не влияет на оксигенацию крови, но значительно увеличивает работу дыхания.
Пример: эмфизема лёгких.
При эмфиземе наблюдается:
Деструкция межальвеолярных перегородок + редукция капиллярного русла. Значит: а) перфузия уменьшается; б) вентиляция сохранена.
↓
↑VД и ↑ неэффективная вентиляция,
но гипоксемии нет, за счёт ↑ДО и/или ↑ЧД
↓
«розовые пыхтельщики:
пыхтящее дыхание через полусомкнутые губы
+ истощение
(результаты увеличенной работы дыхательных мышц)
Недостаток вентиляции и преобладание перфузии →
VА < Q → VА /Q < 1,0
Кровь притекает в эту зону, но оттекает не оксигенированной (увеличивается фракция венозного примешивания). Развивается гипоксемия.
Компенсаторные механизмы те же: а) увеличение ДО;
б) увеличение ЧД (f).
НО! Они приводят только к увеличению выделения СО2 и не корректируют гипоксемию.
Итак: артериальная гипоксемия возникает при недостаточной вентиляции перфузируемых альвеол.
При этом, выраженность гипоксемии определяется величиной пострадавших участков.
Пример 1: обструктивный бронхит:
В лёгких есть участки с низкой вентиляцией и в них VА < Q
↓
VА /Q < 1,0
↓
Гипоксемия
↓
Рефлекс Эйлера-Лильестрандта
↓
↑ давления в малом круге
↓
Развитие правожелудочковой недостаточности
↓
Цианоз + отёки
↓
«Синюшные отёчники»
Пример 2: ТЭЛА
Тромбоэмболия лёгочной артериии
↓
Перераспределение крови в неэмболизированные участки лёгких
↓
Чрезмерная перфузия нормально вентилируемых альвеол
↓
VА < Q → VА /Q < 1,0
↓
Гипоксемия
↓
Рефлекс Эйлера – Лильестрандта
↓
Лёгочная гипертензия + правожелудочковая недостаточность
↓
«Синюшные отёчники»
Шунтирование крови. Шунт крови справа налево – это прямой сброс венозной крови в артериальное русло.
Варианты шунта справа налево:
1) бедная кислородом кровь полностью минует лёгочное русло (анатомический шунт);
2) кровь проходит в сосуды того участка, где отсутствует газообмен (альвеолярный шунт).
Патогенетичечсая значимость:
1) это крайний вариант нарушения VА /Q ;
2) ведёт к артериальной гипоксемии.
Анатомический шунтможет быть в норме, но он не превышает 10% от среднего выброса, следовательно даже в норме 10% крови от УО возвращается в левые отделы сердца неоксигенированной.
Увеличение анатомического шунта может быть при:
1) врождённых порокахсердца со сбросом крови справа налево;
2) ТЭЛА: в норме ≈ у 25 % людей овальное отверстие закрыто только функционально, но не анатомически. Причина: при нормальном внутрилёгочном давлении нет градиента право-левопредсердного давления и следовательно овальное окно, хотя и открыто анатомически, но не функционирует. При ТЭЛА повышено давления в малом круге и правом желудочке. Следовательно возможен сброс крови через овальное отверстие из правого предсердия в левое предсердие.
3. портопульмональном шунтировании: из V. porta в V. cava по порто-кавальным анастомозам сначала в малый, затем в большой круг, минуя печень, идёт необезвреженная кровь. Причина: портальная гипертензия различного происхождения.
Источник
Хотя легочную вазоконстрикцию вызывает множество факторов, гипоксия является наиболее сильным. Гипоксическая легочная вазоконстрикция (ГЛ В) как реакция на альвеолярную гипоксию приводит к заметному сужению прилегающих к альвеолам прекапиллярных мышечных легочных артерий и артериол. В случае локальной альвеолярной гипоксии (как при пневмонии или региональном ателектазе) легочная вазоконстрикция тоже локализуется, отводя кровоток от гигюксических областей и уменьшая степень вентиляционно-перфузионного несоответствия (гл. 13). Однако при диффузном характере альвеолярной гипоксии возникающая легочная вазоконстрикция воздействует на легкое в целом. У плода диффузная ГЛ В увеличивает PVR и соответственно возрастает часть плацентарного кровотока, шунтируемого через овальное отверстие. У взрослых увеличенное легочное сосудистое сопротивление, наблюдаемое на больших высотах, есть следствие гипоксической легочной вазоконстрикции. При хронической обструктивной болезни легких гипок-сическая легочная вазоконстрккция является компонентом повышения сосудистого сопротивления легких.
Патогенез легочной гипертензии
В развитии легочной гипертензии может участвовать ряд факторов, таких как: изменение давления наполнения левого сердца, сердечный выброс, частота сердечных сокращений, гематокрит и объем крови в легких. Однако наиболее важным патофизиологическим фактором является повышение легочного сосудистого сопротивления, локализованное, главным образом, в прекапиллярных артериях и ар-териолах. Гипертензия может быть вызвана как сужением или окклюзией микро-циркуляторного ложа (анатомическая основа), так и вазоконстрикцией; но чаще
действуют оба механизма.
Когда, независимо от этиологии, резервы сосудистого русла сокращаются в результате снижения его протяженности или растяжимости, увеличение сердечного
-ч———-…г,,, с* roirmiM^iu ипрмрни все меньший при-
ления. Целый ряд физиологических параметров оказывают влияние на давление в легочной артерии.
Напряжение кислорода и двуокиси углерода
Наиболее сильным стимулом легочной вазоконстрикции является альвеолярная гипоксия, которая действует на прилегающие к альвеолам мелкие легочные артерии и артериолы. Медиаторы, вовлеченные в гипоксическую легочную вазоконстрикцию,.пока не идентифицированы. Системная артериальная гипоксемия углубляет локальные воздействия альвеолярной гипоксии косвенно, через симпатические нервные рефлексы. При хронической гипоксемии воздействия стимулов легочной вазоконстрикции часто усиливаются повышенной вязкостью крови вследствие вторичной полицитемии. Эпизодические обострения гипоксемии приводят к постепенной перестройке легочных сосудов, поддерживая легочную гипертензию, даже если ранние эпизоды являлись полностью обратимыми.
В отличие от гипоксемии, гиперкапния, по-видимому, способствует легочной гипертензии, вызывая ацидемию, а напрямую вазоконстрикцию. Задержка двуокиси углерода может быть самоподдерживающейся; гиперкапния снижает чувствительность дыхательного центра к СО2 (гл. 16) и способствует задержке бикарбоната почками (гл. 10). Накопление СО2, возникающее вследствие расстройства функции легких как вентиляторного насоса и для компенсации метаболического алкалоза, приводит к ослаблению вентиляции, углублению гиперкапнии, гипоксии и легочной вазоконстрикции.
Кислотно-основное состояние
Значительная ацидемия (рН крови < 7.2) вызывает легочную вазоконстрикцию. У человека ацидемия действует синергически с гипоксией. Значительная алка-лемия (рН крови > 7.5) уменьшает сужение сосудов в ответ на гипоксию. Биологическая основа этих реакций и участвующие в них медиаторы не установлены.
Дата: 2019-03-05, просмотров: 62.
Источник
