Гликозаминогликаны значение в стенке сосудов
ГЛИКОЗАМИНОГЛИКАНЫ (мукополисахариды) – представляют собой гетерополисахариды натурального происхождения.
Находятся:
- в пространстве между клеток органов и тканей;
- в синовиальной жидкости;
- в кожных покровах;
- в хрящах,
- в связках,
- базальных мембранах.
В сочетании с коллагеновыми волокнами и эластином они создают прочную основу под названием матрикс.
Гликозаминогликаны сформированы из дисахаридных единиц, которые повторяются. В каждом из них, кроме гиалуроновой кислоты, есть остаток моносахаридов ГЛЮКОЗАМИНА либо галактозамина, с обязательным наличием S-мостиков (СЕРЫ).
Функции гликозаминогликанов:
Гликозаминогликаны обладают свойством связывать молекулы воды в большом количестве, благодаря чему межклеточное вещество принимает желеобразную консистенцию.
Известны шесть главных видов этих веществ, которые находятся в разных тканях и решают конкретные задачи.
Классификация гликозаминогликанов:
- Гиалуроновая кислота;
- Кератансульфаты;
- Гепарин;
- Хондроитин сульфаты;
- Дерматансульфат;
- Гепарансульфат.
ГИАЛУРОНОВАЯ КИСЛОТА может встретиться в разных тканях и органах, где она выполняет функцию смазочного вещества.
В суставах, например, снижает трение между поверхностями суставов, обеспечивает скольжение.
Гиалуроновая кислота является главным компонентом синовиальной жидкости, отвечающим за её вязкость. Наряду с лубрицином, гиалуроновая кислота – основной компонент биологической смазки.
Гиалуроновая кислота – важный компонент суставного хряща, в котором присутствует в виде оболочки каждой клетки (хондроцита). При связывании гиалуроновой кислоты с мономерами аггрекана в присутствии связующего белка, в хряще формируются крупные отрицательно заряженные агрегаты, поглощающие воду.
Эти агрегаты отвечают за упругость хряща (устойчивость его к компрессии). Молекулярная масса (длина цепи) гиалуроновой кислоты в хряще уменьшается с возрастом организма, при этом общее её содержание увеличивается.
Также гиалуроновая кислота входит в состав кожи, где участвует в регенерации ткани.
При чрезмерном воздействии на кожу ультрафиолета происходит её воспаление, в клетках дермы прекращается синтез гиалуроновой кислоты и увеличивается скорость её распада…
В состав гиалуроновой кислоты входят глюкозамин и глюкуроновая кислота.
В процессе биосинтеза гликозаминогликанов принимает участие большое количество различных ферментов, в том числе трансфераз.
Кератансульфаты обнаруживаются в межпозвоночном диске, хрящах и костной ткани.
Вещество под названием ГЕПАРИН является основным компонентом крови, который отвечает за ее свертываемость. Производится гепарин тучными клетками и содержится внутри них в специальных гранулах. Больше всего этого полисахарида находится в кожных покровах, легких и в печени.
ХОНДРОИТИН СУЛЬФАТ относится к САМЫМ РАСПРОСТРАНЁННЫМ гликозаминогликанам, которые обнаруживаются в связках, сухожилиях, составных поверхностях и артериях. Это очень важный составляющий компонент хряща.
Дерматансульфат встречается в большом количестве в межклеточном веществе хрящевой ткани.
Гепарансульфат находится в составе протеогликанов базальных мембран и считается постоянным веществом клеточной поверхности.
Т.е., исходя из полисахаридной структуры гликозаминогликанов можно с уверенностью говорить, что препараты, содержащие Глюкозамин, гиалуроновую кислоту и Хондроитин СУЛЬФАТ являются, однозначно эффективными в лечении заболеваний суставов, связок, межпозвоночных дисков, варикозном расширении вен, укреплении тургора и эластичности кожи. Они отлично подходят для использования организмом. При здоровом кишечнике и активной работе ферментных систем легко встраиваются в создаваемый матрикс.
Остаются ещё вопросы к производителям по качеству и биодоступности…
Это глобальное отличие от препаратов «готового»коллагена. Это не белок!
Только, необходимо помнить об остальных компонентах, в 100% случаев участвующих в образовании и созревании здорового коллагена, гладких суставных поверхностей, крепких и эластичных связок, здоровых стенок артерий и вен, синовиальной «смазки», гибкого позвоночника и «молодого» клапанного аппарата сердца:
- Кислород
- Сера
- Медь
- Железо
- Полноценный, с биофлавоноидами, витамин С
- Правильные жиры
- АТФ
- нормальный уровень инсулина и гормонов щитовидной железы
- и т.д. – Метаболическая «фабрика».
Есть над чем работать.
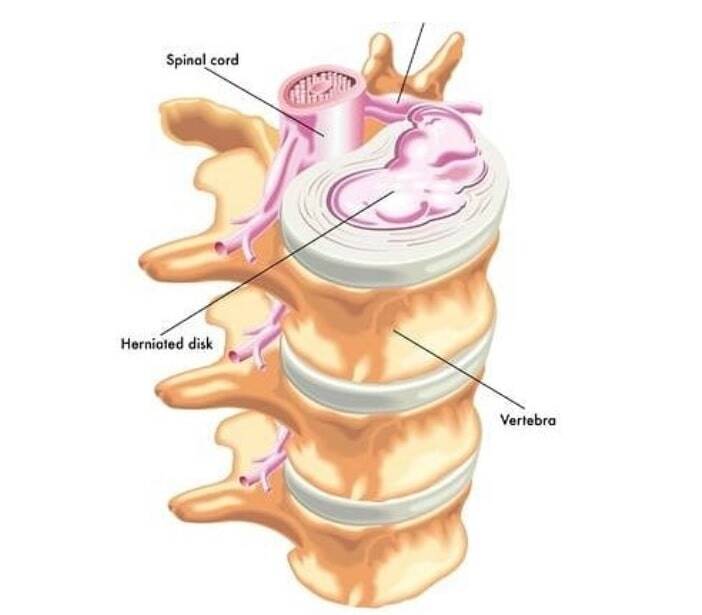
Межпозвоночные диски – амортизирующая функция, обеспечивают гибкость и подвижность позвоночника в целом.
Большая часть болей в спине обусловлена изменениями в самих межпозвоночных дисках. Таких как, остеохондроз, грыжи дисков (пролабирование, протрузия, экструзия). Либо изменениями других структур, вызванное изменением в строении и нарушением функции дисков («высыхание», снижение высоты).
Между позвонками находится 24 диска. Их нет между затылочной костью и первым позвонком, между первым и вторым позвонком, в крестце.
Диск анатомически делится на три составляющих:
1. Внутренняя – пульпозное ядро. Гелеобразная масса, очень богатая водой.
2. Наружная часть, фиброзное кольцо, состоящее из плотных, переплетённых между собой соединительнотканных волокон. Волокна идут в разных направлениях, что позволяет выдерживать огромные нагрузки при сгибании и скручивании.
3. Тонкий слой гиалинового хряща, который отделяет диск от тела позвонка. Играет важную роль в питании диска.
Состав всех частей диска: больше всего воды, затем коллаген и протеогликаны (белковое ядро и гликозаминогликаны). Отличается только % соотношение.
Протеогликаны.
Протеогликаны как и гликозаминогликаны являются компонентом межклеточного матрикса, играют значительную роль в создании каркаса и поддерживании всех внутренних органов и систем. Эти вещества представляют собой высокомолекулярные белковые образования – структурный комплекс из гликозаминогликанов с белком.
Для здоровой функции дисков необходимо понимать, что:
- чем больше у нас гликозаминогликанов, тем большее сродство к воде в нашем матриксе. Тем более упругими будут диски.
- Водный режим!!! Отдельно об этом будем писать. И о воде в целом.
- Коллаген – как обязательная составляющая дисков. Ежедневно необходимо создавать условия для его синтеза – реабилитация и поддержание порядка в ЖКТ, восполнение дефицита нутриентов (см. коллаген).
- Здоровье хряща. Улучшение микроциркуляции и питания хряща, «наводнение» его, забота о матриксе.
- Упражнения на гибкость и растягивание. Укрепление мышечного каркаса.
Здоровый позвоночник – это залог нашей молодости. Стоит в питании и поддержании его здоровья разобраться. Каждому!
Из лекции врача-нутрициолога Аркадия Бибикова.
Источник
Гликозаминогликаны (ГАГ), являясь обязательными компонентами межклеточного матрикса, участвуют в межклеточных взаимодействиях, формировании и поддержании формы клеток и тканей, образовании каркаса при их формировании. Если говорить о химической структуре, то ГАГ – это углеводная часть углеводсодержащих биополимеров гликозаминопротеогликанов или протеогликанов (Г.Я. Видершайн, 1980; В.В. Серов, А.Б. Шехтер, 1981). ГАГ (сульфатированные и несульфатированные фракции) входят в состав межклеточного вещества соединительной ткани, содержатся в костях, синовиальной жидкости, стекловидном теле и роговице глаза.
Молекулы ГАГ состоят из повторяющихся звеньев, которые построены из остатков уроновых кислот (D-глюкуроновой или L-идуроновой) и сульфатированных и ацетилированных аминосахаров. Кроме указанных основных моносахаридных компонентов, в составе ГАГ в качестве так называемых минорных сахаров встречаются L-фукоза, сиаловые кислоты, D-манноза и D-ксилоза. Практически все ГАГ ковалентно связаны с белком в молекуле гликозаминопротеогликанов (протеогликанов) (А. Пири, Р. Гейнинген, 1968; T.D. Fitzsimmons, 1994; K.L. Goa, 1994).
ГАГ подразделяют на семь основных типов. Шесть из них – гиалуроновые кислоты, хондроитин-4-сульфат, хондроитин-6-сульфат, дерматансульфат, гепарин и гепарансульфат – структурно сходны. В их полисахаридных цепях чередуются дисахаридные звенья, состоящие из остатков сульфатированных аминосахаров (N-ацетилглюкозамина и М-ацетилгалактозамина) и гексуроновых кислот (D-глюкуроновой или L-идуроновой). В гликозаминогликанах седьмого типа – кератансульфате, или кератосульфате, в дисахаридных звеньях вместо уроновых кислот находится D-галактоза (Г.Я. Видершайн, 1980).
Гиалуроновая кислота (ГК) – несульфатированный гликозаминогликан, неразветвленный полисахарид, состоящий из дисахаридных единиц, образованных N-ацетил-D-глюкозамином и D-глюкуроновой кислотой, соединенных между собой b-1,3- и b-1,4-гликозидными связями (Е.Н. Матчин, В.Л. Потапов, 1998). В организме человека гиалуроновая кислота встречается в соединительных тканях в виде натриевой соли (гиалуроната натрия), являясь одним из основных компонентов экстрацеллюлярного матрикса (ЭЦМ), в том числе стекловидного тела глаза и синовиальной жидкости (табл. 2).
За период, прошедший со времени открытия ГК, произошел переход от первоначальной точки зрения, согласно которой ГК является пассивным структурным компонентом ЭЦМ, обеспечивающим в частности непроницаемость кожных покровов для микробов и токсинов, к признанию того, что эта широко распространенная макромолекула динамически включается во многие биологические процессы: от модуляции клеточной миграции и дифференцировки в течение эмбриогенеза до регуляции процессов организации и метаболизма ЭЦМ и важной роли в процессах заживления ран, воспаления и метастазирования (Е.Н. Матчин, В.Л. Потапов, 1998; K.L. Goa, 1994).
Имеются убедительные экспериментально-гистологические данные (Б.А. Стадников, 2005) о том, что при использовании ГК или куриозина отмечаются лучшая сохранность базальных мемран (lamina rara), а также выраженная дегидратация в области воспаления (в частности, в зоне панкреонекроза). С другой стороны, отмечены более раннее и эффективное отграничесние зон некроза, а также мобилизация клеток фибробластического ряда.
В патогенезе ожоговой травмы органа зрения существенная роль принадлежит дестабилизации гликозаминогликанового статуса оптических сред глаза и сыворотки крови, которая выражается в изменении их фракционного состава (А.Р. Шамратова, 2002). При щелочном ожоге роговицы наблюдается активация реакций глюкуронидной конъюгации в тканях органа зрения, выраженная в наибольшей степени в переднем отрезке глаза (S. Miyaushi, 1996).
Мы еще раз подчеркиваем, что ГАГ участвуют в воспалительных реакциях и репаративных процессах, выполняют трофическую и антитоксическую функции (Е.Н. Матчин с соавт., 2001; А.Р. Шамратова, 2002; М.Б. Эгембердиев, 2005).
В настоящее время препараты на основе сульфатированных ГАГ используются в офтальмологии (М.Т. Азнабаев с соавт., 1996, 1997; С.Н. Багров, Т.И. Ронкина, 1999). Терапевтический эффект этих препаратов связывают с наличием кератан-сульфата, специфического для роговицы, определяющего ее прозрачность (С.Н. Багров, Т.Н. Ронкина, 1977, 1999).
Известно, что ГАГ и глюкуронидные конъюгаты синтезируются из общего предшественника – УДФ-глюкуроновой кислоты (УДФ-ГлК), в связи с чем введение экзогенных ГАГ по механизму обратной связи снижает долю УДФ-ГлК, расходуемую в реакциях глюкуронидной конъюгации и увеличивает возможность ее использования на синтез ГАГ (А.Н. Зимницкий, 2004). При этом показано, что введенные экзогенные ГАГ, постепенно поступая в клетку путем рецепторного эндоцитоза и деполимеризуясь в лизосомах, вступают на метаболический путь уроновой кислоты в глюкуронатксилулезном цикле и в виде ксилулезы поступают в гексозомонофосфатный шунт с образованием рибозо-5-фосфата, используемого для синтеза важнейших для процессов репаративной регенерации биологически активных молекул (ДНК, РНК, НАД, ФАД, коэнзим-А) [А. Пири, Р. Гейнинген, 1968; K.L. Goa, 1994].
Использование для стимуляции глюкуронидной конъюгации именно гиалуроновой кислоты, а не сульфатированных ГАГ, предположительно энергетически более выгодно из-за отсутствия необходимости десульфатирования их молекул клетками. Есть данные о том, что препараты гиалуроновой кислоты стимулируют репаративную регенерацию тканей глаза: а) приводят к увеличению общего содержания гликозаминогликанов в оптических средах глаза и сыворотке крови после щелочного ожога роговицы, а также восстанавлению фракционного состава гликозаминогликанов; б) препараты гиалуроновой кислоты оказывают мембраностабилизирующее и противовоспалительное действие. Так коррекция ожогового процесса препаратом гиалуроновой кислоты приводит к интенсификации реакций глюкуронидной конъюгации в оптических средах глаза (А.Р. Шамратова, 2002).
Процесс фибриллогенеза в организме включает в себя сложный комплекс взаимодействия коллагена с ГАГ, их протеогликанами и гликопротеинами. Хорошо известны факты опережающего накопления ГАГ (сначала ГК, затем сульфатированных), а также гликопротеинов там, где идет активный фибриллогенез: в эмбриональных тканях, при заживлении ран, фиброзирующих процессах (Л.Б. Шехтер, Г.Н. Берченко 1978).
В научно-производственной лаборатории клеточных технологий Оренбургского государственного университета разработан оригинальный наноструктурированный биопластический материал (С.Н. Летута с соавт., 2011). Он представляет собой эластично-упругую пленку белого или желтоватого цвета толщиной 0,3-0,5 мм, длиной 150 мм и шириной 100 мм, и при смачивании способен прилипать к подлежащей поверхности не требует фиксирующих повязок.
Данный биопластический материал был получен из исходного гидрогеля ГК, который подвергали воздействию ультрафиолетового облучения ( λmax=230 нм), в результате чего происходила фотохимическая сшивка макромолекул. Использование данного метода придает биоматериалу оптимальные биоинженерные свойства: эластичность, адгезию, дренажные качества и значительно улучшает биосовместимость за счет метаболизации материала в ране. Преимущества фотохимической сшивки в том, что для приготовления полимера не применялись химические реагенты и благодаря этому в биоматериале отсутствовали химические примеси, что позволило избежать аллергических реакций при его применении.
Этот биоматериал был, прежде всего, предназначен для восстановления дефектов кожных покровов и разрешен Федеральной службой по надзору в сфере здравоохранения и социального развития к применению в общей и пластической хирургии (регистрационное удостоверение ФСР 2011/10313 от 18.03.2011 г.).
На сегодняшний день накоплен значительный клинический опыт применения данного материала для восстановления целостности барабанной перепонки при ее травматических и гнойно-воспалительных повреждениях (А.А. Стадников с соавт., 2009; Р.А. Забиров с соавт., 2009, 2011; Р.А. Забиров, Р.Р. Рахматуллин, 2013). Забиров Р.А. с соавт. (2013) разработали основные показания для мирингопластики с использованием разработанного биопластического материала:
• Для пластики центральных дефектов барабанной перепонки диаметром до 5 мм у больных хроническим туботимпанальным средним отитом.
В данной группе больных после пластических операций с использованием этого материала положительный клинико-морфологический результат имел место в ближайшем периоде наблюдения у 27 (90%) больных, в отдаленном периоде наблюдения – у 30 (100%), положительный функциональный результат с улучшением слуховой функции наблюдался в ближайшем периоде наблюдения – у 27 (90%) пациентов, в отдаленном периоде наблюдения – у 30 (100%) человек.
• При тимпанопластике у больных хроническим эпитимпано-антральным средним отитом.
У обследованных больных данной группы положительный клинический результат в ближайшие сроки наблюдения был у 18 (90%) пациентов, в отдаленном периоде наблюдения – у 17 (85%). Положительные морфофункциональные результаты с улучшением слуха установлены в ближайшем периоде наблюдения – у 18 (90%) человек, в отдаленном периоде наблюдения – у 16 (80%) человек.
• При реконструктивных слухоулучшающих операциях у больных с болезнью оперированного уха.
У наблюдаемых больных положительный клинический результат в ближайшие сроки послеоперационного периода установлен у 11 (73%) больных, в отдаленном периоде – у 14 (93%) пациентов. Положительный функциональный результат в ближайшие сроки наблюдения установлен у 12 (80%) больных, в отдаленном периоде наблюдения – у 11 (73%) пациентов.
• Для пластики рецидивов перфораций тимпанальной мембраны в ближайшем послеоперационном периоде у оперированных больных хроническим средним отитом.
Анализ результатов лечения данной группы пациентов убедительно показал, что разработанный биопластический материал – высокоэффективный пластический материал, который можно использовать для пластики рецидивов дефекта неотимпанальной мембраны, возникших в ближайшем послеоперационном периоде после хирургических вмешательств на среднем ухе у больных хроническим средним отитом. Положительный клинико-анатомический результат был у 24 (96%) больных.
• Для пластики разрывов барабанной перепонки у больных с посттравматическими повреждениями тимпанальной мембраны.
У данной группы больных положительные анатомические и функциональные результаты установлены в ближайшем и отдаленном периодах наблюдения у всех 50 (100%) пациентов.
Анализ результатов исследования убедительно показывает эффективность использования нового биопластического материала в клинической практике для пластики дефектов барабанной перепонки и неотимпанальной мембраны у больных хроническим средним отитом, болезнью оперированного уха и острым посттравматическим разрывом тимпанальной мембраны (Р.А. Забиров с соавт., 2013).
К настоящему времени такой биопластический материал применяли для лечения ладонно-подошвенного псориаза (О.И. Бурлуцкая с соавт., 2011). После предварительной очистки раны от шелушащихся участков кожи на воспаленную поверхность рук укладывали биопластический материал с перехватом краев раны. С целью формирования оптимальных условий для метаболизации биоматериала поверх накладывали полимерную перевязочную пленку (фирма Urcell), которая обеспечивала состояние увлажненности биопластического материала (С.Н. Летута с соавт., 2011). В результате проведенных исследований авторы отмечают, что применение данного биоматериала обеспечивает длительную ремиссию псориаза и повышение качества проводимой терапии.
Р.Р. Рахматулин с соавт. (2010), Л.Р. Адельшина с соавт. (2011) показали, что данный биопластический материал хорошо адгезируется на поверхности кожной раны, и может пролонгированно находиться в области раневого дефекта в течение 3-х сут. до полного лизиса. При этом биоматериал создает оптимальную внеклеточную микросреду для миграции и усиления митотической активности эпителиоцитов, благодаря чему под его покровом формируется полноценный органотипический регенерат.
Вместе с тем, О.И.Бурлуцкая и Р.Р.Рахматуллин (2011) обосновывают целесообразность применения женщинами комплексной композиции «ГК + матричные пептиды» с целью лифтинг-эффекта кожи лица и зоны декольте. При этом увеличивалось клеточное обновление эпидермиса, а спустя 20-30 дней после применения отмечено повышение его способности к восстановлению и обновлению.
При использовании разработанного биопластического материала для восстановления покровных тканей и лечения вяло гранулирующих ран и трофических язв у пациентов была выше скорость заживления дефектов покровных тканей, ускорялись репаративные процессы, значительно сокращалось время лечения, повышалось качество жизни, в результате чего была получена экономическая эффективность лечения (Р.Р. Рахматуллин с соавт., 2011).
Применение данного биопластического материала у больного с врожденным буллезным эпидермолизом позволило достичь полного восстановления дефекта кожного покрова и избежать смены повязок, которые болезненно переносились пациентом (Р.Р. Рахматуллин с соавт., 2011).
В своей совокупности можно сделать заключение о позитивном воздействии материала при лечении трофических язв. Так в ходе комплексного местного лечения с использованием аппликаций биопластического материала во вторую фазу раневого процесса у больных основной группы было достигнуто более раннее очищение язв, в среднем на 5-6-е сут., а также выявлено статистически достоверное ускорение заживления в первые 10 дней, степень которого сохранялась в последующие сроки наблюдения (21 день). Клинически эффект лечения в основной группе проявлялся быстрым уменьшением боли и отека тканей в области язв, отчетливым улучшением общего состояния больных, более ранним появлением грануляций и краевой эпителизации. При этом у больных основной группы эпителизация язв началась в среднем на 10-е сутки, тогда как в контроле – в среднем на 23-и сутки. Результаты лечения в основной группе, прослеженные в сроки от 7 до 26 мес. (в среднем – в срок более года), сохранялись (Р.Р. Рахматуллин с соавт., 2011).
Общность эмбрионального происхождения эпидермиса и переднего эпителия роговицы (Э.Ф.Левкоева, 1951; А.А.Клишов, 1984; В.Н. Канюков, А.А. Стадников, О.М. Трубина, 2005), приведенные выше сведения об эффективности применения биоматериала при лечении ожогов и заболеваний кожи предполагают целесообразность проведения дополнительных исследований в аспекте возможного его применения при лечении ожогов и механических повреждений роговицы. Данное заключение явилось методологической основой для наших экспериментально-гистологических исследований (по сути дела проведение доклинических испытаний новых пластических материалов для целей офтальмохирургии).
Оставляя за рамками данной книги ряд дискуссионных вопросов и, несмотря на то, что механизм действия ГК на репарацию тканей мезенхимного генеза до конца не известен, и она широко применяется в хирургии, дерматологии, косметологии, при лечении артритов, ран и ожогов кожи, вопрос о ее применения в качестве биопластического материала при ожогах и травматических повреждениях роговицы до конца не изучен.
В последующих разделах монографии мы приводим собственные результаты по изучению влияния пластического материала первого поколения на репаративные гистогенезы структур роговицы.
Источник
