Горение в закрытом сосуде
Горение в закрытых сосудах сопровождается повышением давления. Если в открытом пространстве нагреваемый при горении газ имеет возможность свободно расширяться и на работу расширения идет часть выделившегося в хим реакции тепла, то в закрытых сосудах стенки препятствуют расширению газа и все тепло хим реакции идет только на увелич внутр энергии газа. Вследствие повышения давления в закрытых сосудах горение происходит с более сильным возрастанием температуры при выгорании той же массы горючего вещества и того же состава в открытом пространстве, при постоянном давлении. Если реакция с выделением тепла прошла до полного своего завершения равномерно по всему объему сосуда, и через стенки сосуда тепло не отводилось (или теплопотери малы), то температуру в продуктах горения в постоянном объеме Tbv можно рассчитать, приравнивая начальную полную внутр энергию горючей газовой смеси внутренней энергии продуктов горения. Tbv = T 0 + Qa 0 / cv. Где Q-тепловой эффект реакции, а0-концентрация горючего в-ва, к которому отнесен тепловой эффект реакции, Т0 – исходная температура, сv- теплоемкость при пост объеме. Если по сосуду от источника поджигания распространяется пламя, то скорость выгорания определяется скоростью распространения пламени, и давление в каждый момент времени успевает выравниваться по всему сосуду, поскольку скорость пламени значительно меньше скорости звука. Можно сказать, что горение в каждый момент идет в тонком слое: фронт пламени имеет конечную толщину. Реагирует один слой за другим. В отличие от хим реакции, протекающей во всем объеме одинаково в каждый момент времени, такое горение можно назвать послойным. Из-за послойного горения в закрытых сосудах возникает неоднородное состояние продуктов горения. Явление это связано с тем, что конечная (после горения) величина температуры элементарного объема, заполненного продуктами горения, зависит не только от конечного давления в сосуде, но и от того давления, при котором произошло сгорание данного объема. Температура газа меняется в силу двух причин: из-за тепловыделения при хим превращении и из-за адиабатического сжатия в силу общего роста давления. В общем случае произвольных объем газа, сгорающий в какой-то промежуточный момент времени (между нач и концом процесса) сперва сжимается до реакции, затем реагирует и нагревается и далее снова сжимается (уже находясь в состоянии продуктов горения) в ходе дальнейшего повышения давления. Элемент объема газа, который сгорел в начале процесса недалеко от источника поджигания, принимает температуру продуктов горения при том давлении, при котором он сгорел, а затем его температура растет из-за поджатия соседними элементами газа, причем сжатие осуществляется от давления сгорания до конечного давления, достигаемого после полного завершения горения. Напротив, элемент объема газа, сгоревший к концу процесса, сначала сжимался, но после горения не испытывает дополнительного сжатия и не изменяет свою температуру; поэтому его темп определяется только теплотой горения и исходным состояние горючего газа. В результате выгорания всей горючей смеси в закрытом сосуде разные объемы газа имеют различную температуру: более высокую – сгоревшие первыми и затем адиабатически сжатые до конечной температуры и низкую – сгоревшие последними после предварительного поджатия. Эффект неравномерности носит название эффекта Махе.
23. ПРЕДЕЛЫ РАСПРОСТРАНЕНИЯ ГОРЕНИЯ. ПРИЧИНЫ СУЩЕСТВОВАНИЯ ПРЕДЕЛОВ.
Из опыта известно, что в горючих смесях, сильно разбавленных инертными газами, пламя не распространяется. На первый взгляд кажется, что этот факт противоречит теории, в которой показывается, что Un ~ ехр (—E/2RTb), и поэтому разбавление смеси должно приводить только к уменьшению скорости пламени, но не к прекращению горения вообще. На опыте, однако, этого не наблюдается — горючие смеси горят лишь в том случае, если содержание горючего и окислителя достаточно для горения со скоростью не менее нескольких сантиметров в секунду.
По мере разбавления Un падает до некоторого минимального значения, и при дальнейшем разбавлении горение становится невозможным. Это обстоятельство использовалось в качестве одной из главных предпосылок в старых теориях горения, основанных на представлении о существовании фиксированной температуры воспламенения Ti. Концентрационные пределы распространения пламени в этих теориях казались очевидными: если в результате разбавления смеси температура горения Тb оказывается ниже Тi, то горение газа оказывается невозможным. Однако расчет скорости пламени по этим теориям приводит к выводу о том, что скорость пламени должна по мере разбавления, т. е. по мере понижения Тb, плавно уменьшаться, доходя до нуля при Тb=Тi что противоречит экспериментальным фактам.
Распределение температуры во фронте пламени при наличии теплопотерь в окружающую среду Пунктиром показано распределение температуры в отсутствие тепло – потерь
На самом деле пределы горения обусловлены тепловыми потерями в окружающую среду и на излучение. Часть тепла отдается теплопроводностью через стенки трубы. Теплопотери имеют место главным образом в зоне подогрева и в области продуктов горения. Охлаждение приводит к снижению температуры при удалении от зоны реакции и появлению соответствующего продольного (в направлении, обратном распространению пламени) потока тепла (рис. 1.32). Отвод тепла из зоны реакции к продуктам горения зависит от скорости их охлаждения.
По этим причинам температура пламени Т’b в реальных условиях сжигания горючей смеси, оказывается меньше адиабатической температуры горения Тb, вычисляемой по (4. 24), и соответственно скорость распространения пламени при наличии тепловых потерь U’n меньше нормальной скорости Un, отвечающей термодинамической температуре Тb.
Но тепловые потери теплопроводностью в стенки и потери излучением, правда, в меньшей степени, сами зависят от скорости распространения пламени.
распространение пламени возможно лишь в таких смесях, температура горения которых отличается от адиабатической на величину, меньшую, чем RTb/E. При разбавлении смеси, приводящем к Т’b, меньшим, чем Т’b„ распространение пламени невозможно.
Рекомендуемые страницы:
Источник
- Фосфид кальция обработали соляной кислотой. Выделившийся газ сожгли в закрытом сосуде, продукт горения полностью нейтрализовали раствором гидроксида калия. К полученному раствору прилили раствор нитрата серебра. Напишите уравнения описанных реакций.
Ca3P2 + 6HCl = 3CaCl2 + 2PH3↑
PH3 + 2O2 = H3PO4
H3PO4 + 3KOH = K3PO4 + 3H2O
K3PO4 + 3AgNO3 = Ag3PO4↓ + 3KNO3
- Ортофосфат кальция прокалили с углем и речным песком. Образовавшееся при этом белое светящееся в темноте вещество сожгли в атмосфере хлора. Продукт этой реакции растворили в избытке гидроксида калия. К полученной смеси прилили раствор гидроксида бария. Напишите уравнения описанных реакций.
Ca3(PO4)2 + 5C + 3SiO2 → 3CaSiO3 + 5CO + 2P
2P + 5Cl2 = 2PCl5
PCl5 + 8KOH = K3PO4 + 5KCl + 4H2O
2K3PO4 + 3Ba(OH)2 = Ba3(PO4)2 + 6KOH
- Простое вещество, полученное при нагревании смеси фосфата кальция с коксом и оксидом кремния, растворяется в растворе едкого кали. Выделяющееся газообразное вещество сожгли, продукты горения собрали и охладили, а в полученный раствор добавили нитрат серебра. Напишите уравнения описанных реакций.
Ca3(PO4)2 + 5C + 3SiO2 → 3CaSiO3 + 5CO + 2P
4P + 3KOH + 3H2O = 3KH2PO2 + PH3↑
2PH3 + 4O2 = P2O5 + 3H2O
P2O5 + 3H2O = 2H3PO4 или
PH3 + 2O2 = H3PO4
H3PO4 + 3AgNO3 = Ag3PO4↓ + 3HNO3
- Смесь ортофосфата кальция, кокса и песка нагрели в электрической печи. Один из продуктов этой реакции может самовоспламеняться на воздухе. Твердый продукт горения этого вещества при нагревании растворили в воде и через полученный раствор пропустили газообразный аммиак. Напишите уравнения описанных реакций.
Ca3(PO4)2 + 5C + 3SiO2 → 3CaSiO3 + 5CO + 2P
4P + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
2H3PO4 + 3NH3 = NH4H2PO4 + (NH4)2HPO4
- Простое вещество, смесь которого с бертолетовой солью используется в спичках и воспламеняется при трении, сожгли в избытке кислорода. Твердое вещество белого цвета, образовавшееся в результате сгорания, растворили в избытке раствора гидроксида натрия. Полученная при этом соль с раствором нитрата серебра образует осадок ярко-желтого цвета. Напишите уравнения описанных реакций.
6P + 5KClO3 = 5KCl + 3P2O5
4P + 5O2 = 2P2O5
P2O5 + 6NaOH = 2Na3PO4 + 3H2O
Na3PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3
- Белый фосфор растворяется в растворе едкого кали с выделением газа с чесночным запахом, который самовоспламеняется на воздухе. Твердый продукт реакции горения прореагировал с едким натром в таком соотношении, что в образовавшемся веществе белого цвета содержится один атом водорода, при прокаливании последнего вещества образуется пирофосфат натрия. Напишите уравнения описанных реакций.
P4 + 3KOH + 3H2O = 3KH2PO2 + PH3↑
2PH3 + 4O2 = P2O5 + 3H2O
P2O5 + 4NaOH = 2Na2HPO4 + H2O
2Na2HPO4 → Na4P2O7 + H2O
- Фосфор сожгли в избытке хлора, образующееся твердое вещество смешали с фосфором и нагрели. Продукт реакции обработали водой, при этом выделился бесцветный газ с резким запахом. Раствор добавили к подкисленному серной кислотой раствору перманганата калия, который в результате реакции обесцветился. Напишите уравнения описанных реакций.
2P + 5Cl2 = 2PCl5
3PCl5 + 2P = 5PCl3
PCl3 + 3H2O = H3PO3 + 3HCl↑
5H3PO3 + 2KMnO4 + 3H2SO4 = 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
или, так как ортофосфат марганца нерастворим
15H3PO3 + 6KMnO4 + 3H2SO4 = 11H3PO4 + 3K2SO4 + 2Mn3(PO4)2↓ + 9H2O
- Продукт взаимодействия фосфида магния с водой сожгли и продукты реакции поглотили водой. Образовавшееся вещество используется в промышленности для получения двойного суперфосфата из фосфорита. Напишите уравнения описанных реакций.
Mg3P2 + 6H2O = 3Mg(OH)2↓ + 2PH3↑
2PH3 + 4O2 = P2O5 + 3H2O
P2O5 + 3H2O = 2H3PO4
Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2
- Фосфин пропустили через горячий раствор концентрированной азотной кислоты. раствор нейтрализовали негашеной известью, выпавший осадок отделили, смешали с коксом и кремнезёмом и прокалили. Продукт реакции, который светится на воздухе, нагрели в растворе едкого натра. Напишите уравнения описанных реакций.
PH3 + 8HNO3(конц. гор.) = H3PO4 + 8NO2 + 4H2O
2H3PO4 + 3CaO = Ca3(PO4)2↓ + 3H2O
2HNO3 + CaO = Ca(NO3)2 + H2O
Ca3(PO4)2 + 5C + 3SiO2 → 3CaSiO3 + 5CO + 2P
4P + 3NaOH + 3H2O = 3NaH2PO2 + PH3↑
- Красный фосфор сожгли в атмосфере хлора. Продукт реакции обработали избытком воды и в раствор добавили порошкообразный цинк. Выделившийся газ пропустили над нагретым оксидом двухвалентного железа. Напишите уравнения описанных реакций.
2P + 5Cl2 = 2PCl5
PCl5 + 4H2O = H3PO4 + 5HCl↑
3Zn + 2H3PO4 = Zn3(PO4)2↓ + 3H2
H2 + FeO = Fe + H2O
- Вещество красного цвета, которое используется в производстве спичек, сожгли в избытке воздуха и продукт реакции при нагревании растворили в большом количестве воды. После нейтрализации полученного раствора пищевой содой в него добавили нитрат серебра. Напишите уравнения описанных реакций.
4P + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
H3PO4 + 3NaHCO3 = Na3PO4 + 3CO2 + 3H2O
Na3PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3
- К твёрдому веществу, которое образуется при сжигании фосфора в избытке хлора, добавили фосфор и смесь нагрели. Продукт реакции обработали небольшим количеством горячей воды и в полученный раствор добавили подкисленный серной кислотой раствор перманганата калия. Напишите уравнения описанных реакций.
2P + 5Cl2 = 2PCl5
3PCl5 + 2P = 5PCl3
PCl3 + 3H2O = H3PO3 + 3HCl↑
5H3PO3 + 2KMnO4 + 3H2SO4 = 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
- Твердое вещество, которое образуется при нагревании фосфора и пятихлористого фосфора, растворили в большом количестве воды. Часть полученного раствора добавили в подкисленный серной кислотой раствор перманганата калия, при этом последний обесцветился. Напишите уравнения описанных реакций.
2P + 3Cl2 = 2PCl3
PCl3 + 3H2O = H3PO3 + 3HCl↑
5H3PO3 + 2KMnO4 + 3H2SO4 = 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
10HCl + 2KMnO4 + 3H2SO4 = 5Cl2 + K2SO4 + 2MnSO4 + 8H2O
или
16HCl + 2KMnO4 = 5Cl2 + 2KCl + MnCl2 + 8H2O
- Фосфат кальция прокалили с углем в присутствии речного песка. Образовавшееся простое вещество прореагировало с избытком хлора. Полученный продукт внесли в избыток раствора гидроксида калия. На образовавшийся раствор подействовали известковой водой. Напишите уравнения описанных реакций.
Ca3(PO4)2 + 5C + 3SiO2 → 3CaSiO3 + 5CO + 2P
2P + 5Cl2 = 2PCl5
PCl5 + 8KOH = K3PO3 + 5KCl + 4H2O
2K3PO3 + 3Ca(OH)2 = Ca3(PO4)2↓ + 6KOH
- Фосфат кальция прокалили с песком и углем. Полученное простое вещество сожгли в кислороде, продукт реакции растворили в воде и нейтрализовали гидроксидом натрия. Напишите уравнения описанных реакций.
Ca3(PO4)2 + 5C + 3SiO2 → 3CaSiO3 + 5CO + 2P
4P + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
H3PO4 + 3NaOH = Na3PO4 + 3H2O
- Фосфор сожгли в избытке кислорода, а образовавшееся вещество сплавили с оксидом натрия. полученную соль разделили на две части: первую ввели в реакцию с хлоридом кальция, а вторую – с нитратом серебра. Напишите уравнения описанных реакций.
4P + 5O2 = 2P2O5
P2O5 + 3Na2O = 2Na3PO4
2Na3PO3 + 3CaCl2 = Ca3(PO4)2↓ + 6NaCl
Na3PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3
- Красный фосфор окислили кипящей азотной кислотой. Выделившийся при этом газ поглотили раствором гидроксида калия. Продукт окисления в первой реакции нейтрализовали гидроксидом натрия, а к образовавшейся реакционной массе по каплям добавили раствор хлорида кальция до прекращения выпадения осадка. Напишите уравнения описанных реакций.
P + 5HNO3 = H3PO4 + 5NO2 + H2O
2NO2 + 2KOH = KNO2 + KNO3 + H2O
3NaOH + H3PO4 = Na3PO4 + 3H2O
3CaCl2 + 2Na3PO4 = Ca3(PO4)2 + 6NaCl
Источник
Анонимный вопрос
16 августа 2017 · 27,6 K
Стоит уточнить,что именно горит в вашем вопросе,т.к. температура воспламенения и горения у разных веществ-разная. Для примера дам несколько вариантов:
Температура воспламенения для большинства твердых материалов — 300°С.
Температура пламени в горящей сигарете — 250—300°С.
У спички температура пламени 750—850 °С, при этом 300°С — температура воспламенения дерева, а температура горения дерева равняется примерно 800—1000 °С.
Температура горения пропан-бутана колеблется от 800 до 1970 °С.
Температура пламени керосина — 800, в среде чистого кислорода — 2000 °С.
Температура горения бензина — 1300—1400 °С.
Температура пламени спирта не превышает 900 °С.
Температура горения магния — 2200 °С.
Возможно ли разжечь огонь под водой?
химик, продавец металлов, коллекционер банкнот, начинающий путешественник…
Костер, разумеется, под водой разжечь не получится, но если обеспечить доступ кислорода и взять вещество, которое горит с большим выделением тепла, то огонь под водой возможен. Например: горение фосфора под водой www.youtube.com , горение магния под водой www.youtube.com , Также гореть под водой могут любые смеси, которые содержат окислитель (обеспечивает наличие в смеси кислорода, который выделятся при нагревании, примеры веществ: селитра, хлорат калия, перхлораты и другие) и восстановитель (который при горении выделят много тепла/газов, например: порошок магния или алюминия, сера, фосфор и другие), это могут быть бенгальские огни или охотничьи спички: www.youtube.com
Прочитать ещё 1 ответ
Что делать, если при запуске игры компьютер перезагружается? Температура 40-42 градуса.
Я – специалист технической поддержки систем связанных с компьютерной техникой…
Обычно в таких ситуациях смотрят журнал событий в операционной системе. Чаще всего там или есть конкретная ошибка, решение которой можно поискать по ее коду ошибки, либо ссылка на решение прямо в ошибке.
Найти журнал событий Windows можно нажав на “Мой Компьютер” правой кнопкой и в контекстном меню выбрав пункт “управление”
Горючие вещества с температурой плавления более 50 градусов, называются?
Эксперт в области компьютерных технологии, программирования и сео продвижения
Температура вспышки – самая низкая температура горючего вещества, при которой в условиях специальных испытаний над её поверхностью образуются пары или газы, способные вспыхнуть от источника зажигания, но скорость образования этих паров или газов, не достаточна, для устойчивого горения. По температуре вспышки вещества делятся на: легко воспламеняющиеся (температура вспышки менее 61 градуса в закрытом сосуде или 66 градусов в открытом сосуде) (сероводород – 50; ацетон – 18; метиловый спирт – 8; бензин от – 7 до – 30; керосин от 50 до 60) и горючие вещества (температура вспышки более 61 градуса в закрытом сосуде и 66 градусов в закрытом сосуде) (мазут 60-120; смазочные масла 130-300 градусов).
Источник: https://vuzlit.ru/142835/goryuchie_veschestva_istochniki_zazhiganiya
Прочитать ещё 1 ответ
Как определить температуру воды без термометра?
Без термометра выяснить точное значение температуры воды невозможно, но можно приблизительно узнать степень охлаждения или нагрева жидкости.
Если вода испаряется, значит, она горячая (70-95°С). При закипании точнее установить значение поможет размер пузырьков:
- мелкие пузырьки – 70°С;
- средние (крупнее булавочной головки) – 80°С;
- крупные, поднимаются кверху – 85°С;
- нитевидные – 90-95°С.
Если вода не парит и не кипятится, опустите в неё локоть и подержите пять-десять секунд. Проанализируйте ощущения:
- можно, но сложно терпеть – 60-65°С;
- едва ощутимое тепло – 38-40°С;
- ничего не ощущается – 36°С;
- холод – 15-20°С.
При температуре 5°С на поверхности ёмкости образуется конденсат.
Прочитать ещё 1 ответ
Горит ли кислород?
Обычный человек. увлекаюсь научной фантастикой.
Вопрос спорный. Так как горение в обычном понимании это окисление вещества кислородом с выделением температуры. Но кислород может оксислиться “гореть” в атмосфере фтора.
Прочитать ещё 2 ответа
Источник
При
горении газов в открытой трубе и в потоке
продукты реакции свободно расширяются,
давление остается практически постоянным.
Сжигание в замкнутом сосуде связано с
ростом давления. Это имеет большое
значение для решения задач взрывобезопасности.
Повышение давления при сгорании в
замкнутых аппаратах, а также в помещениях,
может приводить к разрушениям и авариям.
При
горении без тепловых потерь (адиабатическом
горении) в замкну-том объеме в
результате повышения температуры с То
до температуры горе-ния Тг
и изменения числа грамм-молекул при
реакции давление возрастает с Ро
до Рг:
![]() (7.8)
(7.8)
где:
m,
n
– число молей веществ до и после взрыва
стехиометрическо-
го состава
смеси.
Однако
наибольшее давление развивается не для
стехиометрических смесей, хотя они
обладают наибольшей теплотой сгорания
и создают макси-мальную Тг,
а смеси, обогащенные горючим веществом,
которые имеют мак-симальную скорость
горения. При дефлаграционном горении
давление дос-тигает 7-10 атм., при
детонации – намного выше.
Характерной
особенностью процесса сгорания в
замкнутом объеме является неравномерность
распределения температуры продуктов
реакции непосредственно после сгорания.
Первоначально сгорающая часть горючей
смеси, находящаяся в центре сосуда,
реагирует при начальном давлении ро;последний
слой, сгорающий у стенки, реагирует при
конечном давлении р.
Нагревание
каждого слоя газа протекает в две стадии:
при химическом превращении и адиабатическом
сжатии. Хотя во всех точках объема состав
продуктов сгорания и давление одинаковы,конечная
температура существенно зависит от
последовательности обоих нагревающих
процессов. При адиабатическом сжатии
от давления ро
до
давления р
рост температуры от То
до Т определяется уравнением Пуассона
![]() ,
,
(7.9)
где:
= ср/сv.
Конечная
температура продуктов сгорания будет
выше в том случае, ес-ли газ сначала
нагревается при химическом превращении,
а затем его темпе- ратура возрастает
при сжатии по уравнению (7.9), чем в случае
обратной пос-ледовательности обоих
процессов.
7.3. Движение газов при горении.
Расширение
газов в пламени (по закону Гей-Люссака)
приводит к тому, что горение всегда
сопровождается движением газов. Обозначим
через ρг
– плотность исходной среды, ρпр
– плотность продуктов горения, их
скорость по отношению к неподвижному
фронту пламени равна uпр.
На каждый квад-ратный сантиметр
поверхности фронта поток приносит
ежесекундно uн
см3
горючей смеси, её масса равна uн*ρг
соответственно от этого участка пламени
отводится в 1 сек uпр
см3
продуктов реакции с массой uпр*ρпр.
Поскольку мас-сы сгорающей смеси и
продуктов реакции равны, то
uн*ρг
= uпр*ρпр
(7.10)
Уравнение (7.10)
выражает закон сохранения массы при
горении.
Величина
uпр
превосходит нормальную скорость пламени
во столько раз, во сколько плотность
исходной среды больше плотности продуктов
сгорания. Увеличение скорости газового
потока при сгорании является след-ствием
расширения газов.
Абсолютная
температура при сгорании повышается в
5–10 раз. Если горение происходит при
постоянном давлении, газ расширяется
в о/рпрраз.
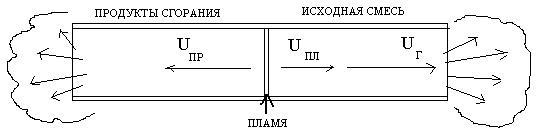
Рассмотрим
горение стационарного фронта пламени
в открытой трубе, изоб-раженной на
рисунке 28.

ρПР
Р
ω
ис. 28. Схема пояснения закона площадей:S
– сечение трубы, F
– поверхность фронта пламени, ω- скорость исходной
горючей смеси, Т0
,![]() – температура и плотность исходной
– температура и плотность исходной
смеси,UH
– нормальная скорость горения, UПЛ
– скорость рас-пространения пламени,
UПР
– скорость продуктов горения, ТПР,
![]() –
–
температура и плотность про-дуктов
горения.
Так
как пламя располагается неподвижно, ω
= UПР.
Тогда, например, на 1 см2
поверхности фронта пламени F
поток приносит ω
см3/с
горючей смеси. Её масса равна ω![]() .
.
Соответственно от этого участка отводитсяUПР
см3/с
продуктов сгорания с массою UПР![]() .
.
Тогда по закону сохранения масс
(уравнение 7.10) приω
= UПЛ:
![]() (7.11)
(7.11)
Таким образом,
объемная скорость продуктов сгорания
превышает ско-рость горения во столько
раз, во сколько плотность исходной среды
больше плотности продуктов горения.
С
другой стороны, если на 1 см2
поверхности фронта пламени сгорает UН
см3/с
смеси, то на всей площади F
сгорает UН*F
см3/с.
В то же время объ-ем сгорающего газа
равен объемной скорости газового потока
ω*S
см3/с.
То-гда UH*F
= ω*S,
или ω
= UH*F
/ S.
При
равенстве ω
=UПЛ:
UПЛ
= UH*F
/ S.
(7.12)
Получаем
закон площадей:
скорость распространения пламени в
трубе будет во столько раз больше
нормальной, во сколько поверхность
пламени превосходит поперечное сечение
трубы.
Если
рассматривать неподвижную горючую
смесь, то при распростра-нении фронта
пламени резко нагретые газы не успевают
расширяться, и в зо-не горения резко
повышается давление, которое «распирает»
и выталкивает газы в обе стороны от
пламени, причем выталкиваются не только
продукты горения, но и возникает
движение исходной смеси впереди фронта
пламени, как на рисунке 29:

Рис.
29.
Скорость
газов возрастает по мере сгорания
исходной смеси и соответ-ственно,
давления газов. При этом с одного конца
трубы выбрасываются сжа-тые раскаленные
сгоревшие газы, а с другого выталкивается
сжатая исходная смесь, которая
взрывообразно воспламеняется от
выброшенного пламени в атмосфере
помещения с последующей ударной волной,
пожаром и разруше-нием.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
Источник
