Индекс резистентности сосудов почек что это такое
Строение сосудов почки
Почечные артерии отходят от брюшной аорты чуть ниже верхней брыжеечной артерии — на уровне II поясничного позвонка. Кпереди от почечной артерией располагается почечная вена. В воротах почки оба сосуда находятся кпереди от лоханки.
ППА проходит позади нижней полой вены. ЛПВ проходит через «пинцет» между аортой и верхней брыжеечной артерией. Иногда встречается кольцевидная ЛПВ, тогда одна ветвь располагается впереди, а другая — позади аорты.
Нажимайте на картинки, чтобы увеличить.

Для исследования сосудов почки используют конвексный датчик 2,5-7 МГц. Положение пациента лежа на спине, датчик располагают в эпигастрии. Оцените аорту от чревного ствола до бифуркации в В-режиме и ЦДК. Проследите ход ППА и ЛПА от аорты до ворот почки.
Рисунок. В режиме ЦДК на продольном (1) и поперечном (2) срезах от аорты отходят ППА и ЛПА. Сосуды направляются к воротам почки. Кпереди от почечной артерии располагается почечная вена (3).
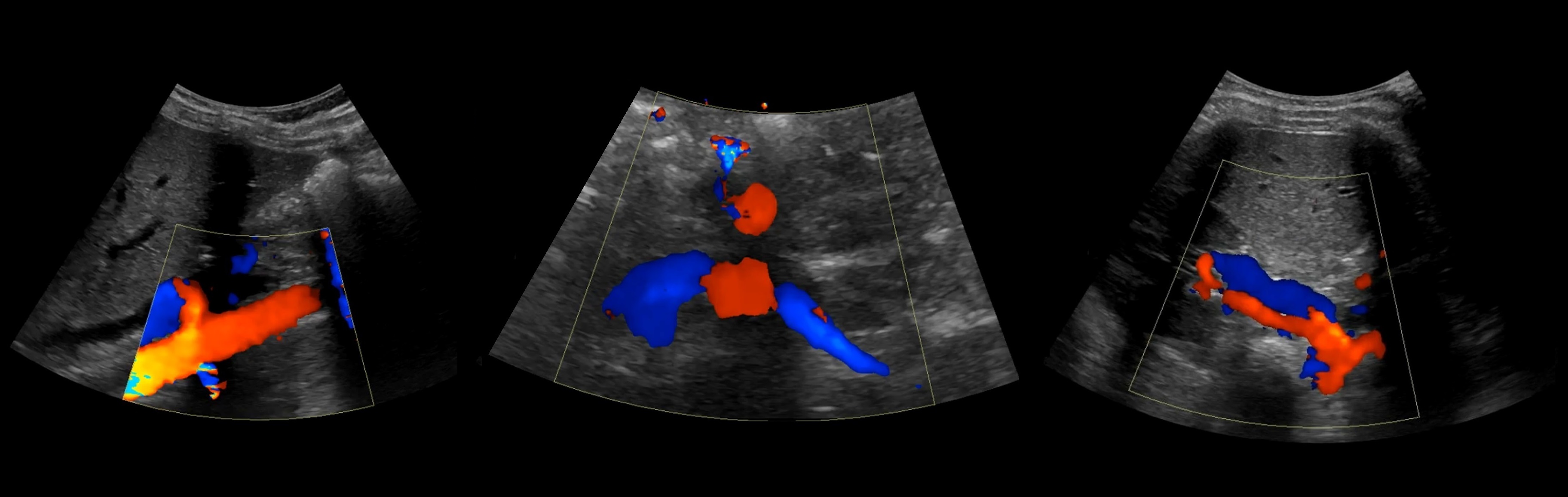
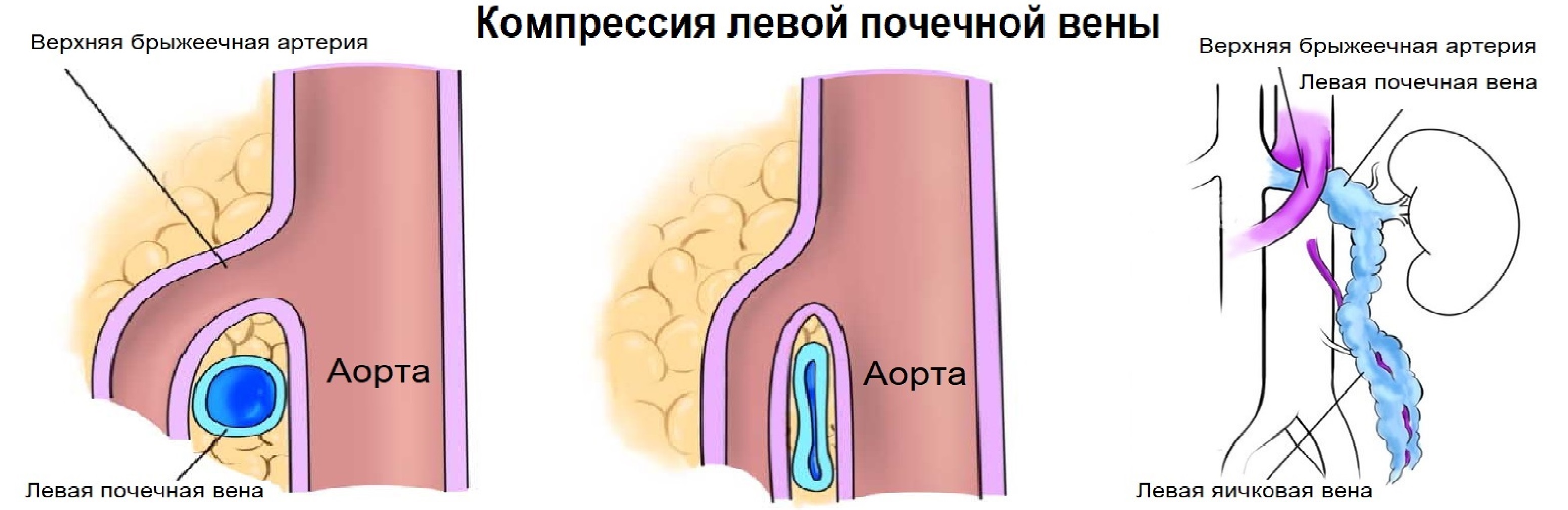
Рисунок. Почечные вены впадают в нижнюю полую вену (1, 2). Аортомезентериальный «пинцет» может сдавливать ЛПВ (3).
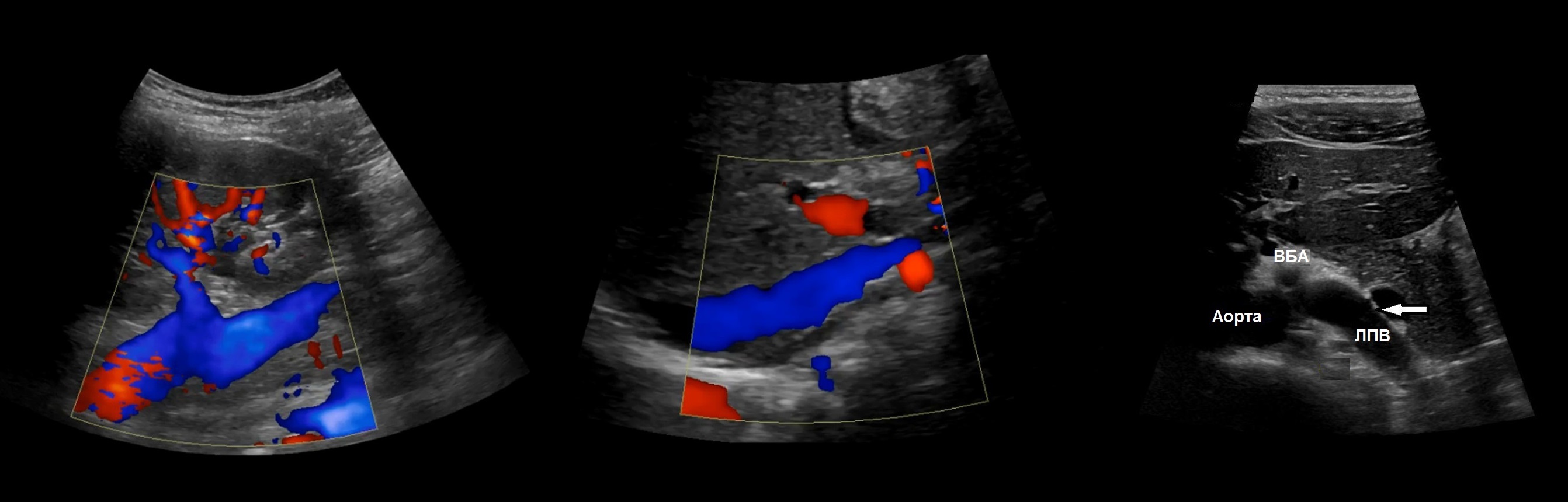
Рисунок. В воротах почки главная почечная артерия делится на пять сегментарных: задняя, верхушечная, верхняя, средняя и нижняя. Сегментарные артерии разделяются на междолевые артерии, которые располагаются между пирамидками почки. Междолевые артерии продолжаются в дугообразные → междольковые → приносящие артериолы клубочков → капиллярные клубочки. Кровь от клубочка отходит по выносящей артериоле в междольковые вены. Междольковые вены продолжаются в дугообразные → междолевые → сегментарные → главную почечную вену → нижнюю полую вену.

Рисунок. В норме при ЦДК сосуды почек прослеживаются до капсулы (1, 2, 3). Главная почечная артерия входит через ворота почки, добавочные артерии из аорты или подвздошной артерии могут подходить у полюсов (2).

Рисунок. На УЗИ здоровая почка: вдоль основания пирамид (кортикомедуллярный переход) определяются линейные гиперэхогенные структуры с гипоэхогенной дорожкой в центре. Это дугообразные артерии, которые ошибочно расценивать как нефрокальциноз или камни.

Видео. Дугообразные артерии почки на УЗИ
Доплер сосудов почки в норме
Диаметр почечной артерии у взрослых в норме от 5 до 10 мм. Если диаметр <4,65 мм, вероятно наличие дополнительной почечной артерии. При диаметре главной почечной артерии <4,15 мм, дополнительная почечная артерия имеется почти всегда.
Почечную артерию следует оценивать в семи точках: при выходе из аорты, в проксимальном, среднем и дистальном сегментах, а так же верхушечную, среднюю и нижнюю сегментарные артерии. Оцениваем пиковую систолическую (PSV) и конечно-диастолическую (EDV) скорости кровотока, индекс резистивности (RI), время ускорения (АТ), индекс ускорения (PSV/АТ). Подробнее смотри Доплер сосудов.
Нормальный спектр почечных артерий имеет выраженный систолический пик с антеградным диастолическим потоком на протяжении всего сердечного цикла. У взрослых в норме на главной почечной артерии PSV 100±20 см/сек, EDV — 25-50 см/сек, у детей раннего возраста PSV 40-90 см/сек. В сегментарных артериях PSV падает до 30 см/сек, в междолевых до 25 см/сек, в дуговых до 15 см/сек и междольковых до 10 см/сек. RI в воротах почки <0,8, RI на внутрипочечных артериях 0,34-0,74. У новорожденного RI на внутрипочечных артериях достигает 0,8-0,85, к 1 месяцу опускается до 0,75-0,79, к 1 году до 0,7, у подростков 0,58-0,6. В норме PI 1,2-1,5; S/D 1,8-3.
Рисунок. Нормальный спектр почечных артерий — высокий систолический пик, антеградный диастолический поток, низкое периферическое сопротивление — RI в норме <0,8.
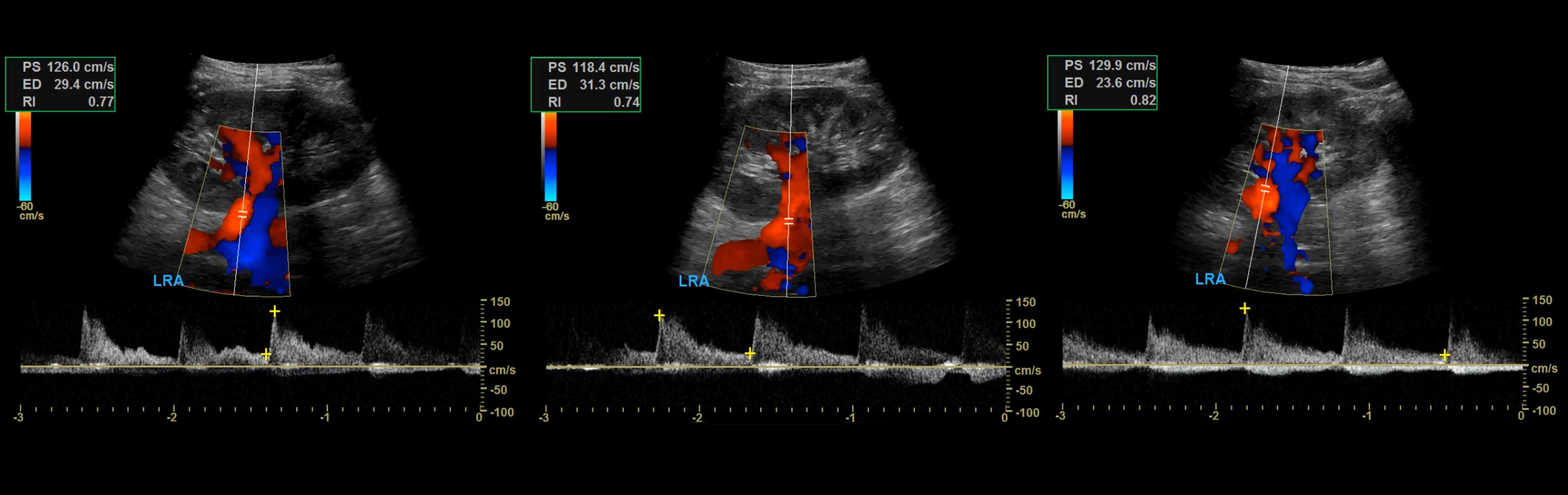
Рисунок. Спектр сосудов почки у новорожденных: почечная артерия — выраженный систолический пик и антеградным диастолический поток (1); высокое сопротивление на внутрипочечных артериях считается нормальным для новорожденных — RI 0,88 (2); почечная вена — поток антеградный с постоянной скоростью на протяжении всего сердечного цикла, минимальные дыхательные колебания (3).
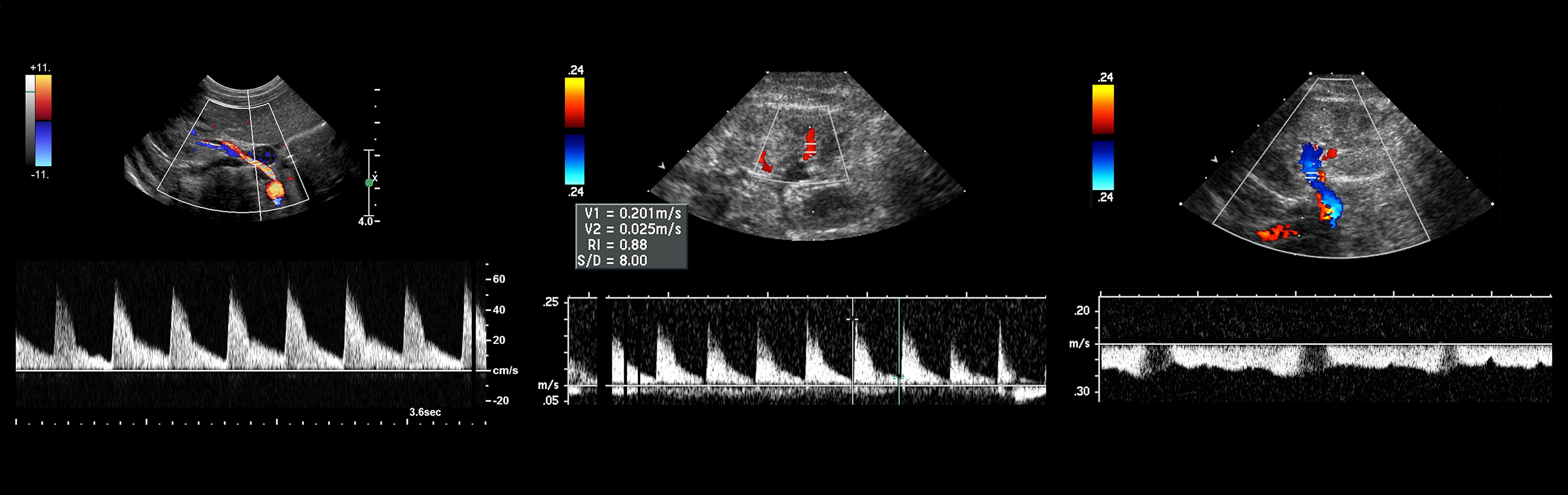
Доплер при стенозе почечной артерии
Стеноз почечной артерии можно встретить при атеросклерозе или фибромышечной дисплазией. При атеросклерозе чаще страдает проксимальный сегмент почечной артерии, а при фибромышечной дисплазии — средний и дистальный сегменты.
Прямые признаки стеноза почечной артерии
Элайзинг указывает место турбулентного высокоскоростного потока, где следует производить измерения. В зоне стеноза PSV >180 см/сек. У молодых на аорте и ее ветвях в норме может быть высокая PSV (>180 см/сек), а у пациентов с сердечной недостаточностью PSV низкая даже в области стеноза. Эти особенности нивелирует почечно-аортальное соотношение RAR (PSV в зоне стеноза/PSV в брюшной аорте). RAR при стенозе почечной артерии >3,5.
Таблица. Критерии стеноза почечной артерии на УЗИ
| Стеноз почечной артерии | PSV в месте стеноза | RAR |
| Норма | <180 см/сек | <3,5 |
| <60% | >180 см/сек | <3,5 |
| ≥60% | >180 см/сек | ≥3,5 |
| Окклюзия | Нет сигнала | — |
Косвенные признаки стеноза почечных артерий
Прямые критерии является предпочтительными, диагноз не должен быть основан исключительно на косвенных признаках. В постстенотическом отделе поток затухает — tardus-parvus эффект. При стенозе почечной артерии на внутрипочечных артериях PSV слишком поздний (tardus) и слишком маленький (parvus) — АТ >70 мс, PSV/АТ <300 см/сек². Настораживает значительная разница между двумя почками — RI >0,05 и PI >0,12.
Таблица. Критерии стеноза почечной артерии на УЗИ
| Признаки | Главная почечная артерия | Сегментарные или междолевые артерии |
| Прямые | PSV >180 см/сек, RAR >3,5 | |
| Косвенные | AT >70 мс, AI <300 см/сек² | |
| Сочетание | PSV в междолевых артериях <15 см/сек, RIR (PSV почечная артерия в месте стеноза/PSV междолевая артерия) >5 | |
Рисунок. Пациентка 60-ти лет с рефрактерной артериальной гипертензией. PSV на брюшной аорте 59 см/сек. В проксимальном отделе ППА при ЦДК элайзинг (1), PSV значительно повышен 366 см/сек (2), RAR 6,2. В среднем сегменте ППА при ЦДК элайзинг, PSV 193 см/сек (3), RAR 3,2. На сегментарных артериях без существенного увеличения времени ускорения: верхняя — 47 мс, средняя — 93 мс, нижняя — 33 мс. Заключение: Стеноз в проксимальном отделе правой почечной артерии.

Рисунок. Пациент с острой почечной недостаточностью и рефрактерной артериальной гипертензией. УЗИ брюшной аорты и почечной артерий затруднено из-за газа в кишечнике. На сегментарных артериях слева RI о,68 (1), справа RI 0,52 (2), разница 0,16. Спектр правой сегментарной артерии имеет форму tardus-parvus — время ускорения увеличено, PSV низкий, вершина округлая. Заключение: Косвенные признаки стеноза правой почечной артерии. КТ-ангиография подтвердила диагноз: в устье правой почечной артерии атеросклеротические бляшки с кальцификацией, стеноз умеренной степени.
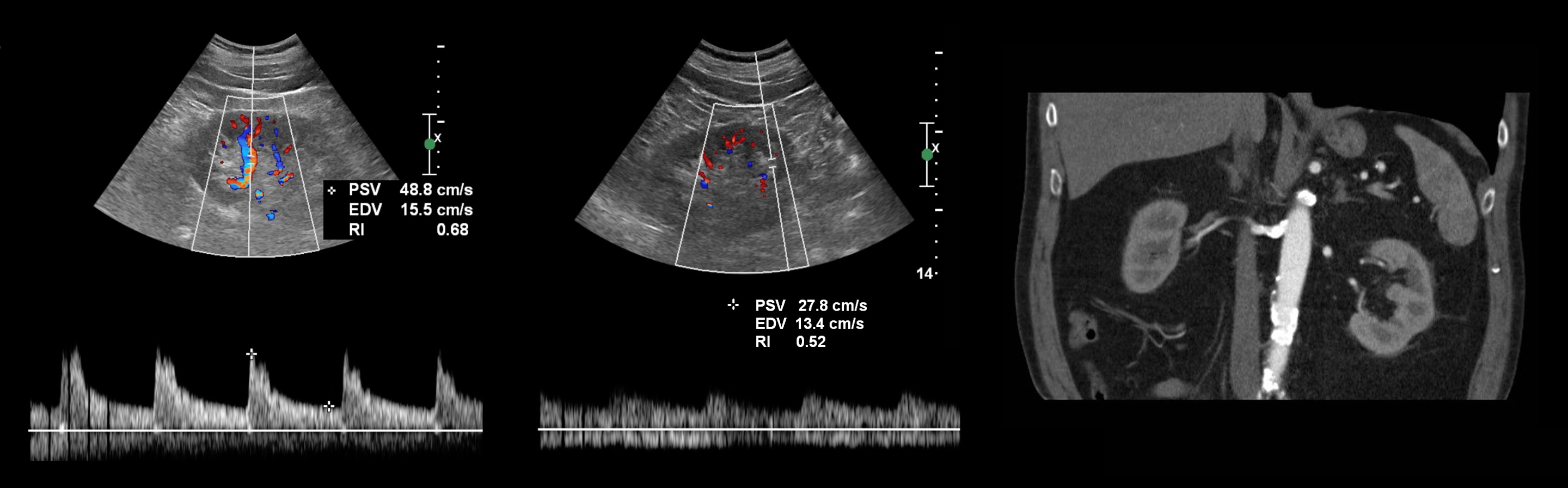
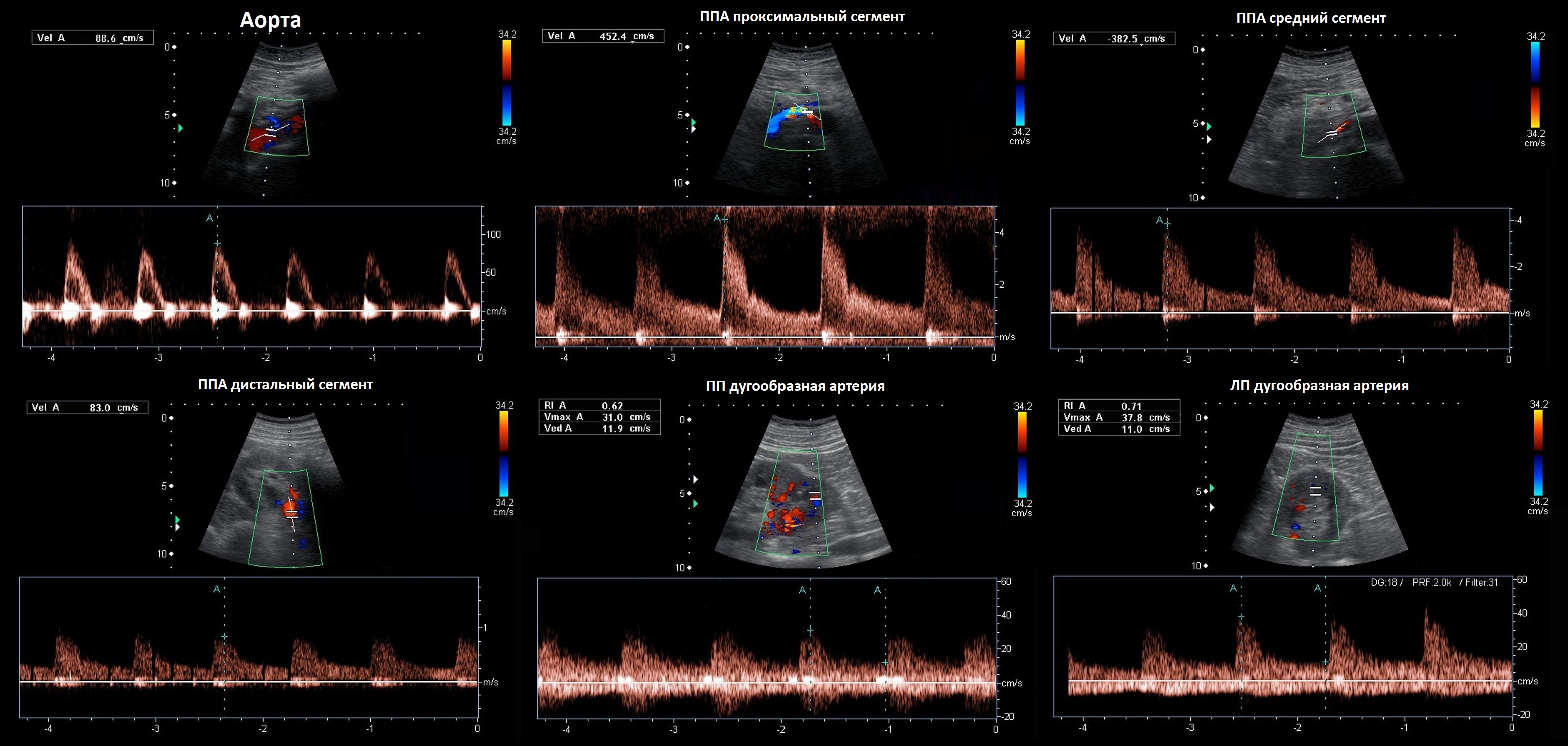
Рисунок. Пациент с артериальной гипертензией. PSV в аорте 88,6 см/сек (1). В проксимальном отделе ППА элайзинг, PSV 452 см/сек, RAR 5,1 (2). В среднем отделе ППА элайзинг, PSV 385 см/сек, RAR 4,3 (3). В дистальном отделе ППА PSV 83 см/сек (4). На внутрипочечных сосудах tardus-parvus эффект не определяется, справа RI 0,62 (5), слева RI 0,71 (6), разница 0,09. Заключение: Стеноз в проксимальном отделе правой почечной артерии.
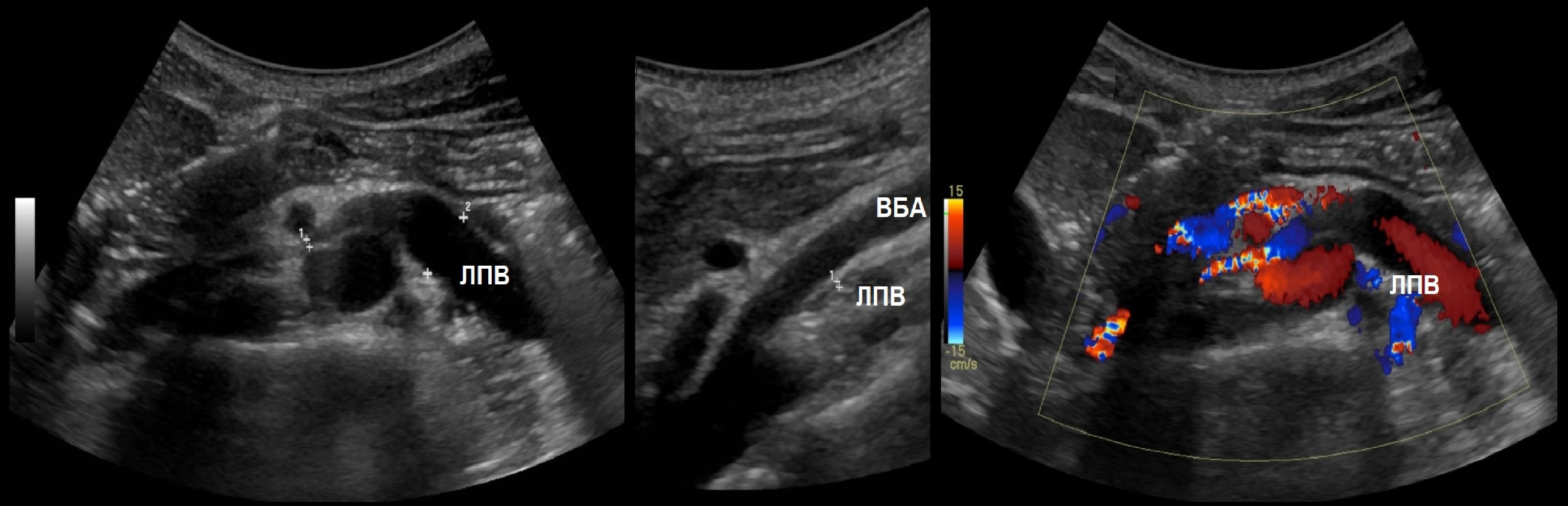
Доплер почечных вен
Левая почечная вена проходит между аортой и верхней брыжеечной артерией. Аортомезентериальный «пинцет» может сдавливать вену, что ведет к венной почечной гипертензии. В положении стоя «пинцет» сжимается, а в положении лежа — раскрывается. При синдроме Щелкунчика затрудняется отток по левой яичковой вене. Это фактор риска развития левостороннего варикоцеле.

Из-за сдавления спектр ЛПВ похож на воротную вену — спектр выше базовой линии, постоянная низкая скорость, контур плавными волнами. Если соотношение диаметра ЛПВ перед и в зоне сужения более 5 или скорость потока менее 10 см/сек выносим заключение о повышении венозного давления в левой почке.
Задача. На УЗИ левая почечная вена расширена (13 мм), участок между аортой и верхней брыжеечной артерией заужен (1 мм). Кровоток в зоне стеноза с высокой скоростью (320 cм/сек), реверс кровотока в проксимальном сегменте. Заключение: Компрессия левой почечной вены аортомезентериальным «пинцетом» (синдром Щелкунчика).
Сдавление почечной вены возможно из-за аномального расположения позади аорты. Соотношение диаметра и скорость потока оценивают по вышеуказанным правилам.
Характер кровотока в правой почечной вене приближается к кавальному. Форма кривой меняется при задержке дыхания может быть более пологой. Скорость кровотока 15-30 см/сек.
Берегите себя, Ваш Диагностер!
Источник
АГ — артериальная гипертония
ИР — индекс резистентности
МА — междолевые артерии
ПА — почечная артерия
ПД — пульсовое давление
ППИ — паренхимопиелический индекс
ПУ — протеинурия
СА — сегментарные артерии
СКФ — скорость клубочковой фильтрации
УЗДГ — ультразвуковая допплерография
УЗИ — ультразвуковое исследование
ХБП — хроническая болезнь почек
ХГН — хронический гломерулонефрит
Высокий стандартизованный показатель смертности у больных хронической болезнью почек — ХБП (70 на 1000 больных) обусловливает необходимость постоянного совершенствования подходов к выявлению признаков поражения почек на ранних его этапах [1]. Современная диагностика ХБП включает следующие параметры: скорость клубочковой фильтрации (СКФ), альбуминурию/протеинурию, изменения осадка мочи и электролитного баланса вследствие поражения канальцев, данные нефробиопсии, наличие трансплантации в анамнезе, а также особенности изменений структуры и размеров почек по данным ультразвукового исследования (УЗИ) [2—4]. Вместе с тем при первичной диагностике ХБП перечисленные данные не позволяют достаточно точно охарактеризовать тяжесть поражения почек и степень нефросклероза, тем более что проведение биопсии почки с этой целью не всегда возможно. В связи с этим обоснован поиск клинических и лабораторных факторов неблагоприятного прогноза ХБП. Согласно ряду исследований к ним относятся возраст пациента, выраженность протеинурии (ПУ), снижение СКФ, наличие артериальной гипертонии (АГ) [4—6]. Помимо этого в прогрессирование ХБП большой вклад вносит нарушение внутрипочечной гемодинамики. Одним из методов визуальной оценки, позволяющим характеризовать особенности внутрипочечного кровотока, является ультразвуковая допплерография (УЗДГ) сосудов почек, позволяющая определить расчетные индексы, в частности индекс резистентности (ИР), который отражает сопротивление мышечного слоя стенки сосуда. С целью уточнения диагностической значимости УЗДГ в определении темпов прогрессирования ХБП сопоставляли клинико-лабораторные показатели со значениями ИР магистральных и внутрипочечных артерий.
В ретроспективное исследование включили 53 больных с признаками ХБП, находившихся под наблюдением в Клинике нефрологии, внутренних и профессиональных болезней им. Е.М. Тареева в период с января 2003 г. по октябрь 2013 г. Среди них 25 (47,2%) женщин и 28 (52,8%) мужчин; средний возраст составил 44,4±13,6 года.
Всех больных разделили на две сопоставимые по численности группы: 26 с преобладанием гломерулярной патологии (хронический гломерулонефрит — ХГН) и 27 с тубулоинтерстициальными повреждениями, в частности 9 пациентов страдали тубулоинтерстициальным нефритом (ТИН), 4 — хроническим пиелонефритом, 6 — поражением почек, ассоциированным с гипертонической болезнью, 5 — с антифосфолипидным синдромом, оставшиеся — поликистозом почек. При первой госпитализации анализировали клинические, инструментально-лабораторные данные пациентов: возраст, суточная ПУ, СКФ (рассчитывали по формуле CKD-EPI), систолическое и диастолическое артериальное давление, пульсовое давление (ПД), ИР по данным УЗДГ. Для определения темпов прогрессирования почечной недостаточности в динамике оценивали СКФ. Снижение СКФ на 10 мл/мин/1,73 м2 расценивали как снижение функции почек. Период наблюдения пациентов составил 14±2,64 мес.
Стандартное УЗИ, УЗДГ провели всем 53 пациентам на ультразвуковом аппарате экспертного класса Sonoline Antares («Siemens Medical Solutions») с использованием датчика с частотой 1—5 МГц. Измеряли длину и поперечный размер почек, толщину почечной паренхимы с последующим расчетом средних значений. Паренхимопиелический индекс (ППИ) вычисляли как отношение размера паренхимы к размеру центрального эхокомплекса, который включает чашечно-лоханочную систему с жировой тканью, кровеносные и лимфатические сосуды [7]. ИР — это отношение разницы между максимальной систолической скоростью и конечной диастолической к максимальной систолической скорости, определявшийся для почечной артерии (ПА), междолевых артерий (МА) и дуговых артерий почек. Для сравнительного анализа корреляции в независимых выборках между количественными данными применяли критерий Пирсона (где р<0,05 оценивали как статистически значимый результат). При расчете коэффициентов корреляции взято среднее значение ИР артерий почек на основании того, что данный показатель варьирует незначительно между органами [8].
Для оценки прогностической значимости ИР ПА, сегментарных артерий (СА) и МА, их чувствительности и специфичности, применяли ROC-анализ с построением одноименных кривых.
Для определения факторов, влияющих на внутрипочечную гемодинамику, применяли пошаговый многофакторный регрессионный анализ.
При анализе связи ИР с клиническими и лабораторными параметрами у всех больных выявлено, что ИР почечных сосудов находятся в прямой зависимости от возраста пациентов и ПД (табл. 1).
 Таблица 1. Взаимосвязь возраста пациента, ПД и СКФ, определяемой по формуле CKD-EPI, и ИР в устье ПА и внутрипочечных артериях
Таблица 1. Взаимосвязь возраста пациента, ПД и СКФ, определяемой по формуле CKD-EPI, и ИР в устье ПА и внутрипочечных артериях
ИР устья ПА и внутрипочечных артерий находятся в обратной зависимости от СКФ (см. табл. 1), статистически значимой связи с выраженностью ПУ не выявлено.
В связи с тем что при поликистозе нарушается кортикомедуллярная дифференциация структуры почки, для корректной оценки связи между ИР и размерами почек из выборки исключили больных с кистозными изменениями почек. Оказалось, что ИР устья ПА (r=0,370; p=0,006) и СА (r=0,377; p=0,007) находится в прямой связи с длиной почки, в то время как МА — в обратной (r=–0,564; p=0,0001). Поперечный размер почки прямо положительно коррелировал с ИР устья ПА (r=0,357; p=0,009), СА (r=0,521; p=0,0001) и МА (r=0,377; p=0,005).
Для анализа структурных изменений оценивали толщину почечной паренхимы и ППИ. В обратной связи с показателем толщины почечной паренхимы и значениями ППИ находились ИР ПА (r=–0,440; p=0,004; r=–0,392; p=0,011), СА (r=–0,361; p=0,024; r=–0,334; p=0,038), МА (r=–0,310; p=0,033; r=–0,345; p=0,025).
Для более детального анализа взаимосвязи клинико-лабораторных параметров ИР выборку, которая характеризуется гетерогенностью заболеваний с принципиально разным патогенезом, разделили на 2 группы: пациенты с гломерулярными болезнями и пациенты с интерстициальными болезнями (АГ, пиелонефрит и ТИН). Данное соотношение составило 49,05 и 35,83%.
В группе пациентов с гломерулярными болезнями обнаружена положительная корреляция между ИР и выраженностью ПУ и отрицательная с СКФ (табл. 2). При этом в группе гломерулярных болезней размеры почки и показатели, отражающие ее структуру, в частности толщина паренхимы и ППИ, не зависели от ИР.
 Таблица 2. Взаимосвязь П.У. и ИР устья ПА и паренхиматозных почечных артерий у больных с гломерулярными болезнями
Таблица 2. Взаимосвязь П.У. и ИР устья ПА и паренхиматозных почечных артерий у больных с гломерулярными болезнями
Практически обратная ситуация наблюдалась в группе пациентов с интерстициальными поражениями почек. Так, индексы сосудистого сопротивления не коррелировали со значениями ПУ и СКФ (определяемой по расчетным формулам), но коррелировали с размерами почки (см. табл. 2).
Значение ИР устья ПА как прогностического признака ухудшения функции почек имело площадь под ROC-кривой 0,668 (p=0,038), что характеризует ее качество как хорошее. Точка перегиба кривой, т. е. пороговое значение, при котором наблюдалось ухудшение функции почек, составила 0,715, причем чувствительность достигала 56%, а специфичность — 71%. Под ROC-кривой для ИР СА была больше, чем для устья ПА 0,749 (p=0,002), с точкой перегиба 0,67, в которой чувствительность равна 62,5%, а специфичность — 78%. Самую большую площадь под ROC-кривой определена для ИР МА — 0,781 (p<0,001), где точка перегиба кривой равнялась 0,655 с чувствительностью 71% и специфичностью 72% (см. рисунок).
 ROC-кривые для ПУ и ИР устья ПА и внутрипочечных артерий у пациентов исследуемой выборки.
ROC-кривые для ПУ и ИР устья ПА и внутрипочечных артерий у пациентов исследуемой выборки.
Таким образом, данное исследование демонстрирует, что наибольшей прогностической значимостью для оценки темпов прогрессирования ХБП обладает ИР МА.
Кроме того, нами проведено сравнение чувствительности и специфичности ИР ПА и внутрипочечных сосудов с достоверным прогностическим признаком ухудшения функции почек — П.У. На рисунке видно, что по прогностической ценности ИР сопоставимы с ПУ (AUC=0,749; p=0,002).
Для оценки влияния факторов, определяющих внутрипочечную гемодинамику, применен пошаговый многофакторный регрессионный анализ, в который включены возраст пациента, ИМТ, ПД, значение протеинурии, СКФ (расчетная по CKD-EPI и определенная по формуле Реберга—Тареева), концентрации креатинина и мочевой кислоты в крови. Оказалось, что среди исследуемых показателей на ИР статистически значимо влияют возраст пациента (β=0,522; р=0,0001) и концентрация креатинина в плазме крови (β=0,482; р=0,001; r2=0,5; p<0,001).
Результаты проведенной работы позволяют считать измерение ИР у пациентов с ХБП целесообразным в связи с рядом причин. Так, величина ИР напрямую зависит от возраста пациента и ПД [9—11]. Такой результат свидетельствует, что ИР является отражением степени повреждения почечных сосудов, во многом зависящих от таких патологических процессов, как АГ и атеросклероз. Прямая зависимость между значениями ИР устья ПА и ПД свидетельствует, что данный индекс отражает нарушения системной гемодинамики; это же показано в других работах [12]. Важно отметить, что повышение ИР МА служит фактором риска развития сердечно-сосудистых заболеваний у пожилых пациентов, а также ассоциирован с высоким риском по Фрамингемской шкале [10, 13]. В нашей работе показано, что УЗДГ с расчетом ИР сосудов почек разного калибра позволяет определить признаки и выраженность нарушения функции и структуры почек: снижение СКФ, толщины почечной паренхимы и изменения ППИ.
При гломерулярных болезнях ИР сосудов почек ассоциирован с выраженностью ПУ и снижения СКФ, вероятно, вследствие фиброза почечной паренхимы, в то время как при интерстициальных — нарушения размеров почки и ее структуры. Отражает ли ИР почечных сосудов выраженность гломерулосклероза, спорный вопрос. Так, в работах J. Platt и соавт. [14] показано отсутствие корреляций между значениями ИР и выраженностью гистологических изменений. К таким же выводам пришли N. Bige и соавт. [15], причем по их результатам изолированное поражение клубочков не было ассоциировано даже с изменением И.Р. При этом в одной из последних работ на достаточно большой выборке (n=202) пациентов с гломерулонефритом и поражением интерстициальной ткани показано, что ИР почечных сосудов коррелирует с выраженностью склероза клубочков [16]. Ранее также показана связь между склерозом клубочков, интерстициальной ткани и ростом ИР [9]. Однако, учитывая в целом противоречивые результаты работ, отсутствие крупных рандомизированных исследований, сложно сказать, отражает ли изменение величины ИР степень поражения клубочкового аппарата. Вероятно, что повышение ИР почечных сосудов более мелкого калибра отражает поражение клубочкового аппарата. Кроме того, обе упомянутые работы характеризуются тем, что в выборке есть пациенты с разными группами нефропатий. В нашей работе сопоставлялись данные больных с преимущественно первичным гломерулярным и преимущественно интерстициальным механизмом нефропатий. Благодаря этому впервые отмечена корреляция между ИР и ПУ.
Повышенные значения ИР, полученные при изучении больных с преимущественно интерстициальным поражением почек, совпадают с данными других авторов [14, 17]. Основные механизмы, которые приводят к такой связи, — увеличение сосудистого сопротивления и внутрисосудистого давления вследствие атеросклероза ветвей почечных артерий и фиброза почечной паренхимы.
Кроме связи с клинико-лабораторными параметрами и выраженностью гистологических изменений важность измерения величины ИР продиктована тем, что его повышенные и высокие значения ассоциированы с ухудшением функции почек. Одной из первых работ, в которой показана прогностическая значимость ИР относительно тяжести течения нефропатии, является исследование J. Platt и соавт. [18], проведенное на выборке пациентов с волчаночным нефритом. Значительно позднее T. Sugiura и соавт. [19] показали прогностическую значимость ИР на выборке из 311 человек с ХБП с периодом наблюдения 2 года. Сходные данные получены и в работе N. Bige и соавт. [15]. При этом в обеих работах показано разное пороговое значение ИР, что связано с изучением сосудов разного калибра, а также степенью снижения СКФ — при ИР 0,70 степень снижения на протяжении 2 лет составила 10 мл/мин 1,73 м2/год, а при ИР 0,65 — 5 мл/мин 1,73 м2/год. Учитывая такую разницу, мы исследовали сосуды разного калибра. Согласно нашим данным, ИР МА является наиболее точным параметром для определения степени прогрессирования ХБП, при этом прогностически неблагоприятным является ИР более 0,65. Прогностическая ценность данного значения совпадает с и ПУ — доказанного фактора риска прогрессирования ХБП. Важно подчеркнуть, что ИР 0,65 находится в пределах референсных значений, тем не менее оно ассоциировано с ухудшением функций почек, что обусловливает необходимость адекватной терапии.
Другой вывод нашей работы состоит в том, что наиболее значимыми факторами, влияющими на ИР МА, являются возраст пациента и концентрация креатинина в сыворотке крови.
Таким образом, данные УЗДГ сосудов почек, в частности ИР, позволяют уточнить степень фиброза почек и могут использоваться в качестве дополнительного прогностического фактора, позволяющего прогнозировать скорость прогрессирования ХБП.
Источник
