Испарение в закрытом сосуде

Главная
Онлайн учебники
База репетиторов России
Тренажеры по физике
Подготовка к ЕГЭ 2017 онлайн
Глава 3. Молекулярная физика и термодинамика
Молекулярно-кинетическая теория
3.4. Испарение, конденсация, кипение. Насыщенные и ненасыщенные пары
Любое вещество при определенных условиях может находиться в различных агрегатных состояниях – твердом, жидком и газообразном. Переход из одного состояния в другое называется фазовым переходом. Испарение и конденсация являются примерами фазовых переходов.
Все реальные газы (кислород, азот, водород и т. д.) при определенных условиях способны превращаться в жидкость. Однако такое превращение может происходить только при температурах ниже определенной, так называемой критической температуры Tкр. Например, для воды критическая температура равна 647,3 К, для азота 126 К, для кислорода 154,3 К. При комнатной температуре (≈ 300 К) вода может находиться и в жидком, и в газообразном состояниях, а азот и кислород существуют только в виде газов.
Испарением называется фазовый переход из жидкого состояния в газообразное. С точки зрения молекулярно-кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, т. е. к охлаждению жидкости (если нет подвода энергии от окружающих тел).
Конденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость.
 |
Модель. |
В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, т. е. когда скорости процессов испарения и конденсации одинаковы. Такую систему называют двухфазной. Пар, находящийся в равновесии со своей жидкостью, называют насыщенным.
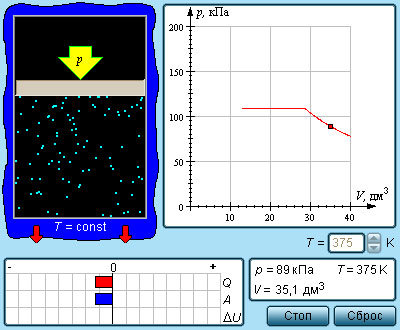
Число молекул, вылетающих с единицы площади поверхности жидкости за одну секунду, зависит от температуры жидкости. Число молекул, возвращающихся из пара в жидкость, зависит от концентрации молекул пара и от средней скорости их теплового движения, которая определяется температурой пара. Отсюда следует, что для данного вещества концентрация молекул пара при равновесии жидкости и ее пара определяется их равновесной температурой. Установление динамического равновесия между процессами испарения и конденсации при повышении температуры происходит при более высоких концентрациях молекул пара. Так как давление газа (пара) определяется его концентрацией и температурой, то можно сделать вывод: давление насыщенного пара p0 данного вещества зависит только от его температуры и не зависит от объема. Поэтому изотермы реальных газов на плоскости (p, V) содержат горизонтальные участки, соответствующие двухфазной системе (рис. 3.4.1).
| Рисунок 3.4.1. Изотермы реального газа. Область I – жидкость, область II – двухфазная система «жидкость + насыщенный пар», область III – газообразное вещество. K – критическая точка |
При повышении температуры давление насыщенного пара и его плотность возрастают, а плотность жидкости уменьшается из-за теплового расширения. При температуре, равной критической температуре Tкр для данного вещества, плотности пара и жидкости становятся одинаковыми. При T > Tкр исчезают физические различия между жидкостью и ее насыщенным паром.
Если изотермически сжимать ненасыщенный пар при T < Tкр, то его давление будет возрастать, пока не станет равным давлению насыщенного пара. При дальнейшем уменьшении объема на дне сосуда образуется жидкость и устанавливается динамическое равновесие между жидкостью и ее насыщенным паром. С уменьшением объема все большая часть пара конденсируется, а его давление остается неизменным (горизонтальный участок на изотерме). Когда весь пар превращается в жидкость, давление резко возрастает при дальнейшем уменьшении объема вследствие малой сжимаемости жидкости.
Из газообразного состояния в жидкое можно перейти, минуя двухфазную область. Для этого нужно совершить процесс в обход критической точки K. Один из возможных процессов такого рода показан на рис. 3.4.1 ломаной линией ABC.
 |
Модель. |
В атмосферном воздухе всегда присутствуют пары воды при некотором парциальном давлении p, которое, как правило, меньше давления насыщенного пара p0. Отношение p / p0, выраженное в процентах, называется относительной влажностью воздуха.
Ненасыщенный пар можно теоретически описывать с помощью уравнения состояния идеального газа при обычных для реальных газов ограничениях: давление пара должно быть не слишком велико (практически p ≤ (106–107) Па), а его температура выше некоторого определенного для каждого вещества значения. К насыщенному пару также можно приближенно применять законы идеального газа при условии, что для каждой температуры T давление p0 насыщенного пара определяется по кривой равновесия p0(T) для данного вещества.
Давление p0 насыщенного пара очень быстро возрастает с ростом температуры T. Зависимость p0 (T) нельзя получить из законов идеального газа. Давление газа при постоянной концентрации молекул растет прямо пропорционально температуре. В насыщенном паре при повышении температуры возрастает не только средняя кинетическая энергия движения молекул, но и их концентрация. Поэтому давление насыщенного пара при повышении температуры возрастает быстрее, чем давление идеального газа при постоянной концентрации молекул.
Испарение может происходить не только с поверхности, но и в объеме жидкости. В жидкости всегда имеются мельчайшие пузырьки газа. Если давление насыщенного пара жидкости равно внешнему давлению (т. е. давлению газа в пузырьках) или превышает его, жидкость будет испаряться внутрь пузырьков. Пузырьки, наполненные паром, расширяются и всплывают на поверхность. Этот процесс называется кипением. Таким образом, кипение жидкости начинается при такой температуре, при которой давление ее насыщенных паров становится равным внешнему давлению.
В частности, при нормальном атмосферном давлении вода кипит при температуре 100 °С. Это значит, что при такой температуре давление насыщенных паров воды равно 1 атм. При подъеме в горы атмосферное давление уменьшается, и поэтому температура кипения воды понижается (приблизительно на 1 °С на каждые 300 метров высоты). На высоте 7 км давление составляет примерно 0,4 атм, и температура кипения понижается до 70 °С.
В герметически закрытом сосуде жидкость кипеть не может, т. к. при каждом значении температуры устанавливается равновесие между жидкостью и ее насыщенным паром. По кривой равновесия p0 (T) можно определять температуру кипения жидкости при различных давлениях.
Изображенная на рис. 3.4.1 картина изотерм реального газа описывает процессы испарения и конденсации, т. е. фазовый переход между газообразной и жидкой фазами вещества. На самом деле эта картина является неполной, т. к. из газообразного и жидкого любое вещество может перейти в твердое состояние. При заданной температуре T термодинамическое равновесие между двумя фазами одного и того же вещества возможно лишь при определенном значении давления в системе. Зависимость равновесного давления от температуры называется кривой фазового равновесия. Примером может служить кривая равновесия p0 (T) насыщенного пара и жидкости. Если кривые равновесия между различными фазами данного вещества построить на плоскости (p, T), то они разбивают эту плоскость на отдельные области, в которых вещество существует в однородном агрегатном состоянии – твердом, жидком или газообразном (рис. 3.4.2). Изображенные в координатной системе (p, T) кривые равновесия называются фазовой диаграммой.
| Рисунок 3.4.2. Типичная фазовая диаграмма вещества. K – критическая точка, T – тройная точка. Область I – твердое тело, область II – жидкость, область III – газообразное вещество |
Кривая 0T, соответствующая равновесию между твердой и газообразной фазами, называется кривой сублимации. Кривая TK равновесия между жидкостью и паром называется кривой испарения, она обрывается в критической точке K. Кривая TM равновесия между твердым телом и жидкостью называется кривой плавления.
Кривые равновесия сходятся в точке T, в которой могут сосуществовать в равновесии все три фазы. Эта точка называется тройной точкой.
Для многих веществ давление pтр в тройной точке меньше 1 атм ≈ 105 Па. Такие вещества при нагревании при атмосферном давлении плавятся. Например, тройная точка воды имеет координаты Tтр = 273,16 К, pтр = 6,02·102 Па и используется в качестве опорной для калибровки абсолютной температурной шкалы Кельвина (см. §3.2). Существуют, однако, и такие вещества, у которых pтр превышает 1 атм. Так для углекислоты (CO2) давление pтр = 5,11 атм и температура Tтр = 216,5 К. Поэтому при атмосферном давлении твердая углекислота может существовать только при низкой температуре, а в жидком состоянии при p = 1 атм она вообще не существует. В твердом состоянии в равновесии со своим паром при атмосферном давлении углекислота находится при температуре 173 К или –80 °С. Это широко применяемый «сухой лед», который никогда не плавится, а только испаряется (сублимирует).
Источник
Èñïàðåíèå.
Èñïàðåíèå — ýòî ïåðåõîä âåùåñòâà èç æèäêîãî ñîñòîÿíèÿ â ãàçîîáðàçíîå (ïàð), ïðîèñõîäÿùåå ñî ñâîáîäíîé ïîâåðõíîñòè æèäêîñòè.
Ñóáëèìàöèþ, èëè âîçãîíêó, ò.å. ïåðåõîä âåùåñòâà èç òâåðäîãî ñîñòîÿíèÿ â ãàçîîáðàçíîå, òàêæå íàçûâàþò èñïàðåíèåì.
Èç ïîâñåäíåâíûõ íàáëþäåíèé èçâåñòíî, ÷òî êîëè÷åñòâî ëþáîé æèäêîñòè (áåíçèíà, ýôèðà, âîäû), íàõîäÿùåéñÿ â îòêðûòîì ñîñóäå, ïîñòåïåííî óìåíüøàåòñÿ. Æèäêîñòü íå èñ÷åçàåò áåññëåäíî — îíà ïðåâðàùàåòñÿ â ïàð. Èñïàðåíèå — ýòî îäèí èç âèäîâ ïàðîîáðàçîâàíèÿ. Äðóãîé âèä — ýòî êèïåíèå.
Ìåõàíèçì èñïàðåíèÿ.
Êàê ïðîèñõîäèò èñïàðåíèå? Ìîëåêóëû ëþáîé æèäêîñòè íàõîäÿòñÿ â íåïðåðûâíîì è áåñïîðÿäî÷íîì äâèæåíèè, ïðè÷åì, ÷åì âûøå òåìïåðàòóðà æèäêîñòè, òåì áîëüøå êèíåòè÷åñêàÿ ýíåðãèÿ ìîëåêóë. Ñðåäíåå çíà÷åíèå êèíåòè÷åñêîé ýíåðãèè èìååò îïðåäåëåííóþ âåëè÷èíó. Íî ó êàæäîé ìîëåêóëû êèíåòè÷åñêàÿ ýíåðãèÿ ìîæåò áûòü êàê áîëüøå, òàê è ìåíüøå ñðåäíåé. Åñëè âáëèçè ïîâåðõíîñòè îêàæåòñÿ ìîëåêóëà ñ êèíåòè÷åñêîé ýíåðãèåé, äîñòàòî÷íîé äëÿ ïðåîäîëåíèÿ ñèë ìåæìîëåêóëÿðíîãî ïðèòÿæåíèÿ, îíà âûëåòèò èç æèäêîñòè. Òî æå ñàìîå ïîâòîðèòñÿ ñ äðóãîé áûñòðîé ìîëåêóëîé, ñî âòîðîé, òðåòüåé è ò. ä. Âûëåòàÿ íàðóæó, ýòè ìîëåêóëû îáðàçóþò íàä æèäêîñòüþ ïàð. Îáðàçîâàíèå ýòîãî ïàðà è åñòü èñïàðåíèå.
Ïîãëîùåíèå ýíåðãèè ïðè èñïàðåíèè.
Ïîñêîëüêó ïðè èñïàðåíèè èç æèäêîñòè âûëåòàþò áîëåå áûñòðûå ìîëåêóëû, ñðåäíÿÿ êèíåòè÷åñêàÿ ýíåðãèÿ îñòàâøèõñÿ â æèäêîñòè ìîëåêóë ñòàíîâèòñÿ âñå ìåíüøå è ìåíüøå. Ýòî çíà÷èò, ÷òî âíóòðåííÿÿ ýíåðãèÿ èñïàðÿþùåéñÿ æèäêîñòè óìåíüøàåòñÿ. Ïîýòîìó åñëè íåò ïðèòîêà ýíåðãèè ê æèäêîñòè èçâíå, òåìïåðàòóðà èñïàðÿþùåéñÿ æèäêîñòè ïîíèæàåòñÿ, æèäêîñòü îõëàæäàåòñÿ (èìåííî ïîýòîìó, â ÷àñòíîñòè, ÷åëîâåêó â ìîêðîé îäåæäå õîëîäíåå, ÷åì â ñóõîé, îñîáåííî ïðè âåòðå).
Îäíàêî ïðè èñïàðåíèè âîäû, íàëèòîé â ñòàêàí, ìû íå çàìå÷àåì ïîíèæåíèÿ åå òåìïåðàòóðû. ×åì ýòî îáúÿñíèòü? Äåëî â òîì, ÷òî èñïàðåíèå â äàííîì ñëó÷àå ïðîèñõîäèò ìåäëåííî, è òåìïåðàòóðà âîäû ïîääåðæèâàåòñÿ ïîñòîÿííîé çà ñ÷åò òåïëîîáìåíà ñ îêðóæàþùèì âîçäóõîì, èç êîòîðîãî â æèäêîñòü ïîñòóïàåò íåîáõîäèìîå êîëè÷åñòâî òåïëîòû. Çíà÷èò, ÷òîáû èñïàðåíèå æèäêîñòè ïðî èñõîäèëî áåç èçìåíåíèÿ åå òåìïåðàòóðû, æèäêîñòè íåîáõîäèìî ñîîáùàòü ýíåðãèþ.
Êîëè÷åñòâî òåïëîòû, êîòîðîå íåîáõîäèìî ñîîáùèòü æèäêîñòè äëÿ îáðàçîâàíèÿ åäèíèöû ìàññû ïàðà ïðè ïîñòîÿííîé òåìïåðàòóðå, íàçûâàåòñÿ òåïëîòîé ïàðîîáðàçîâàíèÿ.
Ñêîðîñòü èñïàðåíèÿ æèäêîñòè.
 îòëè÷èå îò êèïåíèÿ, èñïàðåíèå ïðîèñõîäèò ïðè ëþáîé òåìïåðàòóðå, îäíàêî ñ ïîâûøåíèåì òåìïåðàòóðû æèäêîñòè ñêîðîñòü èñïàðåíèÿ âîçðàñòàåò. ×åì âûøå òåìïåðàòóðà æèäêîñòè, òåì áîëüøå áûñòðî äâèæóùèõñÿ ìîëåêóë èìååò äîñòàòî÷íóþ êèíåòè÷åñêóþ ýíåðãèþ, ÷òîáû ïðåîäîëåòü ñèëû ïðèòÿæåíèÿ ñîñåäíèõ ÷àñòèö è âûëåòåòü çà ïðåäåëû æèäêîñòè, è òåì áûñòðåå èäåò èñïàðåíèå.
Ñêîðîñòü èñïàðåíèÿ çàâèñèò îò ðîäà æèäêîñòè. Áûñòðî èñïàðÿþòñÿ ëåòó÷èå æèäêîñòè, ó êîòîðûõ ñèëû ìåæìîëåêóëÿðíîãî âçàèìîäåéñòâèÿ ìàëû (íàïðèìåð, ýôèð, ñïèðò, áåíçèí). Åñëè êàïíóòü òàêîé æèäêîñòüþ íà ðóêó, ìû îùóòèì õîëîä. Èñïàðÿÿñü ñ ïîâåðõíîñòè ðóêè, òàêàÿ æèäêîñòü áóäåò îõëàæäàòüñÿ è îòáèðàòü ó íåå íåêîòîðîå êîëè÷åñòâî òåïëîòû.
Ñêîðîñòü èñïàðåíèÿ æèäêîñòè çàâèñèò îò ïëîùàäè åå ñâîáîäíîé ïîâåðõíîñòè. Ýòî îáúÿñíÿåòñÿ òåì, ÷òî æèäêîñòü èñïàðÿåòñÿ ñ ïîâåðõíîñòè, è ÷åì áîëüøå ïëîùàäü ñâîáîäíîé ïîâåðõíîñòè æèäêîñòè, òåì áîëüøåå êîëè÷åñòâî ìîëåêóë îäíîâðåìåííî âûëåòàåò â âîçäóõ.
 îòêðûòîì ñîñóäå ìàññà æèäêîñòè âñëåäñòâèå èñïàðåíèÿ ïîñòåïåííî óìåíüøàåòñÿ. Ýòî ñâÿçàíî ñ òåì, ÷òî áîëüøèíñòâî ìîëåêóë ïàðà ðàññåèâàåòñÿ â âîçäóõå, íå âîçâðàùàÿñü â æèäêîñòü (â îòëè÷èå îò òîãî, ÷òî ïðîèñõîäèò â çàêðûòîì ñîñóäå). Íî íåáîëüøàÿ ÷àñòü èõ âîçâðàùàåòñÿ â æèäêîñòü, çàìåäëÿÿ òåì ñàìûì èñïàðåíèå. Ïîýòîìó ïðè âåòðå, êîòîðûé óíîñèò ìîëåêóëû ïàðà, èñïàðåíèå æèäêîñòè ïðîèñõîäèò áûñòðåå.
Ïðèìåíåíèå èñïàðåíèÿ â òåõíèêå.
Èñïàðåíèå èãðàåò âàæíóþ ðîëü â ýíåðãåòèêå, õîëîäèëüíîé òåõíèêå, â ïðîöåññàõ ñóøêè, èñïàðèòåëüíîãî îõëàæäåíèÿ. Íàïðèìåð, â êîñìè÷åñêîé òåõíèêå áûñòðîèñïàðÿþùèìèñÿ âåùåñòâàìè ïîêðûâàþò ñïóñêàåìûå àïïàðàòû. Ïðè ïðîõîæäåíèè ÷åðåç àòìîñôåðó ïëàíåòû êîðïóñ àïïàðàòà â ðåçóëüòàòå òðåíèÿ íàãðåâàåòñÿ, è ïîêðûâàþùåå åãî âåùåñòâî íà÷èíàåò èñïàðÿòüñÿ. Èñïàðÿÿñü, îíî îõëàæäàåò êîñìè÷åñêèé àïïàðàò, ñïàñàÿ åãî òåì ñàìûì îò ïåðåãðåâà.
Êîíäåíñàöèÿ.
Êîíäåíñàöèÿ (îò ëàò. condensatio — óïëîòíåíèå, ñãóùåíèå) — ïåðåõîä âåùåñòâà èç ãàçîîáðàçíîãî ñîñòîÿíèÿ (ïàðà) â æèäêîå èëè òâåðäîå ñîñòîÿíèå.
Èçâåñòíî, ÷òî ïðè íàëè÷èè âåòðà æèäêîñòü èñïàðÿåòñÿ áûñòðåå. Ïî÷åìó? Äåëî â òîì, ÷òî îäíîâðåìåííî ñ èñïàðåíèåì ñ ïîâåðõíîñòè æèäêîñòè èäåò è êîíäåíñàöèÿ. Êîíäåíñàöèÿ ïðîèñõîäèò èç-çà òîãî, ÷òî ÷àñòü ìîëåêóë ïàðà, áåñïîðÿäî÷íî ïåðåìåùàÿñü íàä æèäêîñòüþ, ñíîâà âîçâðàùàåòñÿ â íåå. Âåòåð æå âûíîñèò âûëåòåâøèå èç æèäêîñòè ìîëåêóëû è íå äàåò èì âîçâðàùàòüñÿ.
Êîíäåíñàöèÿ ìîæåò ïðîèñõîäèòü è òîãäà, êîãäà ïàð íå ñîïðèêàñàåòñÿ ñ æèäêîñòüþ. Èìåííî êîíäåíñàöèåé îáúÿñíÿåòñÿ, íàïðèìåð, îáðàçîâàíèå îáëàêîâ: ìîëåêóëû âîäÿíîãî ïàðà, ïîäíèìàþùèåñÿ íàä çåìëåé, â áîëåå õîëîäíûõ ñëîÿõ àòìîñôåðû ãðóïïèðóþòñÿ â ìåëü÷àéøèå êàïåëüêè âîäû, ñêîïëåíèÿ êîòîðûõ è ïðåäñòàâëÿþò ñîáîé îáëàêà. Ñëåäñòâèåì êîíäåíñàöèè âîäÿíîãî ïàðà â àòìîñôåðå ÿâëÿþòñÿ òàêæå äîæäü è ðîñà.
Ïðè èñïàðåíèè æèäêîñòü îõëàæäàåòñÿ è, ñòàâ áîëåå õîëîäíîé, ÷åì îêðóæàþùàÿ ñðåäà, íà÷èíàåò ïîãëîùàòü åå ýíåðãèþ. Ïðè êîíäåíñàöèè æå, íàîáîðîò, ïðîèñõîäèò âûäåëåíèå íåêîòîðîãî êîëè÷åñòâà òåïëîòû â îêðóæàþùóþ ñðåäó, è åå òåìïåðàòóðà íåñêîëüêî ïîâûøàåòñÿ. Êîëè÷åñòâî òåïëîòû, âûäåëÿþùååñÿ ïðè êîíäåíñàöèè åäèíèöû ìàññû, ðàâíî òåïëîòå èñïàðåíèÿ.
Источник
Конспект по физике для 8 класса «Испарение и конденсация. Насыщенный пар». ВЫ УЗНАЕТЕ: Какие виды парообразования существуют. Что такое испарение. От каких факторов зависит скорость испарения. Что такое динамическое равновесие. Что такое насыщенный и ненасыщенный пар.
Конспекты по физике Учебник физики Тесты по физике
Испарение и конденсация.
Насыщенный пар
Нам всем хорошо известно, что роса, появившаяся утром на траве, к полудню исчезает, лужи после дождя высыхают, уровень воды в реках и озёрах летом уменьшается. Жидкость в открытом сосуде со временем постепенно убывает. Однако молекулы жидкости не могут исчезнуть бесследно, просто жидкость превращается в пар.
ВИДЫ ПАРООБРАЗОВАНИЯ
Существует два способа перехода вещества из жидкого состояния в газообразное: испарение и кипение.
ИСПАРЕНИЕ
Парообразование, происходящее с поверхности жидкости, называется испарением.
Почему жидкость испаряется? Известно, что молекулы жидкости находятся в состоянии непрерывного и хаотического движения. При этом молекулы имеют различные скорости движения и, следовательно, разные кинетические энергии. Когда у поверхности жидкости оказывается молекула с относительно большой скоростью, она может преодолеть силы притяжения соседних молекул и вылететь из жидкости. Молекулы, покинувшие поверхность жидкости, образуют над ней пар. Это и есть процесс испарения жидкости.
СКОРОСТЬ ИСПАРЕНИЯ
Из повседневной жизни известно, что лужи после дождя высыхают и в прохладную погоду, и в жару. Однако в одном случае испарение происходит медленнее, в другом — быстрее. Почему? В жидкости всегда имеются молекулы, кинетическая энергия которых больше кинетической энергии других молекул, поэтому испарение происходит при любой температуре. Однако есть несколько факторов, влияющих на скорость испарения. Это температура, площадь поверхности жидкости, движение воздуха (ветер) и род жидкости. Чем выше температура жидкости, тем больше средняя скорость движения молекул и тем больше молекул, у которых кинетическая энергия достаточна для того, чтобы преодолеть притяжение соседних молекул и вылететь с поверхности жидкости. Так как жидкость могут покинуть только те молекулы, которые находятся у самой поверхности, то, чем больше площадь испаряемой поверхности, тем большее число молекул покидают жидкость.
Молекула, вылетевшая из жидкости, двигаясь хаотично над поверхностью жидкости, может изменить направление своего движения и вернуться обратно. Если дует ветер, который уносит эти молекулы, то испарение жидкости происходит быстрее.
Если листок бумаги смочить эфиром, водой и маслом, то мы заметим, что эфир испарился значительно быстрее, чем вода, а вода — быстрее, чем масло. Это связано с тем, что между молекулами эфира силы взаимодействия меньше, чем между молекулами воды или масла. Поэтому большее число молекул эфира способно преодолеть силы притяжения и покинуть поверхность жидкости.
Следовательно, чем меньше силы взаимодействия между молекулами жидкости, тем быстрее происходит процесс испарения.
В жару лужи высыхают быстрее, потому что средняя кинетическая энергия молекул больше и большее их число покидает жидкость. Расправленное мокрое полотенце высыхает быстрее, чем скомканное, из-за разницы в площади поверхности. А в ветреную погоду мокрые вещи высыхают быстрее из-за того, что ветер относит водяные пары в сторону.
Из-за охлаждения жидкости при испарении человек в мокрой одежде мёрзнет, а в сухой нет. По этой же причине, выходя из воды, мы чувствуем прохладу даже в самый жаркий день.
ИЗМЕНЕНИЕ ВНУТРЕННЕЙ ЭНЕРГИИ ПРИ ИСПАРЕНИИ
Поскольку при испарении жидкость покидают молекулы, обладающие повышенной кинетической энергией, то средняя кинетическая энергия оставшихся молекул уменьшается. Следовательно, внутренняя энергия испаряющейся жидкости также уменьшается, что приводит к понижению её температуры.
Проведём следующий опыт. Конец термометра обмотаем ватой, смоченной эфиром (или водой). При этом показания термометра начнут уменьшаться, что свидетельствует о понижении температуры испаряющейся жидкости.
КОНДЕНСАЦИЯ
Одновременно с испарением происходит и обратный процесс — переход части молекул пара в жидкость. Явление превращения пара в жидкость называется конденсацией. Конденсация пара сопровождается выделением энергии.
ДИНАМИЧЕСКОЕ РАВНОВЕСИЕ И НАСЫЩЕННЫЙ ПАР
Когда сосуд открыт, процесс испарения происходит быстрее, чем обратный процесс конденсации. При этом масса жидкости в сосуде уменьшается. Если же испарение происходит в закрытом сосуде, то после того, как закрыли сосуд, число молекул, покидающих поверхность жидкости в единицу времени, будет больше числа молекул, возвращающихся обратно. При этом плотность паров жидкости в сосуде будет увеличиваться.
С увеличением числа молекул пара над поверхностью жидкости возрастает также число молекул, возвращающихся обратно в жидкость. Через некоторое время количество вылетающих из жидкости и возвращающихся молекул сравняется. Наступает динамическое равновесие между жидкостью и паром, когда число молекул пара над жидкостью становится постоянным. При динамическом равновесии масса жидкости в закрытом сосуде не изменяется, хотя процесс испарения продолжается.
Пар, находящийся в динамическом равновесии со своей жидкостью, называется насыщенным.
Пар, не находящийся в состоянии равновесия со своей жидкостью, называется ненасыщенным. В этом случае возможно дальнейшее испарение жидкости.
Прохладным летним утром мы можем видеть росу. Ночью, когда воздух становится холоднее, водяной пар, находящийся в воздухе, конденсируется и маленькие капельки воды оседают на траве и листьях. Выпадает роса.
Облака образуются также в процессе конденсации. Они состоят из маленьких капелек воды, в которые превратились водяные пары, поднявшиеся над землёй и попавшие в верхние, более холодные слои атмосферы.
Вы смотрели Конспект по физике для 8 класса «Испарение и конденсация. Насыщенный пар».
Вернуться к Списку конспектов по физике (Оглавление).
Просмотров:
1 329
Источник
