Изобарный в закрытом сосуде
Печатать книгу
| Сайт: | Профильное обучение |
| Курс: | Физика. 10 класс |
| Книга: | § 6. Изотермический, изобарный и изохорный процессы |
| Напечатано:: | Гость |
| Дата: | Суббота, 21 Ноябрь 2020, 18:17 |
Свойство газов существенно изменять предоставленный им объём широко используют в тепловых двигателях. Анализируя процессы, происходящие с газом в этих устройствах, важно знать, каким законам подчиняются газы и каковы условия применимости этих законов.
Процессы в газах часто происходят так, что изменяются только два параметра из пяти (p, V, T, m, M). Если при постоянных массе и молярной массе ещё один из макропараметров (p, V, T), входящих в уравнение состояния идеального газа, не изменяется, то такие процессы называют изопроцессами.
Изотермический процесс. Процесс изменения состояния физической системы при постоянной температуре (T = const) называют изотермическим.
Если при переходе из начального состояния в конечное масса и молярная масса идеального газа не изменяются, то из уравнения Клапейрона–Менделеева следует:
Давление данной массы газа при постоянных молярной массе и температуре обратно пропорционально его объёму.
Это утверждение называют законом Бойля–Мариотта.
Справедливость закона Бойля–Мариотта можно продемонстрировать экспериментально, используя установку, представленную на рисунке 18 в § 5.
Если медленно изменять объём газа, находящегося в сосуде, то вследствие теплообмена с окружающей средой можно поддерживать температуру газа в сосуде практически постоянной. При этом уменьшение объёма газа при вращении винта 3 повлечёт за собой увеличение его давления и некоторое незначительное увеличение температуры. И наоборот, увеличение объёма приведёт к уменьшению давления и некоторому незначительному уменьшению температуры газа*.
От теории к практике
1. Почему пузырьки воздуха, находящиеся в жидкости, поднимаясь вверх, увеличиваются в объёме?
2. Если, не отрываясь, выпить из пластиковой бутылки газированную воду, то можно обнаружить, что бутылка деформируется. Почему?
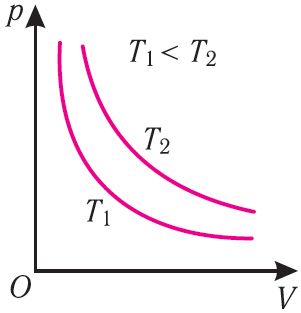 Рис. 22
Рис. 22График изотермического процесса, совершаемого идеальным газом, в координатах (p, V) представляет собой гиперболу (рис. 22). В физике такую кривую называют изотермой. Разным значениям температуры газа соответствуют разные изотермы. Согласно соотношениям (6.1) для одинаковых объёмов газов с одинаковыми количествами вещества и разными температурами чем больше давление, тем выше температура (рис. 22).
Многочисленные опыты показали, что исследованные газы подчиняются закону Бойля–Мариотта тем точнее, чем меньше их плотность. При значительном увеличении давления газа этот закон перестаёт выполняться.
От теории к практике
Изобразите графики изотермического процесса в координатах (p, T) и (V, T).
Интересно знать
Лёгкие расположены в грудной клетке, объём которой при дыхании периодически изменяется благодаря работе межрёберных мышц и диафрагмы. К огда грудная клетка расширяется, давление воздуха в лёгких становится меньше атмосферного, и воздух через воздухоносные пути устремляется в лёгкие — происходит вдох. При выдохе объём грудной клетки уменьшается, что вызывает уменьшение объёма лёгких. Давление воздуха в них становится выше атмосферного, и воздух из лёгких устремляется в окружающую среду.
* Незначительное изменение температуры газа принципиально необходимо для теплообмена с термостатом — передача тепла возможна только при разных температурах тел. ↑
Изобарный процесс. Процесс изменения состояния газа при постоянном давлении (p = const) называют изобарным.
В 1802 г. французский учёный Жозеф Гей-Люссак (1778–1850) рассмотрел этот процесс для воздуха, водорода, кислорода и азота.
Если при переходе из начального состояния в конечное масса и молярная масса газа не изменяются, то объём газа, как следует из уравнения Клапейрона–Менделеева:
Объём данной массы газа при постоянных молярной массе и давлении прямо пропорционален абсолютной температуре.
Это утверждение называют законом Гей-Люссака.
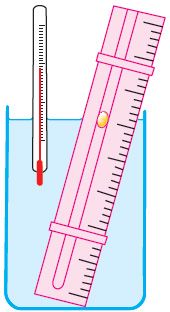 Рис. 23
Рис. 23Справедливость закона Гей-Люссака можно продемонстрировать экспериментально, используя установку, представленную на рисунке 23. Жидкость в сосуде находится в тепловом равновесии с тонкой трубкой, заполненной воздухом, запертым капелькой масла. При увеличении температуры жидкости объём воздуха, находящегося в трубке под капелькой масла, возрастает и капелька движется вверх. При уменьшении температуры объём воздуха уменьшается — и капелька движется вниз.
От теории к практике
Можно ли считать расширение газа при медленном нагревании его в цилиндре с подвижным поршнем изобарным процессом?
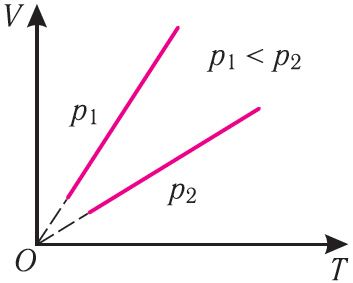 Рис. 24
Рис. 24Поскольку V ~ T, то в координатах (V, T) график изобарного процесса, совершаемого идеальным газом, представляет собой прямую линию, продолжение которой проходит через начало координат (рис. 24). Эту линию называют изобарой.
Изобара реальных газов не может быть продлена до нулевого значения температуры (на графике пунктирная линия), потому что при низких температурах все газы существенно отличаются от модели «идеальный газ» и при дальнейшем уменьшении температуры превращаются в жидкости.
В одних и тех же координатах (V, T) можно построить несколько изобар, которые соответствуют разным давлениям данной массы идеального газа при неизменной молярной массе. Анализ соотношений (6.2) позволяет сделать вывод, что большему давлению соответствует меньший наклон изобары к оси температур (см. рис. 24).
От теории к практике
Изобразите графики изобарного процесса в координатах (p, V) и (p, T).
Изохорный процесс. Процесс изменения состояния газа при постоянном объёме (V = const) называют изохорным.
Впервые этот процесс рассмотрел в 1787 г. французский учёный Жак Шарль (1746–1823)*.
Если при переходе из начального состояния в конечное масса и молярная масса идеального газа не изменяются, то давление газа, как следует из уравнения Клапейрона–Менделеева:
Давление данной массы газа при постоянных молярной массе и объёме прямо пропорционально абсолютной температуре.
Это утверждение называют законом Шарля.
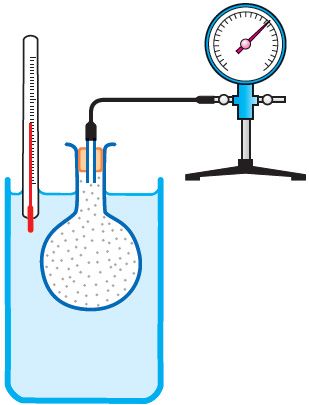 Рис. 25
Рис. 25Справедливость закона Шарля можно продемонстрировать экспериментально, используя установку, представленную на рисунке 25. Колба, наполненная воздухом и соединённая с манометром, находится в тепловом равновесии с жидкостью в сосуде. При увеличении температуры жидкости давление воздуха в колбе возрастает, а при уменьшении температуры — давление воздуха уменьшается.
От теории к практике
Идеальный газ определённой массы изохорно охлаждают так, что его температура уменьшается от t1 = 327 °С до t2 = 7 °С. Во сколько раз уменьшается давление газа?
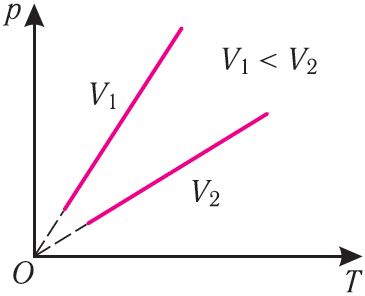 Рис. 26
Рис. 26В координатах (p, T) график изохорного процесса, совершаемого идеальным газом, представляет собой прямую линию, продолжение которой проходит через начало координат (рис. 26). Эту линию называют изохорой.
Как и в случае изобарного процесса, изохора реальных газов не может быть продлена до нулевого значения температуры.
В одних и тех же координатах (p, T) можно построить несколько изохор, соответствующих разным объёмам данной массы газа при неизменной молярной массе. Анализ соотношений (6.3) показывает, что большему объёму соответствует меньший наклон изохоры к оси температур (см. рис. 26).
От теории к практике
Изобразите графики изохорного процесса в координатах (p, V) и (V, T).
![]()
1. Как связаны давление и объём идеального газа при изотермическом процессе?
2. Как связаны объём и абсолютная температура идеального газа при изобарном процессе?
3. Как связаны давление и абсолютная температура идеального газа при изохорном процессе?
4. При выполнении каких условий справедлив каждый из законов изопроцессов в реальном газе?
5. Объём идеального газа определённой массы и неизменного химического состава изобарно увеличили в b = 1,5 раза, а затем давление газа изохорно уменьшили в c = 3 раза.
а) Как изменилась абсолютная температура газа в результате первого процесса?
б) Как изменилась абсолютная температура газа в результате второго процесса?
в) Во сколько раз начальная абсолютная температура газа отличается от его конечной температуры?
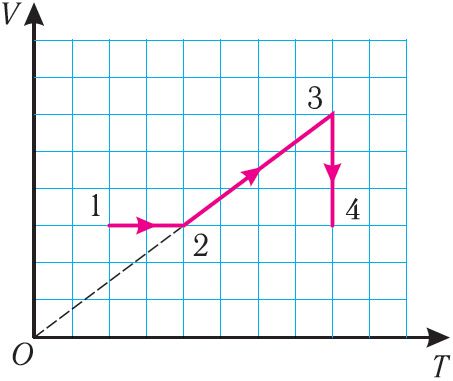 Рис. 27
Рис. 276. На рисунке 27 представлен график трёх процессов изменения состояния идеального газа определённой массы и неизменного химического состава.
а) Какому процессу соответствует участок 1 2 графика? Во сколько раз увеличилось давление газа в этом процессе?
б) Какому процессу соответствует участок 2 3 графика? Во сколько раз увеличились объём и абсолютная температура газа в этом процессе?
в) Какому процессу соответствует участок 3 4 графика? Как и во сколько раз изменились объём и давление газа в этом процессе?
г) Во сколько раз следует уменьшить температуру газа, чтобы изохорно перевести газ из состояния 4 в состояние 2?
* Несмотря на то что Шарль не опубликовал результаты своих исследований, история физики отдаёт приоритет открытия ему. ↑
Примеры решения задач
Решение. На участке 1 2 объём газа прямо пропорционален абсолютной температуре, следовательно, процесс перехода газа из состояния 1 в состояние 2 является изобарным. Из графика следует, что в состоянии 2 температура и объём газа больше в 4 раза, чем в состоянии 1. Следовательно, в процессе изобарного расширения некоторой массы газа из состояния 1 в состояние 2 температура и объём газа увеличились. Это можно записать таким образом:
переход , , , ,
происходит изобарное нагревание газа.
В процессе перехода газа из состояния 2 в состояние 3 остаётся постоянным объём (процесс изохорный), а температура газа уменьшается в 4 раза. Из соотношения (6.3) следует, что при изохорном охлаждении давление газа уменьшается пропорционально его абсолютной температуре. Поэтому можно записать:
переход , , ,
происходит изохорное охлаждение газа.
Процесс перехода газа из состояния 3 в состояние 1 — изотермический. При этом объём газа уменьшается в 4 раза, что влечёт за собой, согласно закону Бойля–Мариотта, увеличение давления газа в 4 раза:
переход , ,
происходит изотермическое сжатие газа.
Опираясь на сделанные выводы, представим все три процесса в координатах (p, V) и (p, T) (рис. 29, а, б).
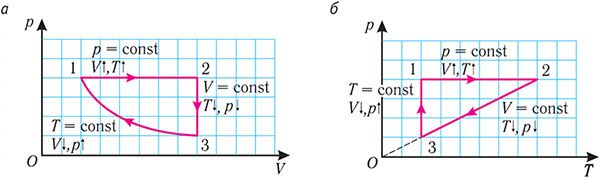 Рис. 29
Рис. 29
Пример 2. При изотермическом расширении идеального газа определённой массы его объём увеличился от V1 = 2,0 л до V2 = 5,0 л, а давление уменьшилось на Δp = –15 кПа. Определите первоначальное давление газа.
Дано:
V1 = 2,0 л = 2,0 · 10–3 м3
V2 = 5,0 л = 5,0 · 10–3 м3
Δp = –15 кПа = –1,5 · 104 Па
р1 — ?
Решение: Так как температура и масса газа не изменяются, то его начальное и конечное состояния связаны законом Бойля–Мариотта, т. е. . С учётом того, что , получим:
.
Откуда .
.
Ответ: .
![]()
Пример 3. В двух сосудах вместимостью V1 = 20 л и V2 = 30 л находятся химически не реагирующие идеальные газы, давления которых p1 = 1,0 МПа и p2 = 0,40 МПа соответственно. Определите давление газов в сосудах после того, как их соединили тонкой короткой трубкой. Температура газов до и после соединения сосудов одинаковая.
Дано:
V1 = 20 л = 2,0 · 10-2 м3
V2 = 30 л = 3,0 · 10-2 м3
p1 = 1,0 МПа = 1,0 · 106 Па
p2 = 0,40 МПа = 4,0 · 105 Па
T = const
р — ?
Решение: Давление смеси газов равно сумме парциальных давлений (закон Дальтона): . Найдём парциальное давление каждого газа после соединения сосудов. Так как температура и массы газов не изменяются, то начальное и конечное состояния каждого газа связаны законом Бойля–Мариотта, т. е.
, .
Следовательно, парциальные давления газов после соединения сосудов: , . Тогда .
Ответ: p = 0,64 МПа.
Упражнение 5
1. При изобарном увеличении температуры идеального газа, находящегося в герметично закрытом цилиндре, на ΔT = 60,0 К его объём увеличился в β = 1,21 раза. Определите начальную абсолютную температуру газа.
2. Изобразите графически процесс изобарного охлаждения определённой массы идеального газа в координатах (p, T); (V, T); (V, p).
3. Идеальный газ определённой массы сначала изобарно расширили, а затем изотермически сжали до первоначального объёма. Изобразите графически эти процессы в координатах (V, T); (p, V).
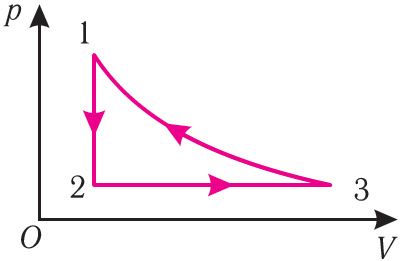 Рис. 30
Рис. 304. На рисунке 30 представлен график изменения состояния определённой массы идеального газа. (Переход 3 1 осуществляется при неизменной температуре.) Изобразите графически этот процесс в координатах (T, V) и (p, T).
5. При температуре t1 = –3,0 °С манометр на баллоне со сжатым кислородом показывал давление p1 = 1,8 · 106 Па, а при температуре t2 = 27 °С — давление p2 = 2,0 · 106 Па. Определите, была ли утечка газа из баллона.
![]()
6. В герметичном сосуде, заполненном воздухом (), лежит полый металлический шарик, диаметр которого d = 4,0 см, а масса m = 0,64 г. Определите минимальное значение давления воздуха, накачиваемого в сосуд, при котором бы шарик поднялся вверх, если температура t = 17 °С остаётся постоянной.
7. Идеальный газ, давление которого p1 = 4 · 105 Па, занимал объём V1 = 2 л. Сначала газ изотермически расширили до объёма V2 = 8 л, а затем изохорно нагрели, в результате чего его абсолютная температура увеличилась в α = 3 раза. Определите давление р3 газа в конце процесса, если при переходе из начального состояния в конечное масса газа оставалась неизменной.
Источник
Основными термодинамическими процессами являются:
1) процесс сообщения или отнятия теплоты при постоянном объеме газа (V=const) – изохорный процесс;
2) процесс сообщения или отнятия теплоты при постоянном давлении (P=const) – изобарный процесс;
3) процесс сообщения или отнятия теплоты при постоянной температуре (T=const) – изотермический процесс;
4) процесс без сообщения или отнятия теплоты извне (dq=0) – адиабатный процесс;
5) процесс, в котором изменение параметров подчиняется уравнению
,
где m – величина, постоянная для данного процесса, – политропный процесс.
В изохорном процессе зависимость между начальными и конечными параметрами определяется следующей зависимостью
(7.1)
Изменение внутренней энергии
(7.2)
Если в процессе участвует кг или м3 газа, то количество теплоты или изменение внутренней энергии газа
(7.3)
Задачи
7.1. Газ при давлении Р1=1МПа и температуре t1=20 ОС нагревается при постоянном объеме до t2=300 ОС. Найти конечное давление газа.
Ответ: Р2=1.956 МПа.
7.2. В закрытом сосуде емкостью V=0.3 м3 содержится 2.75 кг воздуха при давлении Р1=0.8 МПа и температуре t1=25 ОС. Определить давление и удельный объем после охлаждения воздуха до 0 ОС.
Ответ: Р2=0.732 МПа, v2=0.109 м3/кг.
7.3. В закрытом сосуде заключен газ при разрежении Р1=6667 Па и температуре t1=70 ОС. Показание барометра – 101325 Па. До какой температуры нужно охладить газ, чтобы разрежение стало Р2=13 332 Па?
Решение:
Так как процесс происходит при V =const , то согласно формуле (7.1)
(101 325-6667)/(101 325-13332)=(273+70)/T2.
Отсюда
Т2=87993*343/94658=318.8 K; t2=45.8°С.
Ответ: t2=45.8 °С
7.4.До какой температуры t2 нужно нагреть газ при V=const , если начальное давление газа P1=0.2 МПа и температура t1=20 °С, а конечное давление P2=0.5 МПа.
Ответ: До t2=459.5 °С.
7.5. В закрытом сосуде емкостью V=0.6 м3 содержится воздух при давлении р1=0.5 МПа и температуре t1=20 °С. В результате охлаждения сосуда воздух, содержащийся в нем, теряет 105 кДж. Принимая теплоемкость воздуха постоянной, определить, какое давление и какая температура устанавливаются после этого в сосуде.
Решение:
Пользуясь уравнением состояния, находим массу воздуха в сосуде
M=РV/RT=0.5∙106∙0.6/287∙293=3.57 кг.
Количество теплоты, отводимой от воздуха в процессе, определяется уравнением
Q=Mcvm(t2-t1)
откуда
t2=Q/Mcvm+t1= -105/3.57∙0.723+20= -40.7+20= -20.7 °С.
Значение сvm=0.723 получено из выражения cvm=mcvm/m=20.93/28.96 (для двухатомных газов).
Из соотношения параметров в изохорном процессе имеем
Р2=Р1∙Т2/Т1=0.5∙(273-20.7)/293=0.43 МПа.
Ответ: Р2=0.43 МПа
7.6. В закрытом сосуде емкостью V=0.5 м3 содержится двуокись углерода при р1=0.6 МПа и температуре t1=527 °С. Как изменится давление газа , если от него отнять 420 кДж? Принять зависимость С=f(t) линейной.
Ответ: р2=0.42 МПа.
7.7. Сосуд емкостью 90 л содержит воздух при давлении 0.8 МПа и температуре 30 °С. Определить количество теплоты, которое необходимо сообщить воздуху, чтобы повысить его давление при V=const до 1.6 МПа. Принять зависимость с=f(t) нелинейной.
Решение:
Из соотношения параметров изохорного процесса получим
Т2=Т1∙P2/P1=303∙1.6/0.8=606 К, t2=606-273=333°С.
По уравнению qv=cvm2t2-cvm1t1.
Пользуясь табл. 4.2,4.3 , находим
сvm1=0.7173 кДж/кг К ; cvm2=0.7351 кДж/кг К..
Следовательно,
qv=0.7351∙333-0.7173∙30=223.2 кДж/кг.
Массу воздуха, находящегося в резервуаре, определяем из уравнения
M=p1V1/RT1=0.8∙106∙0.09/287∙303=0.8278 кг,
а сообщенное ему количество теплоты
Qv=0.8278∙223.2=184.8 кДж.
7.8. До какой температуры нужно охладить 0.8 м3 воздуха с начальным давлением 0.3 МПа и температурой 15°С , чтобы давление при постоянном объеме понизилось до 0.1 МПа? Какое количество теплоты нужно для этого отвести? Теплоемкость воздуха принять постоянной.
Отв. До t2= -177°С; Q=- 402 кДж.
Дата добавления: 2014-11-13; просмотров: 306; Нарушение авторских прав
Источник
КПД тепловой машины.
Если понизить температуру холодильник при неизменной температуре нагревателя, КПД идеальной тепловой машины увеличится.
Формулы для КПД тепловой машины
η=(1-Tх/Tн)*100% – зависимость КПД тепловой машины от температуры нагревателя и холодильника.
η=((Тн-Тх)/Тн)*100% – развёрнутая формула.
В абсолютном смысле, КПД связан с работой газа А и количеством теплоты Q, полученным газом за цикл, соотношением: η=(A/Q)*100%
Qхол=Q-A
Qхол – количество теплоты, отданное холодильнику.
Поскольку при понижении температуры холодильника количество теплоты, полученное газом от нагревателя за цикл, не изменяется, заключаем, что работа газа за цикл увеличивается. Отданное количество теплоты холодильнику можно найти, вычитая из количества затраченной теплоты совершённую работу. Если повысить температуру холодильника при неизменной температуре нагревателя, КПД идеальной тепловой машины уменьшится (см. формулу в рамке слева).
КПД связан с работой газа и количеством теплоты, полученным газом за цикл, отношением количества совершённой работы к количеству затраченной теплоты. Таким образом, при повышении температуры холодильника работа газа за цикл уменьшится. Количество теплоты, отданное холодильнику, увеличится.
Совершённой за цикл механической работе тепловой машины на диаграмме p-V соответствует площадь внутри цикла на диаграмме. Если площадь двух равных циклов одинакова, значит одинакова и работа, совершённая в этих циклах. При увеличении давления, а также при увеличении объёма неизменного количества газа, его температура увеличивается. И напротив, при уменьшении объёма, а также при уменьшении давления, температура тоже уменьшается.
При изохорном увеличении давления температура газа увеличивается так, что всё поступающее от нагревателя тепло, расходуется на увеличение внутренней энергии, без совершения работы: Q=ΔU=(3/2)vRΔT.
При изобарном уменьшении объёма, всё поступающее тепло расходуется на увеличение объёма, без изменения внутренней энергии: Q=A=p0(V2-V1). Если в результате изменения цикла работа газа не изменяется, а передаваемое от нагревателя количество теплоты увеличивается, то КПД тепловой машины уменьшается.
Характеристики газа в закрытом сосуде
Для газа в герметично закрытом сосуде соблюдаются законы изохорных процессов. При изохорном охлаждении давление газа уменьшается, так как уменьшается кинетическая энергия молекул, а объём не меняется. Плотность газа не изменяется, так как не меняется объём, занимаемый газом, и не изменяется количество газа. Внутренняя энергия, как было отмечено, уменьшается, так как для фиксированного количества вещества зависит только от его температуры.
Внутренняя энергия газа
U=(i/2)vRT, где i – число степеней свободы газа.
Если же газ из сосуда выпускать или выкачивать наружу, то его количество в сосуде будет уменьшаться. Значит давление в сосуде будет уменьшаться, так как прежний объем занимает меньшее количество газа. Внутренняя энергия содержимого уменьшится, так как уменьшится количество молекул, а именно они и являются носителями этой энергии. Температура не изменится, если с внешней средой будет установлено тепловое равновесие (сначала температура снизится по идее, но потом извне поступит тепло). Если же сказано, что после выпускания газа давление в сосуде осталось неизменным, а плотность и количество уменьшились, значит была увеличена температура газа.
При изохорном нагревании концентрация молекул газа не изменяется; внутренняя энергия увеличивается, поскольку для фиксированного одноатомного идеального газаона зависит только от температуры: ΔU=(3/2)vRT. Поскольку объём фиксирован, теплоёмкость зависит только от количесвта теплоты и изменения температуры: c=Q/ΔT=ΔU/ΔT, так как всё поступающее тепло расходуется только на изменение внутренней энергии, ведь газ не совершает работу. В итоге все величины, от которых зависит теплоёмкость, в данном случае не изменяются, а значит и теплоёмкость не изменяется.
При изохорном уменьшении температуры, давление газа уменьшается, объём не изменяется, внутренняя энергия уменьшается. Внутренняя энергия в данном случае зависит только от температуры.
В изохорном процессе при неизменном количестве вещества, по закону Шарля, p/T=const.
Характеристика газа с постоянным давлением
Процессы, происходящие при постоянном давлении, называются изобарными.
При изобарном нагреванииV/T=const, значит объём газа увеличивается. Плотность обратно пропорциональна объёму и, так как количество газа не меняется, плотность газа уменьшается. Внутренняя энергия с увеличением температуры увеличивается.
При изобарном процессе, давление газа не меняется, при увеличении температуры объём увеличивается.
в изобарном процессе при неизменном количестве вещества,по закону Гей-Люссака, V/T=const.
Изотермические процессы
При изотермическом расширении температура газа остаётся неизменной, объём газа увеличивается, давление газа уменьшается, поскольку в изотермических процессах величина pV не изменяется, так как pV~T, T=const.
В изотермическом процессе при неизменном количестве вещества по закону Бойля-Мариотта, pV=const.
Адиабатические процессы
При адиабатическом увеличении объёма сосуда, температура уменьшается. Дело в том, что при расширении газ совершает работу, теплообмен с внешней средой отсутствует ,а значит внутренняя энергия уменьшается: Q=ΔU+A; ΔU=-A, т.к. Q=0 при адиабатическом процессе. Температура газа зависит только от его внутренней энергии, а значит, уменьшается. Объём увеличивается, а количество молекул газа не изменяется, а значит уменьшается концентрация: n=N/V. Давление связано с концентрацией молекул и температурой соотношением p=nKT. Таким образом, при адиабатическом увеличении объёма, давление уменьшится.
Внутренняя энергия, работа, температура
Согласно первому началу термодинамики, переданное газу количество теплоты идёт на изменение его внутренней энергии, а также на совершение газом работы против внешних сил: Q=ΔU+A.
Всё переданное газу количество теплоты идёт на совершение газом работы при изотермическом процессе, так как при постоянной температуре внутренняя энергия не изменяется. При изохорном процессе изменение внутренней энергии газа равно количеству переданной теплоты, так как при постоянном объёме газ не совершает работу.
При совершении газом положительной работы, его объём увеличивается, давление уменьшается (при изотермическом процессе), внутренняя энергия не изменяется.
Согласно первому началу термодинамики, внутреннюю энергию тела можно изменить, совершая над газом работу или передавая ему тепло. При плавлении льда, его температура не изменяется, а внутренняя энергия увеличивается. При выделении же тепла, внутренняя энергия вещества уменьшается. При кристаллизации воды, её температура не меняется, а внутренняя энергия уменьшается: Q=λm.
Температура при плавлении остаётся постоянной, поэтому постоянной будет и средняя кинетическая энергия движения молекул, но изменяется потенциальная энергия их взаимодействия. Следовательно, изменяется и сумма всех кинетических и потенциальных энергий всех молекул (внутренняя энергия). Из-за изменения взаимодействия молекул при кристаллизации уменьшается внутренняя энергия, а при плавлении – увеличивается.
Внутренняя энергия одноатомного идеального газа связана с его температурой соотношением U=(3/2)vRT. Следовательно, температура равна T=2U/(3vR). Давление, температура и занимаемый газом объём не независимы, они связаны уравнением состояния Менделеева-Клапейрона: pV=vRT. Таким образом, давление газа равно p=vRT/V=(2/3)*(U/V).
При изотермическом процессе, температура остаётся неизменной, поэтому внутренняя энергия идеального газа не меняется, а значит, согласно первому началу термодинамики, всё переданное тепло полностью превращается в работу.
При изобарном процессе, давление не изменяется, но меняются как температура, так и объём газа, а значит при передаче газу тепла в данном процессе, газ совершает работу, нагреваясь при этом, то есть кроме совершения работы, происходит увеличение внутренней энергии.
При изохорном процессе объём газа фиксирован, значит газ не может совершать работу, следовательно всё поступающее тепло идёт на увеличение внутренней энергии.
При постоянном давлении изменение внутренней энергии прямо пропорционально изменению объёма газа, так как внутренняя энергия напрямую зависит от температуры. Внутренняя энергия уменьшается с потерей температуры. Если изменение внутренней энергии положительно, значит абсолютная температура тела уменьшилась.
Теплоёмкость газа постоянна.
Насыщенный пар
При изотермическом уменьшении объёма сосуда с насыщенным паром, давление в сосуде не изменяется, масса конденсированной воды увеличивается, масса пара уменьшается. Это объясняется тем, что в данном процессе пар конденсируется и его концентрация не изменяется, но уменьшается объём (давление не меняется в отсутствии воздуха; в присутствии воздуха, суммарное давление газов увеличивается, парциальное давление пара не изменяется, парциальное давление воздуха увеличивается).
Сосуд с поршнем
Давление поршня на газ
p=mg/S
m – масса поршня;
g – ускорение свободного падения;
s – площадь поршня
Если система находится под атмосферным давлением, то давление газа под поршнем равно сумме давление поршня и атмосферного давления
При добавлении газа в сосуд с подвижным свободным поршнем, объём газа увеличивается, давление не изменяется. Поршень находится в равновесии, а значит pатмS+mg=pгазаS, так как поршень покоится. Увеличение количества вещества при неизменной температуре и давлении приведёт к увеличению объёма. Архимедова сила определяется плотностью среды, в которую помещено тело: FA=ρgVтела. Поскольку плотность газа не изменяется, сила Архимеда тоже неизменна.
При охлаждении газа под свободным поршнем, объём газа уменьшается, так как идёт изобарный процесс. Давление не изменится, а Архимедова сила, действующая на тело, находящееся в сосуде, увеличится, так как при уменьшении объёма количество газа осталось прежним, значит концентрация увеличилась, следовательно, увеличилась плотность газа, а сила Архимеда с увеличением плотности, увеличилась.
В газе, находящемся под свободным поршнем все процессы происходят изобарически. Переданное тепло идёт на работу газа против внешних сил, а также на увеличение внутренней энергии, а значит и температуры.
В результате изобарного расширения, да и вообще любого расширения газа, с фиксированным количеством вещества, концентрация молекул уменьшается.
Испарение жидкости
Испарение жидкости, в отличие от кипения, происходит при любой температуре. Процесс испарения воды представляет собой вылет молекул воды с поверхности жидкости. При этом преимущественно вылетают самые быстрые молекулы, и средняя кинетическая энергия движения молекул воды в сосуде уменьшается, а значит, уменьшается и температура жидкости, что можно подтвердить с помощью термометра (данный эффект используется для измерения влажности окружающего воздуха при помощи психрометра). Присутствует и обратный процесс, конденсация, но при относительной влажности воздуха ниже 100% процесс испарения преобладает. Если относительная влажность воздуха равна 100%, то количество испаряющихся в единицу времени молекул равно количеству конденсирующихся, а значит в среднем в сосуде количество молекул не изменяется. Если относительная влажность воздуха менее 100%, то количество молекул в сосуде постепенно уменьшается, а значит уменьшается внутренняя энергия и температура воды. При плавлении и кипении же температура не изменяется, но изменяется внутренняя энергия вещества. При испарении без кипения, чтобы молекулы жидкости переходили из жидкого состояния в газообразное, им тоже нужна добавка к энергии, которая идёт за счёт уменьшения средней энергии движения оставшихся молекул, в результате чего температура жидкости уменьшается.
при испарении жидкости без кипения, температура пара увеличивается, а температура жидкости уменьшается.
Тепловое равновесие
При установлении теплового равновесия, температуры всех тел сравниваются. Внутренние энергии тел разной температуры при тепловом контакте изменяются: внутренняя энергия горячего ела уменьшается, а холодного – увеличивается. Суммарная внутренняя энергия замкнутой системы не изменяется (по закону сохранения энергии).
Изохорный процесс
При постоянном объёме с увеличением внутренней энергии давление увеличивается прямо пропорционально.
Плавление и кристаллизация
Если 1 кг льда при температуре 0°С передать 330 кДж энергии (удельная теплота плавления льда равна 330 кДж/кг), то вся энергия будет израсходована на плавление, весь лёд растает. При этом его температура не изменится, внутренняя энергия увеличится, объём уменьшится. при кристаллизации же напротив, внутренняя энергия уменьшится, температура не изменится, объём увеличится.
Если в тёплую воду погрузить кусок льда, то когда он растает, уровень воды не изменится по сравнению с тем, что был тогда, когда погрузили лёд, так как несмотря на то, что объём льда уменьшился, его плотность была меньше, чем у воды, и он плавал на поверхности, вытесняя такой объём жидкости, который потом сам займёт, когда растает.
Источник
