Эмбриогенез оболочек кровеносных сосудов
Эмбриогенез гемомикроциркуляции. Развитие внутриорганной кровеносной системыСледовательно, морфология зрелой системы гемомикроциркуляции исследована довольно полно, чего нельзя сказать о полноте изучения ее развития в эмбриогенезе. Более того, можно с уверенностью утверждать, что в морфологической науке до сих пор нет четких представлений о том, за счет каких исходных структур, в какой последовательности и с помощью каких механизмов формируются сосудистые звенья системы гемомикроциркуляции в пренатальном онтогенезе человека. Современная биология располагает большим набором методических приемов, обеспечивающих успешное изучение многих проявлений эмбрионального морфогенеза. В исследованиях, касающихся построения кровеносного русла, особую ценность представляют методы, позволяющие выявлять сосуды всех блоков системы гемомикроциркуляции в их топографической взаимосвязи. Наш опыт показал, что в наибольшей степени этим требованиям отвечает пленочный морфологический метод. К сожалению, эмбриологами в работах по изучению ангиогенеза он почти не применяется, хотя высокая его информативность доказана. При изучении морфогенеза внутриорганной кровеносной системы в эмбриогенезе человека в качестве тест-объекта выбран большой сальник. Использован трупный материал 42 плодов с гестационным возрастом от 12-14 до 28 недель (масса тела от 60 до 1000 г), 108 недоношенных детей, родившихся с I (30 аутопсий), II (41), III (28) и IY (9) степенью незрелости (масса тела от 900 до 2500 г) и 48 доношенных зрелых детей, умерших от различных заболеваний в возрасте от 1-6 дней до 3 лет.
Сосуды в пленочных препаратах выявляли импрегнацией нитратом серебра (В.В.Куприянов, 1969) и гистохимическими методами с применением судана черного В или реактива Шиффа с докраской пленок толуидиновым синим (Н.Е.Ярыгин, С.В.Панченко, 1980). В ряде случаев исследование микрососудов проводили в серийных полутонких срезах, окрашенных метиленовым синим. Принято считать (Б.М.Пэттен, 1959; А.Г.Кнорре, 1967; В.В.Куприянов, 1969; О.В.Волкова, М.И.Пекарский, 1976; И.Станек, 1977; Б.Карлсон, 1983; И.И.Бобрик, В.Г.Черкасов, Е.А.Шевченко, А.И.Парахин, 1986; В.В.Куприянов, 1986; В.В.Куприянов, В.А.Миронов, А.А.Миронов, О.Ю.Гурина, 1993; Wagner, 1980; Merlen, 1983; Hudlicka, Tyler, 1986), что васкуляризация развивающихся органов в эмбриогенезе человека начинается с преобразования вазоформативных клеток мезенхимы в эндотелиоциты. Так, в эмбриональном зачатке органа образуются изолированные друг от друга островки из примордиального эндотелия, превращающиеся вскоре в первичные (презумптивные) кровеносные сосуды, получившие название протокапилляров, при анастомозирований которых формируются первичные капиллярные сети. В последующем первичное диффузное протокапиллярное русло ремоделируется во вторичное, органоспецифическое гемомикроциркуляторное русло. Этот переход проявляется редукцией части протокапилляров и конструированием в презумптивных сосудистых сетях артериолярного и венулярного звеньев за счет морфофункциональной перестройки сохранившихся первичных капилляров и новообразующихся на их основе вторичных (окончательных) капилляров. По мнению некоторых сторонников излагаемой концепции центральные и периферические звенья кровеносного русла в раннем пренатальном онтогенезе конструируются раздельно, а затем при «встречном» (от центра к периферии и от периферии к центру) росте сосудов соединяются. Однако убедительных доказательств в пользу возможного раздельного формирования центральных и периферических отделов кровеносной системы и реальности последующей их интеграции в эмбриологической литературе не приводится. – Также рекомендуем “Эмбриональный ангиогенез. Петлевидный ангиогенез” Оглавление темы “Микроциркуляция и мироциркуляторное русло”: |
Источник
Строение сосудов
Сердечно-сосудистая система (ССС) состоит из сердца, кровеносных и лимфатиче-ских сосудов.
Сосуды в эмбриогенезе формируются из мезенхимы. Они образуются из мезенхимы краевых зон сосудистой полоски желточного мешка или мезенхимы зародыша. В позднем эмбриональном развитии и после рождения сосуды формируются путем почкования от капилляров и посткапиллярных структур (венул и вен).
Кровеносные сосуды подразделяются на магистральные сосуды (артерии, вены) и сосуды микроциркуляторного русла (артериолы, прекапилляры, капилляры, посткапилляры и венулы). В магистральных сосудах — кровь течёт с большой скоростью и не происходит обмена крови с тканями, в сосудах микроциркуляторного русла кровь течёт медленно для лучшего обмена крови с тканями.
Все органы сердечно сосудистой системы являются полыми и, кроме сосудов системы микроциркуляторного русла, содержат три оболочки:
1. Внутренняя оболочка (интима) представлена внутренним эндотелиальным слоем. За ним располагается подэндотелиальный слой (РВСТ). Подэндотелиальный слой содержит большое количество малодифференцированных клеток, мигрирующих в среднюю оболочку, и нежные ретикулярные и эластические волокна. В артериях мышечного типа внутренняя оболочка отделена от средней оболочки внутренней эластической мембраной, представляющей собой скопление эластических волокон.
2. Средняя оболочка (медиа) в артериях состоит из гладких миоцитов, располагающихся по пологой спирали (почти циркулярно), эластических волокон или эластических мембран (в артериях эластического типа); В венах в ней могут быть гладкие миоциты (в венах мышечного типа) или преобладать соединительная ткань (вены безмышечного типа). В венах, в отличие от артерий, средняя оболочка (медия) значительно тоньше в сравнении с наружной оболочкой (адвентицией).
3. Наружная оболочка (адвентиция) образована РВСТ. В артериях мышечного типа имеется более тонкая, чем внутренняя – наружная эластическая мембрана.
Артерии
Артерии имеют в строении стенки 3 оболочки: интима, медиа, адвентиция. Артерии классифицируются в зависимости от преобладания эластических или мышечных элементов на артерии: 1) эластического, 2) мышечного и 3) смешанного типа.
В артериях эластического и смешанного типов в сравнении с артериями мышечного типа значительно толще подэндотелиальный слой. Среднюю оболочку в артериях эластического типа формируют окончатые эластические мембраны — скопление эластических волокон с зонами их редкого распределения («окнами»). Между ними имеются прослойки РВСТ с единичными гладкими миоцитами и клетками фибробластического ряда. В артериях мышечного типа — много гладкомышечных клеток. Чем дальше от сердца, тем располагаются артерии с преобладанием мышечного компонента: аорта — эластического типа, подключичная артерия — смешанного, плечевая — мышечного. Пример мышечного типа также — бедренная артерия.
Вены
Вены имеют в строении 3 оболочки: интима, медиа, адвентиция. Вены подразделяются на 1) безмышечные и 2) мышечные (со слабым, средним или сильным развитием мышечных элементов средней оболочки). Вены безмышечного типа располагаются на уровне головы, и наоборот — вены с сильным развитием мышечной оболочки на нижних конечностях. Вены с хорошо развитой мышечной оболочкой имеют клапаны. Клапаны образуются внутренней оболочкой вен. Такое распределение мышечных элементов связано с действием силы тяжести: из ног труднее поднимать кровь к сердцу, чем из головы, поэтому в голове — безмышечного типа, в ногах — с сильно развитым мышечным слоем (пример — бедренная вена).
Кровоснабжение сосудов ограничено наружными слоями средней оболочки и адвентицией, в то время как в венах капилляры достигают внутренней оболочки. Иннервация сосудов обеспечивается вегетативными афферентными и эфферентными нервными волокнами. Они формируют адвентициальное сплетение. Эфферентные нервные окончания достигают, в основном наружных областей средней оболочки и являются преимущественно адренергическими. Афферентные нервные окончания барорецепторов, реагирующие на давление, формируют локальные подэндотелиальные скопления в магистральных сосудах.
Важную роль в регуляции сосудистого мышечного тонуса, наряду с вегетативной нервной системой, играют биологически активные вещества, в том числе гормоны (адреналин, норадреналин, ацетилхолин и т. д.).
Кровеносные капилляры
Кровеносные капилляры содержат эндотелиоциты, лежащие на базальной мембране. Эндотелий имеет аппарат для обмена веществ, способен вырабатывать большое количество биологически активных факторов, в том числе эндотелины, оксид азота, противосвертывающие факторы и т.д., контролирующие сосудистый тонус, проницаемость сосудов. Тесно прилежат к сосудам адвентициальные клетки. В образовании базальных мембран капилляров принимают участие перициты, которые могут находиться в расщеплении мембраны.
Различают капилляры:
1. Соматического типа. Диаметр просвета 4-8 мкм. Эндотелий непрерывный, не фенестрирован (т.е. не истончён, фенестра — окошко в переводе). Базальная мембрана непрерывная, хорошо выражена. Хорошо развит слой перицитов. Имеются адвентициальные клетки. Такие капилляры располагаются в коже, мышцах, костях (то, что относят к соме), а также в органах, где надо защитить клетки — в составе гистогематических барьеров (мозг, гонады и т.д.)
2. Висцерального типа. Просвет до 8-12 мкм. Эндотелий непрерывный, фенестрирован (в области окошек практически отсутствует цитоплазма эндотелиоцита и его мембрана прилежит непосредственно к базальной мембране). Между эндотелиоцитами преобладают все типы контактов. Базальная мембрана истончена. Перицитов и адвентициальных клеток меньше. Такие капилляры встречаются во внутренних органах, например, в почках, где нужно обеспечить фильтрацию мочи.
3. Синусоидного типа. Диаметр просвета более 12 мкм. Эндотелиальный слой прерывистый. Эндотелиоциты образуют поры, люки, фенестры. Базальная мембрана прерывистая или отсутствует. Перицитов нет. Такие капилляры необходимы, где происходидт не только обмен веществ между кровью и тканями, но и «обмен клетками», т.е. в некоторых органах кровеобразования (красный костный мозг, селезёнка), или крупных веществ — в печени.
Артериолы и прекапилляры.
Артериолы имеют диаметр просвета до 50 мкм. Их стенка содержит 1-2 слоя гладких миоцитов. Эндотелий удлинен по ходу сосуда. Его поверхность ровная. Клетки характери-зуются хорошо развитым цитоскелетом, обилием десмосомальных, замковых, черепичных контактов.
Перед капиллярами артериола суживается и переходит в прекапилляр. Прекапилляры имеют более тонкую стенку. Мышечная оболочка представлена отдельными гладкими мио-цитами.
Посткапилляры и венулы.
Посткапилляры, имеют просвет меньшего диаметра, чем у венул. Строение стенки сходно со строением венулы.
Венулы имеют диаметр до 100 мкм. Внутренняя поверхность неровная. Цитоскелет развит слабее. Контакты, в основном простые, в «стык». Нередко эндотелий выше, чем в других сосудах микроциркуляторного русла. Через стенку венулы проникают клетки лей-коцитарного ряда, в основном в зонах межклеточных контактов. Наружные слои по особен-ностям строения аналогичны капиллярам.
Артериоло-венулярные анастомозы.
Кровь может поступать из артериальной систем в венозную, минуя капилляры, через артериоло-венулярные анастомозы (АВА). Выделяют истинные АВА (шунты) и атипичные АВА (полушунты). В полушунтах приносящий и выносящий сосуды соединены через ко-роткий, широкий капилляр. В результате в венулу попадает смешанная кровь. В истинных шунтах обмена между сосудом и органом не происходит и в вену попадает артериальная кровь. Истинные шунты подразделяются на простые (один анастомоз) и сложные (несколько анастомозов). Можно выделить шунты без специальных запирательных устройств (роль сфинктера играют гладкие миоциты) и со специальным сократительным аппаратом (эпителиоидные клетки, которые при набухании сдавливают анастомоз, закрывая шунт).
Лимфатические сосуды.
Лимфатические сосуды представлены микрососудами лимфатической системы (капиллярами и посткапиллярами), внутриорганными и внеорганными лимфатическими сосудами.
Лимфатические капилляры начинаются в тканям слепо, содержат тонкий эндотелий и истонченную базальную мембрану.
В стенке средних и крупных лимфатических сосудов имеется эндотелий, подэндотелиальный слой, мышечная оболочка и адвентициальная. По строению оболочек лимфатический сосуд напоминает вену мышечного типа. Внутренняя оболочка лимфатических сосудов формирует клапаны, которые являются неотьемлемым атрибутом всех лимфатиче-ских сосудов после капиллярного отдела.
Клиническое значение.
1. В организме к атеросклерозу наиболее чувствительны артерии и особенно эластического и мышечно-эластического типов. Это связано с гемодинамикой и диффузным характером трофического обеспечения внутренней оболочки, значительным ее развитием в этих артериях.
2. В венах клапанный аппарат наиболее развит в нижних конечностях. Это значительно облегчает движение крови против градиента гидростатического давления. Нарушение структуры клапанного аппарата приводит к грубому нарушению гемодинамики, отекам и варикозному расширению нижних конечностей.
3. Гипоксия и низкомолекулярные продукты разрушения клеток и анаэробного гликолиза являются одними из самых мощных факторов стимулирующих формирование новых кровеносных сосудов. Таким образом, области воспаления, гипоксии и т. д., характеризуются последующим бурным ростом микрососудов (ангиогенезом), что обеспечивает восстановление трофического обеспечения поврежденного органа и его регенерацию.
4. Антиангиогенные факторы, препятствующие росту новых сосудов, по мнению ряда современных авторов, могли бы стать одной из эффективных противоопу-холевых групп препаратов. Блокируя рост сосудов в быстро растущие опухоли, врачи, тем самым, могли бы вызвать гипоксию и гибель раковых клеток.
Источник
Оглавление темы “Развитие сердца и кровеносных сосудов.”:
1. Развитие сердца.
2. Развитие артерий.
3. Развитие вен.
4. Плацентарное кровообращение.
Развитие (эмбриогенез) артерий
Отражая переход в процессе филогенеза от жаберного круга кровообращения к легочному, у человека в процессе онтогенеза сначала закладываются аортальные дуги, которые затем преобразуются в артерии легочного и телесного кругов кровообращения. У 3-недельного зародыша truncus arteriosus, выходя из сердца, дает начало двум артериальным стволам, носящим название вентральных аорт (правой и левой). Вентральные аорты идут в восходящем направлении, затем поворачивают назад на спинную сторону зародыша; здесь они, проходя по бокам от хорды, идут уже в нисходящем направлении и носят название дорсальных аорт.
Дорсальные аорты постепенно сближаются друг с другом и в среднем отделе зародыша сливаются в одну непарную нисходящую аорту. По мере развития на головном конце зародыша жаберных дуг в каждой из них образуется так называемая аортальная дуга, или артерия; эти артерии соединяют между собой вентральную и дорсальную аорты на каждой стороне. Таким образом, в области жаберных дуг вентральные (восходящие) и дорсальные (нисходящие) аорты соединяются между собой при помощи 6 пар аортальных дуг.
В дальнейшем часть аортальных дуг и часть дорсальных аорт, особенно правой, редуцируется, а из оставшихся первичных сосудов развиваются крупные присердечные и магистральные артерии, а именно: truncus arteriosus, как отмечалось выше, делится фронтальной перегородкой на вентральную часть, из которой образуется легочный ствол, и дорсальную, превращающуюся в восходящую аорту. Этим объясняется расположение аорты позади легочного ствола.
Следует отметить, что последняя по току крови пара аортальных дуг, которая у двоякодышащих рыб и земноводных приобретает связь с легкими, превращается и у человека в две легочные артерии — правую и левую, ветви truncus pulmonalis. При этом, если правая шестая аортальная дуга сохраняется только на небольшом проксимальном отрезке, то левая остается на всем протяжении, образуя ductus arteriosus, который связывает легочный ствол с концом дуги аорты, что имеет значение для кровообращения плода (см. далее).
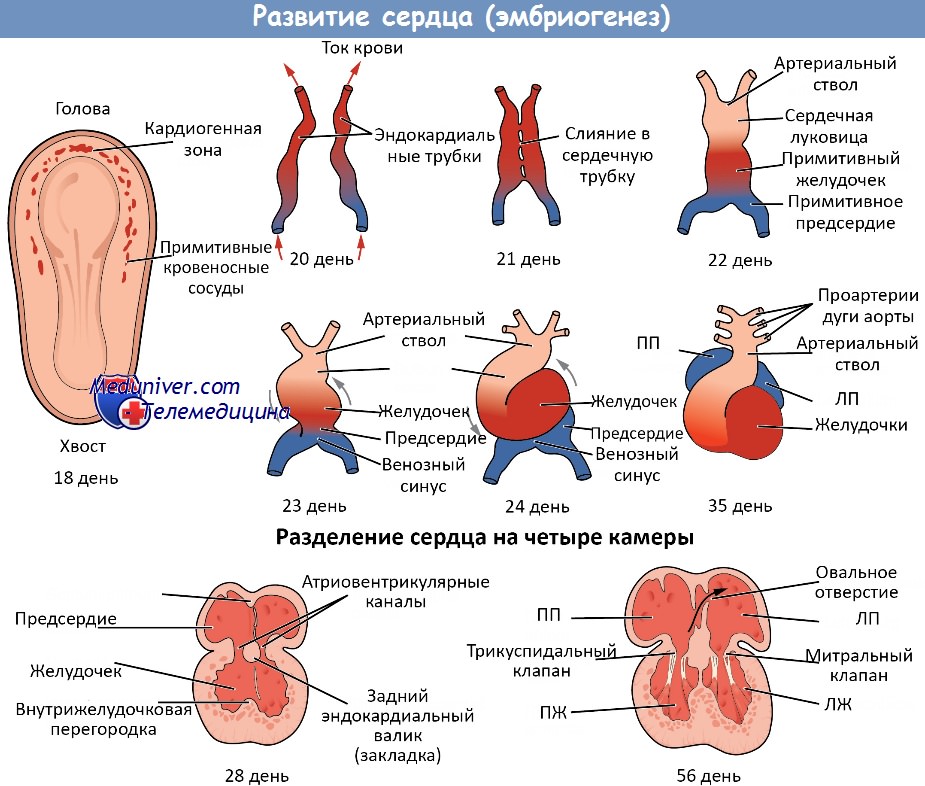
Четвертая пара аортальных дуг сохраняется на обеих сторонах на всем протяжении, но дает начало различным сосудам. Левая 4-я аортальная дуга вместе с левой вентральной аортой и частью левой дорсальной аорты образуют дугу аорты, arcus aortae.
Проксимальный отрезок правой вентральной аорты превращается в плечеголовной ствол, truncus blachiocephalicus, правая 4-я аортальная дуга — в отходящее от названного ствола начало правой подключичной артерии, a. subclavia dextra. Левая подключичная артерия вырастает из левой дорсальной аорты каудальнее последней аортальной дуги.
Дорсальные аорты на участке между 3-й и 4-й аортальными дугами облитерируются; кроме того, правая дорсальная аорта облитерируется также на протяжении от места отхождения правой подключичной артерии до слияния с левой дорсальной аортой.
Обе вентральные аорты на участке между четвертой и третьей аортальными дугами преобразуются в общие сонные артерии, аа. carotides communes, причем вследствие указанных выше преобразований проксимального отдела вентральной аорты правая общая сонная артерия оказывается отходящей от плечеголовного ствола, а левая — непосредственно от arcus aortae. На дальнейшем протяжении вентральные аорты превращаются в наружные сонные артерии, аа. carotides externae.
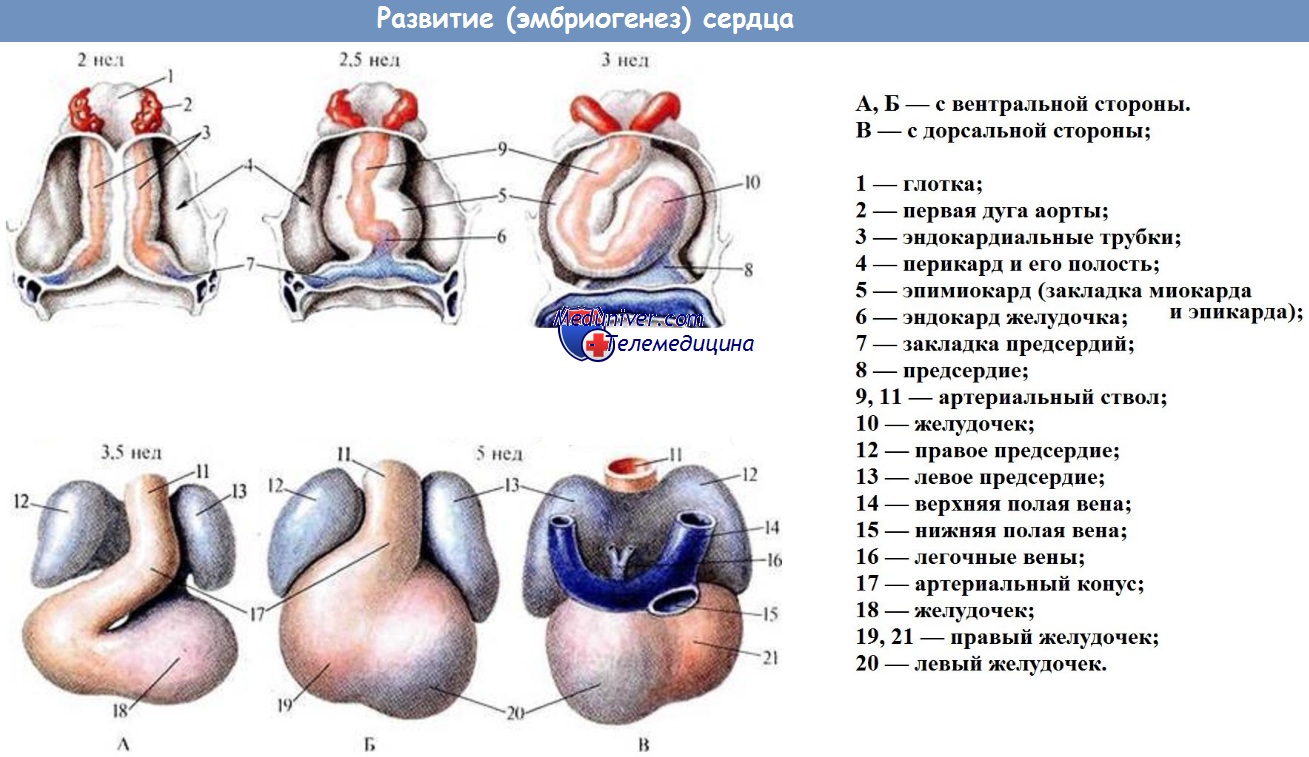
Третья пара аортальных дуг и дорсальные аорты на отрезке от третьей до первой жаберной дуги развиваются во внутренние сонные артерии, аа. carotides internae, чбм и объясняется, что внутренние сонные артерии лежат у взрослого латеральнее, чем наружные. Вторая пара аортальных дуг превращается в аа. linguales et pharyngeae, а первая пара — в челюстные, лицевые и височные артерии. При нарушении обычного хода развития возникают разные аномалии.
Из дорсальных аорт возникает ряд мелких парных сосудов, идущих в дорсальном направлении по обеим сторонам нервной трубки. Так как эти сосуды отходят через правильные интервалы в рыхлую мезенхимную ткань, расположенную между сомитами, они называются дорсальными межсегментарными артериями. В области шеи они по обеим сторонам тела рано соединяются серией анастомозов, образуя продольные сосуды — позвоночные артерии.
На уровне 6-й, 7-й и 8-й шейных межсегментарных артерий закладываются почки верхних конечностей. Одна из артерий, обычно 7-я, врастает в верхнюю конечность и с развитием руки увеличивается, образуя дистальный отдел подключичной артерии (проксимальный отдел ее развивается, как уже указывалось, справа из 4-й аортальной дуги, слева вырастает из левой дорсальной аорты, с которыми 7-е межсегментарные артерии соединяются).
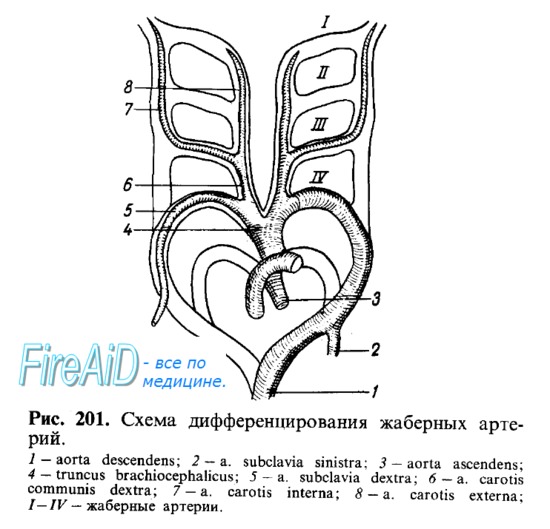
В последующем шейные межсегментарные артерии облитерируются, в результате чего позвоночные артерии оказываются отходящими от подключичных.
Грудные и поясничные межсегментарные артерии дают начало аа. intercostales posteriores и аа. lumbales.
Висцеральные артерии брюшной полости развиваются частью из аа. omphalomesentericae (желточно-брыжеечное кровообращение) и частью из аорты.
Артерии конечностей первоначально заложены вдоль нервных стволов в виде петель.
Одни из этих петель (вдоль n. femoralis) развиваются в основные артерии конечностей, другие (вдоль n. medianus, n. ischiadicus) остаются спутницами нервов.
– Также рекомендуем “Развитие вен.”
Источник
