Эмбриогенеза сердца и сосудов

Кардиогенез :: Волкова О.В. Эмбриогенез и возрастная эмбриология… (О.В.Волкова, М.И.Пекарский Эмбриогенез и возрастная гистология внутренних органов человека 1976) Глава I. Вопросы анте- и постнатального гистогенеза сердечно-сосудистой системы(Часть 1, с.5-10)Сердечно-сосудистая система человека представлена во всех отделах – от сердца до капилляров – слоистыми трубками. Такая структура, основы которой возникают уже на ранних этапах эмбрионального развития, сохраняется на всех и последующих этапах.
Первые кровеносные сосуды появляются вне тела эмбриона, в мезодерме стенки желточного пузыря (рис. 1). Закладка их обнаруживается в виде скоплений клеточного материала внезародышевой мезодермы – так называемых кровяных островков. Клетки, находящиеся на периферии этих островков – ангио-бласты, активно митотически размножаются. Они уплощаются, устанавливают более тесные контакты друг с другом, образуя стенку сосуда. Так возникают первичные сосуды, представляющие собой тонкостенные трубочки, содержащие первичную кровь. На первых порах стенка новообразующихся сосудов не сплошная: на больших участках кровяные островки длительное время не имеют сосудистой стенки. Несколько позже сходным образом возникают сосуды и в мезенхиме тела эмбриона. Отличия заключаются в том, что в кровяных островках вне тела эмбриона ангио- и гематогенные процессы идут параллельно, в теле же эмбриона мезенхима, как правило, образует свободные от крови эндотелиальные трубочки. Вскоре между возникшими таким образом эмбриональными и внеэмбриональными сосудами устанавливается сообщение. Только в этот момент внеэмбрионально образованная кровь поступает в тело эмбриона. Одновременно регистрируются и первые сокращения сердечной трубки. Тем самым начинается становление первого, желточного, круга кровообращения развивающегося зародыша.
Первые закладки сосудов в теле эмбриона отмечены в период формирования первой пары сомитов. Они представлены тяжами, состоящими из скоплений мезенхимных клеток, расположенных между мезодермой и энтодермой на уровне передней кишки. Эти тяжи образуют с каждой стороны два ряда: медиальный (“аортальная линия”) и латеральный (“сердечная линия”). Краниально эти закладки сливаются, образуя сетевидное “эндотелиальное сердце”. Одновременно из мезенхимы по бокам тела зародыша между энтодермой и мезодермой образуются закладки пупочных вен. Далее отмечается преимущественное развитие сердца, обеих аорт и пупочных вен. Только после того, как эти главные магистрали желточного и хорионального (аллантоидного) кровообращения в основном сформируются (стадия 10 пар сомитов) начинается, собственно, развитие других сосудов тела эмбриона (Clara, 1966). У человеческого зародыша кровообращение в желточном и аллантоидном кругах начинается практически одновременно у 17-сегментного эмбриона (начало сердцебиений). Желточное кровообращение существует у человека недолго, аллантоидное преобразуется в плацентарное и осуществляется вплоть до конца внутриутробного периода. Описанный способ образования сосудов имеет место в основном в раннем эмбриогенезе. Сосуды, образующиеся позже, развиваются несколько иным путем. Со временем все большее распространение получает способ новообразования сосудов (сначала типа капилляров) путем почкования. Этот последний способ в постэмбриональном периоде становится единственным.
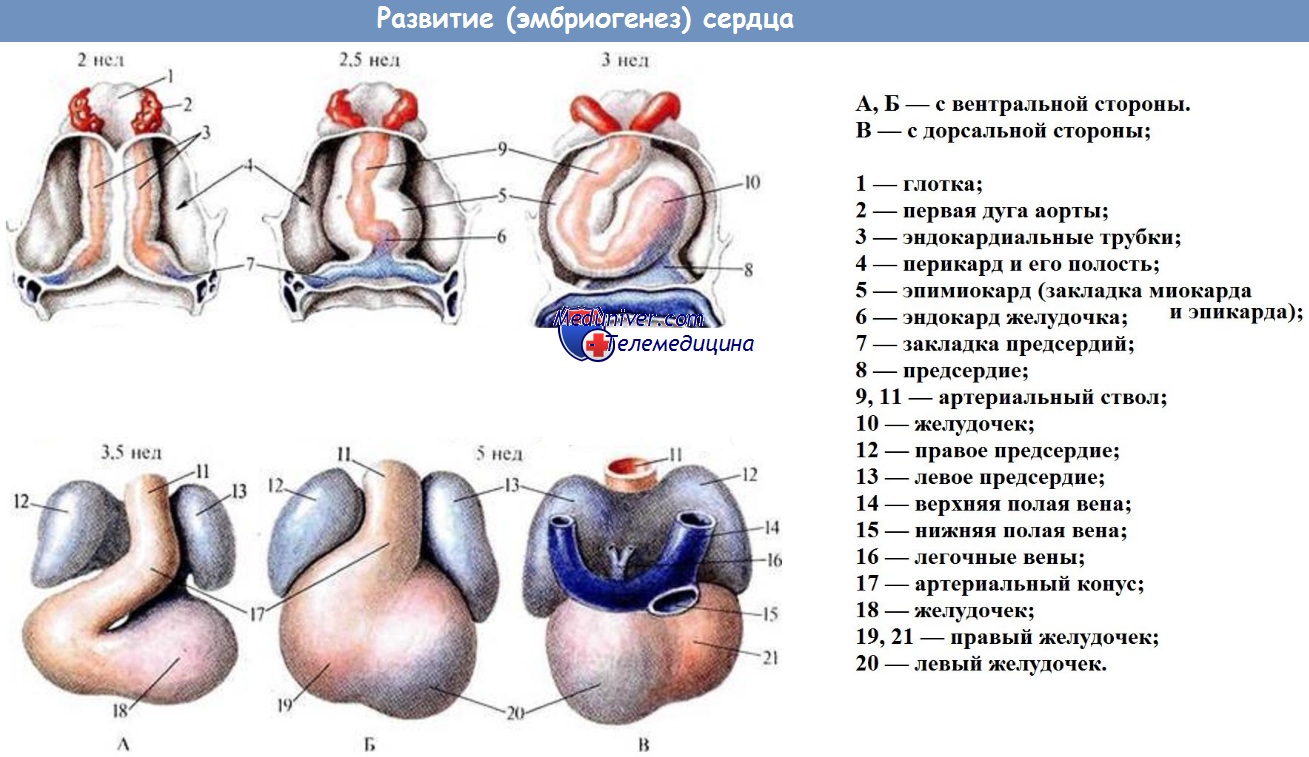
В эмбриогенезе человека сердце закладывается очень рано (рис. 2), когда зародыш еще не обособлен от желточного пузыря и кишечная энтодерма одновременно представляет собой крышу последнего. В это время в кардиогенной зоне в шейной области, между энтодермой и висцеральными листками спланхнотомов слева и справа, скапливаются выселяющиеся из мезодермы клетки мезенхимы, образующие справа и слева клеточные тяжи. Эти тяжи вскоре превращаются в эндотелиальные трубки. Последние вместе с прилегающей к ним мезенхимой составляют закладку эндокарда. Сразу же нужно отметить, что закладки эндокарда и сосудов в принципе тождественны. Отсюда вытекает и принципиальное сходство процессов гистогенеза и их результата- дефинитивных структур. Одновременно с образованием эндотелиальных трубок происходят процессы, приводящие к образованию остальных оболочек сердца – миокарда и эпикарда. Такие процессы разыгрываются в примыкающих к зачаткам эндокарда листках спланхноплевры. Эти участки утолщаются и разрастаются, окружая зачаток эндокарда мешком, вдающимся в полость тела. Здесь содержатся как элементы, образующие в дальнейшем миокард, так и элементы, строящие эпикард. Все образование в связи с этим называют миоэпикардиальной мантией, или, чаще, миоэпикардиальной пластинкой.
Тем временем в области глотки происходит замыкание кишечной трубки. В связи с этим левый и правый зачатки эндокарда все более сближаются, пока не сливаются в единую трубку (рис.3) Немного позже объединяются также левая и правая миоэпикардиальные пластинки. На первых порах миоэпикардиальная пластинка отделяется от эндокардиальной трубки широкой щелью, заполненной желеобразной субстанцией. Впоследствии происходит их сближение. Миоэпикардиальная пластинка накладывается непосредственно на закладку эндокарда сначала в области венозного синуса, затем предсердий и, наконец, желудочков. Только в тех местах, в которых впоследствии происходит образование клапанов, желеобразная субстанция сохраняется относительно долго. Образовавшаяся непарная закладка сердца соединяется с дорсальной и вентральной стенками полости тела зародыша, соответственно дорсальной и вентральной брыжейками, которые в дальнейшем редуцируются (сначала редуцируется вентральная, а затем дорсальная), и сердце оказывается свободно лежащим, как бы подвешенным, на сосудах, во вторичной полости тела, в полости перикарда. Следует отметить, что наряду с широко распространенным представлением о единстве образования целомических полостей в отношении человека существует мнение о том, что образование полости перикарда происходит ранее формирования брюшной полости и независимо от нее путем слияния отдельных лакун, возникающих в мезодерме головного конца зародыша (Clara, 1955, 1962).
Первоначально сердце представляет собой прямую трубку, затем каудальное расширение сердечной трубки, принимающее венозные сосуды, образует венозный синус. Головной конец сердечной трубки сужен. В это время обнаруживается четкое метамерное строение сердечной трубки. Хорошо различаются метамеры, содержащие материал основных дефинитивных отделов сердца. Расположение их – обратное топографии соответствующих отделов окончательно сформированного сердца. Показано (De Haan, 1959), что в раннем трубчатом сердце эндокард представлен одним слоем рыхло расположенных эндотелиальных клеток, в цитоплазме которых обнаруживается значительное количество электронноплотных гранул. Миокард состоит из рыхло расположенных полигональных или веретеновидных миобластов, образующих слой толщиной в 2-3 клетки. Цитоплазма их богата водой, содержит большое количество гранулярного материала (предположительно РНК, гликоген), относительно небольшое количество равномерно распределенных митохондрий.
Одним из факторов, характеризующих ранние этапы развития сердца, является быстрый рост первичной сердечной трубки, увеличивающейся в длину быстрее, чем полость, в которой она расположена. Это обстоятельство является одной из причин того, что сердечная трубка, увеличиваясь в длину, образует ряд характерных изгибов, расширений (рис. 4). При этом венозный отдел смещается краниально и охватывает с боков артериальный конус, а артериальный отдел сильно разрастается и смещается каудально. В результате в развивающемся сердце эмбриона можно видеть контуры его основных дефинитивных отделов – предсердий и желудочков (рис. 5). Дальнейшие изменения приводят к образованию четырехкамерного сердца… |
Источник
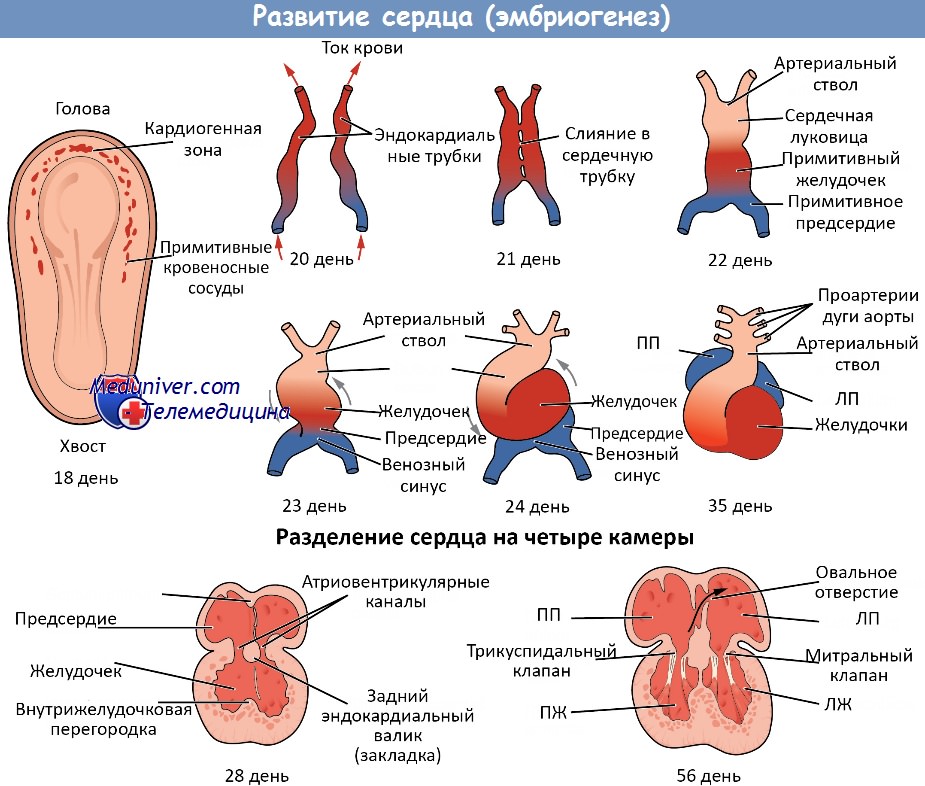
Сердечно-сосудистая система эмбриона. Развитие сердца эмбрионаЭмбрион млекопитающего, не имея желтка, который он мог бы использовать в качестве пищи, нуждается в быстром установлении связи с кровообращением матери. Это обусловливает раннее развитие сосудистой системы эмбриона, так как материнская система кровообращения остается в пределах стенки матки, а кровеносная система эмбриона должна врасти в нее. До того как это произойдет, эмбрион абсорбирует пищевые вещества из матки. Однако их количество способно обеспечить рост эмбриона только на очень ранних стадиях, когда его объем крайне незначителен. Сердце эмбриона человека начинает формироваться в течение третьей недели развития из парных зачатков, расположенных вентро-латерально под передней кишкой. Тот факт, что сердце, являясь у взрослого срединной непарной структурой, возникает из парных зачатков, лежащих вначале совершенно отдельно по обеим сторонам от средней линии, объясняется тем, что тело эмбриона вначале открыто с вентральной стороны и расположено на поверхности желточного мешка. Вначале сердце является двуслойным как в правой половине, так и в левой. Внутренний слой называется эндокардом, так как он предназначен для формирования внутренней выстилки сердца. Наружный слой назван эпимиокардом, так как он дает начало мышечному слою стенки сердца и его эпикардиальной оболочке.
Эндокард вначале образуется в виде группы пучков и тяжей мезенхимных клеток, расположенных между висцеральной мезодермой и энтодермой. Эти клетки начинают собираться в два главных пучка, лежащих по обеим сторонам от кишки. Вскоре после образования пучков в них появляется просвет и они приобретают название эндокардиалъных трубок. Эндокардиальные трубки распространяются за пределы области сердца в виде ветвящихся пучков, из которых в дальнейшем образуются с головной стороны первичные аорты, а с каудальной – вены, входящие в сердце. Висцеральная мезодерма в том месте, где она окружает с боков эндокардиальные трубки, начинает вскоре заметно утолщаться, составляя эпимиокардиальный слой сердца. Между тем продолжается обособление тела эмбриона вместе с сопутствующим увеличением и закрытием передней кишки на уровне сердца. В результате парные эндокардиальные трубки сближаются. Наконец, они достигают друг друга и срастаются, образуя единую трубку, расположенную по средней линии. Благодаря этому же процессу эпимиокардиалъные листки загибаются к середине, полностью окружая эндокард. Вентрально от сердца мезодермальные листки противоположных сторон тела сближаются друг с другом таким образом, что первоначально парные – правая и левая – камеры целома объединяются, образуя срединную перикардиальную полость. Дорзально правый и левый эпимиокардиалъные листки становятся смежными, но не срастаются сразу же, как это происходит вентрально от сердца. В течение некоторого времени они сохраняются в виде двуслойной поддерживающей оболочки, названной дорзальным мезокардием. Таким образом, сердце образуется в виде почти прямой двуслойной трубки, расположенной по средней линии в передней части целома. Дорзальный мезокардии вскоре исчезает, за исключением своего каудального конца, и трубчатое сердце располагается в перикардиальной полости, прикрепленное только с головной стороны, где вентральные ветви аорты отходят в ткань под передней кишкой, и с каудальной, где в сердце входят большие вены. Будучи не прикрепленными в своей средней части, сердце может свободно изменять свою форму и положение и так как оно растет значительно быстрее в длину, чем перикардиальная часть целома, в котором оно расположено, первоначально прямая сердечная трубка вскоре заметно изгибается. При удлинении и изгибании сердечной трубки она впервые разделяется на отделы. Называя их в порядке прохождения крови, различают венозный синус (sinus venosus), предсердие (atrium), желудочек (ventriculus) и артериальный ствол (truncus arteriosus).
Учебное видео развития сердца (эмбриогенеза)
– Также рекомендуем “Венозный синус. Формирование сердца эмбриона” Оглавление темы “Желудочно-кишечный тракт эмбриона. Сердечно-сосудистая система эмбриона”: 1. Обособление внутризародышевой кишки. Образование кишки у эмбриона 2. Образование ротового и клоачного отверстий эмбриона. Глотка эмбриона 3. Кишечник эмбриона. Мочеполовая система эмбриона 4. Целом. Характеристика целома эмбриона 5. Сердечно-сосудистая система эмбриона. Развитие сердца эмбриона 6. Венозный синус. Формирование сердца эмбриона 7. Артерии эмбриона. Формирование и развитие эмбриональных артерий 8. Дорзальная аорта эмбриона. Ветви аорты эмбриона 9. Вены эмбриона. Венозная система эмбриона 10. Внеэмбриональная кровеносная система. Кровоснабжение эмбриона |
Источник
Сердце развивается из мезодермы на 3-й неделе эмбриогенеза в виде парных трубок (мешочков) на уровне глотки по обе стороны от первичной кишки между энтодермой и спланхноплеврой. Сливаясь, эти закладки образуют одну трубку – трубчатое сердце с двухслойной стенкой. В дальнейшем из внутреннего слоя трубки образуется эндокард, а из наружного – миокард и эпикард. Закладка сердца расположена в области шеи. Краниально она пeреходит в артериальный ствол, а каудально – в расширенный венозный синус.
Средний отдел трубчатого сердца интенсивно растет и приобретает форму дуги, т.к. краниальный и каудальный отделы закладки сердца фиксированы остатками дорсальной брыжейки сердца. Место изгиба – будущая верхушка сердца, краниальная часть дуги – будущий артериальный отдел, а каудальная часть – венозный отдел сердца.
В последующем средний отдел дуги изгибается, приобретая S-образную форму (сигмовидное сердце). При этом предсердие и редуцированный венозный синус оказываются дорсально и находится в восходящем отделе сигмовидного сердца, а желудочек и артериальный ствол в его переднем выпуклом отделе.
На внешней поверхности сигмовидного сердца появляется предсердно-желудочковая борозда (будущая венечная борозда). Предсердие сообщается с желудочком предсердно-желудочковым (ушковидным) каналом, на стенках которого возникают вентральное и дорсальное утолщения – предсердно-желудочковые эндокардиальные валики, из которых в последующем развиваются двух- и трехстворчатые клапаны.
В устье артериального ствола образуются 4 эндокардиальных валика (передний, задний и два боковых), которые после формирования перегородки превращаются в полулунные заслонки клапанов аорты и легочного ствола.
На 4-й неделе эмбриогенеза от верхне-заднего отдела внутренней поверхности общего предсердия растет первичная межпредсердная перегородка в сторону предсердно-желудочкового отверстия и разделяет общее предсердие на правое и левое.
Однако это разделение не полное, т.к. в перегородке сохраняется широкое первичное межпредсердное отверстие. Справа от первичной перегородки от верхне-задней стенки предсердия растет вторичная межпредсердная перегородка, которая срастается с первичной, полностью разделяя оба предсердия. Краниальный отдел вторичной перегородки прорывается, образуя вторичное межпредсердное отверстие (овальное отверстие).
В начале 8-й недели эмбриогенеза на задненижней стенке закладки желудочков образуется складка – будущая межжелудочковая перегородка, которая растет вперед и вверх. Одновременно в артериальном стволе появляются две складки, которые растут навстречу друг другу и вниз; сливаясь, они образуют аорто-легочную перегородку, которая отделяет восходящую часть аорты от легочного ствола и делит 4 эндокардиальных валика на полулунные створки: 1 переднюю и 2 задних для легочного ствола, 2 передних и 1 заднюю для аорты. Продолжаясь вниз, эта перегородка растет навстречу межжелудочковой перегородке, образуя ее перепончатую часть.
В связи с возникновением перегородок (межжелудочковой, аорто-легочной, межпредсердной) образуется четырехкамерное сердце. В процессе развития сердце из шейной области постепенно опускается в грудную полость, где в зависимости от возраста меняет свое положение.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
01.06.201519.52 Mб36Эндокринная система.djvu
- #
- #
- #
Источник
Кардиогенез :: Волкова О.В. Эмбриогенез и возрастная эмбриология… (О.В.Волкова, М.И.Пекарский Эмбриогенез и возрастная гистология внутренних органов человека 1976) Глава I. Вопросы анте- и постнатального гистогенеза сердечно-сосудистой системы(Часть 2, с.10-20)Дальнейшие изменения приводят к образованию четырехкамерного сердца. Вначале венозный и артериальный отделы разделены поперечной перетяжкой. Сообщаются эти отделы через узкий ушковый канал. Двухкамерное сердце существует в эмбриогенезе человека недолго и преобразуется с возникновением продольных перегородок в четырехкамерное (у эмбриона 16-17 мм). Образование межпредсердной перегородки происходит в два этапа. В начале закладывается первичная перегородка с первичным овальным отверстием. Последнее закрывается, а первичная перегородка преобразуется в клапан вторичного овального отверстия, располагающегося во вторичной перегородке, развивающейся несколько позже и латеральнее. В межжелудочковой перегородке также длительное время сохраняется отверстие. Интересно, что довольно полное разделение потоков крови, по-видимому, возможно до завершения образования сплошных перегородок. Об этом свидетельствуют физиологические наблюдения над сердцами животных с трех-камерным сердцем (П. А. Коржуев, 1971). Описанные выше изменения обычно подразделяются на две фазы (Clara, 1962). Результат первой фазы – возникновение метамерно разделенной сердечной трубки. В течение второй фазы формирующийся орган приобретает вид, соответствующий основным чертам дефинитивного сердца. В основе этих изменений лежат закономерные гистогенетические процессы, происходящие как в закладке эндокарда, так и в миоэпикардиальной пластинке. Развитие закладки эндокарда, как указывалось, принципиально соответствует процессам, происходящим при дифференцировке сосудистой стенки. К эндотелиальной трубке, образовавшейся на самых ранних этапах, присоединяются впоследствии субэндотелий, эластический аппарат, коллагеновые волокна и гладкие мышцы, дифференцирующиеся из окружающей мезенхимы. В миоэпикардиальной пластинке также заметны процессы дифференцировки. Прежде всего на наружной ее поверхности, обращенной к целомической полости, возникает эпителиоподобный слой клеток с расположенной под ним соединительной тканью. Иными словами, возникает закладка эпикарда. Только после этого активируются гистогенетические процессы, приводящие к формированию миокарда. До недавнего времени не было полной ясности относительно дефинитивной структуры сердечной мышцы. Только электронномикроскопические исследования сравнительно недавнего времени показали, что вставочные пластинки являются истинными границами клетки (van Breeman, 1953; Sjostrand е.а., 1953; Schulze, 1962, и др.). Волокна сердечной мышцы, таким образом, представляют собой не симпласт, а образования, составленные из клеток.
Еще большие споры на протяжении длительного времени вызывали вопросы, связанные с гистогенезом миокарда. Все исследователи соглашались в том, что закладка сердечной мышцы имеет клеточное строение. Подавляющее большинство авторов склонялись к тому мнению, что клеточное строение при дифференцировке миокарда довольно быстро сменяется симпластическим. Только относительно небольшая группа авторов считала, что клеточное строение сердечная мышца сохраняет на всех этапах развития. В числе таких работ можно упомянуть и старые классические работы Kolliker (1882), Weissmann (1891), В. А. Догеля (1895), Goyer (1899). По данным электронной микроскопии (Hibbs, 1955, 1956; Muir, 1957; Edwards, Challice, 1958; Schulze, 1962; Leak, Burke, 1964), полученным на основании изучения развивающегося сердца различных позвоночных (курица, кролик, мышь, собака, человек), гистогенетические процессы в миокарде можно представить себе следующим образом. В раннем эмбриогенезе миокард представляет собой слой толщиной в несколько клеток (рис. 6-7). Это клетки неправильной, полигональной или веретенообразной формы. Их цитоплазма богата водой и содержит значительное количество гранул (по-видимому, РНК и гликогена), небольшое количество рассеянных в цитоплазме митохондрий, а также везикулы эндоплазматического ретикулума. Описанные процессы дифференцировки в разных клетках миокарда происходят неодновременно, с разной скоростью, поэтому отчетливо выявляется довольно выраженная картина мозаичности в степени дифференцировки разных клеток. Такая мозаичность отчасти объясняется неодинаковой ролью различных частей миокарда на разных этапах онтогенеза. Так называемый “трабекулярный миокард” на ранних этапах внутриутробного развития, по некоторым признакам, оказывается более продвинутым: его миофибриллы толще, более многочисленны, более правильно ориентированы, обладают более четкой исчерченностью. Миокард трабекулярного типа играет большую роль в течение всей жизни у низших позвоночных. У млекопитающих и человека он играет практически роль провизорной структуры (П. П. Румянцев, И. Л. Соколовская, 1964). До завершения васкуляризации сердца трабекулярное строение миокарда наилучшим образом обеспечивает питание сердца кровью из полостей желудочков и предсердий. В ходе дальнейшего развития различия между трабекулярным и компактным миокардом постепенно теряются. Первый получает дополнительную васкуляризацию. Все же в дефинитивном сердце наиболее близка к трабекулярному миокарду сердечная мышца, прилегающая к полостям предсердий (особенно ушек), желудочков и мышцы, управляющие работой клапанного аппарата.
На рис. 8-10 показан плотный, плохо васкуляризированный трабекулярный миокард зародыша. Во второй половине внутриутробного периода стенка сердца представлена преимущественно так называемым “компактным миокардом” (рис. 11-12), в котором можно видеть значительное количество капилляров, хотя процесс васкуляризации его завершается только после рождения. Рассмотрим еще ряд важных данных по гистогенезу сердечной мышцы. В местах контакта миобластов их мембраны представляются утолщенными в определенных зонах за счет скопления электронноплотных гранул. Такие гранулы, находящиеся вне связи с фибриллярным материалом, образуют десмосомоподобные структуры. Эти структуры возникают в миокарде зародыша.
Постепенно в дифференцирующихся мышечных клетках увеличивается количество митохондрий. В начале митохондрии часто имеют неправильную форму, рассеяны в клетке диффузно. Отмечено, что в периферической зоне клеток, в которой, как указано выше, происходит образование фибрилл, располагаются более крупные митохондрии. В дальнейшем митохондрии постепенно удлиняются и располагаются упорядоченно, между миофибриллами и параллельно их длине. Известно, что в сердцах эмбрионов первых недель развития как только появляются z-полоски, можно видеть рыхлые тубулярные и везикулярные компоненты саркоплазматического ретикулума. Вскоре после того, как образуются выраженные саркомеры, такие везикулы можно наблюдать и в связи с z-полосками. Важно отметить, что увеличения длины саркомеров, продольного роста фибрилл, расположенных между Z-полосками, не происходит и длина саркомера остается во время развития постоянной (Muir, 1957). При изучении гистогенеза скелетной мышцы было показано (Stocdale, Holtzer, 1961), что синтез ДНК (т.е. в конечном счете пролиферативная активность) прекращается с началом синтеза сократимых белков. Можно было ожидать, что и для развивающегося миокарда характерны подобные отношения. Однако оказалось, что конкурентные взаимоотношения между пролиферативной активностью и синтезом специфических белков в онтогенезе миокарда проявляются не столь резко. По наблюдениям П. П. Румянцева и И. Л. Соколовской (1964), до 50% ядер в сердечной мышце новорожденных крысят, содержащей довольно значительное количество миофибрилл, синтезируют ДНК. Это вполне понятно, так как сердце начинает функционировать очень рано. Таким образом, в течение длительного времени должны “сосуществовать” оба процесса. Синтез специфических белков начинается очень рано. Вместе с тем он идет не так интенсивно, как в скелетной мышце. Малая “загрузка” мышечных элементов миофибриллами на протяжении длительного периода гистогенеза обеспечивает возможность протекания в них митозов. Однако, по-видимому, своеобразным следствием раннего начала функционирования является более медленная дифференцировка основных структур. По мере накопления сократительных белков в миокарде происходит торможение пролиферации.
В той же работе показано, что при этом происходит постепенное изменение параметров митоза: удлиняются основные периоды (S, Y1, Y2 и, возможно, М). Вместе с тем меняются и морфологические характеристики митоза: наблюдаются сближенные хромосомные комплексы в телофазах, раннее образование интерфазной структуры (Stocdale, Holtzer, 1961; Zhinkin, Andreeva, 1963; Rumyantsev, 1963). Подобные картины нередко ошибочно принимают за амитоз. Однако, по-видимому, нельзя говорить о постепенном падении уровня пролиферативной активности миокарда в ходе эмбриогенеза. И.Л. Ерохина-Соколовская (1968), изучая ранние этапы кардиогенеза у мышей, показала, что в “сердечной мезодерме” и миокарде сердечной трубки на 9-е сутки темп размножения по сравнению с таковым на 8-е сутки снижается, что связано с выходом из цикла около 50% ядер и с увеличением длительности цикла в 1,5 раза. Это падение, по-видимому, связано с повышением уровня синтеза сократительных белков. К 10-м суткам, в уже сокращающемся миокарде пролиферативный пул вновь поднимается до 80-95% и до 15-х суток держится на высоком уровне (до 85%). Linzbach (1966) насчитывает к 8-му месяцу внутриутробного развития человека в сердечной мышце 11 волн митотической активности. По-видимому, в конце внутриутробного периода или в начале внеутробного митотический индекс приближается к нулю. В дальнейшем митозы в миокарде появляются только в особых случаях, например, после экспериментальной травмы (Robledo, 1956, и др.). Причина подобного “ритма” пролиферативной активности и связанной с ней интенсивности дифференцировки не вполне ясна. В этой связи интересны сопоставления темпов пролиферации миокарда с развитием сосудов в нем. По-видимому, длительное время (до 7-й недели; Linzbach, 1959) растущая масса миокарда питается за счет крови сердечной полости, главным образом через так называемые трабекулярные синусы. Подобный “диффузионный” тип питания особенно характерен для трабекулярных мышц. Развивающиеся позже в компактном миокарде капилляры (ветви внедряющихся со стороны эпикарда венечных сосудов) резко улучшают условия его кровоснабжения. Это хорошо видно из следующих подсчетов Linzbach (1959). Расстояние между трабекулярными синусами в сердце ранних эмбрионов человека составляет примерно 60 мкм, а среднее расстояние между капиллярами компактной мускулатуры -25 мкм, которое в ходе дальнейшего развития остается практически постоянным (см. рис. 18). Улучшение питания активизирует процесс дифференцировки и пролиферации миокарда. В. А. Ермакова (1964) связывает с интенсивным образованием сосудов у плодов длиной 2,4-17 и 19-27 см обнаруженную ею активную дифференцировку миоцитов у плодов длиной 3 и 13 см. Несмотря на то что предметом внимания в настоящей работе являются в основном гистогенетические процессы, однако мы считаем необходимым коснуться в данном разделе макро-микроскопических (собственно анатомических) данных, важных для понимания гистогенетических процессов. При рассмотрении структурных изменений нередко особенно отчетливо видна их взаимная связь с постоянно меняющимися функциональными характеристиками. Так, в кровообращении плода правый и левый желудочки сообщаются. При этом большая часть систолического объема правого желудочка идет через боталлов проток в аорту, меньшая через легочную артерию попадает в легкие. Это создает анатомические предпосылки примерно равной рабочей нагрузки желудочков сердца плода. В соответствии с этим вес правого желудочка у плода примерно равен весу левого. По данным Linzbach (1966), исследовавшего сердце плодов человека весом от 40 до 800 г, вес правого желудочка в среднем составляет 0,943 веса левого. В последней четверти внутриутробного периода мускулатура правого желудочка растет даже быстрее, чем левого. К моменту рождения вес правого желудочка превышает вес левого примерно в 1,3 раза (Hort, 1955; Merkel, Witt, 1955; Moltz, 1962). Клапанный аппарат сердца развивается как дупликатура эндокарда. Процесс начинается с бурного местного разрастания эндокарда, особенно субэндотелиальной рыхлой соединительной ткани. Уже в возрасте 4 недель атрио-вентрикулярные клапаны представляют собой сформированные “эндотелиальные подушки”, которые в течение следующих недель значительно увеличиваются (рис. 6, 7, 9). В состав формирующихся клапанов может со временем вовлекаться какое-то количество миокардиальных элементов. Впоследствии рыхлая соединительная ткань замещается плотной. Данные о развитии, особенно о гистогенезе проводящей системы сердца, не слишком многочисленны… |
Источник








 Эти клетки – миобласты – лежат рыхло, на довольно значительном расстоянии друг от друга. В дальнейшем миобласты устанавливают контакт друг с другом. Увеличение массы миокарда в эмбриональном периоде происходит как за счет митозов, так и за счет увеличения размеров клеток (рис. 8-12). Постэмбриональное сердце растет (даже в случаях гипертрофии) без увеличения количества кардиомитоцитов. Увеличение диаметра волокон миокарда связано с увеличением массы цитоплазмы, главным образом за счет новообразования миофибрилл внутри каждой клетки.
Эти клетки – миобласты – лежат рыхло, на довольно значительном расстоянии друг от друга. В дальнейшем миобласты устанавливают контакт друг с другом. Увеличение массы миокарда в эмбриональном периоде происходит как за счет митозов, так и за счет увеличения размеров клеток (рис. 8-12). Постэмбриональное сердце растет (даже в случаях гипертрофии) без увеличения количества кардиомитоцитов. Увеличение диаметра волокон миокарда связано с увеличением массы цитоплазмы, главным образом за счет новообразования миофибрилл внутри каждой клетки.
 Клетки в этот период выглядят удлиненными. В них обнаруживаются неупорядоченно располагающиеся миофиламенты, большое количество гранул гликогена. Десмосомоподобные контакты можно видеть по всей поверхности миобластов. Уже к середине 2-го месяца в большинстве случаев десмосомоподобные структуры на боковых поверхностях исчезают. Щели между клетками увеличиваются. Сохранившиеся десмосомоподобные структуры усложняются, образуя вставочные пластинки, обеспечивающие прочные контакты мышечных клеток, строящих волокна миокарда. На протяжении всего внутриутробного периода вставочные пластинки представляют собой довольно просто устроенные контакты с малоизвитыми клеточными мембранами. Усложнение структуры вставочных пластинок продолжается после рождения (рис. 13).
Клетки в этот период выглядят удлиненными. В них обнаруживаются неупорядоченно располагающиеся миофиламенты, большое количество гранул гликогена. Десмосомоподобные контакты можно видеть по всей поверхности миобластов. Уже к середине 2-го месяца в большинстве случаев десмосомоподобные структуры на боковых поверхностях исчезают. Щели между клетками увеличиваются. Сохранившиеся десмосомоподобные структуры усложняются, образуя вставочные пластинки, обеспечивающие прочные контакты мышечных клеток, строящих волокна миокарда. На протяжении всего внутриутробного периода вставочные пластинки представляют собой довольно просто устроенные контакты с малоизвитыми клеточными мембранами. Усложнение структуры вставочных пластинок продолжается после рождения (рис. 13).  Наиболее ранние этапы фибриллогенеза практически не изучены. В периферических частях цитоплазмы клеток зачатка миокарда появляются первые тонкие миофиламенты (протофибриллы), сгруппированные в рыхлые пучки. При этом видны и первичные z-мембраны. Эти мембраны, очевидно, увязывают протофибриллы в пучки и, возможно, служат точкой роста миофибриллярного аппарата. Cedegren и Нагагу (1964), исследуя в культуре ткани миобласты сердца 1-5-дневных мышей, обнаружили в цитоплазме рядом с развивающимися миофибриллами цепи рибосом. Авторы считают, что это полисомы, с которыми связан синтез молекул миозина (и тем самым протофибрилл). Довольно рано обнаруживается и поперечная исчерченность фибрилл. Так, Lewis (1919, 1926), используя усовершенствованную технику, обнаружил ее уже у 10-сомитного зародыша цыпленка. Признаки поперечной исчерченности были обнаружены затем у еще более ранних эмбрионов. Baud (1955) наблюдал ее в сердце 8-сомитного зародыша цыпленка, a Olivo и соавторы (1964) показали отдельные исчерченные участки фибрилл в сердце 7-сомитного эмбриона цыпленка. Интересны данные Holtzer с соавторами (1959), которые, используя флюоресцентную антисыворотку, обнаружили поперечную исчерченность фибрилл в сердце зародыша цыпленка после 26-часовой инкубации.
Наиболее ранние этапы фибриллогенеза практически не изучены. В периферических частях цитоплазмы клеток зачатка миокарда появляются первые тонкие миофиламенты (протофибриллы), сгруппированные в рыхлые пучки. При этом видны и первичные z-мембраны. Эти мембраны, очевидно, увязывают протофибриллы в пучки и, возможно, служат точкой роста миофибриллярного аппарата. Cedegren и Нагагу (1964), исследуя в культуре ткани миобласты сердца 1-5-дневных мышей, обнаружили в цитоплазме рядом с развивающимися миофибриллами цепи рибосом. Авторы считают, что это полисомы, с которыми связан синтез молекул миозина (и тем самым протофибрилл). Довольно рано обнаруживается и поперечная исчерченность фибрилл. Так, Lewis (1919, 1926), используя усовершенствованную технику, обнаружил ее уже у 10-сомитного зародыша цыпленка. Признаки поперечной исчерченности были обнаружены затем у еще более ранних эмбрионов. Baud (1955) наблюдал ее в сердце 8-сомитного зародыша цыпленка, a Olivo и соавторы (1964) показали отдельные исчерченные участки фибрилл в сердце 7-сомитного эмбриона цыпленка. Интересны данные Holtzer с соавторами (1959), которые, используя флюоресцентную антисыворотку, обнаружили поперечную исчерченность фибрилл в сердце зародыша цыпленка после 26-часовой инкубации.
 Так начинается образование поперечной T-системы, а примерно после 45 ч инкубации зародыша цыпленка между пучками миофибрилл можно видеть продольно расположенные канальцы.
Так начинается образование поперечной T-системы, а примерно после 45 ч инкубации зародыша цыпленка между пучками миофибрилл можно видеть продольно расположенные канальцы.