Эндотелиального фактора роста сосуд

Навигация по статье:
Что такое Сосудисто-эндотелиальный фактор роста (VEGF human)?
В течение 30 лет предполагалось, что ангиогенез – процесс образования новых кровеносных сосудов – может стать важной мишенью противоопухолевой терапии. И лишь недавно эта возможность была реализована. Клинические данные продемонстрировали, что гуманизированные моноклональные антитела – препарат бевацизумаб – прицельно действующие на важнейшую молекулу с проангиогенными свойствами, а именно – сосудистый эндотелиальный фактор роста (VEGF), могут увеличить продолжительность жизни больных метастатическим колоректальным раком при назначении в качестве терапии первой линии в комбинации с химиопрепаратами. Здесь мы обсудим функции и значение VECF, чтобы показать, что VEGF является обоснованной точкой приложения действия противоопухолевой терапии.
Что такое VEGF?
VEGF – один из членов семейства структурно близких между собой белков, которые являются лигандами для семейства рецепторов VEGF. VEGF влияет на развитие новых кровеносных сосудов (ангиогенез) и выживание незрелых кровеносных сосудов (сосудистая поддержка), связываясь с двумя близкими по строению мембранными тирозинкиназными рецепторами (рецептором-1 VEGF и рецептором-2 VEGF) и активируя их. Эти рецепторы экспрессируются клетками эндотелия стенки кровеносных сосудов (таблица 1). Связывание VEGF с этими рецепторами запускает сигнальный каскад, который в конечном итоге стимулирует рост эндотелиальных клеток сосуда, их выживание и пролиферацию. Эндотелиальные клетки участвуют в таких разнообразных процессах, как вазоконстрикция и вазодилатация, презентация антигенов, а также служат очень важными элементами всех кровеносных сосудов – как капилляров, так и вен или артерий. Таким образом, стимулируя эндотелиальные клетки, VEGF играет центральную роль в процессе ангиогенеза.
Почему важно делать Сосудисто-эндотелиального фактора роста (VEGF human)?
VEGF чрезвычайно важен для формирования адекватной функционирующей сосудистой системы в ходе эмбриогенеза и в раннем постнатальном периоде, однако у взрослых его физиологическая активность ограничена. Эксперименты на мышах показали следующее:
- Целенаправленное повреждение одной или двух аллелей гена VEGF приводит к гибели эмбриона
- Инактивация VEGF в период раннего постнатального развития также ведет к летальному исходу
- Повреждение VEGF у взрослых мышей не сопровождается какими-либо явными аномалиями, поскольку его роль ограничена развитием фолликулов, заживлением ран и репродуктивном циклом у самок.
Ограниченное значение ангиогенеза у взрослых означает, что подавление активности VEGF представляет собой выполнимую терапевтическую задачу.
Для проверки/улучшения работоспособности каких органов нужно делать Сосудисто-эндотелиального фактора роста (VEGF human)?
Сердечно-сосудистая система.
Как подготовиться к сдаче Сосудисто-эндотелиального фактора роста (VEGF human)?
Кровь натощак.
Материал для сдачи Сосудисто-эндотелиального фактора роста (VEGF human)
Сыворотка натощак.
Срок выполнения Сосудисто-эндотелиального фактора роста (VEGF human)
14 дней.
К каким докторам следует обращаться для консультаций по Сосудисто-эндотелиальному фактору роста (VEGF human)?
- иммунолог
- эндокринолог
- терапевт.
Источник
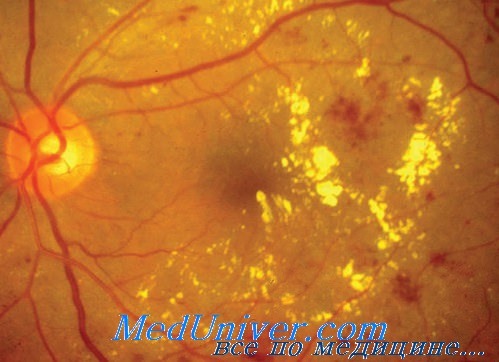
Антагонисты сосудистого эндотелиального фактора роста (СЭФР) при диабетическом макулярном отеке (ДМО). РекомендацииСосудистый эндотелиальный фактор роста (СЭФР) является причиной макулярного отека, также он вызывает неоваскуляризацию сетчатки на фоне диабета и неоваскуляризацию хориоидеи при возрастной макулярной дистрофии (ВМД). Сосудистый эндотелиальный фактор роста (СЭФР) снижает плотность контакта эндотелиальных клеток сосудов глазного дна, вызывая нарушение гематоретинального барьера, что в свою очередь приводит к выходу плазмы крови и макромолекул в межклеточное пространство сетчатки. Ишемия, приводящая к увеличению продукции сосудистого эндотелиального фактора роста (СЭФР), в некоторых случаях может быть фактором, играющим роль в развитии макулярного отека. По этой причине пациенты с макулярным отеком, которые не реагируют на прямую фокальную лазерную коагуляцию подтекающих микроаневризм или участков подтекания, выявляемых при проведении флуоресцентной ангиографии, могут реагировать на лазерную коагуляцию участков ишемии. Лазерная коагуляция высокой мощности, вероятно, приводит к небольшому уменьшению неоваскуляризации сетчатки и значительному сужению центрального поля зрения, а следовательно, осложняет различение пациентом небольших объектов, таких как буквы при чтении, кроме того, эта процедура часто приводит к снижению остроты зрения от близкой к 100% до отсутствия предметного зрения.
Внедрение в клиническую практику антагонистов сосудистого эндотелиального фактора роста (СЭФР) привело к появлению нового метода лечения пациентов с макулярным отеком, вторичным по отношению к НПДР, а также с ОВС. Бевацизумаб (Авастин) является антагонистом сосудистого эндотелиального фактора роста (СЭФР), применение которого в настоящее время разрешено FDA для системной терапии рака. Интравитреальное введение Авастина широко применяется для лечения хориоидальной неоваскуляризации при ВМД, оно также используется при макулярном отеке, вторичном по отношению к окклюзии ветвей центральной вены сетчатки (ОВЦВС) и центральной вены сетчатки (ОЦВС), а также при неоваскуляризации сетчатки на фоне ПДР. Первые публикации, посвященные применению этих препаратов, а также клинический опыт авторов статьи показывают, что терапия антагонистами сосудистого эндотелиального фактора роста (СЭФР) в сочетании с лазерной коагуляцией сетчатки должна стать стандартным методом при лечении ДМО и ПДР. – Также рекомендуем “Лечение диабетического макулярного отека (ДМО). Рекомендации” Оглавление темы “Лечение патологии сетчатки”:
|
Источник
Несмотря на многочисленные исследования, патогенез синдрома поликистозных яичников (СПКЯ) до настоящего времени до конца не изучен. Частота СПКЯ составляет примерно 11–16% среди женщин репродуктивного возраста, а в структуре ановуляторного бесплодия доходит до 75–80% [1, 12]. Длительно существующие в клинической практике критерии диагностики синдрома поликистозных яичников (олигоменорея, гирсутизм, ожирение и увеличенные яичники), в настоящее время выявляются только у 65–70% пациенток [7, 9]. Большинство исследователей приняли критерии диагностики СПКЯ, предложенные на Ротердамской конференции: хроническая ановуляция, гиперандрогения, эхографические признаки поликистозных яичников (ПКЯ). Наличие двух из трех вышеперечисленных критериев позволяет верифицировать диагноз: «Синдром поликистозных яичников».
В последние годы повысилось число пациенток, резистентных к кломифену, который с 60-х годов прошлого столетия и до настоящего времени является первым этапом в индукции овуляции у больных с СПКЯ. Применение в схемах стимуляции овуляции гонадотропинов, несмотря на появление рекомбинантных форм, сопровождается высоким риском развития синдрома гиперстимуляции яичников (СГЯ). В последние годы возрос интерес к поиску маркеров прогнозирования СГЯ, чтобы выбрать щадящий метод стимуляции овуляции у данной группы пациенток [1, 2].
В настоящее время активно изучается роль ангиогенеза и множества других цитокинов в патофизиологии не только СПКЯ, но и СГЯ. По мнению ряда авторов, в основе патогенеза многих заболеваний лежит дисбаланс между факторами, регулирующими процессы пролиферации клеток и ангиогенеза [4]. Среди этих факторов — сосудистого эндотелиального фактора роста (СЭФР), который продуцируется в основном клетками эндотелия, является медиатором неоангиогенеза, играет важную роль в фолликулогенезе и развитии СГЯ. Результаты ряда клинических исследований свидетельствуют о том, что изучение роли СЭФР при СПКЯ следует считать актуальным и перспективным с клинической и научно-исследовательской точки зрения [5, 6].
Целью настоящего исследования явилось изучение содержания СЭФР в сыворотке крови больных с различными формами синдрома поликистозных яичников и определить его клиническое значение.
Материалы и методы
Обследовано 246 пациенток с СПКЯ (средний возраст 27,7 ± 1,4 года) с нарушениями генеративной функции. Критериями включения пациенток в исследование были: ановуляция или редкие овуляции по типу синдрома лютеинизации неовулированного фолликула (СЛНФ), бесплодие I, клинические и/или биохимические проявления гиперандрогении, эхографические признаки ПКЯ. Критерии исключения: метаболический синдром, гиперпролактинемия, болезнь Кушинга. Все пациентки были разделены на две группы с учетом клинико-морфологического типа поликистозных яичников.
I группу составили 119 пациенток с диффузным расположением фолликулов, II — 127 пациенток с периферическим расположением фолликулов по отношению к гиперплазированной строме. III группу — контрольную — составили 30 практически здоровых женщин (средний возраст 25,9 ± 1,7 года).
В ходе работы проводились клинико-лабораторные, инструментальные методы исследования.
Концентрацию СЭФР в сыворотке обследованных больных определяли иммуноферментным методом набором коммерческих реактивов фирмы R&D (США) и измеряли в пг/мл.
На 2–3 день самостоятельной или индуцированной гестагенами менструации всем пациенткам проводили трансвагинальное ультразвуковое исследование яичников с допплерометрией внутрияичникового кровотока на аппарате Sonoline Sienna (Siemens, Германия) с использованием трансвагинального датчика с частотой 6,5 МГц в режимах сканирования в двухмерной серой шкале (B-mode), цветового допплеровского картирования (C-mode).
Проводили радиоиммунологическое исследование гормонов в сыворотке крови (лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), общего тестостерона, эстрадиола, пролактина, инсулина, дегидроэпиандростерон-сульфата (ДГЭА-С), кортизола) иммунохемилюминисцентным методом на автоматическом анализаторе ACS 180. Инсулинорезистентность (ИР) определяли по индексу HOMA, для вычисления которого базальные концентрации глюкозы и инсулина перемножаются и делятся на 22,5. Если полученные показатели составляют более 2,5 — это соответствует ИР.
Статистический анализ полученных результатов исследования проводили на персональном компьютере с использованием пакета программ обработки данных медицинского исследования. Достоверность отличий в группах определяли по t-критерию Стъюдента. Отличия считали достоверными при значениях р < 0,05.
Результаты и обсуждение
Основными причинами, побудившими пациенток обратиться в клинику, были бесплодие и нарушение менструального цикла. Кроме того, они жаловались на избыточное оволосение и угревую сыпь, а также ожирение, которое составило 51% от общего числа больных.
У пациенток с СПКЯ показатели СЭФР оказались достоверно выше, чем в группе практически здоровых женщин: 193,1 ± 27,1 и 92,5 ± 27,9 пг/мл соответственно (табл. 1).
.jpg)
В I группе исследуемых пациенток с диффузным расположением фолликулов уровни СЭФР изменялись в широких пределах от 94,9 до 461,9 пг/мл, составляя в среднем 246,3 ± 25,9 пг/мл. Во II группе пациенток с периферическим расположением фолликулов по отношению к гиперплазированной строме уровни СЭФР варьировали от 40,8 до 320,9 пг/мл, в среднем — 167,2 ± 31,4 пг/мл. В группе контроля результаты исследования составили в среднем 92,5 ± 27,9 пг/мл (от 30,5 до 149,4 пг/мл).
Таким образом, было выявлено, что максимальный уровень СЭФР в сыворотке крови отмечался у пациенток с I типом ПКЯ, что достоверно отличается от показателей СЭФР у пациенток со II типом ПКЯ и здоровых женщин. Полученные данные согласуются с проведенными ранее исследованиями, в которых также получены достоверно более высокие концентрации СЭФР в крови больных с СПКЯ по сравнению со здоровыми женщинами [5, 8].
Для изучения взаимосвязи между содержанием СЭФР в сыворотке крови исследуемых пациенток и различными эхографическим показателями были выбраны наиболее значимые для ПКЯ критерии: объем яичников, количество антральных фолликулов и пиковая систолическая скорость (ПСС) кровотока в стромальных артериях яичников, так же полагают и другие авторы [3, 10, 11]. Было выявлено, что содержание СЭФР в сыворотке крови у пациенток с СПКЯ увеличивалось прямо пропорционально увеличению объема яичников (независимо от типа ПКЯ) (табл. 2)
.jpg)
и количеству фолликулов (табл. 3).
.jpg)
Отмечена также положительная корреляционная зависимость между ПСС кровотока и уровнем СЭФР (табл. 4),
.jpg)
что согласуется с результатами исследования других авторов [5, 8].
У больных с инсулинорезистентностью содержание СЭФР в сыворотке крови достоверно выше аналогичного показателя женщин контрольной группы (рис.). Кроме того, выявлена тенденция к повышению его уровня у пациенток с ожирением (среднее значение СЭФР 329,2 ± 26,1 пг/мл).
.jpg)
Изучение показателей СЭФР в зависимости от базальных концентраций в крови гонадотропных гормонов выявило, что повышение его уровня положительно коррелировало (r = 0,21) с увеличением содержания ЛГ в сыворотке крови и не зависело от типа ПКЯ (при уровне ЛГ > 18 МЕ/л — 229,6 ± 17,8 пг/мл, а при уровне ЛГ < 18 МЕ/л — 109,4 ± 15,7 пг/мл). В работе Anasti J. N. получены такие же результаты [6]. По данным Назаренко Т. А. высокие концентрации ЛГ (более 15 МЕ/л) свидетельствуют о риске развития СГЯ, на что указывают и результаты настоящего исследования. В то же время Agrawal R. и соавт. в своих исследованиях не обнаружили корреляционной зависимости между повышенными уровнями СЭФР и гормонами крови [5]. Зависимости между концентрациями СЭФР, общего тестостерона, эстрадиола и других стероидов не выявлено.
В заключение можно сказать, что повышенная васкуляризация поликистозных яичников лежит в основе усиленного кровотока, как показали результаты допплеровского картирования, и связана с высоким уровнем СЭФР в сыворотке крови пациенток с СПКЯ. Наличие взаимосвязи СЭФР с уровнем ЛГ, инсулинорезистентностью, пиковой систолической скоростью, объемом яичников, количеством антральных фолликулов свидетельствует о важной роли сосудистого эндотелиального фактора роста в патофизиологии СПКЯ и может указывать на риск развития СГЯ.
Выводы
- Содержание СЭФР в крови пациенток с СПКЯ достоверно выше, чем у практически здоровых женщин репродуктивного возраста. При I типе ПКЯ (с диффузным расположением фолликулов) концентрация СЭФР достоверно выше по сравнению со II типом (периферической локализацией фолликулов).
- Высокие уровни СЭФР в сыворотке крови у пациенток с ПКЯ положительно коррелировали с пиковой систолической скоростью кровотока, объемом яичников и количеством фолликулов.
- Пациенток с СПКЯ и уровнями ЛГ > 18 МЕ/л, а также гиперинсулинемией и высоким содержанием в крови СЭФР следует относить к группе риска развития синдрома гиперстимуляции яичников, что в свою очередь указывает на необходимость дифференцированного подхода к выбору метода стимуляции овуляции, с целью профилактики развития синдрома гиперстимуляции яичников.
Литература
- Манухин И. Б., Тумилович Л. Г., Геворкян М. А. Клинические лекции по гинекологической эндокринологии. М.: ГЭОТАР-Медиа, 2006. 320 с.
- Назаренко Т. А. Синдром поликистозных яичников: современные подходы к диагностике и лечению бесплодия. М.: МЕД пресс-информ, 2005. 208 с.
- Смирнова А. А. Прогнозирование исхода индукции овуляции у пациенток с синдромом поликистозных яичников: Автореф. канд. мед. наук. М., 2004. 21 с.
- Чеботникова Т. В., Холодова Ж. Л. Синдром поликистозных яичников. М., 2008. С. 3–27.
- Agrawal R., Sladkevicius P., Engrmann L. et al. Vascular endothelial growth factor concentrations and ovarian stromal blood flow are increased in women with polycystic ovaries // Hum. Reprod. 1998. № 10. P. 651–655.
- Anasti J. N., Kalantaridou S. N., Kimzey L. M. et al. Human follicle fluid vascular endothelial growth factor concentrations are correlated with luteinization in spontaneously developing follicles // Hum. Reprod. 1998. Vol. 13. P. 1144–1147.
- Balen A. H., Mac Dougall J., Jacobs H. S. Polycystic ovaries and their relevance to assisted concepction // A textbook of in vitro fertilization and assisted reproduction. 1999. P. 109–130.
- Battaglia C., Artini P. G., Genazzani A. D. Color Doppler analysis in lean and obese women with polycystic ovary syndrome // Ultrasound Obstet. Gynecol. 1996. Vol. 7. P. 342–346.
- De Leo V., la Marca A., Ditto A. et al. Effects of metformin on gonadotropin-induced ovulation in women with polycystic ovary syndrome // Fertil. Steril. 1999. Vol. 72. № 2. P. 282–285.
- Fulghesu A. M., Ciampelli M., Belosi C. et al. A new ultrasound criterion for the diagnosis of polycystic ovarian syndrome: the ovarian stroma/total area ratio // Fertil. Steril. 2001. Vol. 76. № 2. P. 326–331.
- Homburg R. Diagnosis and management of polycystic ovary syndrome // Springer US. 2009. P. 238.
- Lobo R А. What is new in the area of androgen excess // Fertil Steril. 2007. № 13. P. 127–133.
Е. И. Манухина, кандидат медицинских наук, доцент
М. А. Геворкян, доктор медицинских наук, профессор
И. Б. Манухин, доктор медицинских наук, профессор
Л. Б. Студеная, кандидат медицинских наук, доцент
МГМСУ, Москва
Контактная информация об авторах для переписки: katemanu@mail.ru
Источник

Ангиогенез и васкулогенез в сетчатке
Успехи современной неонатологии и оптимизация схем выживания недоношенных детей привели к увеличению числа детей с экстремально низкой массой тела при рождении и, соответственно, к увеличению частоты центральных тяжелых форм ретинопатии недоношенных (РН), более резистентных к проведению лазерной коагуляции (ЛК) аваскулярных зон сетчатки, являющейся на сегодняшний день стандартным методом лечения заболевания. При «плюс-болезни» 1-й зоны и задней агрессивной ретинопатии недоношенных (ЗАРН) эффективность ЛК не превышает 55–77% [1]. Также ЛК приводит к грубой деструкции и перерождению периферической сетчатки [2, 3].
Поэтому в настоящее время весьма актуальна проблема: как остановить РН и сохранить полноценную сетчатку?
Формирование сосудов в сетчатке в зависимости от стадии ее развития может проходить путем васкулогенеза либо ангиогенеза.
Васкулогенез — это рост сосудов у эмбриона с дифференцировкой ангиобластов в эндотелиоциты. Этот процесс происходит в сетчатке плода с 16-й нед. внутриутробного развития и заканчивается полной васкуляризацией сетчатки в носовой половине к 36 нед., а в височной части — к 38 нед. внутриутробного развития. В случае преждевременного рождения ребенка (ранее 34 нед. беременности) васкулогенез сетчатки не успевает завершиться, на ее периферии сохраняются бессосудистые зоны [4, 5].
Дальнейшее формирование сосудистой системы сетчатки во внеутробном периоде происходит путем ангиогенеза — прорастания новых сосудов из уже имеющейся сосудистой сети. Этот путь образования сосудов может приводить как к формированию нормального сосудистого русла, так и к образованию патологических новообразованных сосудов, нарушающих структуру и жизнедеятельность тканей [6]. Процесс ангиогенеза регулируется большим количеством ангиогенных факторов, среди которых одним из основных является фактор роста эндотелия сосудов (vascular endothelium growth factor — VEGF). Группа молекул VEGF включает несколько изоформ: VEGF-А, -В, -C, -D, – и плацентарный фактор роста (placental growth factor — PlGF). VEGF-А, -В и PIGF являются регуляторами роста кровеносных сосудов, VEGF-C и -D регулируют рост лимфатических сосудов [7–9].
Роль VEGF в патогенезе РН несомненна. Недоношенный ребенок рождается с незавершенным васкулогенезом сетчатки. При этом на границе васкуляризованной и бессосудистой зон сетчатки скапливается большое количество веретенообразных клеток — предшественников сосудистого эндотелия. На 1-й нед. жизни ребенка в сетчатке определяются наиболее высокие уровни VEGF. В дальнейшем идет постепенное их снижение, что определяется во многом парциальным давлением кислорода в крови [10]. Гипероксия, характерная для раннего периода выхаживания недоношенных детей, ведет к снижению уровня VEGF в сетчатке, что, в свою очередь, вызывает апоптоз клеток эндотелия и запустевание сосудов. Именно недостаток VEGF в первые недели постнатального развития недоношенного ребенка способствует развитию I стадии РН [11]. В дальнейшем начинает нарастать гипоксия в бессосудистой зоне сетчатки. Это приводит к повышению уровня VEGF. Веретено-образные клетки реагируют на это образованием массивных межклеточных связей, что нарушает их способность к миграции и формированию нормальных сосудов. Вместо этого веретенообразные клетки активизируются и формируют грубый эндоплазматический ретикулум. Кроме того, активизированные клетки сами могут секретировать ангиогенный фактор. Все это приводит к аномальной вазопролиферации и развитию пороговых стадий РН [12].
Анти-VEGF терапия при заболеваниях сетчатки
Открытие препаратов, ингибирующих VEGF и названных анти-VEGF, позволило пересмотреть подход к лечению заболеваний, основой патогенеза которых является рост новообразованных сосудов. Первым антиангиогенным препаратом был TNP-470, клинические испытания которого для лечения онкологических пациентов были проведены в 1992 г. [13]. Первым антиангиогенным препаратом для подавления роста новообразованных сосудов в сетчатке глаза был бевацизумаб (2003 г.) Позднее были синтезированы пегаптаниб, ранибизумаб, афлиберцепт.
Пегаптаниб — олигонуклеотидный аптамер, ингибирующий биологическую активность VEGF165. Сегодня применение пегаптаниба в офтальмологии разрешено только для лечения неоваскулярной («влажной») формы возрастной макулярной дегенерации.
Применение пегаптаниба в лечении РН описано в двух источниках, причем в обоих исследованиях он использовался в сочетании с ЛК бессосудистых зон сетчатки. Н.А. Mintz-Hittner [14] указывает, что применение пегаптаниба в сочетании с лазерным лечением было эффективным у 91,2% по сравнению с 69,0% в контрольной группе, где была выполнена только ЛК. R. Autrata et al. [15] отмечают эффективность комбинированного лечения у 89,7%. Авторы утверждают, что регресс «плюс-болезни» и развитие периферических сосудов сетчатки проявились значительно быстрее при комбинированном лечении. При этом не было замечено ни системных, ни местных осложнений.
Наибольшее количество работ посвящено применению бевацизумаба. Данный препарат представляет собой рекомбинантное гуманизированное моноклональное антитело, которое направлено против всех изоформ VEGF [16]. Бевацизумаб эффективен при лечении многих ретинопатий, связанных с активацией VEGF, таких как неоваскулярная возрастная макулярная дегенерация, пролиферативная диабетическая ретинопатия, неоваскулярная глаукома.
Применение препарата в практике лечения РН началось сравнительно недавно. Опубликованы результаты применения бевацизумаба в качестве монотерапии при лечении РН II и III стадии с «плюс-болезнью» в 1-й и 2-й зонах, а также при ЗАРН. В работах описано разное количество пациентов — от 1 до 23. В большинстве исследований бевацизумаб вводили интравитреально в дозе 0,625 мг (0,025 мл). Также описано интравитреальное введение бевацизумаба в дозах 0,375 мг, 0,5 мг, 0,75 мг и даже 12,5 мг. Эффективность интравитреальных инъекций бевацизумаба при лечении детей с РН составила, по данным этих авторов, от 90 до 100% [17–24].
В исследовании BEAT-ROP (The Bevacizumab Eliminates the Angiogenic Threat of Retinopathy of Prematurity — Бевацизумаб устраняет ангиогенную угрозу ретинопатии недоношенных), которое проводилось с 2008 по 2014 г., участвовало 150 детей с РН, родившихся до 30-й нед. включительно и с массой тела при рождении 1500 г и менее, с III стадией РН в 1-й и 2-й зонах. Было обнаружено снижение частоты рецидивирующей РН для 1-й зоны у пациентов, получавших интравитреальную анти-VEGF-терапию, по сравнению с частотой ЛК. Рецидив РН возник у 4 детей в группе беваци-зумаба (6 из 140 глаз — 4%) и у 19 детей в группе лазерной терапии (32 из 146 глаз — 22%), р=0,002. Действие препарата эффективнее в 1-й зоне и менее выражено во 2-й. Авторы отмечают, что «развитие периферических сосудов сетчатки продолжалось после лечения интравитреальным бевацизумабом, в то время как обычная лазерная терапия приводила к необратимому разрушению периферической сетчатки». При анализе рефрактогенеза было обнаружено, что в группе детей с РН III стадии в 1-й и 2-й зонах, пролеченных бевацизумабом, средняя рефракция составляла -1,36 и -0,63 дптр соответственно. В группе детей с такими же стадиями РН, получивших ЛК сетчатки, средняя рефракция составляла -7,34 дптр после РН в 1-й зоне и -5,20 дптр после РН во 2-й зоне. Таким образом, интравитреальное введение бевацизумаба в дозе 0,625 мг позволило не только купировать проявления РН и сохранить периферию сетчатки, но и у большинства детей нормализовать рефрактогенез [25–28]. В Российской Федерации бевацизумаб для применения в офтальмологии не зарегистрирован.
Афлиберцепт — это рекомбинантный гибридный гликопротеин, состоящий из связывающихся с VEGF частей внеклеточных доменов рецептора VEGF1 и рецептора VEGF2, соединенных с доменом Fc (фрагмента, способного к кристаллизации) иммуноглобулина G1 (IgG1) человека. До настоящего времени афлиберцепт почти не использовали для лечения детей с РН. В литературе имеются единичные сообщения о результатах лечения афлиберцептом детей с пограничными стадиями РН, в которых отмечен положительный результат у 86% пролеченных пациентов [29]. В настоящее время проводится многоцентровое двойное слепое рандомизированное исследование эффективности интравитреальных инъекций афлиберцепта у детей с активной РН по сравнению с ЛК сетчатки: Aflibercept for Retinopathy of Prematurity — Intravitreal Injection Versus Laser Therapy (FIREFLEYE). Исследование было начато в июне 2019 г. В него включено 113 детей, гестационный возраст которых — 32 нед. и менее, вес при рождении — 1500 г и ниже. Стадии РН, подлежащие лечению в данном исследовании: 1-я зона — РН 1+, 2+, 3+; 2-я зона — РН 2+, 3+ и ЗАРН. Анализ непосредственных и отдаленных результатов этого исследования будет закончен в феврале 2021 г., после чего полученные данные будут опубликованы [30].
Ранибизумаб — Fab-фрагмент рекомбинантного моноклонального антитела к VEGF, эффективно подавляющий пролиферацию эндотелиальных клеток, неоваскуляризацию сетчатки и уменьшающий проницаемость сосудов. При введении ранибизумаба в стекловидное тело (1 раз в месяц) его концентрация в плазме крови достигает максимального значения в течение суток после инъекции и находится в диапазоне 0,79–2,9 нг/мл. Минимальная концентрация ранибизумаба в плазме крови находится в диапазоне 0,07–0,49 нг/мл. Концентрация ранибизумаба в сыворотке крови приблизительно в 90 000 раз ниже таковой в стекловидном теле [31].
Опубликовано множество исследований использования ранибизумаба в качестве монотерапии. Препарат вводился пациентам с ЗАРН и с пороговыми стадиями РН в 1-й зоне в дозах от 0,12 до 0,3 мг. Даже при минимальных дозировках регресс активных стадий РН после однократной инъекции ранибизумаба был получен, по разным данным, в 73,1–75,6% пролеченных глаз. Еще 25% глаз понадобилась повторная инъекция ранибизумаба или дополнительная ЛК сетчатки. В целом положительный результат (регресс ретинопатии и завершение васкуляризации сетчатки) был получен у 98,2–100% пациентов. Осложнений местного или системного характера ни в одном исследовании отмечено не было [32–37].
Одно из наиболее авторитетных контролируемых рандомизированных исследований эффективности и безопасности интравитреальных инъекций ранибизумаба (ИИР) по сравнению с ЛК сетчатки (RAINBOW) было проведено на базе 87 медицинских центров в 26 странах в 2015–2017 гг. В исследовании были проанализированы результаты лечения 214 детей (428 глаз), родившихся ранее 32 нед. гестационного возраста с массой тела при рождении менее 1500 г. У всех детей имела место двусторонняя активная РН I и II стадии с «плюс-болезнью» либо III стадии в 1-й зоне, III стадии с «плюс-болезнью» во 2-й зоне, либо ЗАРН. Все дети были рандомизированно разделены на 3 примерно одинаковые по численности группы: 1-й группе интравитреально вводили ранибизумаб в дозе 0,2 мг, 2-й группе — ранибизумаб в дозе 0,1 мг, 3-й группе выполнялась ЛК бессосудистых зон сетчатки. Было установлено, что наиболее эффективной оказалась ИИР в дозе 0,2 мг. В этой группе удалось купировать развитие РН у 80% пациентов. Введение ранибизумаба в дозе 0,1 мг было эффективным у 75% детей, тогда как ЛК оказалась эффективной только в 66% случаев. Концентрация ранибизумаба в сыворотке крови после ИИР 0,2 мг составляла 7,82 пкг/мл и к 29-му дню после инъекции снижалась до 1,07 пкг/мл, в то же время системный уровень VEGF в сыворотке крови в первые 15 дней после инъекции снижался незначительно: со 136 до 130 пкг/мл и возвращался к исходному уровню к 29-му дню. Таким образом, не отмечалось признаков супрессии системного VEGF, отсутствовали различия между 3 группами терапии [38]. Аналогичная динамика уровня VEGF в сыворотке крови после ИИР была получена в исследовании X. Chen et al. Также не было выявлено неблагоприятных системных осложнений, связанных с ИИР [39]. В настоящее время проводится продленное нерандомизированное открытое исследование RAINBOW, направленное на оценку долгосрочной безопасности и эффективности применения ранибизумаба у пациентов с РН. В исследование включены пациенты, получившие от 1 до 2 ИИР в дозах 0,1 мг и 0,2 мг, при повторных инъекциях интервал между ними составил не менее 28 дней. Срок наблюдения за пациентами достигнет 5 лет. Ключевым показателем эффективности в данном исследовании является острота зрения лучше видящего глаза. В число ключевых дополнительных показателей входят частота развития нежелательных явлений, острота зрения глаза с более низким зрением, отсутствие активной РН и офтальмологических структурных изменений, а также рецидива РН. Завершение исследования планируется к концу 2022 г. [40].
Клиническое наблюдение
В клинической практике детского отделения ГБУЗ «СОКОБ им. Т.И. Ерошевского» ИИР при лечении II–III стадии РН с «плюс-болезнью» применялись у 3 пациентов. Был получен положительный непосредственный результат — продолжилась васкуляризация бессосудистых зон сетчатки. Отдаленный результат удалось проследить только в 1 случае.
Пациентка Х. родилась на 28-й нед. беременности с массой тела 800 г. Консультация проведена 01.12.2010 г., в срок 37 нед. постконцептуального возраста. Была обследована на педиатрической ретинальной камере RetCam Clarity (Clarity Medical Systems, Inc., США), поставлен диагноз: OD — РН II+, 2-я зона, суммарно 12 часовых меридианов, активная стадия, OS — РН III+, 2-я зона, суммарно 12 часовых меридианов, активная стадия. Поскольку технической возможности выполнить ЛК сетчатки либо криопексию в тот период не было, консилиумом офтальмологов и педиатров-неонатологов было принято решение провести лечение путем ИИР в дозе 0,2 мг. Было получено добровольное информированное согласие родителей на данный вид лечения. На первом этапе была проведена ИИР в левый глаз. Второй этап — ИИР в правый глаз — удалось провести только через 7 дней из-за общесоматических противопоказаний к более раннему анестезиологическому пособию. В левом глазу полный регресс наступил через 1 нед. после инъекции, васкуляризация сетчатки завершилась через 4 нед. В правом глазу из-за более позднего вмешательства процесс удалось остановить на стадии IVа, в результате чего сформировалась серповидная складка сетчатки. Девочка постоянно наблюдается в детском отделении ГБУЗ «СОКОБ им. Т.И. Ерошевского», получает курсы дедистрофического и плеоптического лечения.
В настоящее время ребенку 9 лет. Девочка соматически здорова, посещает общеобразовательную школу. По данным обследования в марте 2020 г.:
Visus OD = 0,02 sph -1,0 cyl -1,5 ax 105о = 0,08.
Visus OS = 0,1 sph -3,0 cyl -1,5 ax 12о = 0,4.
Ультразвуковая оптическая биометрия: OD = 21,9 мм, OS = 23,5 мм.
Объективно: небольшой горизонтальный нистагм, глаза попеременно отклоняются к носу до 10о по Гиршбергу. Оптические среды прозрачные. Глазное дно: OD — диск зрительного нерва бледно-розовый, границы стушеваны с височной стороны, от него отходит серповидная складка сетчатки, прикрывающая макулярную область. Сосуды сужены, аваскулярных зон нет. OS — диск зрительного нерва бледно-розовый, границы четкие, сосуды незначительно сужены, макулярный рефлекс не контурируется. Аваскулярных зон сетчатки нет.
Исследование зрительных вызванных потенциалов: OU — пики Р100 быстро выделяются из фоновой ритмики, сохранны по форме, амплитуде, латентности.
По данным оптической когерентной томографии: справа определяется темпоральное натяжение макулы; слева послойная структура сетчатки не нарушена, фовеолярная ямка не сформирована, на доступных осмотру участках изменений не выявлено. Диагноз: OD — серповидная складка сетчатки, OS — гипоплазия макулы.
На ультразвуковом исследовании в обоих глазах определяются единичные слабовыраженные плавающие помутнения в стекловидном теле и незначительное уплотнение задней гиалоидной мембраны. Справа у диска зрительного нерва уплотнение и локальная проминенция до 1,6 мм.
Было проведено общесоматическое обследование ребенка, включающее консультации педиатра, кардио-ревматолога, ультразвуковое исследование почек и магнитно-резонансную томографию (МРТ) головного мозга. По заключению педиатра девочка соматически здор?