Как изменится скорость реакции если уменьшить объем сосуда
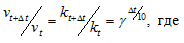
Задача 373.
Как изменится скорость реакции 2NO + O2 ⇔ 2NO2 если объем реакционного сосуда увеличить в 2 раза: а) уменьшится в 4 раза; б) уменьшится в 8 раз; в) возрастет в 4 раза; г) возрастет в 8 раз?
Решение:
Уравнение реакции имеет вид: 2NO + O2 ⇔ 2NO2.
До изменения объёма скорость реакции можно выразить уравнением:
v = k[NO]2. [O2], где
v – скорость реакции, k – константа скорости реакции, [NO] и [O2] – концентрации исходных веществ.
Вследствие увеличения объёма в системе в 2 раза, соответственно концентрация каждого из реагирующих веществ уменьшится в 2 раза. Следовательно, теперь скорость реакции будет равна:
v’ = k(1/2[NO])2. (1/2[O2]) = 1/8k[NO]2. [O2]
Тогда, сравнивая выражения v и v’, находим, что скорость реакции уменьшится в 8 раз
Ответ: б).
Задача 374.
Чем объясняется повышение скорости реакции при введении в систему катализатора: а) уменьшением энергии активации; б) увеличением средней кинетической энергии молекул; в) возрастанием числа столкновений; г)
остом числа активных молекул?
Решение:
Действие катализатора объясняется тем, что при его участии в реакционной системе возникают нестойкие промежуточные соединения (активированные комплексы), распад которых приводит к образованию продуктов реакции. При этом энергия активации реакции значительно понижается и активными становятся некоторые молекулы (реакционные частицы), энергия которых была недостаточна для осуществления реакции в отсутствии катализатора. В результате, при применении катализатора в реакционной системе общее число активных молекул (частиц) и скорость реакции значительно возрастает.
Таким образом, катализатор приводит к уменьшению энергии активации реакции и росту числа активных молекул (частиц).
Ответ: а); г).
Задача 375.
Какие из перечисленных воздействий приведут к изменению константы скорости реакции: а) изменение давления; б) изменение температуры; в) изменение объема реакционного сосуда; г) введение в систему катализатора; д) изменение концентрации реагирующих веществ?
Решение:
а) Согласно закону действующих масс скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Например, для реакции mA + nB ⇔ AmBn зависимость скорости реакции от концентрации реагентов А и В выразится в виде:
V = k[A]m . [B]n, где
А, В – молярные концентрации реагирующих веществ;
m, n – стехиометрические коэффициенты;
k – константа скорости реакции – величина, которая зависит от природы реагирующих веществ и равная единице, когда концентрации реагирующих веществ равны единице.
В случае гетерогенных химических реакций в выражение ЗДМ не входит концентрация веществ находящихся в твёрдой фазе, поскольку процесс протекает лишь на их поверхности.
При изменении давления в реакционной системе, в которой присутствуют газообразные вещества, происходит изменение концентрации газообразных реагентов. Значит, при изменении концентрации изменится значение скорости реакции, а значение константы скорости реакции не изменится.
б) Зависимость скорости реакции (или константы скорости реакции) от температуры может быть выражена уравнением:
Здесь vt и kt – скорость и константа скорости реакции при температуре t °С; vt+ 10 и kt + 10 те же величины при температуре (t + 100 °С); – температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 – 4 (правило Вант-Гоффа). В общем случае, если температура изменилась на °С, последнее уравнение преобразуется к виду:
Зависимость константы скорости реакции (k) от энергии активации (Ea) выражается уравнением Аррениуса: или , где
Ea – энергия активации, k и k’ – константы скорости реакции, Т – температура в К (298). Учитывая зависимость константы скорости реакции от изменения температуры, получим:
Из чего следует, что чем меньше энергия активации и выше температура, тем больше константа скорости реакции и k’/k.
Таким образом, изменение температуры реакционной среды приводит к изменению константы скорости реакции.
в) Изменение объёма жидкой или газообразной системы приводит к изменению конценрации газообразных веществ и веществ, находящихся в жидкой фазе. Следовательно, при изменении концентрации реагирующих веществ, исходя из выражения ЗДМ реакции, изменится только значение скорости процесса, а величина k останется постоянной. Величина константы скорости реакции зависит от природы реагентов и не зависит от изменения концентрации их в реакционной системе.
г) Введение в систему катализатора приводит к увеличению скорости реакции, но концентрации веществ остаются прежними, значит, изменится и значение константы скорости реакции, оно целочисленно станет больше. Катализатор снижает энергию активации реакции, что можно описать с помощью уравнения Аррениуса: где
Ea’ и Ea” – изменение энергии активации в реакционной системе после введения катализатора.
д) Изменение концентрации реагирующих веществ, исходя из выражения ЗДМ реакции, изменится только значение скорости процесса, а величина k останется постоянной.
Вывод:
Константа скорости реакции – это величина, зависящая от природы реагирующих веществ, от температуры и от присутствия катализаторов, но не зависит от концентрации реагирующих веществ.
Ответ: б); г).
Задача 376.
Какое влияние оказывает перемешивание на скорость протекания гетерогенной химической реакции: а) во всех случаях увеличивает скорость реакции; б) в некоторых случаях увеличивает скорость реакции; в) не влияет на скорость реакции?
Решение:
В ходе гетерогенной реакции можно выделить три стадии:
1. Подвод реагирующего вещества;
2. Химические реакции на поверхности;
3. Отвод продукта реакции то поверхности.
Скорость гетерогенной реакции – это количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы.
При перемешивании системы скорость переноса веществ и отвода продуктов реакции увеличивается, соответственно, должна увеличиваться и скорость реакции. Действительно, при перемешивании, скорость реакции увеличивается, если химическая стадия реакции требует небольшой энергии активации. Так реакция горения угля C(тв) + О2(г) ⇔ СО2(г) протекает тем быстрее, чем интенсивнее идёт конвекция в системе. Однако, есть реакции, скорость которых не увеличивается при перемешивании, например, реакция окисления железа кислородом влажного воздуха не ускоряется при увеличении подачи воздуха к поверхности металла, поскольку здесь энергия активации химической стадии процесса значительна.
Стадия, определяющая скорость протекания реакции, называется лимитирующей стадией. В реакции горения угля лимитирующей стадией является перенос вещества, а в реакции окисления железа собственно химическая реакция. Таким образом, перемешивание (конвекция) в некоторых случаях увеличивает скорость гетерогенной реакции, а именно, если стадия переноса веществ является лимитирующей, т.е. энергия активации стадии подвода и отвода веществ невелика.
Ответ: б).
Задача 377.
Увеличение скорости реакции с повышением температуры, вызывается главным образом: а) увеличением средней кинетической энергии молекул; б) возрастанием числа активных молекул; в) ростом числа столкновений?
Решение:
Зависимость скорости реакции (или константы скорости реакции) от температуры может быть выражена уравнением:
Здесь vt и kt – скорость и константа скорости реакции при температуре t °С; v(t + 10) и k(t + 10) те же величины при температуре (t + 100 °С); – температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 – 4 (правило Вант-Гоффа). В общем случае, если температура изменилась на °С, последнее уравнение преобразуется к виду:
Естественно, при повышении температуры системы увеличивается и кинетическая энергия молекул (частиц) и возрастает число столкновений молекул (частиц) реагирующих веществ. Но от этого правила наблюдаются отклонения для гетерогенных реакций, так как скорость их мало изменяется с температурой, и для биохимических реакций, для которых при повышении температуры всего лишь на один градус скорость реакции увеличивается в десятки и сотни раз.
Аррениус дал более точное выражение для зависимости константы скорости реакции от температуры:
Как показывает практика, элементарный акт реакции протекает не при всяком столкновении молекул (частиц) реагирующих веществ: реагируют только те молекулы (частицы), которые обладают достаточной энергией, чтобы разорвать или ослабить связи в исходных молекулах (частицах) и тем самым создать возможность образования новых молекул (частиц). Поэтому каждая реакция характеризуется определённым барьером энергии; для преодоления барьера необходима энергия активации – избыточная энергия, которой должны обладать молекулы (частицы) для того чтобы их столкновение было эффективным. С ростом температуры число активных молекул (частиц) быстро увеличивается, что и приводит к резкому возрастанию скорости реакции.
Ответ: б).
Источник
Скорость химической реакции – основное понятие химической кинетики, выражающее отношения количества прореагировавшего вещества (в молях) к отрезку времени, за которое произошло взаимодействие.
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции: моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в другое в единице объема.
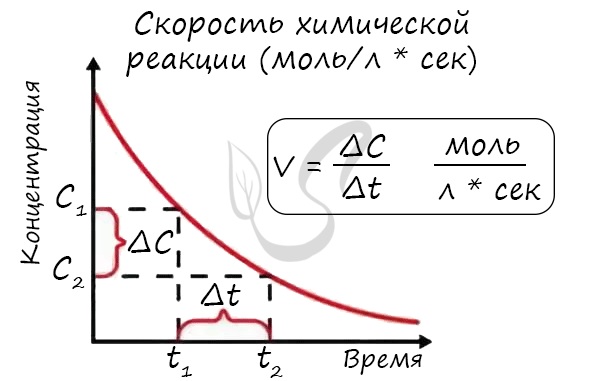
Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость реакции. Давайте решим подобное несложное задание для примера:
Молярная концентрация вещества до реакции составляла 1.5 моль/л по итогу реакции – 3 моль/л. Объем смеси 10 литров, реакция заняла 20 секунд. Рассчитайте скорость реакции.
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.

Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения реагирующих веществ.
Очевидно, что большой кусок железа, положенный в соляную кислоту, будет гораздо дольше реагировать с ней, нежели чем измельченное железо – железная стружка.

Химическая активность также играет важную роль. Например, отвечая на вопрос: какой из металлов Li или K быстрее прореагирует с водой? Мы отдадим предпочтение литию, так как в ряду активности металлов он стоит левее калия, а значит литий активнее калия.

Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Влияние концентрации “прямо пропорционально” скорости реакции: при увлечении концентрации реагирующего вещества скорость реакции повышается, при уменьшении – понижается.
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.

Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции aA + bB → cC определяют по уравнению:
υ = k × СaA × СbB
Физический смысл константы скорости – k – в том, что она численно равна скорости реакции при том условии, что концентрации реагирующих веществ равны 1. Обратите внимание, что стехиометрические коэффициенты уравнения переносятся в степени – a и b.
Записанное выше следствие закона действующих масс нужно не только “зазубрить”, но и понять. Поэтому мы решим пару задач, где потребуется написать подобную формулу.
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции, если объемы системы уменьшить в три раза?

По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если уменьшить концентрацию водорода в два раза?

В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: “Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как экзотермической, так и эндотермической. Исключений нет”.
Очень часто в заданиях следующей темы – химическом равновесии, вас будут пытаться запутать и ввести в заблуждении, но вы не поддавайтесь и помните про постулат!
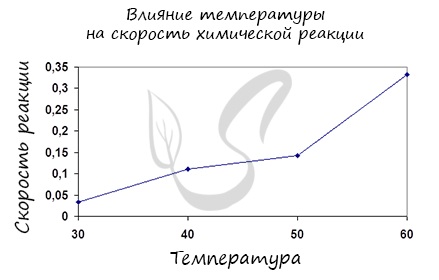
Итак, влияние температуры на скорость реакции “прямо пропорционально”: чем выше температура, тем выше скорость реакции – чем ниже температура, тем меньше и скорость реакции. Однако, как и в случае с концентрацией, это больше чем простая “пропорция”.
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так: “При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два – четыре раза”

В формуле, написанной выше, используются следующие обозначение:
- υ1 – скорость реакции при температуре t1
- υ2 – скорость реакции при температуре t2
- γ – температурный коэффициент, который может быть равен 2-4
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку. Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?
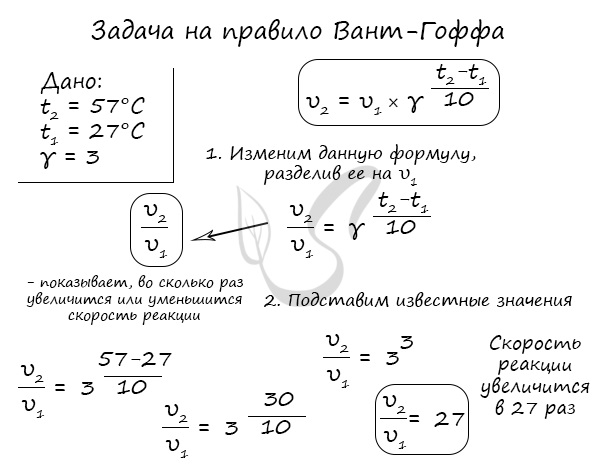
Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: “Рассчитайте, чему равен температурный коэффициент скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз”.

Катализаторы и ингибиторы
Катализатор (греч. katalysis – разрушение) – вещество, ускоряющее химическую реакцию, но не участвующее в ней. Катализатор не расходуется в химической реакции.
Многие химические реакции в нашем организме протекают с участием катализаторов – белковых молекул, ферментов. Без катализаторов подобные реакции шли бы сотни лет, а с катализаторами идут одну долю секунды.
Катализом называют явление ускорения химической реакции под действием катализатора, а химические реакции, идущие с участием катализатора – каталитическими.

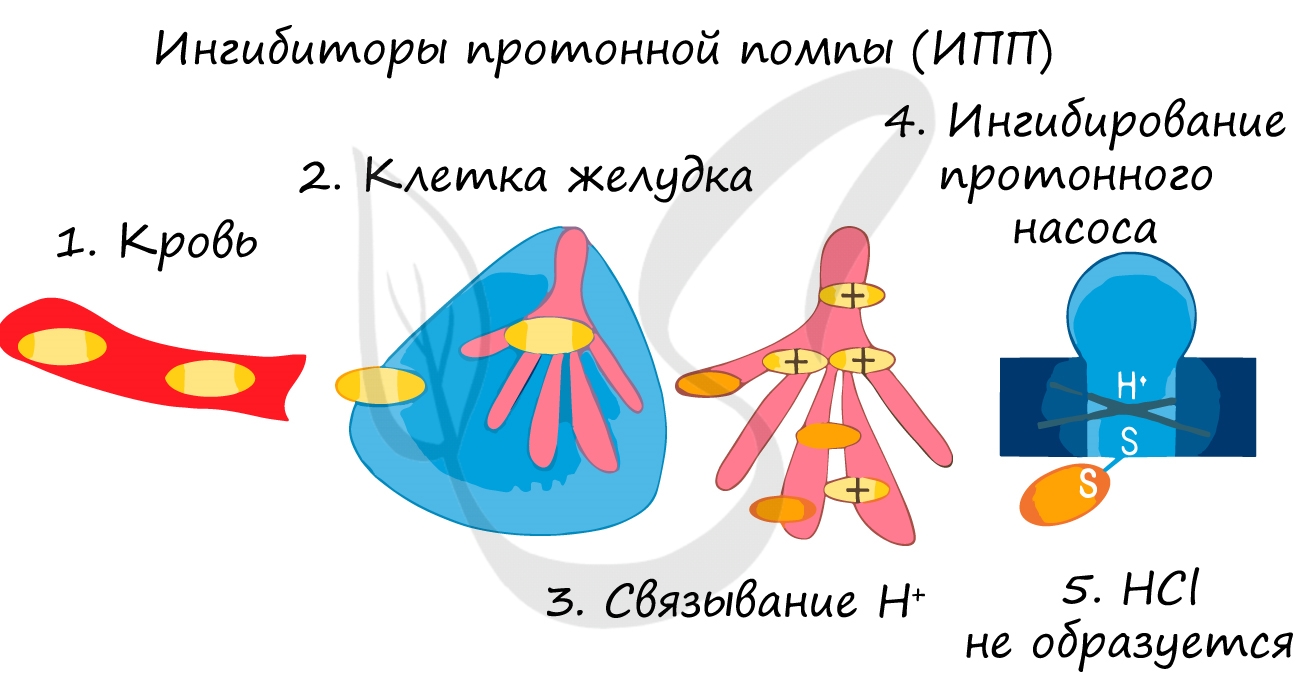
Ингибитор (лат. inhibere – задерживать) – вещество, замедляющее или предотвращающее протекание какой-либо химической реакции.
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества являются ингибиторами.
Так при лечении гастрита – воспаления желудка (греч. gaster – желудок) или язв часто назначаются ингибиторы протонной помпы – химические вещества, которые блокирует выработку HCl слизистой желудке. В результате этого соляная кислота прекращает воздействие на поврежденную стенку желудка, воспаление стихает.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Задача 331.
Реакция между веществами А и В выражается уравнением: А + 2В → С. Начальные концентрации составляют: [А]0 = 0,03 моль/л, [В]0 = 0,05 моль/л. Константа скорости реакции равна 0,4. Найти начальную скорость реакции и скорость реакции по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,01 моль/л.
Решение:
До изменения концентрации скорость реакции можно выразить уравнением:
v – скорость реакции, k – константа скорости реакции, [А] и [В] – концентрации исходных веществ.
Тогда
Для нахождения скорости реакции по истечении некоторого времени учтём, что на образование 1 моля вещества С затрачивается 1 моль вещества А и 2 моля вещества В, поэтому при уменьшении концентрации вещества А на 0,01 моль/л, концентрация вещества В уменьшится соответственно на 0,02 моль/л (2 . 0.01 = 0,02). Тогда оставшиеся концентрации веществ будут равны [A]ост. = 0.03 – 0,01 = 0,02 моль/л, [B]ост. = 0,05 – 0,02 = 0,03моль/л. Тогда скорость реакции по истечении некоторого времени будет составлять:
Ответ: v1 = 3 .10-5; v2 = 7,2 . 10-6.
Задача 332.
Как изменится скорость реакции 2NO (г.) + O2 (г.) → 2NO2 (г.), если: а) увеличить давление в системе в 3 раза; б) уменьшить объем системы в 3 раза; в) повысить концентрацию в 3 раза?
Решение:
До изменения объёма, давления и концентрации скорость реакции можно выразить уравнением:
v – скорость реакции, k – константа скорости реакции, [NO] и [O2] – концентрации исходных веществ.
а) Вследствие увеличения давления в системе в 3 раза, соответственно концентрация каждого из реагирующих веществ возрастёт в 3 раза. Следовательно, теперь скорость реакции будет равна:
Тогда, сравнивая выражения v и vа) , находим, что скорость реакции возрастает в 27 раз
б) при уменьшении объёма в 3 раза в системе концентрация каждого из реагирующих веществ возрастёт в 3 раза. Следовательно, теперь скорость реакции будет равна:
Тогда, сравнивая выражения v и vб), находим, что скорость реакции возрастает в 27 раз
в) При увеличении концентрации NO в 3 раза скорость реакции будет равна:
Cравнивая выражения v и vв), находим, что скорость реакции возрастает в 9 раз
Ответ: а) возрастёт в 27 раз; б) возрастёт в 27 раз; в) возрастёт в 9 раз.
Задача 333.
Две реакции протекают при 25 °С с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2,0, а второй 2,5. Найти отношение скоростей этих реакций при 95°С.
Решение:
Зависимость скорости реакции (или константы скорости реакции) от температуры может быть выражена уравнением:
Здесь vt и kt – скорость и константа скорости реакции при температуре t °С; v(t + 10) и k(t + 10) те же величины при температуре (t + 10 °С); – температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 – 4 (правило Вант-Гоффа). В общем случае, если температура изменилась на 95 °С, последнее уравнение преобразуется к виду:
Поскольку t = 70 °С (95 – 25 = 75), то, скорость реакции равна:
Скорость второй реакции равна:
Найдём отношение этих скоростей:
Ответ:
Задача 334.
Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 градусов скорость реакции возрастает в 15,6 раза?
Решение:
Согласно правилу Вант Гоффа зависимость скорости реакции от температуры выражается уравнением:
vt и kt – скорость и константа скорости реакции при температуре t °С; v(t + 10) и k(t + 10) те же величины при температуре (t + 10 °С); – температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 – 4. Поскольку t = 30 °С, то, подставив в уравнение Вант-Гоффа значения по условию задачи, рассчитаем температурный коэффициент скорости реакции:
Ответ: 2,5.
Задача 335.
Температурный коэффициент скорости некоторой реакции равен 2,3. Во сколько раз увеличится скорость этой реакции, если повысить температуру на 25 градусов?
Решение:
Согласно правилу Вант Гоффа зависимость скорости реакции от температуры выражается уравнением:
vt и kt – скорость и константа скорости реакции при температуре t °С; v(t + 10) и k(t + 10) те же величины при температуре (t + 10 °С); – температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 – 4. Поскольку t = 25 °С, то, обозначив скорость начальной реакции и скорость реакции при повышении температуры системы на 25 градусов соответственно через v и v’, можем записать:
Ответ: в 8 раз.
Источник
