Как можно доказать наличие кислорода в сосуде можно с помощью

КОНКУРС “Я ИДУ НА
УРОК”
ПРАКТИЧЕСКАЯ РАБОТА (1 ч) 8 КЛАСС
Работа проводится учащимися
самостоятельно под контролем учителя.
Предлагаю результат моей многолетней работы по
подготовке и проведению практических работ в
общеобразовательной школе на уроках химии в 8–9-х
классах:
- «Получение и свойства
кислорода», - «Приготовление
растворов солей с определенной массовой долей
растворенного вещества», - «Обобщение сведений о
важнейших классах неорганических соединений», - «Электролитическая
диссоциация», - «Подгруппа кислорода»
(см. след. номера газеты «Химия»).
Все они апробированы мною на занятиях. Их
можно использовать при изучении школьного курса
химии как по новой программе О.С.Габриеляна, так и
по программе Г.Е.Рудзитиса, Ф.Г.Фельдмана.
Ученический эксперимент – это вид
самостоятельной работы. Эксперимент не только
обогащает учащихся новыми понятиями, умениями,
навыками, но и является способом проверки
истинности приобретенных ими знаний,
способствует более глубокому пониманию
материала, усвоению знаний. Он позволяет более
полно осуществлять принцип вариативности
восприятия окружающего мира, т. к. главная
сущность этого принципа – связь с жизнью, с
будущей практической деятельностью учащихся.
Цели. Уметь получать кислород в
лаборатории и собирать его двумя методами:
вытеснением воздуха и вытеснением воды;
подтвердить опытным путем свойства кислорода;
знать правила техники безопасности.
Оборудование. Металлический штатив с
лапкой, спиртовка, спички, пробирка с
газоотводной трубкой, пробирка, комочек ваты,
пипетка, химический стакан, лучинка,
препаровальная игла (или проволока),
кристаллизатор с водой, две конические колбы с
пробками.
Реактивы. KMnO4 кристаллический (5–6
г), известковая вода Сa(OH)2, древесный уголь,
Fe (стальная проволока или скрепка).
Правила техники безопасности.
Осторожно обращайтесь с химическим
оборудованием!
Помните! Пробирку прогревают, держа ее в
наклонном положении, по всей длине двумя-тремя
движениями в пламени спиртовки. При нагревании
направляйте отверстие пробирки в сторону от себя
и соседей.
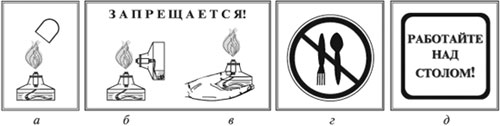 |
Тушите спиртовку только колпачком (а). |
Предварительно учащиеся получают
домашнее задание, связанное с изучением
содержания предстоящей работы по инструкции,
одновременно используя материалы учебников 8-го
класса авторов О.С.Габриеляна (§ 14, 40) или
Г.Е.Рудзитиса, Ф.Г.Фельдмана (§ 19, 20). В тетрадях для
практических работ записывают название темы,
цель, перечисляют оборудование и реактивы,
оформляют таблицу для отчета.
ХОД УРОКА
Один опыт я ставлю выше,
чем тысячу мнений,
рожденных только
воображением.
М.В.Ломоносов
1. Перманганат калия (КMnO4) поместите в
сухую пробирку. У отверстия пробирки положите
рыхлый комочек ваты.
2. Закройте пробирку пробкой с газоотводной
трубкой, проверьте на герметичность (рис. 1).
Рис. 1. |
(Пояснения учителя, как проверить
прибор на герметичность.) Укрепите прибор в лапке
штатива.
3. Газоотводную трубку опустите в стакан, не
касаясь дна, на расстоянии 2–3 мм (рис. 2).
Рис. 2. |
4. Подогрейте вещество в пробирке.
(Помните правила техники безопасности.)
5. Проверьте наличие газа тлеющей лучинкой
(угольком). Что наблюдаете? Почему кислород можно
собирать методом вытеснения воздуха?
6. Соберите полученный кислород в две колбы для
проведения следующих опытов. Колбы закройте
пробками.
7. Оформите отчет, пользуясь табл. 1, которую
разместите на развороте тетради.
1. Пробирку заполните водой. Закройте пробирку
большим пальцем и переверните ее вверх дном. В
таком положении опустите руку с пробиркой в
кристаллизатор с водой. Подведите к концу
газоотводной трубки пробирку, не вынимая ее из
воды (рис. 3).
Рис. 3. |
2. Когда кислород вытеснит воду из
пробирки, закройте ее большим пальцем и выньте из
воды. Почему кислород можно собирать способом
вытеснения воды?
Внимание! Выньте газоотводную трубку из
кристаллизатора, не прекращая нагревать
пробирку с КMnО4. Если этого не сделать, то
воду перебросит в горячую пробирку. Почему?
1. Закрепите уголек на металлической проволоке
(препаровальной игле) и внесите в пламя
спиртовки.
2. Раскаленный уголек опустите в колбу с
кислородом. Что наблюдаете? Дайте объяснение
(рис. 4).
Рис. 4. |
3. После извлечения несгоревшего угля
из колбы, прилейте в нее 5–6 капель известковой
воды
Са(ОН)2. Что наблюдаете? Дайте объяснение.
4. Оформите отчет о работе в табл. 1.
1. Прикрепите к одному концу стальной проволоки
кусочек спички. Зажгите спичку. Проволоку с
горящей спичкой опустите в колбу с кислородом.
Что наблюдаете? Дайте объяснение (рис. 5).
Рис. 5. |
2. Оформите отчет о работе в табл. 1.
Таблица 1
| Выполняемые операции (что делали) | Рисунки с обозначениями исходных и полученных веществ | Наблюдения. Условия проведения реакций. Уравнения реакций | Объяснения наблюдений. Выводы |
|---|---|---|---|
| Сборка прибора для получения кислорода. Проверка прибора на герметичность | |||
| Получение кислорода из KMnО4 при нагревании | |||
| Доказательство получения кислорода c помощью тлеющей лучинки | |||
| Характеристика физических свойств О2. Собирание О2 двумя методами: вытеснением воздуха, вытеснением воды | |||
| Характеристика химических свойств О2. Взаимодействие с простыми веществами: горение угля, горение железа (стальная проволока, скрепка) |
Сделайте
письменный общий вывод о проделанной работе (5
мин).
ВЫВОД. Один из способов получения
кислорода в лаборатории – разложение КMnO4.
Кислород – газ без цвета и запаха, тяжелее
воздуха в 1,103 раза (Mr(O2) = 32, Mr(возд.)
= 29, из чего следует 32/29 1,103),
малорастворим в воде. Вступает в реакции с
простыми веществами, образуя оксиды.
Приведите рабочее место
в порядок (3 мин): разберите прибор, расставьте
посуду и принадлежности на свои места.
Сдайте тетради на
проверку.
Домашнее задание.
Задача. Определите, какое из соединений
железа – Fe2О3 или Fe3О4 –
богаче железом?
| Дано: | Найти: |
| Fe2O3, Fe3O4. | (Fe) в Fe2O3, ‘(Fe) в Fe3O4 |
Решение
(Х) = n•Ar(X)/Mr,
где n – число атомов элемента Х в формуле
вещества.
Mr(Fe2O3) = 56•2 + 16•3 = 160,
(Fe) = 56•2/160 = 0,7,
(Fe) = 70%,
Mr (Fe3O4) = 56•3 + 16•4 = 232,
‘(Fe)
= 56•3/232 = 0,724,
‘(Fe) = 72,4%.
Ответ. Fe3O4 богаче железом, чем Fe2O3.
Учитель во время практической работы наблюдает
за правильностью выполнения приемов и операций
учащимися и отмечает в карточке учета умений
(табл. 2).
Таблица 2
Карточка учета умений
| Операции практической работы | Фамилии учащихся | |||||
|---|---|---|---|---|---|---|
| А | Б | В | Г | Д | Е | |
| Сборка прибора для получения кислорода | ||||||
| Проверка прибора на герметичность | ||||||
| Укрепление пробирки в лапке штатива | ||||||
| Обращение со спиртовкой | ||||||
| Нагревание пробирки с KМnО4 | ||||||
| Проверка выделения О2 | ||||||
| Собирание О2 в сосуд двумя методами: вытеснением воздуха, вытеснением воды | ||||||
| Сжигание угля | ||||||
| Сжигание Fe (стальной проволоки) | ||||||
| Kультура выполнения опытов | ||||||
| Оформление работы в тетради | ||||||
Образец отчета о проделанной практической
работе (табл. 1)
| Выполняемые операции (что делали) | Рисунки с обозначениями исходных и полученных веществ | Наблюдения. Условия проведения реакций. Уравнения реакций | Объяснения наблюдений. Выводы |
|---|---|---|---|
| Сборка прибора для получения кислорода. Проверка прибора на герметичность | Выделяются пузырьки воздуха | Прибор собран герметично | |
| Получение кислорода из KMnO4 при нагревании | При нагревании KMnO4 происходит реакция: | О2 получают в лаборатории разложением KMnO4 при нагревании | |
| Доказательство получения кислорода при помощи тлеющей лучинки | Тлеющая лучинка (уголь) ярко загорается в О2 | Полученный газ О2 поддерживает горение | |
| Характеристика физических свойств О2. Собирание О2 двумя методами: вытеснением воздуха (а), вытеснением воды (б) | Kислород вытесняет воздух и воду из сосудов | Kислород – газ без цвета и запаха, немного тяжелее воздуха, поэтому его собирают в сосуд, поставленный на дно. Kислород малорастворим в воде | |
| Характеристика химических свойств О2. Взаимодействие с простыми веществами: горение угля (a), горение железа (стальная проволока, скрепка, стружка) (б) | Раскаленный уголек ярко горит в О2: Известковая вода мутнеет, т. к. | О2 взаимодействует с простыми веществами – металлами и неметаллами. Образование осадка белого цвета подтверждает наличие в колбе СО2 |
О.М.БЫКОВА,
учитель химии
Красноярской средней школы № 2
(с. Красный Яр, Астраханская обл.)
Источник
- Главная
- Вопросы & Ответы
- Вопрос 7177898
Мари Умняшка
более месяца назад
Просмотров : 22
Ответов : 1
Лучший ответ:
Энджелл
С помощью тлеющей лучинки. При поднесении её к открытому сосуду с кислородом она загорится.
более месяца назад
Ваш ответ:
Комментарий должен быть минимум 20 символов
Чтобы получить баллы за ответ войди на сайт

Лучшее из галереи за : неделю месяц все время































Другие вопросы:
Главный Попко
Между какими веществами произойдет химическая реакция : цинк и раствор сульфата меди; алюминий и хлорид железа; железо и фосфат алюминия
более месяца назад
Смотреть ответ
Просмотров : 8
Ответов :
Пармезан Черница
Помагите честно можно ли ложить коробку от яиц под ноутбук когда он работает в вкученом режиме.
более месяца назад
Смотреть ответ
Просмотров : 9
Ответов : 1
Энджелл
Устоновите соответствие между иименами правителей и проведёными в их царствавание мероприятиями к каждой позиции первого столбца подбери соответствующею поицию второго раскожите о мероприятиях которые окозались лишним.
ПРАВИТИЛИ
1) Анна Иановна
2)Елизовета петровна
3)Екатерин…
более месяца назад
Смотреть ответ
Просмотров : 6
Ответов : 1
Таня Масян
Разложи на множетели 121а^2-b^12 СРОЧНО!
более месяца назад
Смотреть ответ
Просмотров : 6
Ответов : 1
Зачетный Опарыш
Составьте формулу оксида меди, если массовая доля меди в нем 88,8%
более месяца назад
Смотреть ответ
Просмотров : 11
Ответов : 1
Источник
