Как обнаружить водород в сосуде
Анонимный вопрос
10 января 2018 · 7,2 K
Водород – это самый легкий газ. В лаборатории его получают чаще всего в аппарате Кипа взаимодействием цинка с соляной кислотой:
Zn + 2HCl = ZnCl2 + H2 ↑.
Так как водород самый легкий газ, его собирают в перевернутый вверх дном сосуд.
Для распознавания водорода его поджигают и по характеру звука, с которым он сгорает, определяют наличие данного газа: к отверстию перевернутого вверх дном сосуда подносят зажженную лучину. Раздается глухой хлопок, если водород чистый или «лающий» звук, если водород содержит примеси.
Правда ли вулканическая лава при попадании в реку превращает ее в серную кислоту? Если да, то при соединении каких элементов?
Начнем со второго вопроса.
Элементарный состав серной кислоты узнать довольно несложно, достаточно написать в поисковике “серная кислота”, если вы уж из школьного куса химии этого не помните. Но окей, ее состав это H2SO4 – водород (2 шт), кислород (4 шт), ну и сама сера.
Вода, как я надеюсь, вы помните, это H2O, так что водород и кислород у нас уже имеется, осталось только найти серу. И, сюрприз, серную кислоту, в том числе получают из воды и оксида серы (IV), он же серный газ, он же SO3.
И да, серный газ содержится в вулканических выхлопах. Но он кипит при температуре в 45 градусов. Лава несколько горячее, так что много его там быть не может. Но в целом да, при контакте лавы с водой, при наличии в лаве оксида серы, может образовываться небольшое количество кислоты. Ключевое слово тут “небольшое”.
Но скажу вам даже больше. Оксид серы (IV) содержится в луке. И когда вы его режете, он выделяется. И попадает в глаза. И реагирует с водой, увлажняющей роговицу, и получается, да-да, серная кислота. Самая настоящая. Совсем немного, недостаточно чтобы повредить глаза, но достаточно чтобы вызвать бурю незабываемых ощущений.
Как из водорода получить метан?
Водород может получаться при сильном нагревании метана.
Поэтому в промышленности большое количество водорода получают именно из метана, добавляя к нему при высокой температуре перегретый водяной пар:
1) CH4 + H2O = CO + 3 H2
2) CO + H2O = CO2 + H2
В сумме этот процесс можно записать уравнением:
CH4 + 2 H2O = 4 H2 + CO2
Каковы плюсы и минусы водородных автомобилей?
Сотрудник Mitsubishi Power Europe/
Аспирант НИУ МЭИ, кафедра химии и электрохимической… · t.me/century_arch
Водородные транспортные средства определенно представляют интерес, даже вооруженные силы Соединенных Штатов ведут разработки перспективных боевых машин на водородных топливных элементах. В списке находятся боевая машина пехоты и танк, а разработкой ведают ученые из Центра управления боевыми возможностями армии США (GVSC) и Исследовательской лаборатории сухопутных сил.
Топливные элементы вырабатывают электроэнергию почти бесшумно, а так же без какого-либо экологического эффекта.
Энергоэффективность топливных элементов выше чем у двигателей внутреннего сгорания, и водород, используемый в качестве топлива, может поступать из различных источников: его можно вырабатывать из любой жидкости на водной основе, такой как кофе, спортивные напитки или даже моча. Более того, существующие виды топлива, такие как бензин, пропан и природный газ, также могут быть использованы для извлечения водорода.
Можно сказать что водород может стать альтернативой нефти, но в этом и минус этого топлива, требуются весьма энергозатратные мероприятия для получения водорода, а так же на его сжатие, хранение вообще больная тема для водородной энергетики. Необходимо создать соответствующую инфраструктуру для водородной энергосистемы, очень хорошо уплотнять и нейтрализовать все неплотности, поскольку водород очень летуч.
Отдельно стоит вопрос безопасности, на этот счет нет единого мнения, но если взрыв произойдет – он будет сильным.
Прочитать ещё 1 ответ
Где применяют водород и каковы перспективы его применение в будущем?
Получил математическое и богословское образование. Есть дети, соответсвенно и…
Водород широко применяется в нефтепереработке – с его помощью из различных нефтепродуктов удаляются соединения серы. Большой объём этого газа используется для получения аммиака (необходимого, например, для производства удобрений). Также реакция водорода с хлором даёт хлороводород, водный раствор которого известен нам как соляная кислота. С помощью водорода также осуществляется восстановление металлов из их оксидов. Этот газ – важная составляющая при производстве метилового спирта.
Водород используется и в пишевой промышленности – для производства маргарина из растительных масел.
Температура сгорания водорода в кислороде – около 3000 градусов, а в специальных горелках её можно довести и до 4000. Поэтому водород используется для сварки тугоплавких металлов. Также жидкий водород – ракетное топливо.
При сгорании водород образует безопасный водяной пар, поэтому в перспективе он может стать экологичным топливом для автомобилей. Правда в настоящий момент его использование невозможно из-за многих технических ограничений.
Прочитать ещё 2 ответа
Источник
Mitti
20 марта 2019 · 929
Постигший работу в “ООО Яндекс”, копирайтер, испытатель авиационных приборов и…
Обнаружить нет, а вот вытеснить да. Так как водород нерастворим в воде, то путем её добавления можно отделить водород и вытеснить его из смеси.
Какая разница между водородом, атомарным водородом и молекулярным водородом, если я хочу делать воду или получать ингаляции?
Химик, медхимик, органик, метролог, преподаватель
Водород в самой распространённой своей форме – это молекулярный водород, он же Н2. Газ без цвета и запаха, горючий, взрывоопасный. Именно при его соединении с кислородом получается вода Н2О. Атомарный водород – это половинка молекулы Н2, крайне реакционноспособная частица, встретить которую на жизненном пути обычного человека очень маловероятно.
Насыщать водородом воду и получать так называемую “водородную воду” – занимательное модное мракобесие, приносящее хороший доход шарлатанам, продающим специальные приборчики, якобы делающие возможным этот процесс.
Почему вода не горит, если состоит из водорода и кислорода?
Кандидат химических наук, старший научный сотрудник химического факультета МГУ
Потому что водород уже сгорел в кислороде! Это то же самое, что спросить, почему поваренная соль не ядовита. Ведь она состоит из хлора и натрия, и хлор — это ядовитый газ, а натрий — щелочной метал. Но мы едим соль и не травимся. Просто соль — это продукт химической реакции, после которой элементы находятся уже в другом своем состоянии и изменяются их свойства. То же самое и с водой. Кстати, из воды можно обратно сделать водород и кислород и потом снова сжечь водород в кислороде.
Как получить, собрать, распознать водород?
Водород – это самый легкий газ. В лаборатории его получают чаще всего в аппарате Кипа взаимодействием цинка с соляной кислотой:
Zn + 2HCl = ZnCl2 + H2 ↑.
Так как водород самый легкий газ, его собирают в перевернутый вверх дном сосуд.
Для распознавания водорода его поджигают и по характеру звука, с которым он сгорает, определяют наличие данного газа: к отверстию перевернутого вверх дном сосуда подносят зажженную лучину. Раздается глухой хлопок, если водород чистый или «лающий» звук, если водород содержит примеси.
Каким путем в лаборатории можно получить водород?
Существует много способов, достаточно придумать реакцию, результатом которой будет молекулярный водород. Один из способов, который изучается в школе – электролиз воды. Сильное электрическое поле “разрывает” молекулы воды на катионы H+ и анионы OH-. Катионы водорода забирают свободные электроны и, слепившись парами, улетают. При электролизе воды, солей активных металлов и гидроксидов, на катоде происходит:
2H2O + 2(e-) => H2 + 2OH−
Прочитать ещё 1 ответ
Почему до сих пор нет автомобилей на воде? Расщипляем воду на водород и кислород — водород жжём, а кислород в атмосферу.
урофренолог, селахиодермист
Тут есть две больших проблемы. Во-первых, кислородно-водородная связь в воде очень сильна, все известные методики разделения сопряжены с куда большими затратами энергии, чем получается при обратном сожжении.
Во-вторых, у водорода очень низкая плотность, это убивает всю выгоду. Электромобили до сих пор не прижились в первую очередь из-за крайне малой массовой эффективности. У бензина плотность энергии — 46 мегаджоулей на килограмм, а у лучших аккумуляторов — около единицы. То есть чтобы обеспечить тот же пробег на той же мощности — надо везти с собой в полсотни раз больше батареек, чем бензина. У водорода этот показатель намного хуже. Обычный баллон 50л/200бар весит около 90 килограмм, а входит в него менее 900 грамм водорода.
Кроме того, водород весьма взрывоопасен.
Источник
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Место урока: 8 класс. Тема II: Кислород, водород, вода как растворитель.
Тип урока: практическая работа
Задачи:
- Образовательная – совершенствовать экспериментальные умения – приемы работы с лабораторным оборудованием и веществами; умения наблюдать, делать выводы, оформлять результаты практической работы в тетради.
- Развивающая – работа над развитием навыков умелого обращения с огнем, опасными веществами.
- Воспитательная – расширение кругозора обучающихся, формирование уважения к истории науки.
- Здоровьесберегающая – развитие представлений о здоровом образе жизни в блоках: «Химия в быту – безопасное поведение»
Планируемые результаты обучения:
- Уметь работать с автоматическим прибором Кирюшкина для получения газов
- Уметь собирать газ методом вытеснения воды
- Уметь проверять горючий газ на чистоту
- Уметь делать правильные выводы из наблюдаемых опытов и характеризовать свойства водорода
Оборудование:
- Мультимедийная презентация 2 (Microsoft Power Point)
- Спецодежда – халат
- Наполняемость лабораторного лотка для ученика (13 шт.)
- лабораторный штатив с лапкой, держатель для пробирок, штатив для пробирок, ложка-дозатор, фильтровальная бумага
- спиртовка, спички
- автоматический прибор Кирюшкина для получения газов, 3 пробирки, кристаллизатор с водой
- гранулы цинка, соляная кислота (разб.), оксид меди (II)
- Наполняемость лабораторного лотка для учителя:
- лоток для ученика
- тигельные щипцы, стакан, стеклянная пластинка, стеклянная палочка
- «результаты» нарушений правил техники безопасности
Методы и приемы:
- Словесные (рассказ учителя, беседа).
- Наглядные (просмотр слайдов презентации; демонстрация приемов работы с лаборатор-ным оборудованием и веществами).
- Самостоятельная отработка учеником экспериментальных умений.
- Проблемно-поисковый.
Ход урока
(курсивом описаны действия учеников и учителя, особенности методики урока; обычным шрифтом – речь учителя)
I. Организационный момент (1 мин.)
отметить наличие халатов у всех учеников, проверить свободны ли от сумок проходы, убраны ли волосы у девочек. На столах оставить только ручки, калькуляторы и тетради.
II. Активизация знаний, необходимых для выполнения практической работы (13 мин.)
Слайд 1:

На этом уроке мы получим водород в лабораторных условиях. Это газообразное вещество; является взрывоопасным, если загрязнено воздухом, и поэтому требует к себе повышенного внимания.
Ученики одновременно с обсуждением расписываются в журнале техники безопасности.
Слайд 2:
Ознакомление с планом урока. I.

На предыдущем уроке была проведена подготовка учеников к данной практической работе (Презентация 1) и задано домашнее задание:

Слайд 3:
Слайд проявляется постепенно, в соответствии с беседой
Вопросы:
- Какие исходные вещества будем использовать мы для получения водорода?
- Необходимо ли нагревать реакционную смесь?
- На что обратить внимание при записи наблюдений?
- Какой прибор будем использовать для получения водорода?
- Какими способами можно собрать водород, почему?
Слайд 4:
Слайд проявляется постепенно, в соответствии с беседой

Вопросы:
- Как доказать наличие водорода в пробирке-приёмнике?
- Какая химическая реакция происходит при этом?
- На что обратить внимание при записи наблюдений в данном пункте работы?
- Что из себя представляет гремучий газ?
Просмотр двух видеороликов.
Если взрыв произойдет в стеклянном сосуде, то осколки могут поранить окружающих и экспериментатора.
При проверке водорода на чистоту сжигают небольшой его объем (около 15 мл).
Возможный микровзрыв к травме привести не может.
Правило ТБ: пока нет убежденности, что газ из прибора выделяется чистый, держать отверстие газоотводной трубки подальше от пламени спиртовки.
Слайд 5:
Демонстрация результатов нарушений правил ТБ: пробирка с растресканным дном
Правило ТБ: нагревать пробирку необходимо в том месте, где находится твердое вещество, а не выше – где воздух. От неравномерного нагрева пробирка треснет.
пробирка со следами соляной кислоты в смеси с оксидом меди (II)
Правило ТБ: при зарядке автоматического прибора соляной кислотой нужно следить, чтобы не перелить кислоту (max 2 мл), иначе избыток от экзотермичности и бурного течения процесса попадет в газоотводную трубку.
III. Демонстрация эксперимента учителем (7 мин.)
Слайд 6
Слово учителя с элементами беседы

1. Взять ложкой-дозатором небольшое количество черного порошка оксида меди (II), поместить в пробирку, оставить в штативе для пробирок до проведения опыта по изучению восстановительных свойств водорода.
2. Закрепить автоматический прибор для получения газов в лапке штатива. Зарядить прибор исходными веществами: 4-5 гранул цинка поместить на резиновый кружок, через воронку прилить соляную кислоту так, чтобы ее слой над цинком был не более 2 мл. Прибор закрыть максимально герметично.
3. Для проверки газа на чистоту, мне приходится приготовить спиртовку заранее. Вы работаете вдвоем и зажжете спиртовку после того, как наберете газ в пробирку- приемник.
Правила ТБ: работа со спиртовкой
а) прежде чем зажечь спиртовку, нужно проверить плотно ли диск прилегает к отверстию резервуара (иначе искра может попасть в резервуар и весь объем спирта воспламенится)
б) зажигать только спичкой (нельзя использовать зажигалку, другую спиртовку)
в) спичку класть в лоток следует, убедившись, что она затушена (демонстрация нарушения правил ТБ – прожженный лоток)
г) чтобы погасить пламя, ее следует закрыть колпачком (задувать нельзя)
Выделяющийся водород собрать методом вытеснения воздуха, держа пробирку-приёмник вверх дном. Проверить газ на чистоту: зажать отверстие пробирки пальцем и поднести пробирку к пламени спиртовки, открыть ее.
4. Затем выделяющийся водород собрать методом вытеснения воды: набрать полную пробирку воды, перевернуть ее в кристаллизаторе и подвести к отверстию газоотводную трубку. Когда пробирка-приемник полностью заполнится водородом, зажать отверстие пальцем под водой. Убедиться в чистоте газа.
5. Закрепить пробирку с оксидом меди (II) в держателе.
Правила ТБ: закрепление пробирки в держателе
а) пробирку закрепляют в верхней третьей части ближе к отверстию
б) пробирка не должна выпадать, но проворачиваться (иначе при нагревании стекло расширяется и пробирка может лопнуть)
в) чтобы вынуть пробирку из держателя, нужно ослабить зажим.
Прогреть пробирку на пламени спиртовки 2-3 раза, далее нагревать ее в верхней части пламени, в том месте, где находится оксид меди (II). Внести газоотводную трубку с выделяющимся водородом.
После окончания опыта дать пробирке остыть, затем поставить в штатив для пробирок.
6. Потушить спиртовку, перекрыть зажимом выделение водорода.
Основное правило ТБ: работать уверенными руками!
IV. Выполнение практической работы, оформление результатов, уборка рабочего места (23 мин.)
Слайд 6
1. Ученики выполняют практическую работу самостоятельно. Учитель следит за правиль-ностью выполнения техники эксперимента и соблюдением правил ТБ.
2. Уборка рабочего места: после окончания опыта по изучению восстановительных свойств водорода:
1-й ученик: потушить спиртовку, дать пробирке-реактору остыть, затем поставить ее в штатив для пробирок.
2-й ученик: перекрыть выделение газа в автоматическом приборе, вынуть воронку, остатки цинка поместить на фильтровальную бумагу. Вынуть прибор из лапки штатива, слить отра-ботанный раствор в «СКЛЯНКУ ДЛЯ СЛИВА», сдать прибор учителю.
учитель: собирает лотки и кристаллизаторы с водой.
3. Демонстрационный опыт: изучение продукта реакции цинка с соляной киcлотой
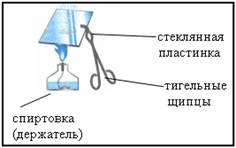
Отработанный раствор слить в стакан и несколько капель с помощью стеклянной палочки перенести на стеклянную пластинку. Укрепить пластинку в тигельных щипцах и упарить раствор на пламени
Что наблюдается?
4. Оформить результаты эксперимента: сформулировать и записать наблюдения, вывод (что узнали про газообразное вещество водород на практической работе), сдать тетрадь.
Проведение урока (Фото-фильм)
Использованные электронные пособия:
- Химия (8-11 класс). Виртуальная лаборатория. Лаборатория систем мультимедиа, МарГТУ, 2004.
- Химия для всех XXI. Химические опыты со взрывами и без. Ахлебинин А.К. и др., 2006.
Оформление работы в тетради ученика:
Практическая работа 5: Получение водорода и изучение его свойств
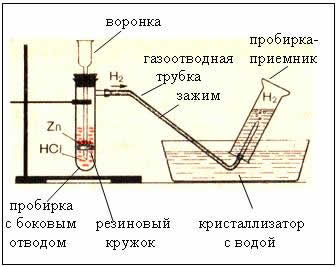
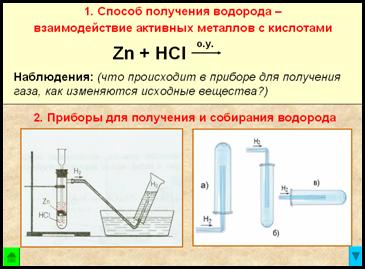
1. Способ получения водорода – взаимодействие активных металлов с кислотами.
Zn + 2HCl = ZnCl2 + Н2↑ + Q – при обычных условиях
Наблюдения:
- реакция взаимодействия гранул цинка с соляной кислотой идет сначала медленно, затем очень бурно, пробирка разогревается
- из газоотводной трубки выделяется бесцветный газ
- при упаривании полученного раствора на стеклянной пластинке остается белый порошок
2. Приборы для получения и собирания водорода

Рис. Прибор для получения водорода – автоматический, который позволяет в любой момент остановить реакцию с помощью зажима (прибор Кирюшкина).
Собирание газа методом вытеснения воды – возможно, т.к. водород малорастворим в ней.
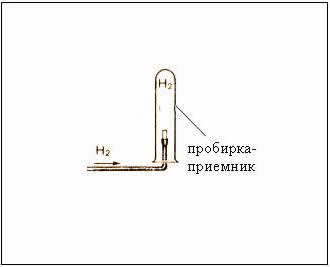
Рис. Собирание газа методом вытеснения воздуха – держа пробирку-приемник вверх дном, т.к.
– следовательно, водород легче воздуха
3. Обнаружение водорода – проверка его на чистоту
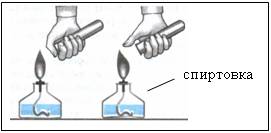
Наблюдения:
- при сжигании первой порции газа раздается резкий лающий звук
- при сжигании второй порции газа слышен легкий хлопок Рисунок 5 «п-пах»
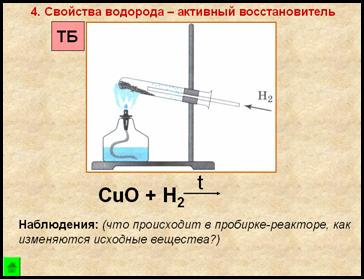
4. Свойство водорода – активный восстановитель
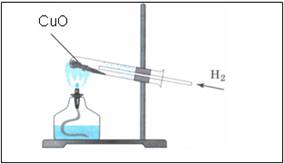
Наблюдения:
- порошок меняет цвет с черного на медный
- на стенках пробирки появляются бесцветные капельки жидкости
Вывод:
Одним из способов получения водорода в лаборатории является взаимодействие цинка с разб. соляной кислотой, при этом образуется соль (хлорид цинка) и водород. Водород – бесцветный газ, без запаха, малорастворим в воде, легче воздуха, в смеси с воздухом взрывоопасен, восстанавливает металлы из их оксидов.
Источник
