Как вычислить давление газа в сосуде с манометром
Давление является одним из трех основных термодинамических макроскопических параметров любой газовой системы. В данной статье рассмотрим формулы давления газа в приближении идеального газа и в рамках молекулярно-кинетической теории.
Идеальные газы
Каждый школьник знает, что газ является одним из четырех (включая плазму) агрегатных состояний материи, в котором частицы не имеют определенных положений и движутся хаотичным образом во всех направлениях с одинаковой вероятностью. Исходя из такого строения, газы не сохраняют ни объем, ни форму при малейшем внешнем силовом воздействии на них.
В любом газе средняя кинетическая энергия его частиц (атомов, молекул) больше, чем энергия межмолекулярного взаимодействия между ними. Кроме того, расстояния между частицами намного превышают их собственные размеры. Если молекулярными взаимодействиями и размерами частиц можно пренебречь, тогда такой газ называется идеальным.
В идеальном газе существует лишь единственный вид взаимодействия – упругие столкновения. Поскольку размер частиц пренебрежимо мал в сравнении с расстояниями между ними, то вероятность столкновений частица-частица будет низкой. Поэтому в идеальной газовой системе существуют только столкновения частиц со стенками сосуда.
Все реальные газы с хорошей точностью можно считать идеальными, если температура в них выше комнатной, и давление не сильно превышает атмосферное.
Причина возникновения давления в газах
Прежде чем записать формулы расчета давления газа, необходимо разобраться, почему оно возникает в изучаемой системе.
Согласно физическому определению, давление – это величина, равная отношению силы, которая перпендикулярно воздействует на некоторую площадку, к площади этой площадки, то есть:
P = F/S
Выше мы отмечали, что существует только один единственный тип взаимодействия в идеальной газовой системе – это абсолютно упругие столкновения. В результате них частицы передают количество движения Δp стенкам сосуда в течение времени соударения Δt. Для этого случая применим второй закон Ньютона:
F*Δt = Δp
Именно сила F приводит к появлению давления на стенки сосуда. Сама величина F от столкновения одной частицы является незначительной, однако количество частиц огромно (≈ 1023), поэтому они в совокупности создают существенный эффект, который проявляется в виде наличия давления в сосуде.
Формула давления газа идеального из молекулярно-кинетической теории
При объяснении концепции идеального газа выше были озвучены основные положения молекулярно-кинетической теории (МКТ). Эта теория основывается на статистической механике. Развита она была во второй половине XIX века такими учеными, как Джеймс Максвелл и Людвиг Больцман, хотя ее основы заложил еще Бернулли в первой половине XVIII века.
Согласно статистике Максвелла-Больцмана, все частицы системы движутся с различными скоростями. При этом существует малая доля частиц, скорость которых практически равна нулю, и такая же доля частиц, имеющих огромные скорости. Если вычислить среднюю квадратичную скорость, то она примет некоторую величину, которая в течение времени остается постоянной. Средняя квадратичная скорость частиц однозначно определяет температуру газа.
Применяя приближения МКТ (невзаимодействующие безразмерные и хаотично перемещающиеся частицы), можно получить следующую формулу давления газа в сосуде:
P = N*m*v2/(3*V)
Здесь N – количество частиц в системе, V – объем, v – средняя квадратичная скорость, m – масса одной частицы. Если все указанные величины определены, то, подставив их в единицах СИ в данное равенство, можно рассчитать давление газа в сосуде.
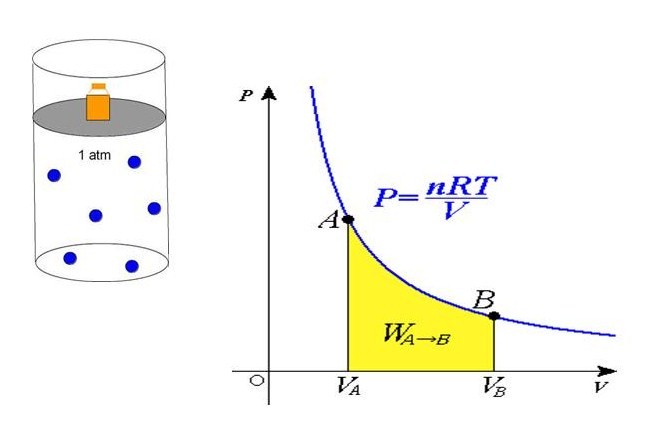
Формула давления из уравнения состояния

В середине 30-х годов XIX века французский инженер Эмиль Клапейрон, обобщая накопленный до него экспериментальный опыт по изучению поведения газов во время разных изопроцессов, получил уравнение, которое в настоящее время называется универсальным уравнением состояния идеального газа. Соответствующая формула имеет вид:
P*V = n*R*T
Здесь n – количество вещества в молях, T – температура по абсолютной шкале (в кельвинах). Величина R называется универсальной газовой постоянной, которая была введена в это уравнение русским химиком Д. И. Менделеевым, поэтому записанное выражение также называют законом Клапейрона-Менделеева.
Из уравнения выше легко получить формулу давления газа:
P = n*R*T/V
Равенство говорит о том, что давление линейно возрастает с температурой при постоянном объеме и увеличивается по гиперболе с уменьшением объема при постоянной температуре. Эти зависимости отражены в законах Гей-Люссака и Бойля-Мариотта.

Если сравнить это выражение с записанной выше формулой, которая следует из положений МКТ, то можно установить связь между кинетической энергией одной частицы или всей системы и абсолютной температурой.
Давление в газовой смеси
Отвечая на вопрос о том, как найти давление газа и формулы, мы ничего не говорили о том, является ли газ чистым, или речь идет о газовой смеси. В случае формулы для P, которая следует из уравнения Клапейрона, нет никакой связи с химическим составом газа, в случае же выражения для P из МКТ эта связь присутствует (параметр m). Поэтому при использовании последней формулы для смеси газов становится непонятным, какую массу частиц выбирать.
Когда необходимо рассчитать давление смеси идеальных газов, следует поступать одним из двух способов:
- Рассчитывать среднюю массу частиц m или, что предпочтительнее, среднее значение молярной массы M, исходя из атомных процентов каждого газа в смеси;
- Воспользоваться законом Дальтона. Он гласит, что давление в системе равно сумме парциальных давлений всех ее компонентов.
Пример задачи
Известно, что средняя скорость молекул кислорода составляет 500 м/с. Необходимо определить давление в сосуде объемом 10 литров, в котором находится 2 моль молекул.
Ответ на задачу можно получить, если воспользоваться формулой для P из МКТ:
P = N*m*v2/(3*V)
Здесь содержатся два неудобных для выполнения расчетов параметра – это m и N. Преобразуем формулу следующим образом:
m = M/NA;
n = N/NA;
m*N = M*n;
P = M*n*v2/(3*V)
Объем сосуда в кубических метрах равен 0,01 м3. Молярная масса молекулы кислорода M равна 0,032 кг/моль. Подставляя в формулу эти значения, а также величины скорости v и количества вещества n из условия задачи, приходим к ответу: P = 533333 Па, что соответствует давлению в 5,3 атмосферы.
Источник
В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатных состояния точно три?
На самом деле, есть еще четвертое – плазма. Звучит, как что-то из научной фантастики, но это просто ионизированный газ – газ, в котором помимо нейтральных частиц, есть еще и заряженные. Ионизаторы воздуха как раз строятся на принципе перехода из газообразного вещества в плазму.
Давление газа
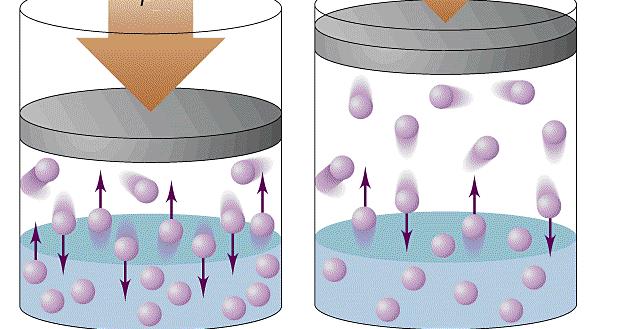
Мы только что выяснили, что молекулы газа беспорядочно движутся. Во время движения они сталкиваются друг с другом, а также со стенками сосуда, в котором этот газ находится. Поскольку молекул много, ударов тоже много.
Например, в комнате, в которой вы сейчас находитесь, на каждый квадратный сантиметр за 1 с молекулами воздуха наносится столько ударов, что их количество выражается двадцати трехзначным числом.
Хотя сила удара отдельной молекулы мала, действие всех молекул о стенки сосуда приводит к значительному давлению. Это как если бы один комар толкал машину, то она бы и не сдвинулась с места, а вот пару сотен миллионов комаров вполне себе способны эту машину сдвинуть.
Зависимость давления от других величин
Зависимость давления от объема
В механике есть формула давления, которая показывает: давление прямо пропорционально силе и обратно пропорционально площади, на которую эта сила оказывается.
Давление
p = F/S
p – давление [Па]
F – сила [Н]
S – площадь [м^2]
То есть, если наши двести миллионов комаров будут толкать легковую машину, они распределятся по меньшей площади, чем если бы они толкали грузовой автомобиль (просто потому что легковая меньше грузовика).
Из формулы давления следует, что давление на легковой автомобиль будет больше из-за меньшей площади.
Давайте рассмотрим аналогичный пример с двумя сосудами разной площади.
Давление в левом сосуде будет больше, чем во втором, по аналогичной схеме – потому что площадь меньше. Но если площадь основания меньше, то и объем меньше. Это значит, что давление будет зависеть от объема следующим образом: чем больше объем, тем меньше давление – и наоборот.
При этом зависимость будет не линейная, а примет вот такой вид (при условии, что температура постоянна):
Такая зависимость называется законом Бойля-Мариотта.
Она экспериментально проверяется с помощью такой установки.
Объем шприца увеличивают с помощью насоса, а манометр измеряет давление. Эксперимент показывает, что при увеличении объема давление действительно уменьшается.
Зависимость давления от температуры
Рассмотрим зависимость давления газа от температуры при условии неизменного объема определенной массы газа. Эти исследования были впервые произведены в Жаком Шарлем.
Газ нагревался в большой колбе, соединенной с ртутным манометром в виде узкой изогнутой трубки. Пренебрегая ничтожным увеличением объема колбы при нагревании и незначительным изменением объема при смещении ртути в узкой манометрической трубке.
Таким образом, можно считать объем газа неизменным. Подогревая воду в сосуде, окружающем колбу, измеряли температуру газа по термометру, а соответствующее давление – по манометру.
Этот эксперимент показал, что давление газа увеличивается с увеличением температуры. Это связано с тем, что при нагревании молекулы газа движутся быстрее, из-за чего чаще ударяются о стенки сосуда.
С температурой все проще. Зависимость давления от температуры при постоянных объеме и массе будет линейно:
Эта зависимость называется законом Шарля.
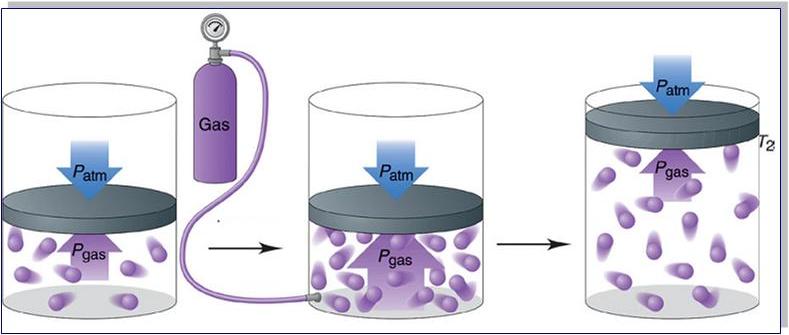
Хранение и транспортировка газов
Если нужно перевезти значительное количество газа из одного места в другое, или когда газы необходимо длительно хранить – их помещают в специальные прочные металлические сосуды. Из-за того, что при уменьшении объема увеличивается давление, газ можно закачать в небольшой баллон, но он должен быть очень прочным.
Сосуды, предназначенные для транспортировки газов, выдерживают высокие давления. Поэтому с помощью специальных насосов (компрессоров) туда можно закачать значительные массы газа, которые в обычных условиях занимали бы в сотни раз больший объем.
Поскольку давление газов в баллонах даже при комнатной температуре очень велико, их ни в коем случае нельзя нагревать. Например, держать под прямыми лучами солнца или любым способом пытаться сделать в них отверстие, даже после использования.
Понимать и любить этот мир проще, когда разбираешься в физике. В этом помогут небезразличные и компетентные преподаватели онлайн-школы Skysmart.
Чтобы формулы и задачки ожили и стали более дружелюбными, на уроках мы разбираем примеры из обычной жизни современных подростков. Приходите на бесплатный вводный урок по физике и начните учиться в удовольствие уже завтра!
Источник
Давление газа – формула. Формула давления газа в сосуде
Давление является одним из трех основных термодинамических макроскопических параметров любой газовой системы. В данной статье рассмотрим формулы давления газа в приближении идеального газа и в рамках молекулярно-кинетической теории.
Идеальные газы
Каждый школьник знает, что газ является одним из четырех (включая плазму) агрегатных состояний материи, в котором частицы не имеют определенных положений и движутся хаотичным образом во всех направлениях с одинаковой вероятностью. Исходя из такого строения, газы не сохраняют ни объем, ни форму при малейшем внешнем силовом воздействии на них.
В любом газе средняя кинетическая энергия его частиц (атомов, молекул) больше, чем энергия межмолекулярного взаимодействия между ними. Кроме того, расстояния между частицами намного превышают их собственные размеры. Если молекулярными взаимодействиями и размерами частиц можно пренебречь, тогда такой газ называется идеальным.
В идеальном газе существует лишь единственный вид взаимодействия – упругие столкновения. Поскольку размер частиц пренебрежимо мал в сравнении с расстояниями между ними, то вероятность столкновений частица-частица будет низкой. Поэтому в идеальной газовой системе существуют только столкновения частиц со стенками сосуда.
Все реальные газы с хорошей точностью можно считать идеальными, если температура в них выше комнатной, и давление не сильно превышает атмосферное.
Причина возникновения давления в газах
Прежде чем записать формулы расчета давления газа, необходимо разобраться, почему оно возникает в изучаемой системе.
Согласно физическому определению, давление – это величина, равная отношению силы, которая перпендикулярно воздействует на некоторую площадку, к площади этой площадки, то есть:
Выше мы отмечали, что существует только один единственный тип взаимодействия в идеальной газовой системе – это абсолютно упругие столкновения. В результате них частицы передают количество движения Δp стенкам сосуда в течение времени соударения Δt. Для этого случая применим второй закон Ньютона:
Именно сила F приводит к появлению давления на стенки сосуда. Сама величина F от столкновения одной частицы является незначительной, однако количество частиц огромно (≈ 10 23 ), поэтому они в совокупности создают существенный эффект, который проявляется в виде наличия давления в сосуде.
Формула давления газа идеального из молекулярно-кинетической теории
При объяснении концепции идеального газа выше были озвучены основные положения молекулярно-кинетической теории (МКТ). Эта теория основывается на статистической механике. Развита она была во второй половине XIX века такими учеными, как Джеймс Максвелл и Людвиг Больцман, хотя ее основы заложил еще Бернулли в первой половине XVIII века.
Согласно статистике Максвелла-Больцмана, все частицы системы движутся с различными скоростями. При этом существует малая доля частиц, скорость которых практически равна нулю, и такая же доля частиц, имеющих огромные скорости. Если вычислить среднюю квадратичную скорость, то она примет некоторую величину, которая в течение времени остается постоянной. Средняя квадратичная скорость частиц однозначно определяет температуру газа.
Применяя приближения МКТ (невзаимодействующие безразмерные и хаотично перемещающиеся частицы), можно получить следующую формулу давления газа в сосуде:
Здесь N – количество частиц в системе, V – объем, v – средняя квадратичная скорость, m – масса одной частицы. Если все указанные величины определены, то, подставив их в единицах СИ в данное равенство, можно рассчитать давление газа в сосуде.
Формула давления из уравнения состояния
В середине 30-х годов XIX века французский инженер Эмиль Клапейрон, обобщая накопленный до него экспериментальный опыт по изучению поведения газов во время разных изопроцессов, получил уравнение, которое в настоящее время называется универсальным уравнением состояния идеального газа. Соответствующая формула имеет вид:
Здесь n – количество вещества в молях, T – температура по абсолютной шкале (в кельвинах). Величина R называется универсальной газовой постоянной, которая была введена в это уравнение русским химиком Д. И. Менделеевым, поэтому записанное выражение также называют законом Клапейрона-Менделеева.
Из уравнения выше легко получить формулу давления газа:
Равенство говорит о том, что давление линейно возрастает с температурой при постоянном объеме и увеличивается по гиперболе с уменьшением объема при постоянной температуре. Эти зависимости отражены в законах Гей-Люссака и Бойля-Мариотта.
Если сравнить это выражение с записанной выше формулой, которая следует из положений МКТ, то можно установить связь между кинетической энергией одной частицы или всей системы и абсолютной температурой.
Давление в газовой смеси
Отвечая на вопрос о том, как найти давление газа и формулы, мы ничего не говорили о том, является ли газ чистым, или речь идет о газовой смеси. В случае формулы для P, которая следует из уравнения Клапейрона, нет никакой связи с химическим составом газа, в случае же выражения для P из МКТ эта связь присутствует (параметр m). Поэтому при использовании последней формулы для смеси газов становится непонятным, какую массу частиц выбирать.
Когда необходимо рассчитать давление смеси идеальных газов, следует поступать одним из двух способов:
- Рассчитывать среднюю массу частиц m или, что предпочтительнее, среднее значение молярной массы M, исходя из атомных процентов каждого газа в смеси;
- Воспользоваться законом Дальтона. Он гласит, что давление в системе равно сумме парциальных давлений всех ее компонентов.
Пример задачи
Известно, что средняя скорость молекул кислорода составляет 500 м/с. Необходимо определить давление в сосуде объемом 10 литров, в котором находится 2 моль молекул.
Ответ на задачу можно получить, если воспользоваться формулой для P из МКТ:
Здесь содержатся два неудобных для выполнения расчетов параметра – это m и N. Преобразуем формулу следующим образом:
Объем сосуда в кубических метрах равен 0,01 м 3 . Молярная масса молекулы кислорода M равна 0,032 кг/моль. Подставляя в формулу эти значения, а также величины скорости v и количества вещества n из условия задачи, приходим к ответу: P = 533333 Па, что соответствует давлению в 5,3 атмосферы.
Источник
Что измеряет манометр и какое давление показывает
Ни одно современное здание не обходится без отопительной системы. А для ее стабильной и безопасной эксплуатации требуется точный контроль давления теплоносителя. Если давление в пределах гидравлического графика стабильное, то отопительная система работает нормально. Однако при ее повышении появляется риск разрыва трубопровода.
Понижение давления также может привести к таким негативным последствиям, как, например, образование кавитации, то есть в трубопроводе образуются пузырьки воздуха, которые, в свою очередь, могут вызвать коррозию. Поэтому поддерживать нормальное давление крайне необходимо, и благодаря манометру это становиться возможным. Помимо отопительных систем такие приборы применяются в самых различных областях.
Описание и назначение манометра
Манометр представляет собой прибор, измеряющий уровень давления. Существуют такие виды манометров, которые применяются в самых разных отраслях, и, разумеется, для каждой из них предназначен свой манометр. Для примера можно взять барометр – прибор, предназначенный для измерения давления атмосферы. Они широко применяются в машиностроении, в сельском хозяйстве, в строительстве, в промышленности и в других сферах.
Эти приборы измеряют давление, и это понятие растяжимое, по крайней мере, и у этой величины также есть свои разновидности. Чтобы ответить на вопрос о том, какое давление показывает манометр, стоит рассмотреть этот показатель в целом. Это величина, определяющая отношение силы, действующей на единицу площади поверхности, перпендикулярно этой поверхности. Практически любой технологический процесс сопровождается этой величиной.
Виды давления:
- атмосферное – давление атмосферы земли, которое создается массой воздушного столба;
- абсолютное давление -это показатель, отсчет которого с учетом атмосферного, начинается с нуля;
- избыточное – под избыточным подразумевают разность двух показателей атмосферного и абсолютного;
- вакуум или, другими словами, разряженное – наоборот, представляет собой разницу абсолютного и атмосферной или барометрической величины;
- дифференциальное – это разность между двумя измеряемыми показателями, которые не имеют отношения к природным показателям.
Для измерения каждого из перечисленных выше видов показателей существуют определенные типы манометров.
Классификация приборов
Типы манометров различаются по двум признакам: по виду измеряемого ими показателя и по принципу действия.
По первому признаку они подразделяются на:
- приборы, предназначенные для измерения атмосферного давления, иначе они называются барометры;
- приборы, измеряющие избыточное и абсолютное;
- вакуумметры, призваны измерять разность атмосферного и абсолютного давлений;
- напорометры, измеряют малое (до 40 кПа) избыточное давление;
- тагометры, вид вакуумметра, которое измеряет избыточное давление верхнего предела 40 кПа;
- дифференциальные манометры, измеряют разность давлений.
Они работают по принципу уравновешивания разницы давлений определенной силой. Поэтому устройство манометров разное, в зависимости от того, как именно происходит это уравновешивание.
По принципу действия они делятся на:
- жидкостные, уравновешивание разницы давлений в таких приборах происходит за счет гидростатического давления столба жидкости, в устройстве используется принцип сообщающихся сосудов;
- пружинные имеют простую конструкцию, и широко применяются для измерения давления среды в широких диапазонах;
- мембранные, основаны на пневматической компенсации, уравновешивание давления происходит за счет силы упругости мембранной коробки;
- электроконтактные, применяются в автоматических системах контроля и сигнализации, поскольку с их помощью можно регулировать измеряемую среду благодаря встроенному в корпус электроконтактному механизму;
- дифференциальные используются для измерения уровня жидкостей под напором расхода жидкости, пара и газа с помощью диафрагм.
По назначению существуют такие виды манометров, как:
- общетехнические приборы применяются для измерения напора жидкостей, газов и паров, химически нейтральных к сплавам меди;
- кислородные, они производятся в корпусах голубого цвета с указанием О2 на циферблате, применяются для измерения кислородного давления в баллонах или вакуумах;
- ацетиленовые применяются для контроля избыточного давления ацетилена;
- эталонные применяются в целях проверки других приборов, поскольку они обладают большой точностью;
- судовые применяются в судах и морском транспорте;
- железнодорожные используются на железнодорожном транспорте;
- самопишущие имеют встроенный механизм, который позволяет воспроизводить на бумаге результат работы.
Устройство и принцип действия
Устройство манометра может иметь различную конструкцию в зависимости от вида и предназначения. Так, например, устройство, измеряющее напор воды, имеет довольно простую и понятную конструкцию. Она состоит из корпуса и шкалы с циферблатом, которая отображает значение. В корпусе имеется встроенная пружина трубчатая либо мембрана с держателем, трипко-секторным механизмом и упругий элемент. Прибор функционирует по принципу уравнивания давления за счет силы изменения формы (деформации) мембраны либо пружины. А деформация, в свою очередь, приводит в движение чувствительный упругий элемент, действие которого отображается на шкале с помощью стрелки.
Жидкостные манометры состоят из длинной трубки, которую наполняют жидкостью. В трубке с жидкостью находится подвижная пробка, на которую влияет рабочая среда, измерять силу напора следует в зависимости от перемещения уровня жидкости. Манометры могут предназначаться для измерения разницы, такие устройства состоят из двух трубок.
Поршневые – состоят из цилиндра и поршня, расположенного внутри. Рабочая среда, в которой измеряется давление воздействует на поршень и уравновешивается грузом некоторой величины. Когда показатель изменяется, поршень перемешается и приводит в действие стрелку, которая показывает значение давления.
Термопроводные состоят из нити накаливания, которые нагреваются, когда через них пропускается электрический разряд. Принцип работы таких приборов основан на снижении теплопроводности газа с давлением.
Манометр Пирани назван так в честь Марчелло Пирани, который впервые сконструировал устройство. В отличие от термопроводных, состоит из металлической проводки, которая также нагревается во время прохождения через нее тока и охлаждается под воздействием рабочей среды, а именно газа. При уменьшении давления газа снижается и эффект охлаждения, а температура проводки возрастает. Величина измеряется посредством измерения напряжения в проводе во время прохождения через нее тока.
Ионизационные являются самыми чувствительными устройствами, которые используются для вычисления малых давлений. Как следует из названия устройства, его принцип работы основывается на измерении ионов, которые образуются под воздействием электронов на газ. Количество ионов зависит от плотности газа. Однако ионы имеют очень нестабильную природу, которая напрямую зависит от рабочей среды газа или пара. Поэтому для уточнения применяются другой вид манометра Мак Леода. Уточнение происходит за счет сравнения показателей ионизационного манометра, с показаниями прибора Мак Леода.
Существует два вида ионизационных устройств: с горячим и холодным катодом.
Первый вид был сконструирован Баярдом Аллертом, состоит из электродов, которые работают в режиме триода, а в качестве катода выступает нить накала. Самый распространённый вид горячего катода – ионный манометр, в конструкции которого помимо коллектора, нити и сетки встроен небольшой ионный коллектор. Такие приборы очень уязвимы, они могут легко потерять калибровку, в зависимости от условий работы. Поэтому показания этих приборов всегда логарифмичны.
Холодный катод также имеет свои разновидности: интегрированный магнетрон и манометр Пеннинга. Их главное отличие заключается в положении анода и катода. В конструкции этих приборов нет нити накалывания, поэтому им для работы им требуется напряжение до 0,4 кВт. Использовать такие устройства не эффективно при низком уровне давления. Поскольку они могут просто не заработать и не включиться. Принцип их работы основан на выработке тока, что невозможно при полном отсутствии газа, особенно для манометра Пеннинга. Так как устройство работает только в определенном магнитном поле. Оно необходимо для создания нужной траектории движения ионов.
Маркировка по цвету
Манометры, измеряющие давление газа, имеют цветные корпуса, их специально окрашивают в различные цвета. Существует несколько основных цветов, которые используются для окрашивания корпуса. Как, например, манометры, которые измеряют давление кислорода, имеют корпус голубого цвета с условным обозначением О2, аммиачные манометры имеют корпус, окрашенный в желтый цвет, ацетиленовые – белого цвета, водородные – темно-зеленого, хлорные – серого. Приборы, измеряющие давление горючих газов, окрашиваются в красный цвет, а негорючих -черный.
Преимущества использования
В первую очередь, стоит отметить универсальность манометра, который заключается в возможности контролировать давление и поддерживать ее на определенном уровне. Во-вторых, устройство позволяет получить точные показатели нормы, так и отклонение от них. В-третьих, доступность практически любо человек может себе позволить приобрести данный прибор. В-четвертых, устройство способно работать стабильно и бесперебойно на протяжении длительного времени, и не требует специальных условий или навыков.
Использование таких устройств в таких областях, как медицина, химическая промышленность, машино- и автомобилестроение, морской транспорт и других требующих точного контроля давления, значительно облегчает работу.
Класс точности прибора
Манометров очень много, и каждому виду присваивается определенный класс точности согласно предписаниям ГОСТ, под которым понимается допустимая погрешность, выражающаяся в процентном отношении к диапазону измерений.
Существует 6 классов точности: 0,4; 0,6; 1; 1,5; 2,5; 4. У каждого типа манометра они также различаются. Приведенный выше список относится к рабочим манометрам. Для пружинных устройств, к примеру, соответствуют следующие показатели 0,16; 0,25 и 0,4. Для поршневых – 0,05 и 0,2 и так далее.
Класс точности имеет обратно пропорциональную зависимость от диаметра шкалы прибора и от типа прибора. То есть, если диаметр шкалы больше, то точность и погрешность манометра уменьшается. Класс точности условно принято обозначать следующими латинскими буквами KL также можно встретить и CL, которая указывается на шкале прибора.
Значение погрешности можно вычислить. Для этого используется два показателя: класс точности или KL и диапазон измерений. Если класс точности (KL) равен 4, то диапазон измерений составит 2,5 МПа (Мегапаскаль), а погрешность будет равна 0,1 МПа. Вычисляется по формуле произведение класса точности и диапазона измерений, деленное на 100. Поскольку погрешность выражается в процентах, результат нужно переводить в проценты путем деления на 100.
Помимо основного вида, существует и дополнительная погрешность. Если для вычисления первого вида используются идеальные условия или натуральные величины, влияющие на особенности конструкции прибора, то второй вид напрямую зависит от условий. Например, от температуры и вибрации или других условий.
Источник
Источник
