Каким способом можно собрать водород в сосуды
Часть 2.
Так как водород, фактически, не встречается на Земле в свободной форме, его вынуждены извлекать из прочих связанных соединений.
Одним из главных преимуществ водородной энергетики является большое разнообразие химических способов получения водорода.
Преимуществом тут является независимость от одного метода получения водорода, что благоприятно сказывается на энергетической безопасности всей концепции водородной энергетики.
Основными методами получения водорода являются:
1. паровая конверсия метана и природного газа;
2. газификация угля;
3. электролиз воды;
4. пиролиз;
5. частичное окисление;
6. биотехнологии.
Водород можно получать взаимодействием активных металлов с кислотами-неокислителями. Например, взаимодействием Цинка и Хлороводорода:
Zn + 2HCl = ZnCl2 + H2.
Как мы видим, взаимодействие Цинка с соляной кислотой даёт выход водорода. Существуют и другие способы подобного получения водорода. Например, взаимодействие алюминия с водными растворами щелочей и т.п. Однако, подобный способ подходит лишь для лабораторных исследований и демонстраций, потому что он очень дорогой.
Концепция водородной энергетики подразумевает промышленное производство водорода; массовость и дешевизна должны быть неотъемлемой частью всей концепции.
Промышленные способы добычи водорода:
1. Электролиз воды
Промышленная установка щелочного электролиза воды
Разберём его чуть подробнее, так как много всяких изобретателей пытаются использовать именно эту технологию.
Воздействуя на дистиллированную воду электрическим током, можно разложить её на составляющие – кислород и водород:
2H2O = 2H2 + O2.
«Впервые электролитическое разложение воды на кислород и водород было осуществлено в 1800 году, а промышленное освоение этого метода началось с 1888 года, когда стали доступны генераторы постоянного тока».
Электролиз воды – довольно дорогая технология получения водорода. В совокупности, на неё приходится всего 4-5% от общего произведённого объёма водорода.
Технология электролиза воды выглядит привлекательно в связи с экологической чистотой получения и возможности создания установок с широким диапазоном производительности (от нескольких литров до сотен кубометров водорода в час).
Способ прост и удобен в эксплуатации, обладает высокой чистотой производимого водорода. Дополнительно, побочным продуктом является получение кислорода – ценного химического вещества.
Но главное, электролиз водорода – очень перспективный метод экологически чистого получения водорода из возобновляемых или атомных источников энергии.
Я напомню, что концепция производства водородной энергетики и её дальнейшего развития в водородную экономику преследует именно экологическую чистоту.
Методов разложения воды для выделения водовода множество.
Основные из них:
- электрохимический;
- термический;
- термохимический;
- биохимический;
- фотохимический;
- электролитический.
Разумеется, наиболее проработанный и изученный метод – электролитический. Он позволяет производить водород с КПД до 90%.
Существуют три промышленных способа реализации электролизной технологии производства водорода. Они отличаются типом используемого электролита и условиями проведения электролиза.
Способы реализации электролизной технологии производства водорода
Щелочной электролиз — процесс прохождения электрического тока через раствор электролита от анода к катоду, вследствие чего на них образуются газы – соответственно, водород и кислород:
1. на аноде: 2OH– → 0,5O2 + H2O + 2e (выделение кислорода);
2. на катоде : 2H2O + 2e– → H2 + 2OH (выделение водорода);
3. суммарная реакция: H2O → H2 + 0,5O2.
Дальнейшим усовершенствованием технологии в области КПД и экономичности стала разработка электролизёров с твердо-полимерным электролитом (ТПЭ).
ТПЭ-электролизёры в 6 раз дороже водно-щелочных с аналогичными характеристиками, но при этом экологически чистые; имеют значительно меньшие массо-габаритные характеристики и энергозатраты, повышенный уровень безопасности, возможность работы в нестационарных режимах, простое обслуживание.
Основной элемент ТПЭ – беспористая полимерная мембрана перфторированного углерода, обладающая высокой химической стойкостью и высокой электропроводностью. Переносчиком заряда в таких мембранах является гидратированный протон:
1. на анод: H2O → O2 + 4H+;
2. на катод: 4H(+) + 4e(–) → 2H2.
Минимальная чистота получения водорода электролизом с ТПЭ – 99,98%.
Принципиальная схема электролизной ячейки с ТПЭ
Третий метод – высокотемпературный электролиз водяного пара. Проводится в ячейках с твёрдым электролитом на основе оксидов циркония, оксидов некоторых элементов (оксиды кальция, иттрия, иттербия, селена, ванадия) для увеличения его электропроводимости. Подобный электролит обладает униполярной проводимостью – ток через него переносится ионами кислорода, образующимися при диссоциации воды и выделении водорода на катоде:
Н2О (пар) + 2е → О2 + Н2 (газ) катод О 2(–) → 0,5 О2 (газ) + 2е.
Вывод водорода осуществляется из катодного пространства вместе с непрореагировавшим паром.
Принципиальная схема ячейки для высокотемпературного электролиза водяного пара с коаксиальным расположением электродов: 1 — катодное пространство ячейки; 2 — катод; 3 — твёрдый электролит на основе оксидов циркония; 4 — анод; 5 — анодное пространство ячейки
Независимо от способа реализации, основной вклад в стоимость водорода, производимого методом электролиза (70–90 %), вносят затраты на электроэнергию!
В комментариях к прошлой статьи читатель писал о якобы новом изобретённом им способе электролиза для получения водорода из морской воды. Но ничего нового тут нет. Смотрим формулу:
2NaCl + 2H2O = H2+ Cl2+ 2NaOH.
Ну это же элементарно, давно известно и вовсю применяется.
Для получения водорода из воды при электролизе требуется, как минимум, столько же энергии, сколько её выделяется при сгорании водорода. Однако не вся эта энергия должна поступать в виде электроэнергии — можно использовать в электролизёрах и тепловую энергию воды. Тут имеется энергетический баланс: чем выше её температура, тем больше вклад тепловой энергии и меньше вклад электрической. В ряде случаев это сулит немалую выгоду – можно использовать тепло от любого источника: скажем, от ядерного реактора. Особенно значительна экономия электроэнергии при температурах воды в районе тысячи градусов. Однако, в этих условиях сама вода переходит в пар, и снова потребуется твердый термостойкий электролит.
Многочисленные работы, в которых сделана попытка дать технико-экономическую оценку путей развития производства водорода на ближайшие годы, свидетельствуют о перспективности разрабатываемых электрохимических методов.
В перспективе можно ожидать, что параллельно с разработкой термических, термохимических, биохимических и других методов получения водорода из воды, начнутся интенсивные работы по усовершенствованию существующих и созданию более экономичных новых методов электролитического разложения воды на базе электрической энергии станций, работающих на атомной энергии. Одно из таких направлений уже разрабатывается – электролиз воды под давлением.
2. Паровая, или парокислородная конверсия метана (ПКМ).
Производство водорода методом риформинга конверсии метана
Метан – основной компонент природного газа, его концентрация в нём достигает от 77 до 99%. Высокое содержание метана и в попутных нефтяных газах – от 31 до 91%. Метан – это, фактически, большая молекула водорода, которая состоит из одного атома углерода и 4-х атомов водорода. Уже из химической формулы ясно, что метан «сильно обогащён» водородом. Следовательно, получение водорода именно из метана должно быть наиболее рентабельным.
Схема реактора паровой конверсии метана
Процесс отделения водорода от углеродной основы в метане протекает в трубчатых печах (химических паровых реформерах) с внешним подводом теплоты при температурах 750–850 градусов Цельсия через стенку трубы на каталитических поверхностях (никель, корунд и др.):
CH4+H2O ↔ CO+3H2;
далее с монооксидом углерода, или попросту «угарным газом», идёт реакция:
CO+H2O ↔ CO2+H2.
Это самый дешёвый и рентабельный способ получения водорода. Себестоимость процесса – от 2 до 5 долларов за 1 кг водорода!
В парокислородной конверсии вместе с горячим паром в активную зону реактора подаётся кислород. Реакции процесса аналогичные, что и для ПКМ, однако дополнительно происходит окисление метана кислородом:
CH4+O2 ↔ 2CO+3H2.
Реагирование веществ в парокислородной конверсии метана даёт общий результирующий тепловой эффект, равный нулю!
Это делает установку дороже на 5–10 %.
Главное преимущество парокислородной конверсии по сравнению с ПКМ — передача теплоты напрямую, а не через стенку теплообменника.
Сравнение характеристик ПКМ и парокислородной конверсии
В настоящий момент уже разработан высокоэффективный проточный мембранный аппарат для одновременного риформинга метана и окисления СО на никелевых и палладиевых катализаторах. Чистота водорода достигает 99,999 %, тогда как при конверсии природного газа — всего 76,2 %.
3. Газификация угля
Установка газификация угля
Самый старейшим с 1940-вых годов способом получения водорода является газификация угля. Справедливо встаёт вопрос: причём здесь уголь, ведь в его составе всего около 6% нужного нам газа? Однако, получение водорода из угля связано с термическим разложением воды, а сам уголь непосредственно используется в качестве энергоресурса и химического реагента. В угле много углерода, который и будет реагировать с кислородом, водой и угарным газом.
Воздействуя на уголь одновременно водяным паром и кислородом, получаем уже знакомую парокислородную конверсию.
Основные реакции процесса газификации угля:
C+O2 ↔ CO2;
C+2H2O ↔ CO2+2H2;
C+H2O ↔ CO+H2;
C+CO2 ↔ 2CO.
Существует большое количество способов газификации угля. Они отличаются термодинамическими параметрами, размером и принципом подачи угля в газогенератор, а также способом удаления шлака. Существует многоступенчатый процесс производства водорода железопаровым способом:
Fe3O4+CO ↔ 3FeO+CO2;
Fe3O4+H2 ↔ 3FeO+H2O.
Все рассмотренные методы – это автотермическое проведение реакций газификации, где в методе с CO2-акцептором осуществлён аллотермический подвод теплоты за счёт реакции СаО с двуокисью углерода. Далее, в регенераторе карбонат кальция разлагается термически:
CaO+CO2 ↔ CaCO3;
CaCO3 ↔ CaO+CO2.
Есть и классические процессы: Лурги, Копперс-Тотцека и Винклера.
Производство синтез-газа, в состав которого входят: водород, метан, окислы углерода и прочие газы – может быть также основано на переработке биомассы и промышленно-бытовых отходов, что одновременно способствует решению экологических проблем. Например, переработать отходы жизнедеятельности рогатого скота, да и вообще любого другого сельскохозяйственного животного.
При термохимической обработке биомассы её нагревают без доступа кислорода до температуры 500–800 градусов Цельсия, в результате чего образуются водород, метан и оксид углерода.
Для выделения водорода из синтез-газа используются разнообразные методы: адсорбция, абсорбция, диффузии через мембраны, электрохимическая конверсия, глубокое охлаждение, катализ.
Параметры методов газификации угля
Это основные, хорошо освоенные и изученные методы промышленного получения водовода. Однако все они дороги в сравнении с традиционной энергетикой. Водород – дорогое топливо. Поэтому его сегодня практически не используют (именно в качестве топлива).
Структура мирового производства (а) и потребления (б) водорода
Основными потребителями водорода являются химическая промышленность и нефтепереработка. Водород является ключевым элементом в производстве минеральных удобрений (получение аммиака).
Более половины потребляемого в мире водорода на сегодняшний день используется в качестве химического сырья. Раскисляющее действие водорода широко применяют в порошковой металлургии, металлообработке, производстве стекла, синтетических рубинов и т.п. Применение водорода в микроэлектронике, главным образом, связано с получением кремния путём восстановления SiCl4. Основным потребителем водорода как топлива является космонавтика. Комбинация «жидкий водород (топливо) — жидкий кислород (окислитель)» обеспечивает выделение максимального количества энергии на единицу веса, что является определяющим критерием для аэрокосмических приложений.
Существуют ли перспективные методы получения водорода, которые будут отличаться дешевизной и качеством? Такие существуют. И не только теоретические, но практические способы.
Например:
плазмохимический способ, который обещает быть в 15 раз дешевле электролизного;
хорошо проработанный способ получения водорода благодаря использованию ядерной энергетики (концепция атомно-водородной энергетики);
получение водорода с помощью альтернативных источников энергии;
усовершенствование методов электролиза воды;
способ использования вещества мантии Земли для получения водорода;
перспективы развития водородной энергетики на основе алюминия и т.д.
О некоторых перспективных способах поговорим в следующей статье.
Часть 3. Водородная энергетика: атомно-водородная технология
================================================================
P. S. Ссылки на источники теперь находятся в группе Вконтакте!
Часть 1. Водородная энергетика: когда наступит будущее?
Источник
Опубликовано – 1 год назад | По предмету
Химия |
автор эрэл2
Самые новые вопросы
Химия – 1 минута назад
2)номер группы показывает… число энергетических уровней число электронов на последнем уровне относительную атомную массу 3) определите типы химических связей у предложенных веществ h2 , co,02, hci, na2s, na so2, fe, si, cao 1. ковалентная неполярная связь 2. ковалентная полярная связь 3. ионная связь 4) используя псхэ дайте краткую характеристику элементу калий химический знак элемента заряд и состав ядра атома номер периода номер группы и вид подгруппы 5) найдите соответствие между элементом и его естественным семейством натрий инертный газ хлор щелочной металл неон галоген калий инертный газ бром галоген аргон щелочной металл 6) определите массу воды в 250 г 10 % -ного раствора хлорида натрия 7) дайте характеристику элементу под номеру 19 по его положению в периодической таблице
Математика – 1 минута назад
Для школников купили 72ложки а нажей в 9раз менше.также купили 37 стаканов. на сколько больше купили стаканов чем ножей?
Химия – 3 минуты назад
2)номер группы показывает… число энергетических уровней число электронов на последнем уровне относительную атомную массу 3) определите типы химических связей у предложенных веществ h2 , co,02, hci, na2s, na so2, fe, si, cao 1. ковалентная неполярная связь 2. ковалентная полярная связь 3. ионная связь 4) используя псхэ дайте краткую характеристику элементу калий химический знак элемента заряд и состав ядра атома номер периода номер группы и вид подгруппы 5) найдите соответствие между элементом и его естественным семейством натрий инертный газ хлор щелочной металл неон галоген калий инертный газ бром галоген аргон щелочной металл 6) определите массу воды в 250 г 10 % -ного раствора хлорида натрия 7) дайте характеристику элементу под номеру 19 по его положению в периодической таблице
Химия – 3 минуты назад
2)номер группы показывает… число энергетических уровней число электронов на последнем уровне относительную атомную массу 3) определите типы химических связей у предложенных веществ h2 , co,02, hci, na2s, na so2, fe, si, cao 1. ковалентная неполярная связь 2. ковалентная полярная связь 3. ионная связь 4) используя псхэ дайте краткую характеристику элементу калий химический знак элемента заряд и состав ядра атома номер периода номер группы и вид подгруппы 5) найдите соответствие между элементом и его естественным семейством натрий инертный газ хлор щелочной металл неон галоген калий инертный газ бром галоген аргон щелочной металл 6) определите массу воды в 250 г 10 % -ного раствора хлорида натрия 7) дайте характеристику элементу под номеру 19 по его положению в периодической таблице
Математика – 3 минуты назад
12 предметов произвольно расставляют по трем комнатам. какова вероятность, что в первой комнате окажется 2 предмета,
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Источник
Развитие водородной энергетики связано с универсальностью применения этого элемента в качестве энергоносителя, неограниченностью его запасов, экологичностью технологий и увеличением показателей качества работы энергетических систем. Главной задачей сейчас является повышение экономичности добыча водорода: пока оно дороже, чем применение природного газа в энергетике.
Способы получения водорода
Водород – газообразный элемент без цвета и запаха с плотностью 1/14 по отношению к воздуху. В свободном состоянии он встречается редко. Обычно водород соединен с другими химическими элементами: кислородом, углеродом.
Получение водорода для промышленных нужд и энергетики проводится несколькими методами. Самыми популярными считаются:
- электролиз воды;
- метод концентрирования;
- низкотемпературная конденсация;
- адсорбция.
Выделить водород можно не только из газовых или водных соединений. Добыча водорода производится при воздействии на дерево и уголь высокими температурами, а также при переработке биоотходов.
Атомный водород для энергетики получают, используя методику термической диссоциации молекулярного вещества на проволоке из платины, вольфрама либо палладия. Ее нагревают в водородной среде под давлением менее 1,33 Па. А также для получения водорода используются радиоактивные элементы.
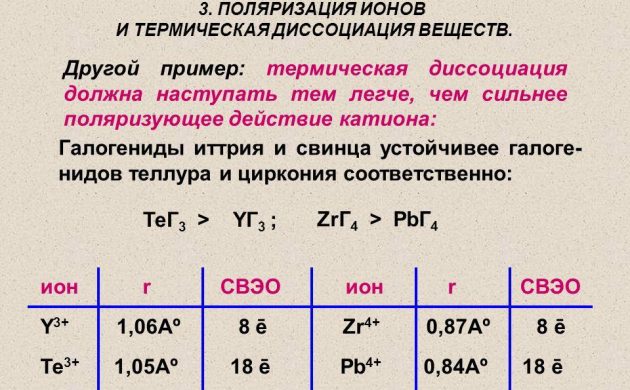
Термическая диссоциация
Электролизный метод
Наиболее простым и популярным методом выделения водорода считается электролиз воды. Он допускает получение практически чистого водорода. Другими преимуществами этого способа считаются:

Принцип действия электролизного генератора водорода
- доступность сырья;
- получение элемента под давлением;
- возможность автоматизации процесса из-за отсутствия движущихся частей.
Процедура расщепления жидкости электролизом обратен горению водорода. Его суть в том, что под воздействием постоянного тока на электродах, опущенных в водный раствор электролита, выделяются кислород и водород.
Дополнительным преимуществом считается получение побочных продуктов, обладающих промышленной ценностью. Так, кислород в большом объеме необходим для катализации технологических процессов в энергетике, очистки почвы и водоемов, утилизации бытовых отходов. Тяжелая вода, получаемая при электролизе, в энергетике используется в атомных реакторах.
Получение водорода концентрированием
Этот способ основан на выделении элемента из содержащих его газовых смесей. Так, наибольшая часть производимого в промышленных объемах вещества, извлекается с помощью паровой конверсии метана. Добытый в этом процессе, водород используют в энергетике, в нефтеочистительной, ракетостроительной индустрии, а также для производства азотных удобрений. Процесс получения H2 осуществляют разными способами:
- короткоцикловым;
- криогенным;
- мембранным.
Последний способ считается наиболее эффективным и менее затратным.
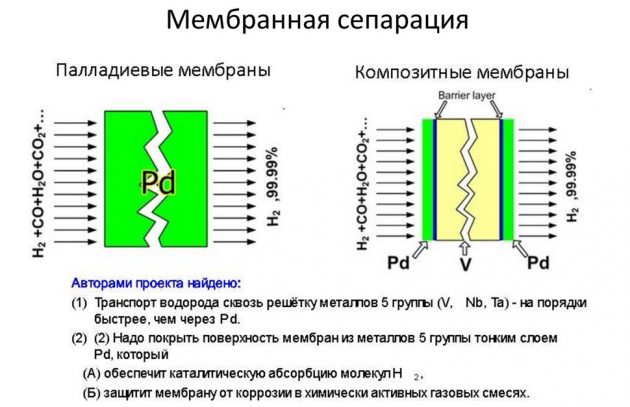
Конденсация под действием низких температур
Эта методика получения H2 заключается в сильном охлаждении газовых соединений под давлением. В результате они трансформируются в двухфазную систему, которая впоследствии разделяется сепаратором на жидкое составляющее и газ. Для охлаждения применяют жидкие среды:
- воду;
- сжиженный этан или пропан;
- жидкий аммиак.

Эта процедура не так проста, как кажется. Чисто разделить углеводородные газы за один раз не получится. Часть компонентов уйдет с газом, забираемым из сепарационного отсека, что не экономично. Решить проблему можно глубоким охлаждением сырья перед сепарацией. Но это требует больших энергозатрат.
В современных системах низкотемпературных конденсаторов дополнительно предусмотрены колонны деметанизации либо деэтанизации. Газовую фазу выводят с последней сепарационной ступени, а жидкость направляется в ректификационную колонну с потоком сырого газа после теплообмена.
Способ адсорбции
Во время адсорбции для выделения водорода используют адсорбенты – твердые вещества, поглощающие необходимые компоненты газовой смеси. В качестве адсорбентов применяют активированный уголь, силикатный гель, цеолиты. Для осуществления этого процесса применяют специальные аппараты – циклические адсорберы или молекулярные сита. При реализации под давлением этот метод позволяет извлекать 85-процентный водород.
Если сравнивать адсорбцию с низкотемпературной конденсацией, можно отметить меньшую материальную и эксплуатационную затратность процесса – в среднем, на 30 процентов. Методом адсорбции производят водород для энергетики и с применением растворителей. Такой способ допускает извлечение 90 процентов H2 из газовой смеси и получение конечного продукта с концентрацией водорода до 99,9%.

Добыча водорода в условиях домашнего хозяйства
Высокотемпературные методы производства водорода в домашних условиях неприменимы. Здесь чаще всего используют электролиз воды.
Выбор электролизера
Для получения элемента дома необходим специальный аппарат – электролизер. Вариантов такого оборудования на рынке много, аппараты предлагают как известные технологические корпорации, так и мелкие производители. Брендовые агрегаты дороже, но качество их сборки выше.
Домашний прибор отличается малыми габаритами и легкостью в эксплуатации. Основными деталями его являются:
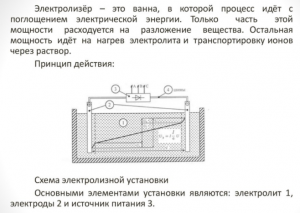
Электролизер — что это
- риформер;
- система очистки;
- топливные элементы;
- компрессорное оборудование;
- емкость для хранения водорода.
В качестве сырья берется простая вода из-под крана, а электричество идет из обычной розетки. Сэкономить на электроэнергии позволяют агрегаты на солнечных батареях.
«Домашний» водород применяют в системах отопления или приготовления пищи. А также им обогащают бензовоздушную смесь, чтобы повысить мощность двигателей автомобиля.
Изготовление аппарата своими руками
Еще дешевле сделать прибор самому в домашних условиях. Сухой электролизер выглядит как герметичный контейнер, который представляет собой две электродные пластины в емкости с электролитическим раствором. Во Всемирной сети предлагаются разнообразные схемы сборки аппаратов разных моделей:
- с двумя фильтрами;
- с верхним либо нижним расположением контейнера;
- с двумя или тремя клапанами;
- с оцинкованной платой;
- на электродах.
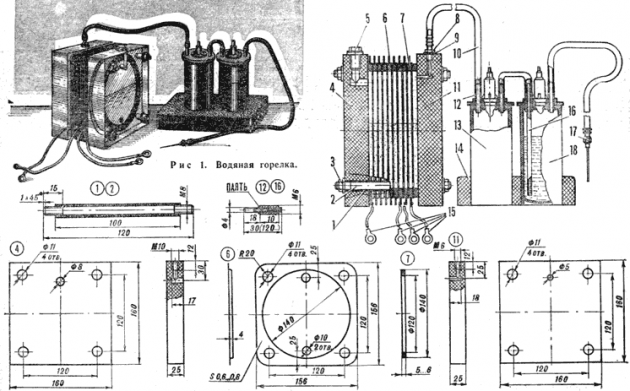
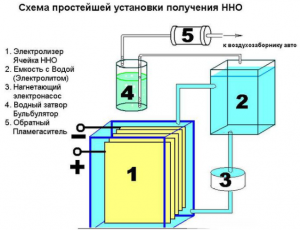
Схема устройства электролиза
Простой прибор для получения водорода создать несложно. Для него потребуются:
- листовая нержавеющая сталь;
- прозрачная трубка;
- штуцеры;
- пластиковая емкость (1,5 л);
- водяной фильтр и обратный клапан.

Устройство простого прибора для получения водорода
Помимо этого, нужны будут различные метизы: гайки, шайбы, болты. Первым делом нужно распилить лист на 16 квадратных отсеков, у каждого из них спилить угол. В противоположном от него углу требуется высверлить отверстие для болтового крепления пластин. Для обеспечения постоянного тока пластины нужно подключать по схеме: плюс–минус–плюс–минус. Изолируют эти детали друг от друга с помощью трубки, а на соединении болтом и шайбами (по три штуки между пластинками). На плюс и минус насаживают по 8 пластин.
При правильной сборке ребра пластинок не будут задевать электроды. Собранные детали опускают в емкость из пластика. В месте касания стенок болтами делают два установочных отверстия. Устанавливают защитный клапан для удаления избытка газа. В крышку контейнера монтируют штуцеры и герметизируют швы силиконом.
Тестирование аппарата
Чтобы протестировать аппарат, выполняют несколько действий:
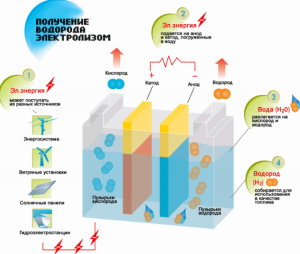
Схема получения водорода
- Наполняют жидкостью.
- Прикрыв крышкой, соединяют один конец трубки со штуцером.
- Второй опускают в воду.
- Подключают к источнику питания.
После включения прибора в розетку через несколько секунд будет заметен процесс электролиза и выпадение осадка.
Чистая вода не обладает хорошей электропроводностью. Для улучшения этого показателя нужно создать электролитический раствор, добавив щелочь – гидроксид натрия. Он есть в составах для очищения труб наподобие «Крота».
Правила техники безопасности
Получение водорода в домашних условиях возможно лишь при ответственном подходе к работе. Этот газ способен легко загореться или взорваться, особенно при использовании аппаратов, собранных своими руками.
Чтобы избежать утечек, перед процедурой электролиза следует проверить герметичность всех частей электролизера:

Техника безопасности при работе с водородом
- трубки;
- насос;
- резервуар.
Небезопасными могут быть и покупные аппараты, особенно неизвестных производителей. Брак может случиться и у самых известных брендов, но риск этого намного меньше – там продукцию тщательно проверяют.
В промышленности добыча водорода необходима для энергетики, например, на нем работают такие энергоисточники, как высокотемпературные реакторы с гелиевым теплоносителем. Применяют элемент и в производстве пластиков, синтетических волокон, извести и цемента, листового стекла. В домашних условиях его используют для отопления помещений и снижения расходов автомобильного топлива.
Видео по теме: Водород — открытие, получение, применение
Источник

Ответ
Ответ дан
galina280995
Собирают двумя способами : вытеснением воды и вытеснением воздуха.
Водород собирают в перевернутый вверх дном сосуд, т.к. водород легче воздуха.