Калиевые каналы в сосудах
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 21 декабря 2019; проверки требуют 2 правки.
Ионы калия движутся по каналу
Калиевые каналы — самый распространённый тип ионных каналов. Обнаруживаются практически во всех клетках живых организмов[1]. Формируют калий-селективные ионные поры, которые обеспечивают ток ионов калия сквозь мембрану клетки. Контролируют множество разнообразных физиологических функций клетки[2][3].
Функция[править | править код]
Калиевые каналы транспортируют ионы калия в противоположную вектору градиента сторону. Скорость транспортировки может достигать скорости диффузии ионов калия в воде, при этом сохраняется высокий уровень избирательности (особенно это касается ионов натрия, несмотря лишь на небольшую разницу в радиусе обоих ионов). Биологическая роль этих каналов состоит в регуляции мембранного потенциала клеток. В возбуждаемых клетках, таких как нейроны, отложенный противоток ионов калия формирует потенциал действия.
Способствуя регуляции длительности потенциала действия в сердечной мышце, нарушение работы калиевых каналов может вызвать опасные для жизни аритмии. Калиевые каналы могут также участвовать в поддержании сосудистого тонуса.
Они также регулируют клеточные процессы, такие как секреция гормонов (например, выделение инсулина из бета-клеток поджелудочной железы), поэтому их нарушение может привести к заболеваниям (например, диабету)
Типы[править | править код]
Существует четыре главных класса калиевых каналов:
- Кальций-зависимые калиевые каналы — открываются в ответ на присутствие ионов кальция или других сигнальных молекул.
- Калиевые каналы внутреннего выпрямления — пропускают ионы калия внутрь клетки.
- Двупоровые калиевые каналы — это постоянно открытые или конститутивно присутствующие в мембране каналы, такие как каналы покоя или протекающие каналы, устанавливающие отрицательный мембранный потенциал на нейроне.
- Потенциал-зависимые калиевые каналы — открываются в ответ на изменение трансмембранного потенциала[en].
| Класс | Подкласс | Функция | Блокаторы | Активаторы |
|---|---|---|---|---|
| Кальций-зависимые 6Т[en] и 1P |
|
|
|
|
| Калиевые каналы внутреннего выпрямления 2T[en] и 1P |
|
|
|
|
|
|
|
| |
|
|
|
| |
| Двупоровые калиевые каналы 4Т[en] и 2P |
|
|
|
|
| Потенциал-зависимые 6T[en] и 1P |
|
|
|
|
Структура[править | править код]
Potassium channel Kv1.2, structure in a membrane-like environment. Calculated hydrocarbon boundaries of the lipid bilayer are indicated by red and blue lines.
Калий-селективный фильтр[править | править код]
Структура калиевого канала бактерии
[23]
Механизм селективности[править | править код]
Гидрофобная область[править | править код]
Центральная полость[править | править код]
Регуляция[править | править код]
Graphical representation of open and shut potassium channels (PDB 1lnq and PDB 1k4c). Two simple bacterial channels are shown to compare the «open» channel structure on the right with the «closed» structure on the left. At top is the filter (selects potassium ions), and at bottom is the gating domain (controls opening and closing of channel).
Блокаторы[править | править код]
Бериотоксин,дендротоксин,тетраэтиламмоний
Мускариновый калиевый канал[править | править код]
Калиевые каналы в искусстве[править | править код]
Фосс-Андре Юлиан. «Рождение Идеи» (Birth of an Idea) (2007). Скульптура, созданная для Родерика Маккинона на основе атомных координат, которые были определены группой Маккинона в 2001 году.
Структура калиевого канала KcsA положена в основу скульптуры «Рождение Идеи» высотой 1,5 метра, созданной для лауреата Нобелевской премии Родерика Маккинона[24]. Работа содержит проволочный каркас, удерживающий выдутый из жёлтого стекла объект, который изображает основную полость канальной структуры.
См. также[править | править код]
- Натриевые каналы
- Кальциевые каналы
Примечания[править | править код]
- ↑ Littleton J.T., Ganetzky B. Ion channels and synaptic organization: analysis of the Drosophila genome (англ.) // Neuron (англ.)русск. : journal. — Cell Press, 2000. — Vol. 26, no. 1. — P. 35—43. — doi:10.1016/S0896-6273(00)81135-6. — PMID 10798390.
- ↑ Hille, Bertil. Chapter 5: Potassium Channels and Chloride Channels // Ion channels of excitable membranes (неопр.). — Sunderland, Mass: Sinauer (англ.)русск., 2001. — С. 131—168. — ISBN 0-87893-321-2.
- ↑ Thomas M.; Jessell; Kandel, Eric R.; Schwartz, James H. Chapter 6: Ion Channels // Principles of Neural Science (англ.)русск. (неопр.). — 4th. — New York: McGraw-Hill Education, 2000. — С. 105—124. — ISBN 0-8385-7701-6.
- ↑ Rang, H. P. Pharmacology (неопр.). — Edinburgh: Churchill Livingstone (англ.)русск., 2003. — С. 60. — ISBN 0-443-07145-4.
- ↑ Kobayashi T., Washiyama K., Ikeda K. Inhibition of G protein-activated inwardly rectifying K+ channels by ifenprodil (англ.) // Neuropsychopharmacology (англ.)русск. : journal. — Nature Publishing Group, 2006. — Vol. 31, no. 3. — P. 516—524. — doi:10.1038/sj.npp.1300844. — PMID 16123769.
- ↑ 1 2 3 4 5 6 Enyedi P., Czirják G. Molecular background of leak K+ currents: two-pore domain potassium channels (англ.) // Physiological Reviews (англ.)русск. : journal. — 2010. — Vol. 90, no. 2. — P. 559—605. — doi:10.1152/physrev.00029.2009. — PMID 20393194.
- ↑ 1 2 3 4 5 6 Lotshaw D.P. Biophysical, pharmacological, and functional characteristics of cloned and native mammalian two-pore domain K+ channels (англ.) // Cell Biochemistry and Biophysics (англ.)русск. : journal. — 2007. — Vol. 47, no. 2. — P. 209—256. — doi:10.1007/s12013-007-0007-8. — PMID 17652773.
- ↑ Fink M., Lesage F., Duprat F., Heurteaux C., Reyes R., Fosset M., Lazdunski M. A neuronal two P domain K+ channel stimulated by arachidonic acid and polyunsaturated fatty acids (англ.) // The EMBO Journal (англ.)русск. : journal. — 1998. — Vol. 17, no. 12. — P. 3297—3308. — doi:10.1093/emboj/17.12.3297. — PMID 9628867.
- ↑ Goldstein S.A., Bockenhauer D., O’Kelly I., Zilberberg N. Potassium leak channels and the KCNK family of two-P-domain subunits (англ.) // Nature Reviews Neuroscience : journal. — 2001. — Vol. 2, no. 3. — P. 175—184. — doi:10.1038/35058574. — PMID 11256078.
- ↑ Sano Y., Inamura K., Miyake A., Mochizuki S., Kitada C., Yokoi H., Nozawa K., Okada H., Matsushime H., Furuichi K. A novel two-pore domain K+ channel, TRESK, is localized in the spinal cord (англ.) // The Journal of Biological Chemistry : journal. — 2003. — Vol. 278, no. 30. — P. 27406—27412. — doi:10.1074/jbc.M206810200. — PMID 12754259.
- ↑ Czirják G., Tóth Z.E., Enyedi P. The two-pore domain K+ channel, TRESK, is activated by the cytoplasmic calcium signal through calcineurin (англ.) // The Journal of Biological Chemistry : journal. — 2004. — Vol. 279, no. 18. — P. 18550—18558. — doi:10.1074/jbc.M312229200. — PMID 14981085.
- ↑ Kindler C.H., Yost C.S., Gray A.T. Local anesthetic inhibition of baseline potassium channels with two pore domains in tandem (англ.) // Anesthesiology (англ.)русск. : journal. — Lippincott Williams & Wilkins (англ.)русск., 1999. — Vol. 90, no. 4. — P. 1092—1102. — doi:10.1097/00000542-199904000-00024. — PMID 10201682.
- ↑ 1 2 3 Meadows H.J., Randall A.D. Functional characterisation of human TASK-3, an acid-sensitive two-pore domain potassium channel (англ.) // Neuropharmacology : journal. — 2001. — Vol. 40, no. 4. — P. 551—559. — doi:10.1016/S0028-3908(00)00189-1. — PMID 11249964.
- ↑ Kindler C.H., Paul M., Zou H., Liu C., Winegar B.D., Gray A.T., Yost C.S. Amide local anesthetics potently inhibit the human tandem pore domain background K+ channel TASK-2 (KCNK5) (англ.) // Journal of Pharmacology and Experimental Therapeutics (англ.)русск. : journal. — 2003. — Vol. 306, no. 1. — P. 84—92. — doi:10.1124/jpet.103.049809. — PMID 12660311.
- ↑ Punke M.A., Licher T., Pongs O., Friederich P. Inhibition of human TREK-1 channels by bupivacaine (неопр.) // Anesthesia anf Analgesia. — 2003. — Т. 96, № 6. — С. 1665—1673. — doi:10.1213/01.ANE.0000062524.90936.1F. — PMID 12760993.
- ↑ Lesage F., Guillemare E., Fink M., Duprat F., Lazdunski M., Romey G., Barhanin J. TWIK-1, a ubiquitous human weakly inward rectifying K+ channel with a novel structure (англ.) // The EMBO Journal (англ.)русск. : journal. — 1996. — Vol. 15, no. 5. — P. 1004—1011. — PMID 8605869.
- ↑ Duprat F., Lesage F., Fink M., Reyes R., Heurteaux C., Lazdunski M. TASK, a human background K+ channel to sense external pH variations near physiological pH (англ.) // The EMBO Journal (англ.)русск. : journal. — 1997. — Vol. 16, no. 17. — P. 5464—5471. — doi:10.1093/emboj/16.17.5464. — PMID 9312005.
- ↑ Reyes R., Duprat F., Lesage F., Fink M., Salinas M., Farman N., Lazdunski M. Cloning and expression of a novel pH-sensitive two pore domain K+ channel from human kidney (англ.) // The Journal of Biological Chemistry : journal. — 1998. — Vol. 273, no. 47. — P. 30863—30869. — doi:10.1074/jbc.273.47.30863. — PMID 9812978.
- ↑ Meadows H.J., Benham C.D., Cairns W., Gloger I., Jennings C., Medhurst A.D., Murdock P., Chapman C.G. Cloning, localisation and functional expression of the human orthologue of the TREK-1 potassium channel (англ.) // Pflügers Archiv : European Journal of Physiology (англ.)русск. : journal. — 2000. — Vol. 439, no. 6. — P. 714—722. — doi:10.1007/s004240050997. — PMID 10784345.
- ↑ Patel A.J., Honoré E., Lesage F., Fink M., Romey G., Lazdunski M. Inhalational anesthetics activate two-pore-domain background K+ channels (англ.) // Nature Neuroscience : journal. — 1999. — Vol. 2, no. 5. — P. 422—426. — doi:10.1038/8084. — PMID 10321245.
- ↑ Gray A.T., Zhao B.B., Kindler C.H., Winegar B.D., Mazurek M.J., Xu J., Chavez R.A., Forsayeth J.R., Yost C.S. Volatile anesthetics activate the human tandem pore domain baseline K+ channel KCNK5 (англ.) // Anesthesiology (англ.)русск. : journal. — Lippincott Williams & Wilkins (англ.)русск., 2000. — Vol. 92, no. 6. — P. 1722—1730. — doi:10.1097/00000542-200006000-00032. — PMID 10839924.
- ↑ Rogawski M.A., Bazil C.W. New Molecular Targets for Antiepileptic Drugs: α2δ, SV2A, and Kv7/KCNQ/M Potassium Channels (англ.) // Curr Neurol Neurosci Rep (англ.)русск. : journal. — 2008. — July (vol. 8, no. 4). — P. 345—352. — doi:10.1007/s11910-008-0053-7. — PMID 18590620.
- ↑ Zhou Y., Morais-Cabral J.H., Kaufman A., MacKinnon R. Chemistry of ion coordination and hydration revealed by a K+ channel-Fab complex at 2.0 Â resolution (англ.) // Nature : journal. — 2001. — Vol. 414, no. 6859. — P. 43—8. — doi:10.1038/35102009. — PMID 11689936.
- ↑ Ball, Philip. The crucible: Art inspired by science should be more than just a pretty picture (англ.) // Chemistry World (англ.)русск. : magazine. — 2008. — March (vol. 5, no. 3). — P. 42—43.
Ссылки[править | править код]
- MeSH Potassium+Channels
- Neuromuscular Disease Center. Potassium Channels. Washington University in St. Louis (4 марта 2008). Дата обращения: 10 марта 2008.
Источник
Калиевые каналы мембраны клетки• К+-каналы функционируют как заполненные водой поры и катализируют селективный и быстрый транспорт ионов К+ • К+-канал представляет собой комплекс, состоящий из четырех идентичных субъединиц, каждая из которых участвует в образовании поры • Селективный фильтр К+-канала представляет собой эволюционно-консервативную структуру • Селективный фильтр К+-канала катализирует процесс дегидратации ионов, благодаря чему канал становится специфичным и транспорт ионов по нему значительно ускоряется Калиевые (К+) каналы представляют собой белки, интегрированные в плазматическую мембрану, которые обеспечивают выход ионов К+ из клетки. Калиевые каналы — эволюционно-консервативные структуры в клетках всех живых существ, от бактерий до человека. В различных типах клеток они выполняют разнообразные функции, от поддержания мембранного потенциала покоя до завершения потенциала действия и поддержания баланса электролитов. (У прокариот функции К+-каналов еще недостаточно выяснены.) Подобно другим ионным каналам, К+-каналы имеют разные воротные механизмы, т. е. в ответ на действие электрических или химических сигналов они могут открываться и закрываться. Поскольку клетки поддерживают существенно более высокую концентрацию внутриклеточного калия, открытие калиевых каналов приводит к выходу его из клетки, так как ионы движутся в направлении электрохимического градиента. Так же как и другие ионные каналы, калиевые представляют собой узкие заполненные водой поры, через которые происходит транспорт ионов. К+-каналы проявляют высокую избирательность по отношению к ионам калия. Эта избирательность играет важную роль в поддержании постоянства концентрации внутриклеточных ионов.
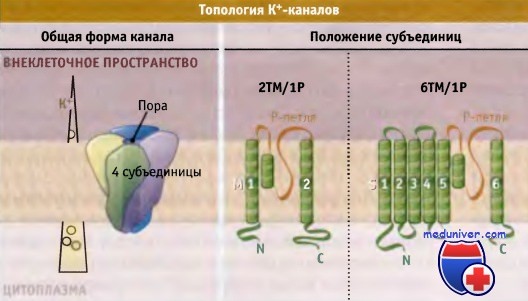
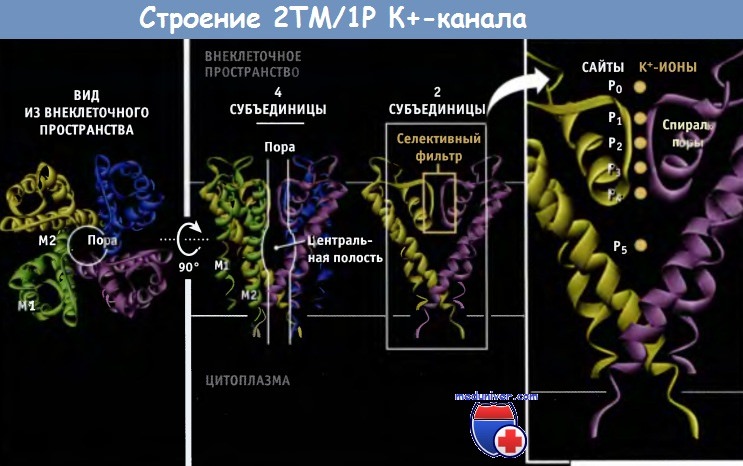
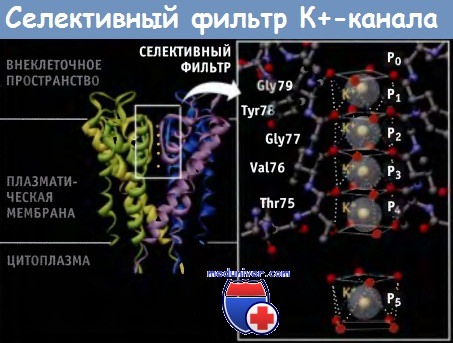
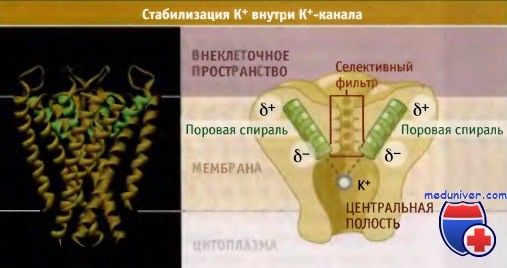
По данным электрофизиологических исследований, транспорт К+ через каналы происходит со скоростью порядка 108 ионов в 1 с, что близко к максимальной скорости диффузии в воде молекул растворенного вещества. В настоящем разделе мы рассмотрим молекулярные основы селективного и при этом быстрого транспорта ионов К+ через мембрану клетки. Каждый К+-канал представляет собой гомотетрамер, состоящий из четырех субъединиц, образующих центральную пору, через которую осуществляется транспорт ионов. В зависимости от трансмембранной топологии субъединиц различают два основных типа К+-каналов. Тип 2ТМ/1Р характеризуется тем, что каждая субъединица имеет две трансмембранных (2ТМ) а-спирали, M1 и М2, которые разделены петлей поры (Р). Р-петля содержит короткий спиральный фрагмент, который называется спиралью поры. Эти детали строения являются общими для всех К+-каналов. Тип 2ТМ/1Р включает канал внутреннего выпрямления, КАТР, и G-белок, с которым сопряжен К+-канал. Каждая субъединица еще одного типа К+-канала, который обозначается как 6ТМ/1Р, содержит шесть трансмембранных доменов (6ТМ) и одну Р-петлю. В этом типе К+-канала домены S5-P-S6 образуют область поры таким же образом, как М1-Р-М2 домены в каналах типа 2ТМ/Р. Четыре добавочных трансмембранных сегмента (S1-S4) участвуют в воротном механизме. Каналы типа 6ТМ/1Р включают К+-каналы, зависящие от потенциала на мембране (Kv-каналы) и от лиганда, например Са2+ активируемые К+-каналы. Нам удалось выяснить причины высокой селективности К+-каналов на основании электрофизиологических исследований, а также используя мутагенез и рентгеноструктурный анализ. Данные рентгеноструктурного анализа позволили не только подтвердить ранее высказанные предположения, но дали возможность создать модели каналов на атомарном уровне. Первый К+-канал, для которого была установлена кристаллическая структура, представлял собой KcsA канал бактерий, относящийся к 2ТМ/1Р типу, в закрытой конфигурации. Пора, через которую проходят ионы, состоит из двух основных частей, селективного фильтра и центральной полости. Внутри поры расположены М2 (внутренние) спирали и Р-петли. Селективный фильтр, который представляет собой самую узкую часть поры, расположен ближе к ее внешнему отверстию и связывает ионы К+. Длина его составляет 12 А, а ширина 3 А, и каждая субъединица добавляет одну Р-петлю к его структуре. В канале присутствуют шесть ион-содержащих сайтов: четыре из них (Р1-Р4) расположены в пределах селективного фильтра, а из двух остальных (Р0 и Р5) один расположен на внешней стороне фильтра, и один — в центральной полости. В составе кристаллической структуры эти сайты формируют сложное изображение всех белков К+ канала. Каждая из четырех Р-петель селективного фильтра К+ канала содержит высококонсервативную последовательность, которая называется сигнатурной последовательностью: Thr-X-Gly-Tyr-Gly или Thr-X-Gly-Phe-Gly (TXGYG или TXGFG соответственно), где X представляет собой один из нескольких аминокислотных остатков. Сигнатурная последовательность для канала KcsA имеет следующий вид: Thr-Val-Gly-Tyr-Gly (TVGYG). От каждого из аминокислотных остатков в канал попадают атомы карбонильного кислорода (или из основной направлены молекулы, или из боковой цепи). Как показано на рисунке ниже, эти атомы, которые частично несут отрицательный заряд, располагаются по углам четырех коробчатых структур, которые координируют положение проходящих ионов К+. Скоординированное положение ионов К+ в селективном фильтре напоминает линейную цепь.
Ионы К+, находящиеся в растворе, гидратированы, т. е. окружены молекулами воды. Для того чтобы ионы могли проникнуть в узкий селективный фильтр, они должны от этих молекул освободиться. Однако процесс дегидратации ионов требует значительного количества энергии, поскольку при этом необходимо разорвать силы притяжения между положительно заряженными ионами К+ и частичным отрицательным зарядом дипольных молекул воды. Эта проблема решается с помощью К+-канала. Отрицательный заряд атомов кислорода, находящихся в селективном фильтре, действует таким же образом, как молекулы воды, создавая гидрофильное окружение, которое снижает энергию дегидратации для ионов К+ и копирует слабые отрицательные заряды диполей воды, создающих гидратную оболочку. Дегидратация является основным этапом на пути формирования ионной селективности каналов. Рассмотрим другой распространенный одновалентный катион, Na+, который по размеру меньше иона К+, однако в 104 раз медленнее проникает через К+-каналы. Причина того, что К+-каналы практически непроницаемы для ионов Na+, заключается в том, что размер селективного фильтра калиевого канала компенсирует энергию дегидратации ионов К+, но не ионов натрия. Дегидратированные ионы К+ хорошо проходят через селективный фильтр, однако дегидратированные ионы Na+ оказываются слишком мелкими для того, чтобы взаимодействовать с карбонильным кислородом таким образом, чтобы дегидратация оказалась энергетически выгодной. Поэтому структура селективного фильтра способствует прохождению ионов калия, но не ионов натрия. Для того чтобы скорость диффузии ионов через К+-канал составляла 108 ионов в 1 с, процессы их дегидратации, прохождения через селективный фильтр и гидратации должны происходить за 10 нс. С помощью компьютерного моделирования разработана модель, позволяющая рассчитать максимально возможную скорость движения ионов. Модель была разработана с учетом анализа различных кристаллических структур, причем каждая структура соответствовала определенной концентрации ионов К+.
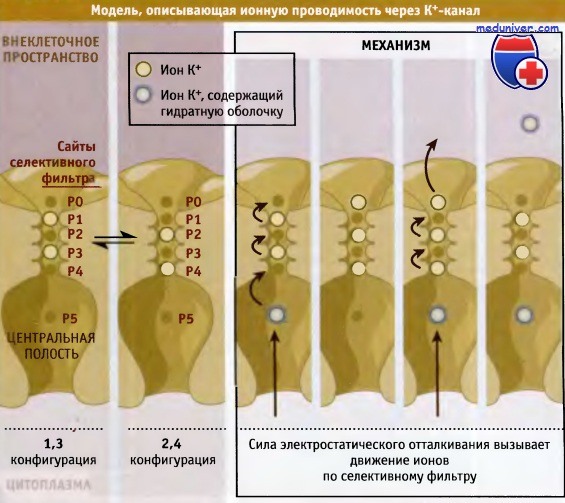
При разработке модели исходили из предположения, что в каждый данный момент времени ионы калия в селективном фильтре могут занимать или положения Р1 и Р3 (конфигурация 1,3), или Р2 и Р4 (конфигурация 2,4). Эти конфигурации предполагают, что ионы К+ не располагаются близко друг к другу из-за существования сил взаимного отталкивания. Две конфигурации энергетически близки друг к другу и находятся во взаимном равновесии. Как только ионы К+ из центральной полости поступают в селективный фильтр, силы электростатического отталкивания продвигают их по фильтру по пути одной из двух возможных конфигураций. В результате ионы выходят с внешней стороны канала. Высокая проводимость канала обеспечивается в том числе отсутствием энергетического барьера между конфигурациями 1,3 и 2,4, который при его наличии существенно затруднял бы транспорт. Отметим также, что общий принцип, определяющий быстрый транспорт ионов, заключается в том, что при открытии канала поры расширяются и через них свободно проходят ионы, которые достигают селективного фильтра. Так, для К+-каналов эффективное расстояние, на которое проникают ионы, укорачивается до 12 А, т. е. до длины селективного фильтра, а не до толщины мембраны. Другая особенность структуры К+-каналов заключается в существовании центральной полости диаметром 10 А, расположенной с внутриклеточной стороны селективного фильтра. Изнутри полость выстлана гидрофобными остатками, что сводит к минимуму взаимодействие ее стенок с гидратированными ионами. В то же время центральная полость помогает ионам К+ преодолевать силы отталкивания от гидрофобного центра липидного бислоя. Два характерных свойства центральной полости способствуют стабилизации ионов К+ в канале, в центре мембраны, где существует максимальный энергетический барьер для прохождения ионов. Во-первых, ионы К+ находятся в центральной полости в гидратированном состоянии. Во-вторых, как показано на рисунке ниже, частичный отрицательный заряд поровых спиралей каждой субъединицы канала направлен к центру центральной полости. (Частичные отрицательный и положительный заряды на а-спиралях возникают в результате образования водородных связей между соседними витками. При этом С-концевая часть приобретает более отрицательный заряд, чем N-концевая.)
– Также рекомендуем “Воротный механизм калиевых каналов – гейтинг” Оглавление темы “Проницаемость мембраны клетки”:
|
Источник