Катод в сосуде с водой

Еще раз про Н2О
Как уже говорилось, впервые химический состав воды был определен французским химиком Лавуазье в 1784 году. Лавуазье вместе с военным инженером Мёнье, прогоняя пары воды над раскаленным листом железа, обнаружил, что вода разлагается, выделяя при этом водород и кислород. Да, конечно, для своего времени, для эпохи «упорядочения вещей», эти выводы имели большое значение. В самом деле, ведь до этого открытия вода считалась совершенно однородным веществом. Нельзя, однако, не отметить и другого: открытие это сыграло и свою вполне очевидную отрицательную роль, так как надолго отвлекло внимание других ученых от поисков в этой области и утвердило в умах многих поколений непогрешимость данного вывода, освященного к тому же авторитетом ученого.
Но, что условия, при которых он проводился, были настолько несовершенны, были «грязны».
Чего стоит одно только наличие железа, над которым пропускались пары воды. Оно способно внести такие моменты в опыт, которые даже трудно учесть наперед. Лавуазье с партнером зафиксировали в своем опыте то, что было наиболее очевидным: выделение двух газов – водорода и кислорода, а что было сверх того, на это они и вовсе не обратили внимание, скорее всего по той причине, что это «сверх того» не было столь очевидным, как выделение двух газов.
Поскольку до этого открытия общим мнением, господствовавшим в науке, было мнение, что вода является однородным веществом, факт открытия ее неоднородного состава можно назвать революционным. Чего еще можно было требовать от первооткрывателей! К тому же очевидность результатов опыта была слишком подкупающей.
Старый взгляд на воду был отброшен и заменен новым представлением о воде как соединении двух элементов – водорода и кислорода, которое быстро утвердилось в науке. Этому способствовало в значительной мере развитие электрохимии.
ЭЛЕКТРОЛИЗ по Дэви
Рядом ученых (Никольсон, Кавендиш и др.) был проведен опыт по электрохимическому разложению воды (подобное определение данного процесса совершенно ошибочно). Под словом «разложение» надо понимать электролиз воды как сложный окислительно-восстановительный процесс, но отнюдь не как простое разложение воды на составляющие элементы.
Итак, при разложении, т.е. электролизе воды выделялись водород и кислород, что, казалось бы, внешним образом подтверждало вывод Лавуазье. Однако при этом «черный ящик» стал неожиданно выдавать дополнительную информацию, которой прежде не было. В процессе электролиза обнаружилось два странных явления: во-первых, обе составные части воды выделялись не вместе, а отдельно друг от друга – кислород у одного электрода, водород – у другого; во-вторых, наблюдалось образование кислоты у кислородного полюса и щелочи у водородного. Это «странное» разложение воды озадачило ученых; притом их больше беспокоила вторая «странность», т.е. появление кислоты и щелочи.
То обстоятельство, что при пропускании через воду электрического тока выделялись водород и кислород, вполне устраивало ученых, ибо как бы подтверждало ставшее уже господствующим мнение о составе воды. Вопрос же о том, каким образом эти составные части выделялись, при каких сопутствующих обстоятельствах, хотя и занимал ученых того времени, но все же не в такой степени: их внимание было направлено главным образом на вторую «странность», ибо она наводила тень сомнения на открытую формулу воды. Неизбежно встал вопрос о том, что является причиной образования кислоты и щелочи при электролизе воды.
За решение этой загадки взялся выдающийся английский химик Гемфри Дэви (1778—1829). Дэви рядом опытов, казалось бы, подтвердил предполагаемый всеми учеными того времени факт, что образование кислоты и щелочи при электролизе воды – явление случайное, не связанное с самой водой, состоящей, как это и было определено Лавуазье, из водорода и кислорода. Но, каким образом Дэви удалось это «доказать».
Дэви проделал многочисленные опыты по «разложению» электричеством тщательно очищенной воды в различных сосудах: агатовых, стеклянных, сделанных из плавикового шпата, сернокислого барита и т.п., чтобы максимально уменьшить влияние материала сосудов на результаты опытов. Во всех без исключения опытах при электролизе воды он получал у анода сильную кислоту, у катода щелочь. Он связывал это с тем, что чистая вода отчасти все же разлагала материал сосудов, что и явилось причиной образования кислоты и щелочи. Важным, однако, следствием опытов было то, что количество образующихся у электродов кислоты и щелочи стояло в прямой зависимости от продолжительности опытов, а именно: чем продолжительнее они были, тем больше образовывалось кислоты и щелочи и тем сильнее была их концентрация.
В опытах Дэви по электролизу различных растворов солей получалась аналогичная картина: у анода шло образование кислоты с выделением кислорода, у катода – образование щелочи с выделением водорода или чистого аммиака. Сами эти процессы должны были бы подтолкнуть по аналогии к выводам относительно общих закономерностей, относящихся к процессу электролиза.
Ведь хорошо известно, что при электролизе различных веществ у электродов происходят окислительно-восстановительные процессы, но отнюдь не простое разложение веществ. Более того, только при наличии окислительно-восстановительного процесса может идти и сам электролиз.
При этом реакция окисления происходит у одного электрода, а реакция восстановления у другого. Поэтому было бы самой грубой ошибкой рассматривать электролиз как простой процесс разложения веществ на составляющие их элементы, будь то вода, соль или кислота. Окисление у одного полюса происходит при одновременном восстановлении у другого, и наоборот. Эти положения суть святая святых электрохимических процессов, полностью согласующихся со вторым началом термодинамики. Действительно, если мы возьмем примеры с электролизом солей, то легко видеть, что у анода происходила реакция восстановления с выделением кислорода (продуктом этой реакции, скапливающимся у анода, во всех случаях выступала какая-нибудь кислота). У катода происходила реакция окисления с выделением водорода или металла (продуктом этой реакции, скапливающимся у катода, всегда была какая-нибудь щелочь).
Естественно, казалось бы, распространить ту же закономерность и на воду: вода как химическое вещество, обладающее во многих отношениях кислотными свойствами, в принципе не может служить в данном случае исключением и просто разваливаться, подобно какой-нибудь механической смеси, на составляющие его части там, где все остальные вещества претерпевают сложные окислительно-восстановительные процессы. Поэтому уже априорно можно было бы ожидать при электролизе воды образования кислоты и щелочи у соответствующих электродов. Вопрос только в том – какой кислоты и какой щелочи?
Но именно эта совершенно очевидная вещь отвергалась. Мысль о ней не допускалась или ею попроступренебрегали. Притом делали это не какие-то дилетанты, а профессионалы высокого класса. Для них, сдается, каким-то символом веры, своего рода «священной коровой» стал факт, что вода состоит из двух элементов – водорода и кислорода, и они направляли все свои недюжинные способности именно на подтверждение данного факта, но отнюдь не на проверку его истинности. То, что оба газа выделялись при электролизе, хотя и у разных электродов, как бы подтверждало эту веру, даже вопреки всем законам электролиза и термодинамики. При этом никого нисколько не смущало, что вода вот так легко может разделяться на составные части, будто два склеенных куска дерева, опущенных в воду.
Для того чтобы избежать всяких побочных влияний, Дэви провел ряд опытов в золотых сосудах с хорошо очищенной водой. На протяжении четырнадцати часов, в течение которых продолжался опыт, количество кислоты в анодном сосуде постоянно возрастало. Дэви обнаружил, что она по своим свойствам ничем не отличалась от азотной кислоты, которая точно таким же образом образовывалась в опытах, проводимых им прежде в стеклянных сосудах. В катодном же сосуде образовывалась летучая щелочь, количество которой скоро доходило до определенного предела. Она обнаруживала свойство аммиака (NH3).
Дэви повторил свой опыт и продолжал его без перерыва трое суток. К концу этого времени, как он сам свидетельствует, вода в сосудах была разложена и выпарилась больше чем на половину своего первоначального объема. В результате, в анодном сосуде образовалась сильная азотная кислота, количество же щелочи оставалось примерно на том же уровне, как и в предыдущем опыте. Дэви посчитал, что последнее было связано с ее постоянным испарением.
Не видя каких-либо явных источников появления в опытах азота, Дэви предположил, что образование азотной кислоты было обязано соединению водорода и кислорода в момент их выделения с азотом воздуха, растворенным в воде. Для подтверждения своей догадки, он проделал тот же опыт под колоколом воздушного насоса, из которого он выкачал воздух (как он пишет сам: осталась лишь 1/64 его первоначального объема). В итоге получились следующие обнадеживающие для него результаты: в катодном сосуде вода вовсе не обнаруживала присутствия щелочи, в анодном сосуде лакмусовая бумажка слабо окрасилась в красный цвет, что свидетельствовало об образовании там небольшого количества кислоты. Казалось, его догадка подтверждалась. Чтобы уже окончательно убедиться в своей правоте, Дэви еще раз повторил свой опыт под колоколом, но теперь уже в атмосфере чистого водорода. При этом для большей чистоты опыта он дважды наполнял колокол водородом, чтобы удалить всякие остатки воздуха. Итоги опыта превзошли все ожидания: ни в одном из сосудов не было обнаружено даже следов щелочи и кислоты. Эти опыты не оставили у Дэви никаких сомнений в том, что образование кислоты и щелочи у электродов – явление случайное и не связано с химическим составом воды, а обязано лишь присутствию воздуха, в котором, как известно, содержится азот. Они убедили не только Дэви, но и многие поколения химиков после него. После этих опытов было уже как бы неприлично возвращаться вновь к вопросу о химическом составе воды – всем все стало ясно.
Вода “под пыткой” у Дэви
А действительно ли в опытах Дэви все было так безукоризненно чисто и хорошо? Рассмотрим опыт Дэви по электролизу воды под колоколом воздушного насоса. Почему в этом опыте образовалось лишь небольшое количество кислоты в анодном сосуде и не было вовсе обнаружено щелочи в сосуде катодном? Действительно ли, как думал Дэви, это было связано с отсутствием воздуха, выкачанного из-под колокола? Отчасти да, но совершенно в другом смысле, нежели он предполагал. Начать с того, что Дэви допустил серьезную ошибку в своем первоначальном предположении, что причиной образования кислоты и щелочи являлся азот воздуха. Образование кислоты и щелочи к азоту воздуха никакого отношения иметь не могло по той простой причине, что азот в обычных условиях химически не активен, не растворяется в воде и не вступает в реакции ни с кислородом, ни с водородом. Один этот факт должен был бы натолкнуть на поиски иных источников образования кислоты и щелочи. Позже, правда, высказывалось предположение, что образование кислоты и щелочи в опытах было, возможно, вызвано присутствием в воздухе некоторого количества аммонийных солей. Этим объяснением и удовлетворились. Однако вряд ли можно всерьез принимать данное объяснение, так как, во-первых, оно было сделано постфактум и, во- вторых, даже если бы какое-то количество таких солей и впрямь присутствовало, то оно настолько должно было быть мало, что не могло оказывать постоянного и закономерного образования кислоты и щелочи в каждом опыте, количество которых стояло, как говорилось, лишь в прямой зависимости от продолжительности проводимых опытов.
Главное, однако, не в этом, а в том, что именно происходило в опытах под колоколом и почему, в отличие от обычных условий, там образовалось лишь небольшое количество кислоты и вовсе не было щелочи. Рассмотрим, прежде всего, возможное влияние на результаты опыта сильно разреженной атмосферы. Известно, что в разреженной атмосфере происходит быстрое выделение из жидкостей растворенных в ней газов и значительно ускоряется процесс ее испарения, причем последний вначале затрагивает более летучие вещества, а затем вещества менее летучие. Естественно предположить, что в опытах Дэви в сильно разреженной атмосфере начался, прежде всего, процесс выделения из раствора летучей щелочи, которая отчасти поэтому и не была обнаружена в катодном сосуде. Затем, поскольку температура кипения азотной кислоты ниже температуры кипения воды, стала также частично испаряться и азотная кислота, образующаяся в анодном сосуде.
Этим, однако, побочные влияния на ход опыта не ограничивались. Поскольку при электролизе воды выделяются кислород и водород, причем объем выделяющегося водорода в семь раз превышает объем кислорода, эти газы, и, прежде всего, водород, не могли не оказывать своего влияния на ход опыта. Если в обычных условиях, т.е. не под колоколом, как аммиак, так и водород, образующиеся во время опыта, улетучивались и не влияли на исход опыта, то под колоколом эти вещества собирались в замкнутом пространстве. Аммиак мог при этом частично вступать в реакцию с образующейся азотной кислотой, нейтрализуя какую-то ее часть. Помимо того, и это, может быть, самое главное, водород как сильный восстановитель, собираясь в значительном количестве под колоколом, несомненно оказывал воздействие на весь ход реакции, давая те результаты, которые и были зафиксированы Дэви как окончательные.
Иллюстрация восстановительного действия водорода.
Если, взять два электрода, один из которых представляет полированную серебряную пластинку, а другой – обычную швейную иглу, поместить их под колокол, и в сильно разреженном воздухе пропускать электрический ток так, чтобы электрический разряд переходил с кончика иглы на полированную пластинку, то напротив кончика иглы пластинка заметно изменится – она окислится и потускнеет, и тем больше, чем дольше будет пропускаться электрический ток. Если же после этого воздух заменить разреженным водородом, то при всех прочих равных и неизменных условиях, дальнейшее пропускание тока приведет к тому, что окись на пластинке будет постепенно сходить, и полировка по большей части восстановится, что хорошо иллюстрирует восстанавливающие свойства водорода.
Второй пример из области живой природы. Клод Бернар приводит такой опыт: он смешивал один объем воздуха с двумя объемами водорода и помещал в эту атмосферу семена. При всех прочих благоприятных условиях (влага, тепло и проч.) прорастания семян не происходило, хотя напряжение кислорода при этом было вполне достаточным для жизнедеятельности. Очевидно, что негативный результат был обязан опять-таки действию водорода, оказывавшего сильное восстанавливающее действие, препятствуя течению окислительно-восстановительного процесса, а вместе с ним и образованию его необходимых продуктов – кислоты и щелочи.
Третье: из физической химии хорошо известно, что азотная кислота является легко восстанавливающимся веществом. Она, например, восстанавливается водородом до свободного азота:
2N03+ 12Н + 10е—> N2+ 6Н20
Это свойство азотной кислоты специально используется в некоторых гальванических элементах для предотвращения поляризации. В этих случаях азотную кислоту добавляют в катодное отделение, где выделяется водород.
Аналогичные процессы происходили и под колоколом в опытах Дэви. Когда он во втором опыте заменил воздух водородом, то тем самым создал там мощную восстановительную среду, действие которой не преминуло сказаться на результатах: в анодном сосуде естественно не было (и не могло быть) обнаружено кислоты, в катодном – щелочи. Все было естественно и закономерно. Но факт остается фактом: опыты Дэви убедили всех окончательно, что вода состоит из двух простых элементов – водорода и кислорода.
Дэви удалось лишь создать условия, при которых во время электролиза воды не образовывались ни кислота, ни щелочь, которые неизменно образуются внормальных, естественных условиях.
Однако предположим, что вода действительно состоит из водорода и кислорода. Тогда естественно было бы предполагать, что, коль скоро вода с такой легкостью разлагается на свои составные части, она должна столь же легко образовываться в результате их синтеза. Ничего подобного, однако, не происходит. Как известно, смесь двух газов в пропорции один к двум (один объем кислорода и два объема водорода) дает так называемый гремучий газ, но отнюдь не воду. Попытки образования воды из водорода и кислорода имели успех только в присутствии катализатора (кстати, в роли катализатора может при этом выступать и железо, то самое железо, над которым Лавуазье пропускал пары воды и извлекал свои исторические выводы).
Можно сказать, что большинство опытов по определению химического состава воды было направлено не столько на объективные поиски, сколько на подгонку их результатов к уже имеющемуся выводу, который стал поистине символом веры. «Черный ящик» давал в основном ту информацию, которую от него ожидали и которую часто заведомо предопределяли направленным действием на его входы.
Источник
Процесс электролиза – это окислительно-восстановительная реакция, возможная только под действием электричества. Электролиз протекает в расплавах и растворах. В лабораториях для получения чистых газов – водорода и кислорода – проводят электролиз воды.

Что такое электролиз
Для осуществления процесса электролиза в раствор или в расплав помещают два электрода, подключённых к противоположным полюсам источника тока. В качестве электродов чаще всего используется металл или графит, так как эти материалы пропускают электрический ток.
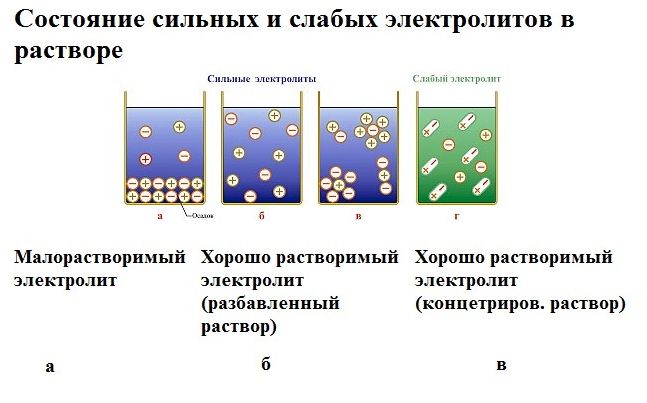
Рис. 1. Электролиты в растворе.
Под действием электричества электрод, подключенный к отрицательному полюсу, становится катодом, а электрод, соединённый с положительным полюсом, превращается в анод. Катод и анод притягивают противоположные ионы: к катоду направляются положительно заряженные катионы, к аноду – отрицательно заряженные анионы.
Катод является окислителем, на нём происходит процесс восстановления катионов. На аноде протекает процесс окисления: анод восстанавливает анионы и окисляется.
Процесс электролиза можно разделить на два этапа. Сначала происходит диссоциация – распад электролита (раствора или расплава) на ионы. Затем протекают реакции на электродах.
Электролиз воды
Если пропустить через воду электрический ток, жидкость начнёт диссоциироваться на составляющие молекулу воды атомы. В результате процесса электролиза воды получают кислород и водород. Однако в зависимости от природы электродов можно получить озон и перекись водорода.
Схема электролиза воды:
- анод:
2H2O → O2 + 4H+ + 4e–;
- катод:
4H+ + 4e– → 2H2.
Или:
- анод:
3H2O → O3 + 6e– + 6H+;
- катод:
O2 + 2H2O + 2e– → H2O2 + 2OH–.
Общее уравнение:
2H2O → 2H2 + O2.
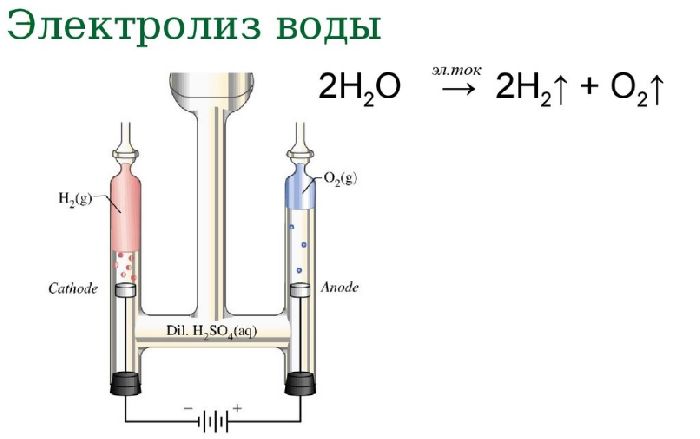
Рис. 2. Схема электролиза воды.
Вода – слабый электролит, поэтому электролиз чистой, дистиллированной воды протекает медленно или не идёт вовсе. Для ускорения процесса в воду добавляют сильный электролит, увеличивающий проводимость электрического тока.
Электролит выбирается так, чтобы исключить конкуренцию между катионами электролита и катионами воды (H+). В противном случае водород не будет произведён. Чтобы исключить конкуренцию, необходимо подобрать электролит, катионы которого будут иметь меньший электродный потенциал, чем H+ воды. На роль катиона электролита подходят:
- Li+;
- Rb+;
- K+;
- Cs+;
- Ba2+;
- Sr2+;
- Ca2+;
- Na+;
- Mg2+.
Для исключения конкуренции анионов, наоборот, подбирают электролит с анионами большего электродного потенциала, чем анион OH– воды. В качестве такого электролита применяется щелочь для образования гидроксильного иона OH–.
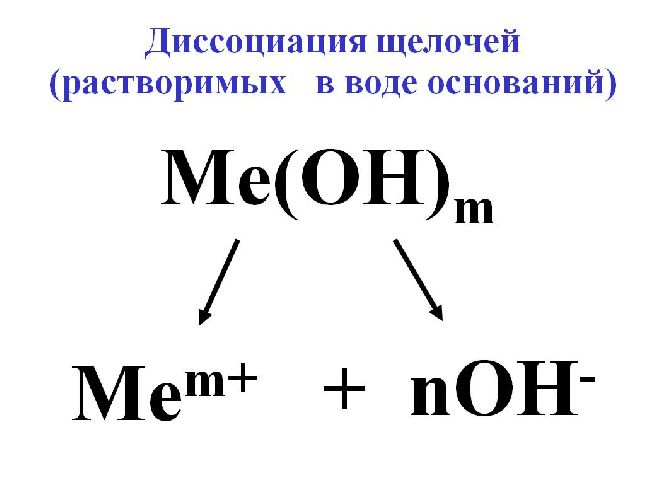
Рис. 3. Диссоциация щёлочи.
Для электролиза воды используются сильные щелочи: гидроксид калия (KOH) или натрия (NaOH). В некоторых случаях применяется сильная кислота, например, H2SO4.
Что мы узнали?
Электролиз – процесс образования и оседания на электродах ионов вещества под действием электрического тока. Вода разделяется на катионы водорода и анионы кислорода. Положительные катионы движутся к катоду, отрицательные анионы – к аноду. В некоторых случаях вода диссоциируется на озон и перекись водорода. Из-за низкой способности к диссоциации в воду добавляется сильный электролит, не мешающий образованию водорода и кислорода. Чаще всего добавляется щёлочь или сильная кислота.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-
Induction System
5/5
Оценка доклада
Средняя оценка: 4.4. Всего получено оценок: 116.
Источник
