Клетки кровеносных сосудов мозга

Активно работающие нейроны побуждают сосуды мозга расти и ветвиться, если же нейроны молчат, сосудистая сеть делается более разреженной.
Нейроны мозга зависят от питающих их кровеносных сосудов. Известно, что во время напряжённой работы мозга усиливается кровоток в тех его областях, которые работают активнее прочих – местные клетки нужно обеспечить питательными веществами и кислородом. Как выяснили исследователи из Медицинской школы Гарварда (США), взаимосвязь между нейронами и кровеносными сосудами на самом деле ещё прочнее, чем полагали ранее – оказывается, сама структура сосудистой сети может меняться в ответ на изменения в нейрональной активности.
Участок коры мозга, принимающий сигналы от вибриссов: аксоны нейронов окрашены красным, кровеносные сосуды – зелёным. (Фото Baptiste Lacoste / Harvard Medical School).
Кровеносные сосуды в коре мозга мышей при отсутствии сенсорных сигналов (слева) и после сенсорной стимуляции (справа). (Фото Baptiste Lacoste / Harvard Medical School).
‹
›
Известно, что нейронная архитектура мозга весьма пластична – нервные клетки постоянно формируют и разрывают контакты друг с другом, а доля белого и серого вещества в разных мозговых отделах может довольно сильно меняться в зависимости от того, какие задачи приходится постоянно выполнять мозгу. Но это нейроны, насчёт же сосудистой сети считалось, что она полностью определяется генами, которые руководят её формированием в ходе индивидуального развития. В статье в Neuron её авторы признают, что гены играют тут огромную роль, особенно на первых этапах созревания мозга, однако дальнейшая настройка сосудистой системы во многом зависит от нейронной активности.
Баптисте Лакост (Baptiste Lacoste) и его коллеги экспериментировали с мышами, пометив у животных нейроны и кровеносные сосуды разными флуоресцентными белками: аксоны нейронов – красным, сосуды – зелёным, чтобы можно было наблюдать за изменениями в тех и в других. В качестве «подопытных» были выбраны нервные клетки из области коры, принимавшей сенсорные сигналы от вибриссов. Исследователей интересовало, изменится ли что-то в сосудах коры, если в неё перестанут поступать сигналы извне (для этого мышей либо модифицировали генетически – так, чтобы нервные импульсы от чувствительных нейронов не доходили до мозга, либо просто удаляли сами вибриссы). Как следствие, кровеносные сосуды в коре укорачивались и они делались менее разветвлёнными. Наоборот, когда вибриссы стимулировали, то и сосуды в вибриссной коре становились длиннее и формировали новые ответвления.
В дальнейшем нейробиологи хотят выяснить, как именно связаны нейроны и сосуды. Возможно, передачей сигналов от одних к другим занимаются астроциты, специальные вспомогательные клетки нервной системы, чья забота – следить за благополучием нейронов (и которых, кстати, в пять раз больше, чем нейронов). Также предстоит более тщательно изучить факторы, которые могут повлиять на взаимодействие нейронов и сосудистой сети. Многие заболевания сопровождаются тем, что мозг перестаёт получать в достаточном количестве кислород и питательные вещества; возможно, чтобы такого не происходило, нужно позаботиться о том, чтобы мозг не испытывал недостатка в ощущениях.
Источник
Сужение сосудов головного мозга – это не заболевание, а симптом, который сопровождает сразу несколько патологий. Чаще всего на начальных стадиях он проявляется головными болями и снижением памяти. Многие пациенты принимают эти признаки за переутомление и не обращаются к врачу. Однако прогрессирование патологий может привести к инсульту или слабоумию. При наличии проявлений сужения сосудов головного мозга обязательно обращайтесь к врачу! Чем раньше начать лечение, тем благоприятнее прогноз.
Запишитесь на прием в Поликлинике Отрадное в удобное для вас время! Опытные врачи направят вас на исследования и по их результатам определят причины сужения сосудов головного мозга в вашем случае. Далее будет разработан индивидуальный план лечения, благодаря которому вы сможете избежать осложнений и повысите качество жизни.
Сосуды головного мозга
Наш мозг ежедневно справляется с огромными нагрузками. Для нормального функционирования ему необходимо много питательных веществ и кислорода. Они доставляются в мозг с кровотоком через 4 магистральные артерии: 2 сонные и 2 позвоночные. Ответвления магистральных сосудов образуют у основания мозга своеобразный круг. Он называется виллизиевым – в честь ученого Томаса Уиллиса, который в 17 веке впервые представил его описание. Этот круг позволяет компенсировать кровообращение при поражении одного или нескольких магистральных сосудов. Компенсаторная способность этого сплетения очень высока. В некоторых случаях даже при патологических процессах в 3 из 4 магистральных артерий человек может ощущать лишь незначительный дискомфорт.
Однако компенсаторные возможности все же не бесконечны. Поэтому рано или поздно поражения сосудов головного мозга будут проявляться заметными нарушениями.
В состоянии покоя головному мозгу для нормального функционирования требуется около 15% объема крови, циркулирующей во всем организме. К нему поступает около 25% кислорода, вдыхаемого человеком. Сосуды головного мозга ежедневно подвержены огромным нагрузкам. При этом в здоровом состоянии они невероятно эластичны. Однако при регулярном воздействии неблагоприятных факторов они способны сузиться, что приведет к недостатку кислорода и питательных веществ в тканях мозга, что негативно скажется на его работе.
Справка! Недостаточность кровоснабжения головного мозга называют дисциркуляторной энцефалопатией.
Классификация стеноза сосудов головного мозга
По форме сужение бывает:
- Острым – такое состояние способно повлечь за собой инсульт или летальный исход.
- Хроническим – развивается постепенно, медленно, человек может длительное время ничего не подозревать о патологических процессах.
Хроническое сужение сосудов имеет 3 стадии развития:
- При первой пациент испытывает незначительные головные боли, сонливость, хроническую усталость, наблюдает у себя рассеянность и небольшую забывчивость.
- На второй проявляются сильные головные боли, расстройства походки, значительное снижение трудоспособности, перепады настроения, сбои функционирования мочевыделительной системы.
- На третьей стадии развивается деменция (слабоумие) – пациент теряет самостоятельность и способность бытового самообслуживания, наблюдаются явные проблемы с координацией движений, непроизвольные мочеиспускания.
Почему возникает стеноз сосудов головного мозга
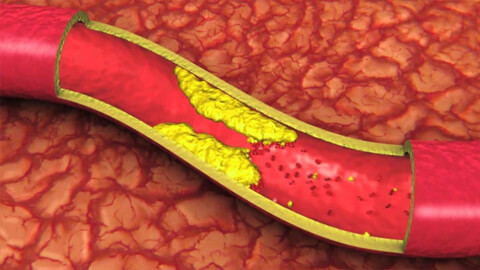
Главными причинами сужения сосудов головного мозга являются:
- Атеросклероз.
- Гипертоническая болезнь.
- Шейный остеохондроз.
Атеросклероз сосудов головного мозга – патологический процесс, при котором из-за нарушения липидного обмена на стенках артерий образуются холестериновые бляшки. Бляшки, разрастаясь, со временем замещаются соединительной тканью. Это сужает просвет сосуда и уменьшает его проходимость. Наиболее подвержены атеросклерозу сонные артерии. Бляшка может полностью закупорить просвет сосуда.
Гипертоническая болезнь – это хроническая патология, при которой наблюдается артериальная гипертензия (повышение давления), в большинстве случаев по неустановленным причинам. Этим заболеванием страдают до 40% людей. Регулярные перепады давления сказываются на эластичности сосудов. Их ткань патологически изменяется, стенки уплотняются, появляются локальные сужения. Со временем просвет сосуда способен полностью закрыться.
Остеохондроз шейного отдела проявляется деформацией межпозвонковых дисков. Они способны зажимать позвоночные артерии, по которым к мозгу поступает кровь.
Сужение сосудов головного мозга может наблюдаться у пациентов любого возраста, включая детей. В группе риска находятся люди, страдающие такими заболеваниями, как:
- Сахарный диабет.
- Сердечно-сосудистые патологии (сбои сердечного ритма, ишемическая болезнь и т.д.).
- Гиперхолестеринемия (повышенный холестерин).
Также возможность сужения сосудов головного мозга повышают:
- Курение.
- Злоупотребление спиртным.
- Малоподвижный образ жизни.
- Частые стрессы и эмоциональные перенапряжения.
- Умственные перегрузки.
- Редкое пребывание на свежем воздухе – при недостатке кислорода может повыситься артериальное давление.
- Лишний вес.
- Генетическая предрасположенность к сердечно-сосудистым заболеваниям.
Симптомы сужения сосудов головного мозга

На начальных стадиях сужение проявляется следующими признаками:
- Снижением памяти (особенно часто в таких ситуациях люди забывают события, которые происходили с ними совсем недавно).
- Ухудшением обучаемости и трудоспособности.
- Головокружениями.
- Хронической усталостью.
- Потерей интереса к происходящему.
- Депрессивными состояниями.
- Перепадами настроения.
- Эмоциональной неустойчивостью.
- Проблемами с концентрацией внимания.
- Расстройствами сна: бессонницей, тревожным сном.
Если лечение провести на данном этапе, то нарушения можно устранить и восстановить качество жизни пациента.
При прогрессировании патологии наблюдаются:
- Нарушения речи.
- Шум в голове.
- Снижение слуха.
- Дрожание рук.
- Неловкость движений.
- Изменение походки.
Осложнения
Длительно суженные сосуды головного мозга способны стать причиной развития:
- Слабоумия.
- Геморрагического инсульта – проявляется разрывом сосуда с последующим кровоизлиянием в головной мозг.
- Ишемического инсульта – нарушения кровоснабжения отделов мозга из-за закупорки сосудов.
Диагностика

Диагностику сужения сосудов головного мозга осуществляет невролог. Для оценки состояния сосудов и кровотока в них назначаются:
- Ультразвуковая допплерография – позволяет изучить скорость кровотока и выявить сужения сосудов.
- Ангиография – дает возможность оценить состояние нервных стволов сосудов.
- Дуплексное сканирование – для определения состояния стенок сосудов, выявления сужений, атеросклеротических бляшек и тромбов.
- ЭКГ.
- Оценка состояния глазного дна – клетки глазного дна связаны с нейронами мозга, и сосудистые нарушения и изменение нервных клеток в области глазного дна могут говорить о патологиях головного мозга.
Лечение
Необходимо устранить причину сужения сосудов, так как если этого не сделать, патология будет прогрессировать. Проводится лечение гипертонической болезни, атеросклероза или шейного остеохондроза. При гипертонии назначают:
- Гипотензивные препараты (снижающие давление).
- Антиагреганты – медикаменты, предупреждающие возникновение тромбов.
- Витаминные комплексы с содержанием витаминов С, PP и B6.
- Диету с ограничением употребления соли.
Лечение атеросклероза подразумевает:
- Статины – снижающие уровень холестерина в крови.
- Диету с ограничением животных жиров.
При шейном остеохондрозе назначают:
- Ношение корсета для поддержания правильного положения спины и шеи.
- Болеутоляющие.
- Противовоспалительные препараты.
- Физиотерапевтические процедуры.
- Массаж.
- Лечебная физкультура.
Также проводится симптоматическая терапия. В зависимости от нарушений, вызванных сужением сосудов, могут быть назначены:
- Препараты, улучшающие обменные процессы в мозге – при потере памяти.
- Лекарства, укрепляющие сосуды – при головокружениях.
- Массаж и лечебная физкультура – при расстройствах двигательных функций.
- Антидепрессанты и успокоительные – при эмоциональных расстройствах и депрессии.
Для профилактики мультиинфарктных состояний мозга пациенты принимают антикоагулянты – препараты, снижающие свертываемость крови.
При нарушении кровотока более чем на 50% может быть назначено хирургическое лечение – стентирование. Это расширение с помощью стента – каркаса, который устанавливают в просвет сосуда. Операция позволяет расширить сосуд и восстановить в нем кровоток.
Профилактика сужения сосудов головного мозга
Полностью избежать вероятности сужения сосудов головного мозга достаточно сложно. Однако некоторые профилактические мероприятия позволят значительно снизить риск развития патологии. Необходимо:
- Пересмотреть рацион.
- Уделять внимание умеренным физическим нагрузкам, чтобы не допускать застойных процессов.
- Избавиться от лишнего веса, если он есть.
- Отказаться от вредных привычек.
- Стараться чаще бывать на свежем воздухе, организовывая активный досуг.
- Тренировать стрессоустойчивость.
Пересмотр рациона подразумевает:
- Включение в него максимально богатых полезными веществами продуктов: свежих овощей и фруктов, нежирного мяса, рыбы, зелени.
- Сокращение употребления вредной еды: копченостей, жирной, соленой пищи.
Профилактикой сужения сосудов головного мозга также является регулярное прохождение медицинских профилактических осмотров. Если это делать ежегодно, то изменения можно будет выявить на ранних стадиях, когда они достаточно легко корректируются.
Источник
Головной мозг кровоснабжается ветвями внутренних сонных и позвоночных артерий. Каждая внутренняя сонная артерия отдает переднюю и среднюю мозговые артерии, переднюю ворсинчатую артерию и заднюю соединительную артерию. Передняя мозговая артерия располагается на медиальной поверхности каждого полушария большого мозга, в борозде мозолистого тела, огибая его спереди и сверху (спереди назад). Ветви этой артерии кровоснабжают медиальную часть полушария большого мозга до теменно-затылочной борозды. В начальном своем отделе эта артерия соединяется с рядом лежащей аналогичной артерией при помощи передней соединительной артерии.
Ветви средней мозговой артерии, расположенной в латеральной борозде, кровоснабжают нижнюю и среднюю лобные извилины, большую часть теменной доли, верхнюю и среднюю височные извилины, островковую долю.
Передняя ворсинчатая артерия, разветвляясь, образует сосудистое сплетение бокового и III желудочков. Задняя соединительная артерия анастомозирует с задней мозговой и внутренней сонной артериями. Этот анастомоз иногда соединяет заднюю мозговую артерию не с внутренней сонной, а со средней мозговой артерией.
Правая и левая позвоночные артерии у заднего края моста соединяются и образуют непарную базилярную (основную) артерию, которая делится на задние мозговые артерии, а также отдает верхние мозжечковые артерии, передние нижние мозжечковые артерии, артерию лабиринта (ветвь внутреннего слухового прохода), артерии моста и средне мозговые артерии. К мозжечку направляются также ветви позвоночной артерии – задние нижние мозжечковые артерии. Задняя мозговая артерия с каждой стороны огибает ножку мозга и разветвляется в затылочной и височной долях (кроме верхней и средней извилин) полушарий большого мозга.
На основании головного мозга находится артериальный круг большого мозга, в образовании которого участвуют передние и задние мозговые артерии, передняя и задние соединительные артерии.
Ветви мозговых артерий кровоснабжают кору большого мозга и глубокие отделы мозга. Внутри мозга между артериальными ветвями имеются многочисленные анастомозы.
Вены головного мозга впадают в синусы твердой оболочки головного мозга. Различают поверхностные и глубокие мозговые вены. К поверхностным относятся верхние и нижние мозговые вены, поверхностная средняя вена и др. Они собирают кровь от большой части коры полушарий большого мозга.
К группе поверхностных верхних мозговых (восходящих) вен относятся вены, расположенные в предцентральной и постцентральной бороздах, а также предлобные, лобные, теменные и затылочные вены. Поднимаясь кверху по верхнелатеральной поверхности полушария большого мозга до его верхнего края, эти вены впадают в верхний сагиттальный синус твердой оболочки головного мозга. Притоками поверхностной средней мозговой вены, лежащей в латеральной борозде, являются вены прилежащих участков лобной, теменной, височной и островковой долей полушария большого мозга. Поверхностная средняя мозговая вена впадает в верхний каменистый или пещеристый синус твердой оболочки головного мозга. Группа поверхностных нижних мозговых (нисходящих) вен объединяет переднюю и заднюю височные и нижнюю затылочную вены. Все они впадают в поперечный или верхний каменистый синус.
Вены медиальной поверхности полушарий большого мозга впадают в верхний сагиттальный синус и в базальную вену, относящуюся к системе глубоких мозговых вен. В базальную вену, являющуюся притоком большой мозговой вены (галенова вена), вливаются мелкие вены передних и задних отделов поясной извилины и вен клина.
Характерной особенностью поверхностных мозговых вен является наличие большого количества анастомозов. Наиболее хорошо развиты нижняя и верхняя анастомотические вены. Первая из них соединяет вены центральной борозды и средней поверхностной мозговой вены с верхним сагиттальным синусом, вторая – среднюю поверхностную мозговую вену с поперечным синусом.
По глубоким венам кровь из сосудистых сплетений боковых и III желудочков мозга и от большей части подкорковых образований (ядер и белого вещества), а также гиппокампа и прозрачной перегородки оттекает во внутренние вены мозга. Правая и левая внутренние мозговые вены позади шишковидного тела сливаются друг с другом, образуя большую мозговую вену, впадающую в передний конец прямого синуса. В большую мозговую вену впадают также вены мозолистого тела, базальные вены, внутренние затылочные вены и верхняя срединная вена мозжечка.
Вены мозжечка чрезвычайно вариабельны, число их колеблется от 6 до 22. Вены верхней и нижней поверхностей мозжечка, боковых поверхностей ножек мозга, крыши среднего мозга и моста объединяются в вены клочка, которые впадают в верхний каменистый синус.
[1], [2], [3], [4], [5], [6]
Источник

Острый лимфобластный лейкоз – злокачественное заболевание, при котором неконтролируемо размножаются незрелые белые кровяные клетки (лимфобласты). Попадание таких клеток в центральную нервную систему отягощает прогноз течения болезни. Терапия в таких случаях затруднена из-за того, что большинство лекарств не могут преодолеть гемато-энцефалический барьер, защищающий мозг от вредных веществ и микроорганизмов. Однако лимфобластам как-то удается попасть в мозг, несмотря на наличие этого барьера. Ученые из Университета Дьюка (США) изучили на модельных мышах пути проникновения клеток острого лимфобластного лейкоза в центральную нервную систему и обеспечивающие его механизмы. Оказалось, что эти клетки проникают в мозг по кровеносным сосудам, но не с кровотоком, а мигрируя по их наружной поверхности. Ключевую роль в такой миграции играет взаимодействие интегрина лимфобластов с ламинином сосудов. Подавление экспрессии интегрина или нейтрализация его специфическими антителами блокирует миграцию клеток острого лимфобластного лейкоза в мозг и вызываемое ими поражение центральной нервной системы.
Злокачественные клетки острого лимфобластного лейкоза (англ. Acute lymphoblastic leukemia, ALL) склонны проникать в центральную нервную систему (ЦНС) и образовывать там метастазы. В отличие от метастазов солидных опухолей (развившихся не из клеток кроветворной системы, а из различных тканей организма) метастазы острого лимфобластного лейкоза редко проникают во внутренние отделы мозга, а локализуются на его оболочках. Проникновение клеток острого лимфобластного лейкоза в мозг сильно снижает эффективность противораковой терапии. А применяемые в таком случае химиотерапевтические средства и радиотерапия могут повредить мозг.
Оболочки мозга представляют собой структуру из четырех слоев. Дальше всего от мозга находится твердая оболочка состоит из соединительной ткани и выстилает внутреннюю часть черепа и спинномозгового канала. Сразу под ней расположена тонкая паутинная (арахноидальная) оболочка, снабженная небольшим количеством нервов и сосудов. Самая внутренняя – мягкая оболочка. Она сращена с мозгом, заходит в борозды и содержит большое количество кровеносных сосудов. Между мягкой и паутинной оболочкой находится подпаутинное (субарахноидальное) пространство, содержащее спинномозговую (цереброспинальную) жидкость, или ликвор, омывающую головной и спинной мозг. Она обеспечивает механическую защиту этих органов и поддерживает обменные процессы между центральной нервной системой и кровью. По составу ликвор похож на плазму крови, прошедшую через фильтр тонкой очистки, но, в отличие от плазмы крови, в ликворе почти нет белков (около 0,3% от белков плазмы), в норме нет красных кровяных клеток и совсем немного белых кровяных клеток.
Чтобы проникнуть в ЦНС, клетки острого лимфобластного лейкоза должны преодолеть гемато-энцефалический барьер (ГЭБ, см. картинку дня Гемато-энцефалический барьер) – физиологический барьер, который защищает нервную ткань и отделяет спинной и головной мозг от обслуживающих их кровеносных сосудов. Стенки этих сосудов ЦНС более плотные, чем в остальных органах и тканях, поэтому многие лекарства, микроорганизмы и даже собственные иммунные клетки сами по себе в мозг проникнуть не могут – только с помощью специального активного транспорта. Однако клеткам острого лимфобластного лейкоза как-то удается попасть в ЦНС – но как именно, оставалось загадкой.
Известно, что метастазы в тканях ЦНС могут образовываться при всех подтипах острого лимфобластного лейкоза. Значит, лимфобласты могут пользоваться каким-то общим консервативным механизмом для того, чтобы достичь мозговых оболочек. Ученые из Института онкологии при Университете Дьюка (Duke Cancer Institute) во главе с Дороти Сипкинс (Dorothy Sipkins) показали, каким может быть этот механизм.
Фермент фосфоинозитид-3-киназы (англ. Phosphoinositide 3-kinases, или PI3K) играет важную роль в передаче межклеточных сигналов, которые регулируют рост и выживание клеток. Его дельта-изоформа – PI3Kδ – присутствует на поверхности нейронов и иммунных клеток, и его ингибиторы (например, иделалисиб) успешно применяются для лечения некоторых форм лимфомы. О влиянии ингибиторов PI3K на острый лимфобластный лейкоз данных не было. Испытание одного из таких ингибиторов, химического соединения GS-649443, провели на мышах, которым предварительно ввели внутривенно линию клеток острого лимфобластного лейкоза человека – Nalm-6. У мышей с иммунодефицитом после инъекций развилась острая лейкемия, поражающая ЦНС.
Испытание показало, что применение этого вещества продлевало жизнь мышей, больных острым лимфобластным лейкозом, на 50% (рис. 2), а количество опытных животных с поражением ЦНС снижалось в 3-6 раз (рис. 3). Еще одним важным результатом этого эксперимента было то, что, хотя в контрольной и опытной группе практически не различалось влияние болезни на клетки крови, костный мозг и селезенку, у мышей, получавших GS-649443, было заметно меньше развитие острого лимфобластного лейкоза в центральной нервной системе.
Далее надо было определить функцию PI3Kδ в проникновении клеток острого лимфобластного лейкоза с периферии в центральную нервную систему. Было известно, что ферменты семейства PI3K играют важную роль в миграции клеток. Оставалось проверить, влияет ли PI3Kδ на подвижность клеток острого лимфобластного лейкоза. Подавление PI3Kδ веществом GS-649443 существенно снижало их подвижность как in vitro, так и in vivo. Подвижность клеток, обработанных GS-649443 (то есть с подавленной PI3Kδ), снижалась как in vitro, так и in vivo: у этих клеток снижалась активность легкой цепи миозина (см. Myosin light chain) – молекулярного мотора, преобразующего химическую энергию клетки в кинетическую.
С помощью метода интравитальной микроскопии (см. Intravital microscopy ученые проследили распределение клеток острого лимфобластного лейкоза в костном мозге, но не нашли никаких отличий между больными мышами, которым вводили плацебо (контрольная группа), и теми, кому вводили GS-649443 (опытная группа). Это означало, что лимфобласты не полностью утратили подвижность после ингибирования PI3Kδ, то есть миграция клеток в центральную нервную систему регулировалась каким-то другим механизмом.
Для определения молекул, участвующих в этом механизме, ученые провели анализ экспрессии генов, связанных (см. Фокальные контакты) с перемещением и прикреплением клеток к поверхности, в клетках спинномозговой жидкости и костного мозга опытных мышей. Результат оказался как раз таким, каким его ожидали: экспрессия этих генов была понижена. Но более всего ученых заинтересовал ген ITGA6, кодирующий белок интегрин альфа-6, поскольку он связан и с миграцией клеток, и с развитием центральной нервной системы. Они определили подвижность клеток острого лимфобластного лейкоза in vitro, сравнив их перемещения на специальных подложках – матрицах, моделирующих внеклеточный матрикс (сравнивали матрицы, состоящие только из коллагена, из коллагена и фибронектина и из коллагена и ламинина). Выяснилось, что во взаимодействии с PI3Kδ, интегрин альфа-6 контролирует миграцию клеток вдоль матрицы, образованной белками ламинином и коллагеном. В ЦНС ламинин локализован на наружной поверхности сосудов, на оболочках мозга и на поверхности сосудистого сплетения мозга.
Чтобы определить, проходят ли клетки острого лимфобластного лейкоза через стенки сосудов мягкой и паутинной оболочки, мышам ввели флуоресцентные клетки Nalm-6 и с помощью интравитальной микроскопии в реальном времени проследили распределение клеток Nalm-6 в сосудистой сети (рис. 4). Несмотря на то что в день инъекции клетки острого лимфобластного лейкоза циркулировали в сосудах мягкой и паутинной оболочек, клетки Nalm-6 не проходили через гематоэнцефалический барьер в течение всего времени наблюдения (см. видео в дополнительных материалах к статье). Зато клетки Nalm-6 быстро проникали через стенки сосудов костного мозга вскоре после внутривенной инъекции. Гистохимическое окрашивание отделов ткани головного мозга подтвердило, что клетки Nalm-6 отсутствовали в ткани мягкой и паутинной мозговых оболочек до поздних стадий заболевания.

Детальный иммуногистохимический анализ показал, что эти клетки проникают в мозговые оболочки очень необычным путем – не через кровеносные сосуды с кровотоком, а путем миграции по наружной поверхности сосудов, проходящих напрямую между костным мозгом позвоночника или черепа и подпаутинным пространством. Базальная мембрана этих сосудов насыщена ламинином, про который известно, что он координирует перемещения нейронных клеток-предшественников. GS-649443 подавлял эту миграцию. Аналогично действовали антитела к интегрину альфа-6, не влияя на прогрессию заболевания вне центральной нервной системы.
Результаты, полученные на мышах, соответствовали клиническим наблюдениям. У больных острым лимфобластным лейкозом частота инвазии лимфобластов в мозг положительно коррелировала с высоким уровнем экспрессии интегрина-альфа-6.
Блокирование проникновения раковых клеток в мозг представляется очень эффективным подходом с точки зрения клинической практики для лечения как острого лимфобластного лейкоза, так и ряда других форм онкологических заболеваний. В частности, другой ингибитор PI3Kδ, иделалисиб, уже успешно применяется для лечения ряда гематологических раков. Возможно, он откроет пути предотвращения миграции острого лимфобластного лейкоза или других раков в мозг.
Эта элегантная работа не только открывает новые перспективы исследований, но и ставит ряд вопросов. Пока неясно, полностью ли верны для человека результаты, полученные на модельных мышах, и могут ли клетки солидных (негематологических) раков использовать пути проникновения в мозг, свойственные для острого лимфобластного лейкоза. Ранее на модельных мышах было показано, что проникновению раковых клеток в мозг, в том числе при лейкозе, мешает подавление активности VEGF-A – фактора роста эндотелия сосудов (V. Münch et al., 2017. Central nervous system involvement in acute lymphoblastic leukemia is ted by vascular endothelial growth factor). При остром лимфобластном лейкозе уровень экспрессии VEGF-A повышен, и антитела к нему могут подавить миграцию злокачественных клеток в мозг.
Авторы обсуждаемой работы показали, что лечение мышей ингибитором PI3Kδ веществом GS-649443 существенно снижало экспрессию VGEF-A, но вопрос об участии этого белка в колонизации ЦНС клетками острого лимфобластного лейкоза пока остался без ответа. В отличие от солидных раков, формирование новых кровеносных сосудов в случае острого лимфобластного лейкоза, вероятно, не требуется. Возможно, VGEF-A производит какую-то модификацию кровеносных сосудов, способствующую проникновению лимфобластов в мозг.
Источники:
1) Hisayuki Yao, Trevor T. Price, Gaia Cantelli, Brandon Ngo, Matthew J. Warner, Lindsey Olivere, Sarah M. Ridge, Elizabeth M. Jablonski, Joseph Therrien, Stacey Tannheimer, Chad M. McCall, Anjen Chenn & Dorothy A. Sipkins. Leukaemia hijacks a neural mechanism to invade the central nervous system // Nature. 2018. V. 560. P. 55-60.
2) Frank Winkler. Leukaemia follows a blood-vessel track to enter the nervous system // Nature. 2018. V. 560. P. 35-36. (Популярный синопсис к обсуждаемой статье.)
Вячеслав Калинин
Источник
