Количество молей идеального газа в сосуде
Уравнение состояния идеального газа было открыто экспериментально. Оно носит название уравнения Клапейрона – Менделеева. Это уравнение устанавливает математическую зависимость между параметрами идеального газа, находящегося в одном состоянии. Математически его можно записать следующими способами:
Уравнение состояния идеального газаВнимание! При решении задач важно все единицы измерения переводить в СИ.
Пример №1. Кислород находится в сосуде вместимостью 0,4 м3 под давлением 8,3∙105 Па и при температуре 320 К. Чему равна масса кислорода? Молярная масса кислорода равна 0,032 кг/моль.
Из основного уравнения состояния идеального газа выразим массу:
Уравнение состояния идеального газа следует использовать, если газ переходит из одного состояния в другое и при этом изменяется его масса (количество вещества, число молекул) или молярная масса. В этом случае необходимо составить уравнение Клапейрона – Менделеева отдельно для каждого состояния. Решая систему уравнений, легко найти недостающий параметр.
Подсказки к задачам
| Давление возросло на 15% | p2 = 1,15p1 |
| Объем увеличился на 2% | V2 = 1,02V1 |
| Масса увеличилась в 3 раза | m2 = 3m1 |
| Газ нагрелся до 25 оС | T2 = 25 + 273 = 298 (К) |
| Температура уменьшилась на 15 К (15 оС) | T2 = T1 – 15 |
| Температура уменьшилась в 2 раза | |
| Масса уменьшилась на 20% | m2 = 0,8m1 |
| Выпущено 0,7 начальной массы | Важна только та масса, что осталась в сосуде. Поэтому: m2 = 0,3m1 |
| Какую массу следует удалить из баллона? | Нужно найти разность начальной и конечной массы: m1 – m2 |
| Газ потерял половину молекул | |
| Молекулы двухатомного газа (например, водорода), диссоциируют на атомы | |
| Озон (трехатомный кислород) при нагревании превращается в кислород (двухатомный газ) | M (O3) = 3Ar (O)∙10-3 кг/моль M (O2) = 2Ar (O)∙10-3 кг/моль |
| Открытый сосуд | Объем V и атмосферное давление pатм остаются постоянными |
| Закрытый сосуд | Масса m, молярная масса M, количество вещества ν, объем V, число N и концентрация n частиц, плотность ρ- постоянные величины |
| Нормальные условия | Температура T0 = 273 К Давление p0 = 105 Па |
| Единицы измерения давления | 1 атм = 105 Па |
Пример №2. В баллоне содержится газ под давлением 2,8 МПа при температуре 280 К. Удалив половину молекул, баллон перенесли в помещение с другой температурой. Определите конечную температуру газа, если давление уменьшилось до 1,5 МПа.
2,8 МПа = 2,8∙106 Па
1,5 МПа = 1,5∙106 Па
Так как половина молекул была выпущена, m2 = 0,5m1. Объем остается постоянным, как и молярная масса. Учитывая это, запишем уравнение состояния идеального газа для начального и конечного случая:
Преобразим уравнения и получим:
Приравняем правые части и выразим искомую величину:
Задание EF19012 На графике представлена зависимость объёма постоянного количества молей одноатомного идеального газа от средней кинетической энергии теплового движения молекул газа. Опишите, как изменяются температура и давление газа в процессах 1−2 и 2−3. Укажите, какие закономерности Вы использовали для объяснения.
Алгоритм решения
1.Указать, в каких координатах построен график.
2.На основании основного уравнения МКТ идеального газа и уравнения Менделеева – Клапейрона выяснить, как меняются указанные физические величины во время процессов 1-2 и 2-3.
Решение
График построен в координатах (V;Ek). Процесс 1-2 представляет собой прямую линию, исходящую из начала координат. Это значит, что при увеличении объема растет средняя кинетическая энергия молекул. Но из основного уравнения МКТ идеального газа следует, что мерой кинетической энергии молекул является температура:
T=2−Ek3
Следовательно, когда кинетическая энергия молекул растет, температура тоже растет.
Запишем уравнение Менделеева – Клапейрона:
pV=νRT
Так как количество вещества одинаковое для обоих состояния 1 и 2, запишем:
νR=p1V1T1=p2V2T2
Мы уже выяснили, что объем и температура увеличиваются пропорционально. Следовательно, давление в состояниях 1 и 2 равны. Поэтому процесс 1-2 является изобарным, давление во время него не меняется.
Процесс 2-3 имеет график в виде прямой линии, перпендикулярной кинетической энергии. Так как температуры прямо пропорциональна кинетической энергии, она остается постоянной вместе с этой энергией. Следовательно, процесс 2-3 является изотермическим, температура во время него не меняется. Мы видим, что объем при этом процессе уменьшается. Но так как объем и давление – обратно пропорциональные величины, то давление на участке 2-3 увеличивается.
Ответ:
• Участок 1-2 – изобарный процесс. Температура увеличивается, давление постоянно.
• Участок 2-3 – изотермический процесс. Температура постоянно, давление увеличивается.
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF22473
На высоте 200 км давление воздуха составляет примерно 10-9 от нормального атмосферного давления, а температура воздуха Т – примерно 1200 К. Оцените плотность воздуха на этой высоте.
Ответ:
а) 8,31⋅ 10-11 кг/м3
б) 1,38⋅ 10-9 кг/м3
в) 3⋅ 10-10 кг/м3
г)29⋅ 10-8 кг/м3
Алгоритм решения
1.Записать исходные данные.
2.Записать уравнение Менделеева – Клапейрона.
3.Выразить из уравнения плотность.
4.Подставить известные данные и сделать вычисления.
Решение
Запишем исходные данные:
• Давление воздуха на высоте 200 км: p = 10-9∙105 Па. Или p = 10-4 Па.
• Температура воздуха на этой же высоте: T = 1200 К.
Запишем уравнение Менделеева – Клапейрона:
pV=mMRT
Плотность определяется формулой:
ρ=mV
Следовательно, масса равна произведению плотности на объем. Перепишем уравнение состояния идеального газа, учитывая, что объем сократится слева и справа:
p=ρMRT
Молярная масса воздуха – табличная величина, равная 28,97 г/моль. Переведем в СИ и получим 28,97∙10-3 кг/моль.
Выразим и вычислим плотность:
Ответ: в
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF22749 Одноатомный идеальный газ в количестве ν моль помещают в открытый сверху сосуд под лёгкий подвижный поршень и начинают нагревать. Начальный объём газа V0, давление p0. Масса газа в сосуде остаётся неизменной. Трением между поршнем и стенками сосуда пренебречь. R- универсальная газовая постоянная.
Установите соответствие между физическими величинами, характеризующими газ, и формулами, выражающими их зависимость от абсолютной температуры T газа в условиях данной задачи.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
Алгоритм решения
1.Записать уравнение состояния идеального газа и выразить из него объем. Выбрать из таблицы соответствующий номер формулы.
2.Определить, от чего зависит внутренняя энергия идеального газа.
3.Записать основное уравнение МКТ и выразить внутреннюю энергию идеального газа. Выбрать из таблицы соответствующий номер формулы.
Решение
Уравнение состояния идеального газа имеет вид:
pV=mMRT
Учтем, что отношение массы к молярной массе есть количество вещества.Отсюда объем равен:
V=νRTp
Следовательно, первой цифрой ответа будет «1».
Внутренняя энергия идеального газа равна сумме кинетических энергий всех молекул этого газа:
E=N−Ek
Запишем основное уравнение МКТ:
p=nkT
Отсюда температура газа равна:
T=pnk
Но температура прямо пропорциональна средней кинетической энергии молекул газа:
T=2−Ek3k
Следовательно:
pnk=2−Ek3k
−Ek=3p2n
E=N−Ek=N3p2n
Но концентрация определяется отношением количества молекул к объему. Следовательно:
E=N3pV2N=3pV2
А произведение давления на объем можно выразить через уравнение Менделеева – Клапейрона. Следовательно:
E=32νRT
Вторая цифра ответа будет «3».
Ответ: 13
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF22795 На рисунке показан график зависимости давления газа в запаянном сосуде от его температуры. Объём сосуда равен 0,25 м3. Какое приблизительно количество газообразного вещества содержится в этом сосуде? Ответ округлите до целых.
Алгоритм решения
1.Записать исходные данные.
2.Выбрать любую точку графика и извлечь из нее дополнительные данные.
3.Записать уравнение состояния идеального газа.
4.Выполнить решение задачи в общем виде.
5.Подставить известные данные и вычислить искомую величину.
Решение
Запишем исходные данные. Объем сосуда равен: V = 0,25 м3. На графике выберем точку, соответствующую температуре T = 300 К. Ей соответствует давление p = 2∙104 Па.
Запишем уравнение состояния идеального газа:
pV=νRT
Отсюда количества вещества равно:
ν=pVRT=2·104·0,258,31·300≈2 (моль)
Ответ: 2
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF17664
Зависимость объёма идеального газа от температуры показана на VТ-диаграмме (см. рисунок). В какой из точек давление газа максимально? Масса газа постоянна.
Ответ:
A
B
C
D
Алгоритм решения
1.Записать уравнение состояния идеального газа.
2.Установить, как зависит давление от объема и температуры газа.
3.На основании графика, отображающего изменение температуры и объема газа, установить, в какой точке давление газа максимально.
Решение
Запишем уравнение состояния идеального газа:
pV=νRT
Отсюда видно, что давление прямо пропорционально температуре. Это значит, что с ростом температуры давление увеличивается.
Также видно, что давление обратно пропорционально объему. Следовательно, давление увеличивается с уменьшением объема.
Отсюда следует, что давление будет максимальным в той точке, в которой температура максимальна, а объем минимален. Такой точкой является точка D.
Ответ: D
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF18093
В камере, заполненной азотом, при температуре
К находится открытый цилиндрический сосуд (см. рис. 1). Высота сосуда см. Сосуд плотно закрывают цилиндрической пробкой и охлаждают до температуры К. В результате расстояние от дна сосуда до низа пробки становится равным h (см. рис. 2). Затем сосуд нагревают до первоначальной температуры T0. Расстояние от дна сосуда до низа пробки при этой температуре становится равным см (см. рис. 3). Чему равно h? Величину силы трения между пробкой и стенками сосуда считать одинаковой при движении пробки вниз и вверх. Массой пробки пренебречь.
Алгоритм решения
1.Записать исходные данные и перевести единицы измерения физических величин в СИ.
2.Записать уравнение Менделеева – Клапейрона и применить его ко всем состояниям газа.
3.Определить условие равновесия пробки.
4.Выполнить решение задачи в общем виде.
5.Вычислить искомую величину.
Решение
Запишем исходные данные:
• Начальная температура азота: T0 = 300 К.
• Высота сосуда: L = 50 см.
• Температура азота после охлаждения: T1 = 240 К.
• Высота столба азота после нагревания: H = 46 см.
50 см = 0,5 м
46 см = 0,46 м
Запишем уравнение Менделеева – Клапейрона:
pV=νRT
Так как количество азота не меняется, можем принять, что:
pVT=const
Применим уравнение Менделеева – Клапейрона для всех трех состояний азота. Учтем, что
p0V0T0=p1V1T1=p2V2T2
Пусть S – площадь поперечного сечения сосуда. Тогда объемы столба азота для каждого из состояний будут равны:
V0=SL
V1=Sh
V2=SH
Известно, что в состоянии 3 температура азота поднимается до первоначальной. Поэтому уравнение Менделеева – Клапейрона примет вид:
p0SLT0=p1ShT1=p2SHT0
p0LT0=p1hT1=p2HT0
Неизвестными остались только давления. Их можно определить, записав условие равновесия пробки.
В состоянии 1 сила давления азота на пробку определяется формулой:
p0S=pатмS
В состоянии 2 на пробку действует сила давления со стороны азота и атмосферного давления, я а также сила трения, направленная вверх. Следовательно:
p1S=pатмS−Fтр=p0S−Fтр
В состоянии 3 на пробку действуют те же силы, но сила трения теперь действует не вверх, а вниз. Поэтому:
p2S=pатмS+Fтр=p0S+Fтр
Выразим из этих уравнений силу трения:
Fтр=p0S−p1S
Fтр=p2S−p0S
Приравняем правые части и получим:
p0S−p1S=p2S−p0S
Отсюда:
p0−p1=p2−p0
2p0=p2+p1
p0=p2+p12
Подставим это значение в уравнение Менделеева – Клапейрона и получим:
p2+p12LT0=p1hT1=p2HT0
Отсюда:
p2+p12L=p2H
p2L+p1L=2p2H
p1L=2p2H−p2L=p2(2H−L)
p1=p2(2H−L)L
Отсюда:
p2(2H−L)LhT1=p2HT0
Давление слева и справа взаимоуничтожается. Остается:
T0(2H−L)Lh=HT1
Отсюда выразим h:
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF18873 В сосуде неизменного объёма при комнатной температуре находилась смесь неона и аргона, по 1 моль каждого. Половину содержимого сосуда выпустили, а затем добавили в сосуд 1 моль аргона. Как изменились в результате парциальное давление неона и давление смеси газов, если температура газов в сосуде поддерживалась неизменной?
Для каждой величины определите соответствующий характер изменения:
- увеличилась
- уменьшилась
- не изменилась
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Алгоритм решения
1.Записать исходные данные.
2.Установить характер изменения парциального давления неона.
3.Применить закон Менделеева – Клапейрона, чтобы установить характер изменения общего давления смеси газов.
Решение
Исходные данные:
• Количество неона: ν1 = 1 моль.
• Количество аргона: ν2 = 1 моль.
• Количество впущенного аргона: ν4 = 1 моль.
Сначала парциальное давление неона и аргона равно. Это объясняется тем, что давление газов при неизменном количестве вещества зависит только от объема и температуры. Эти величины постоянны.
Когда из сосуда выпустили половину газовой смеси, в нем оказалось по половине моля каждого из газов. Затем в сосуд впустили 1 моль аргона. Следовательно, в сосуде стало содержаться 0,5 моль неона и 1,5 моль аргона. Запишем уравнение Менделеева – Клапейрона:
pV=νRT
Из уравнения видно, что давление и количество вещества – прямо пропорциональные величины. Следовательно, если количество неона уменьшилось, то его парциальное давление тоже уменьшилось.
Общая сумма количества вещества равна сумме количеств вещества 1 (неона) и 2 (аргона): 0,5 + 1,5 = 2 (моль). Изначально в сосуде тоже содержалось 2 моль газа. Так как количество вещества, температура и объем сохранились, давление тоже осталось неизменным.
Ответ: 23
pазбирался: Алиса Никитина | обсудить разбор | оценить
Алиса Никитина | ???? Скачать PDF | Просмотров: 1.1k | Оценить:
Источник
2011 год 109 вариант СЗ
В сосуде лежит кусок льда. Температура льда t1 = 0°С. Если сообщить ему количество теплоты Q = 50 кДж, то 3/4 льда растает. Какое количество теплоты q надо после этого сообщить содержимому сосуда дополнительно, чтобы весь лёд растаял и образовавшаяся вода нагрелась до температуры t2 = 20°С? Тепловыми потерями на нагрев сосуда пренебречь. (Решение)
2011 год. 01-2 вариант. С3
В бутылке объемом V = 1 л находится гелий при нормальном атмосферном давлении. Горлышко бутылки площадью S = 2 см2 заткнуто короткой пробкой, имеющей массу m = 20 г. Если бутылка лежит горизонтально, то для того, чтобы медленно вытащить из ее горлышка пробку, нужно приложить к пробке горизонтально направленную силу F = 1 Н. Бутылку поставили на стол вертикально горлышком вверх. Какое количество теплоты нужно сообщить гелию в бутылке для того, чтобы он выдавил пробку из горлышка? (Решение)
2011 год. 01-1 вариант. С3
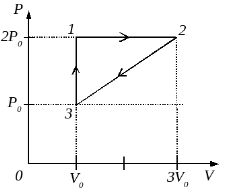
Один моль идеального одноатомного газа переводят из состояния 1 с температурой Т1 = 300 К в состояние 2 таким образом, что в течение всего процесса давление газа возрастает прямо пропорционально его объему. В ходе этого процесса газ получает количество теплоты Q = 14958 Дж. Во сколько раз n уменьшается в результате этого процесса плотность газа? (Решение)
 2010 год. 11 вариант. С1
2010 год. 11 вариант. С1
В кабинете физики проводились опыты с разреженным газом постоянной массы. По невнимательности ученик, отметив на графике начальное и конечное состояния газа (см. рисунок), не указал, какие две величины из трёх (давление р, объём V, температура Т) отложены по осям. В журнале осталась запись, согласно которой названные величины изменялись следующим образом: p1 < р2, V1 > V2, Τ1 < Ί2. Пользуясь этими данными, определите, какие величины были отложены на горизонтальной и вертикальной осях. Ответ поясните, указав, какие физические закономерности вы использовали. (Решение)
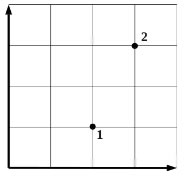
 2010 год 304 вариант СЗ
2010 год 304 вариант СЗ
Некоторое количество одноатомного идеального газа расширяется из одного и того же начального состояния (p1, V1) до одного и того же конечного объёма V2 первый раз по изобаре, а второй – по адиабате (см. рисунок). Отношение количества теплоты Q12, полученного газом на изобаре от нагревателя, к модулю изменения внутренней энергии газа |U3 – U1| на адиабате k = Q12/|U3 – U1| = 6 . Чему равно отношение х работы газа на изобаре А12 к работе газа на адиабате А13? (Решение)
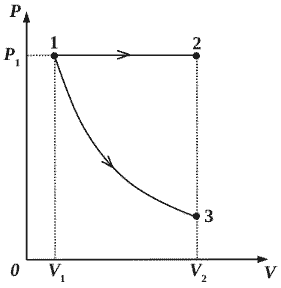
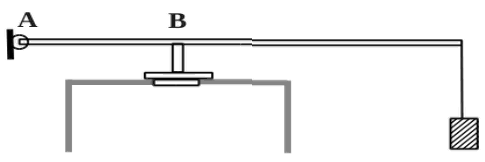 2010 год. 135 вариант. С5
2010 год. 135 вариант. С5
В цилиндр закачивается воздух со скоростью 0,002 кг/с. В верхнем торце цилиндра есть отверстие площадью 5·10-4 м2, закрытое предохранительным клапаном. Клапан удерживается в закрытом состоянии невесомым стержнем длиной 0,5 м, который может свободно поворачиваться вокруг оси в точке А (см. рисунок). Расстояние АВ равно 0,1 м. К свободному концу стержня подвешен груз массой 2 кг. Клапан открывается через 580 с работы насоса, если в начальный момент времени давление воздуха в цилиндре было равно атмосферному. Температура воздуха в цилиндре и снаружи не меняется и равна 300 К. Определите объём цилиндра. (Решение)
2009 год. 133 вариант. С1
В цилиндрическом сосуде под поршнем длительное время находятся вода и ее пар. Поршень начинают вдвигать в сосуд. При этом температура воды и пара остается неизменной. Как будет меняться при этом масса жидкости в сосуде? Ответ поясните. (Решение)
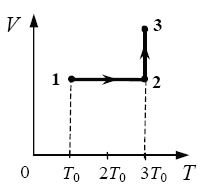 2009 год. 133 вариант. С3
2009 год. 133 вариант. С3
Один моль одноатомного идеального газа переходит из состояния 1 в состояние 3 в соответствии с графиком зависимости его объёма V от температуры T (T0 = 100 К). На участке 2 − 3 к газу подводят 2,5 кДж теплоты. Найдите отношение работы газа А123 ко всему количеству подведенной к газу теплоты Q123. (Решение)
 2009 год. 304 вариант. С3
2009 год. 304 вариант. С3
Постоянная масса одноатомного идеального газа совершает циклический процесс, показанный на рисунке. За цикл от нагревателя газ получает количество теплоты QH = 8 кДж. Какую работу совершают внешние силы при переходе газа из состояния 2 в состояние 3? (Решение)  2008 год. 131 вариант. С2
2008 год. 131 вариант. С2
Разогретый сосуд прикрыли поршнем, который с помощью вертикальной нерастяжимой нити соединили с потолком. На сколько процентов от начальной понизится температура воздуха в сосуде к моменту, когда сосуд оторвется от поверхности, на которой он расположен? Масса сосуда 5 кг. Поршень может скользить по стенкам сосуда без трения. Площадь дна сосуда 125 см2. Атмосферное давление 105 Па. Тепловым расширением сосуда и поршня пренебречь. (Решение)
2008 год. 5941 вариант. С2
В калориметре находился m1 = 1 кг льда при температуре t1 = -5°С. После добавления в калориметр m2 = 25 г воды в нем установилось тепловое равновесие при температуре t = 0°С. Какова температура t2 добавленной в калориметр воды, если в калориметре оказался в итоге только лёд? Теплоёмкостью калориметра пренебречь. (Решение)
2008 год. 05205939 вариант. С2
В горизонтально расположенной трубке постоянного сечения, запаянной с одного конца, помещен столбик ртути длиной 15 см, который отделяет воздух в трубке от атмосферы. Трубку расположили вертикально запаянным концом вниз. На сколько градусов следует нагреть воздух в трубке, чтобы объём, занимаемый воздухом, стал прежним? Температура воздуха в лаборатории 300 К, а атмосферное давление составляет 750 мм рт.ст. (Решение)
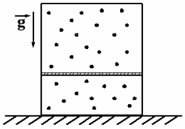 2008 год. 2 вариант. С2
2008 год. 2 вариант. С2
Вертикально расположенный замкнутый цилиндрический сосуд высотой 50 см разделен подвижным поршнем весом 110 Н на две части, в каждой из которых содержится одинаковое количество водорода при температуре 361 К. Какая масса газа находится в каждой части цилиндра, если поршень находится на высоте 20 см от дна сосуда? Толщиной поршня пренебречь. (Решение)
2007 год. 19 вариант. С2
В сосуде находится одноатомный идеальный газ, масса которого 12 г, а молярная масса 0,004 кг/моль. Вначале давление в сосуде было равно 4•105 Па при температуре 400 К. После охлаждения газа давление понизилось до 2•105 Па. Какое количество теплоты отдал газ? (Решение)
2006 год. 61 вариант. С2
В водонепроницаемый мешок, лежащий на дне моря на глубине 73,1 м, закачивается сверху воздух. Вода вытесняется из мешка через нижнее отверстие, и когда объём воздуха в мешке достигает 28,0 м3- мешок всплывает вместе с прикреплённым к нему грузом. Масса оболочки мешка 2710 кг. Определите массу груза. Температура воды равна 7°С, атмосферное давление на уровне моря равно 105 Па. Объёмом груза и стенок мешка пренебречь. (Решение)
2006 год. 86 вариант. С2
Теплоизолированный сосуд объемом V = 2 м3 разделен теплоизолирующей перегородкой на две равные части. В одной части сосуда находится 2 моль гелия, а в другой – такое же количество молей аргона. Начальная температура гелия равна 300 К, а температура аргона 600 К. Определите давление смеси после удаления перегородки. Теплоемкостью сосуда пренебречь. (Решение)
2006 год. 33 вариант. С2
Воздушный шар объемом 2500 м3 с массой оболочки 400 кг имеет внизу отверстие, через которое воздух в шаре нагревается горелкой. Температура окружающего воздуха 7°С, его плотность 1,2 кг/м3. При какой минимальной разности температур воздуха внутри шара и снаружи шар взлетит вместе с грузом (корзиной и воздухоплавателем) массой 200 кг? Оболочку шара считать нерастяжимой. (Решение)
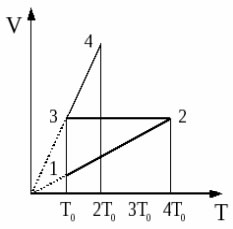 2006 год. 222 вариант. С2
2006 год. 222 вариант. С2
С одним молем идеального одноатомного газа совершают процесс 1-2-3-4, показанный на рисунке в координатах V-Т. Во сколько раз количество теплоты, полученное газом в процессе 1-2-3-4, больше работы газа в этом процессе? (Решение)
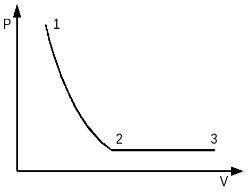 2005 год. 58 вариант. С2
2005 год. 58 вариант. С2
Идеальный одноатомный газ в количестве 1 моль сначала изотермически расширился при температуре T1 = 300 К. Затем газ изобарно нагрели, повысив температуру в 3 раза. Какое количество теплоты получил газ на участке 2-3? (Решение)
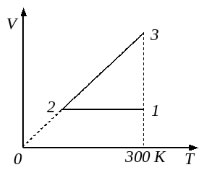 2004 год. 92 вариант. С2
2004 год. 92 вариант. С2
10 моль одноатомного идеального газа сначала охладили, уменьшив давление в 3 раза, а затем нагрели до первоначальной температуры 300 К (см. рисунок). Какое количество теплоты получил газ на участке 2-3? (Решение)
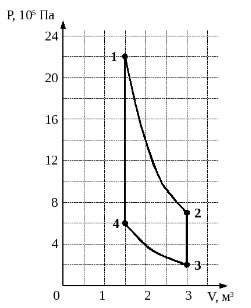 2004 год. 77 вариант. С5
2004 год. 77 вариант. С5
Идеальный одноатомный газ используется в качестве рабочего тела в тепловом двигателе. В ходе работы двигателя состояние газа изменяется в соответствии с циклом, состоящим из двух адиабат и двух изохор (см. рисунок). Вычислите КПД такого двигателя. (Решение)
2004 год. 49 вариант. С5
При электролизе воды образуется кислород О2 и водород Н2. Газы отводят в сосуд объёмом 100 л, поддерживая в нём температуру 300 К. Чему равна масса воды, которая разложилась в результате электролиза, чтобы суммарное давление в сосуде достигло 0,1 атм? Считать, что ничего не взрывается. (Решение)
2004 год. 35 вариант. С5
Смесь одинаковых масс гелия, водорода и азота помещена в сосуд и нагрета до температуры 350 К. Плотность смеси оказалась равной 50 г/м3. Чему равно давление в сосуде? (Решение)
Источник
