Мальформация сосудов головного мозга лечение эмболизация
Алгоритм лечения артерио-венозной мальформации головного мозга – Европейские рекомендации
I. Хирургическое лечение артерио-венозной мальформации (АВМ) головного мозга. Хотя существуют различные виды современной терапии при церебральных артерио-венозных мальформаций (АВМ), хирургическое лечение является наиболее известным вариантом и относится к первому выбору при наличии такой возможности. С развитием микрохирургических методов показатели эффективности полного удаления заметно улучшились.
Принятие решений при церебральных артерио-венозных мальформаций (АВМ) является одним из наиболее сложных аспектов нейрохирургической практики. Решение, следует ли рекомендовать операцию, должно быть основано на объективном сравнении долгосрочных рисков неоперированной артерио-венозной мальформации (АВМ) с риском оперативного лечения.
У молодых пациентов, особенно при наличии неврологических симптомов, попытки хирургического удаления связаны с хирургическим риском, хотя и высоким, но по-прежнему меньшим, чем при естественном течении. У пациентов средних лет и пожилых пациентов с минимальной симптоматикой консервативный подход кажется более разумным, так как риск лечения может быть не меньше, чем при естественном течении.
Наиболее популярная система для оценки риска операции — пятибалльная шкала, разработанная Spetzler и Martin. Она включает в себя три переменные:
• Размер артерио-венозной мальформации (АВМ)
• Характер венозного оттока
• Локализацию артерио-венозной мальформации (АВМ) (функционально значимая зона или нет).
Тип I — малые размеры, поверхностные и расположенные в функционально незначимой зоне мозга, в то время как тип поражения V — это большие, глубокие АВМ в функционально значимой зоне мозга. Размер и структуру венозного оттока из АВМ как хирургические факторы риска оценить довольно несложно, но гораздо сложнее определиться в отношении функционально значимых зон мозга. Повреждение извилин и перемещение функций в связи с реорганизацией коры у пациентов с АВМ может затруднять выявление функционально значимых зон.
Перед операцией полезно проведение функциональной МРТ или ПЭТ для определения функциональных областей мозга и для получения информации о местонахождении зон речи, сенсорной и зрительной коры. Во время операции, выявлению и сохранению важных областей мозговой ткани могут способствовать электрофизиологический мониторинг, системы картирования и корковой нейронавигации.
При хирургическом вмешательстве в принципе допустимы мелкие и средние повреждения конвекситальной поверхности мозга вне критических областей. По сравнению с радиохирургией или наблюдением только хирургическое иссечение является рентабельным и очень эффективным способом улучшения качества и продлении жизни.
По нашему опыту, примерно треть пациентов с АВМ может быть направлена только на хирургическое лечение, а в остальных случаях необходимы эмболизация и/или радиохирургия до, после или вместо хирургического вмешательства.
Лечение при больших АВМ, расположенных в критически важных областях с подкорковыми клинообразными расширениями, достигающими стенок бокового желудочка, представляет собой сложную задачу. Глубокая их часть обычно снабжается из хориоидальных артерий или мелких сосудов, обычно питающих базальные ганглии, внутреннюю капсулу и таламус. Кровотечение из этих сосудов во время операции может привести к гематоцефалии.
Кроме того, трудности контроля глубоких сосудов, таких как лентикулостриарные артерии, при использовании транскортикального или трансвентрикулярного подхода увеличивают риск хирургических осложнений. В этих случаях полезно проведение эндоваскулярной эмболизации до операции.
При больших высокопотоковых артерио-венозных мальформаций (АВМ) обычно требуется предоперационная эмболизация, а некоторые авторы рекомендуют несколько этапов резекции. Поэтапное лечение при больших АВМ может свести к минимуму риски синдрома гиперперфузии и кровоизлияния в мозг после хирургического лечения.
II. Эндоваскулярное лечение артерио-венозной мальформации (АВМ). Альтернативой хирургической резекции артерио-венозной мальформации (АВМ) является эндоваскулярная эмболизация. Принцип эмболизации заключается в окклюзии тела АВМ либо частицами, либо жидким веществом, которое быстро затвердевает при попадании в кровеносный сосуд. Так как частицы не приводят к достаточно надежной окклюзии, в настоящее время используют эмболизаты на основе NBCA (N-бутил-цианакрилат) и ONYX®. Оба агента в настоящее время достаточно изучены для оценки результатов после долгосрочного наблюдения.
Эмболизация обычно проводится под общим наркозом. После пункции бедренной артерии, катетер проводится в сонную артерию по методике Сельдингера. С помощью микрокатетера выполняется суперселективная катетеризация питающих сосудов АВМ, что позволяет получить точное изображение тела АВМ и выявить возможные факторы риска, такие как интранидальные аневризмы. Так как большинство артериальных афферентов не только питают очаг, но и снабжают нормальные ткани мозга (так называемые «транзитные» артерии), устанавливают кончик микрокатетера в положении, из которого снабжается только тело АВМ. В этом положении эмболизационный агент высвобождается и продвигается в тело.
Как правило, для достижения благоприятного результата необходимо проведение нескольких этапов эмболизации.
Хотя метод эндоваскулярной эмболизации достаточно изящен и привлекателен для пациента отказом от краниотомии, к его недостаткам относится возможность излечения лишь в 15% случаев, а неоднократная эмболизация ведет к кумуляции осложнений. Поэтому, эмболизация обычно применяется в составе комбинированной терапии вместе с хирургией или радиохирургией при АВМ степени 3 или выше по Spetzler. Эмболизация служит, например для того, чтобы уменьшить размеры патологического очага и, следовательно, улучшить результаты радиохирургического лечения, или эмболизировать глубокие сосуды, которые трудно контролировать при хирургической резекции АВМ.
В качестве заключения следует сказать, что, эндоваскулярная эмболизация является устоявшимся методом в лечении АВМ. Возможные риски следует соотнести с потенциальным эффектом в каждом конкретном случае. Таким образом, она заняла свое место, в основном, в комбинированном лечении.
III. Стереотаксическая радиохирургия в лечении артерио-венозной мальформации (АВМ):
а) Определение. Однофракционное высокофокусированное стереотаксически направленное излучение малого объема, применяемое для облучения внутричерепных объектов.
б) Синонимы. Радиохирургия, SRS, STRS, хирургия гамма-ножом.
в) История развития:
– 1951 г.: понятие введено Lars Leksell (1907-1986)
– Первое лечение было проведено в 1950 г. с применением рентгеновской трубки и стереотаксической дуги
– 1954 г.: в лаборатории Lawrence и Berkeley разработан перекрестный пучок протонов
– 1968 г.: проведено лечение гамма-ножом
– 1985 г.: Colombo разработал модифицированный линейный ускоритель
– 2000 г.: для гамма-ножа была разработана автоматическая система позиционирования (APS).

г) Принципы радиохирургии. Лечение обычно проводится под местной анестезией, у всех пациентов, кроме детей и лиц, страдающих клаустрофобией. Принцип действий:
• Формирование контуров патологического очага
• Планирование дозы
• Доставка дозы.
1. Формирование контуров патологического очага. Прежде всего, вокруг головы с помощью стереотаксической рамы устанавливается набор стандартных ориентиров или «нормирующих систем».
Контуры патологического очага формируются при помощи цифровой субтракционной ангиографии (DSA), дополненной МРТ и/или КТ в аксиальной проекции. В редких случаях, аксиальных изображений может быть достаточно. Затем вычерчивают контур мишени.
2. Планирование дозы. Цель заключается в максимально точном соответствии дозы лучистой энергии контурам очага поражения. Включение смежных нормальных тканей может привести к побочным эффектам и осложнениям, в то время как эффективность облучения патологического очага снижается. Помимо соответствия форме, внимание уделяется тому, чтобы избежать прохождения пучков излучения через важные структуры, прилегающие к очагу поражения или даже на расстоянии (например, хрусталик глаза). Это достигается путем подключения нескольких источников излучения в гамма-нож или выбором лечения при помощи линейного ускорителя.
3. Доставка дозы. Существуют две основные технологии для доставки дозы: гамма-нож и линейный ускоритель. С точки зрения количества пациентов и публикаций, гамма-нож доминирует над ускорителем и, следовательно, считается «золотым стандартом».
– Гамма-нож. Концентрический массив из 201 источника кобальт-60 обеспечивает выход гамма-лучей, сфокусированных на цели. Комбинация стационарных источников и коллиматоров позволяет достичь точности в 0,1 мм.
– Линейный ускоритель. Существует несколько методов лечения с помощью линейного ускорителя (LINAC — «linear accelerator»). Может быть использована модифицированная LINAC лучевая терапия с вторичной системой коллиматоров или выделенная LINAC лучевая терапия. Наиболее часто применяется многоуровневая однофокусная некомпланарная дуга и методы конформного блока. При первой технике источник излучения перемещается вдоль нескольких дуг, а вторая основана на высоковольтном трансформаторе, создающим высокое переменное напряжение, после чего пучок проходит в нужной фазе вблизи максимума электрического поля.
Коллиматор состоит из ряда индивидуально моторизованных листов вольфрама, которые устанавливаются автоматически и создают любую форму пучка. При технике модуляции интенсивности доза радиации различной интенсивности доставляется по периметру всего очага поражения. Коллиматор динамически открывается и закрывается под управлением компьютера для выбора экспозиции или частей мишени. Эта технология пока находится на раннем этапе развития, в стадии клинической оценки.
4. Лечение артерио-венозной мальформации (АВМ). Целью является тело АВМ. Тело определяется как сеть слабо дифференцированных и незрелых сосудов, в которой сходятся питающие артерии и выходят переполненные вены.
Механизмы действия:
– Преобладающий фактор: пролиферация эндотелиальных клеток и гиалинизация стенок сосудов.
– Вторичный фактор: развитие миофибробластов адвентициальной оболочки.
5. Критерии отбора пациентов. Лечение артерио-венозной мальформации (АВМ) является мультидисциплинарным. Критерии отбора представлены в таблице ниже.

6. Подходящие артерио-венозные мальформации (АВМ). Большинство артерио-венозных мальформаций (АВМ) поддается терапии. В идеальном случае АВМ небольших размеров (<3 см), компактная и глубоко расположена в функционально значимой зоне. Особенности непригодной АВМ:
• Фистулезное строение (эндоваскулярное лечение, как правило, достаточно).
• Множественные узлы (часто неизлечимы независимо от метода лечения).
• Расположенные вокруг функционально важной структуры, например, вокруг зрительного нерва при синдроме Wyburn-Mason.
• Большинство дуральных АВМ (большой объем, плоская форма и нет истинного узла).
• Диаметр >4 см.
7. Результаты. Результат зависит от размера очага и дозы. При небольших (<2 см) артерио-венозных мальформациях (АВМ) излечение наступает у 85-95% пациентов.
8. Осложнения лечения артерио-венозной мальформации (АВМ):
– Отек, выявляемый на МРТ. В среднем развивается через 11 месяцев примерно у 2,5% больных
– Очаговый неврологический дефицит (парезы, поле зрения, учащение судорог у 2-8%).
– Факторы риска: функционально значимая зона (например, ствол мозга, таламус), размер > 3,5 см, периферическая доза > 25 Гр.
9. Варианты лечения при крупных артерио-венозных мальформациях (АВМ):
• Выжидательная тактика
• Стереотаксическая радиохирургия:
— Малая доза менее эффективна
— Стадирование (радиохирургия проводится с интервалом в несколько месяцев между процедурами)
• Уменьшение объема:
— Хирургия
— Эмболизация
III. Консервативное лечение артерио-венозной мальформации (АВМ) без операции. Сведения о долгосрочных спонтанных исходах у пациентов с АВМ в значительной степени основаны на данных Ondra et al. Частота массивных повторных кровоизлияний составила 4,0%, а смертность 1,0% в год, 23% пациентов погибли из-за кровоизлияния из АВМ. Совокупная частота тяжелых осложнений и смертность составили 2,7% в год. Эти ежегодные показатели практически не менялись в течение всего периода исследования. Риск лечения АВМ IV-V степени по Spetzler сопоставим с рисками естественного течения в течение 10 лет.
Таким образом, только в случае эпилепсии или головной боли консервативное лечение может быть оправдано с рекомендацией пересмотра в случае кровоизлияния.

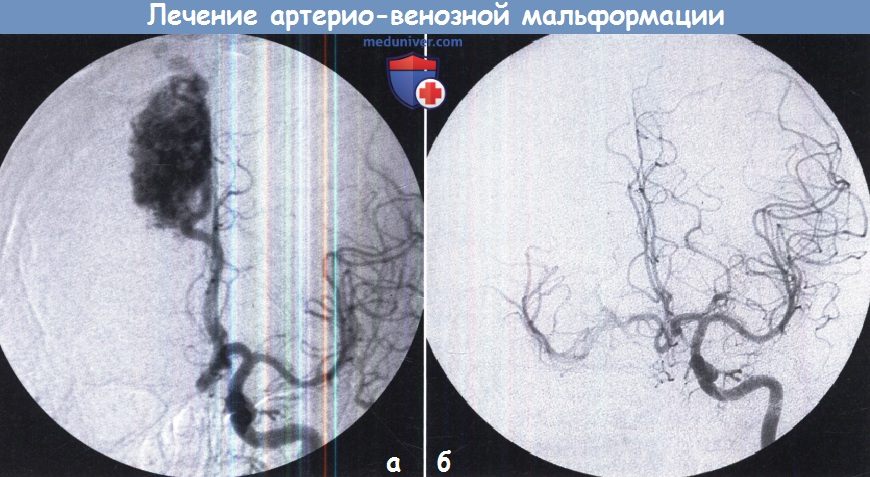
а – Артериовенозная мальформация до радиохирургии.
б – Спустя два года контрольная ангиография показывает полную облитерацию после радиохирургии.
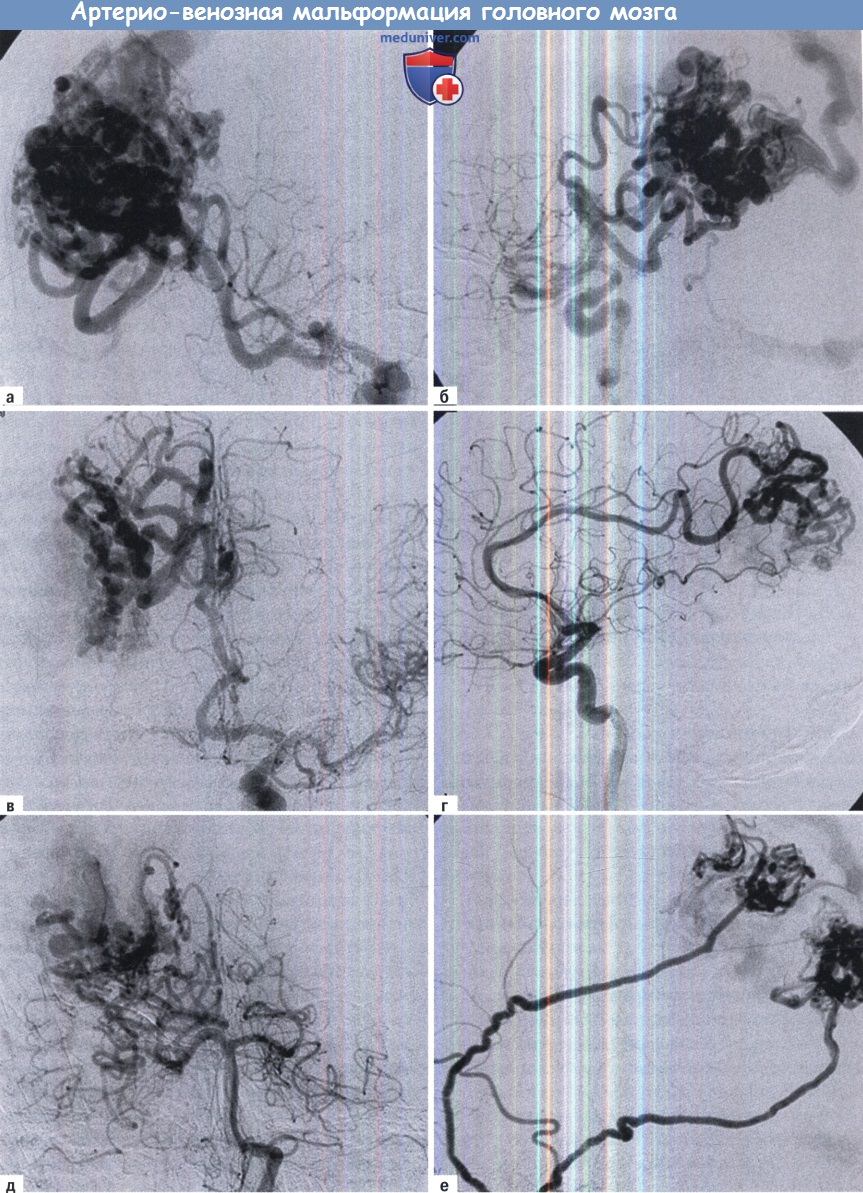
(А, Б) Пример обширной артериовенозной мальформации теменной локализации, питаемой из средней (В, Г) передней и (Д) задней мозговых артерий, а так же из (Е) наружной сонной артерии.
Данный пациент 63 лет поступил с кровоизлиянием. Венозный дренаж осуществляется через верхний сагиттальный синус.
Лечение состояло из совмещения эмболизации и микрохирургии.
– Также рекомендуем “Алгоритм диагностики каверномы головного мозга – Европейские рекомендации”
Оглавление темы “Болезни сосудов головного мозга.”:
- Алгоритм эндоваскулярного лечения аневризмы сосуда головного мозга – Европейские рекомендации
- Алгоритм диагностики артерио-венозных мальформаций головного мозга – Европейские рекомендации
- Алгоритм лечения артерио-венозной мальформации головного мозга – Европейские рекомендации
- Алгоритм диагностики каверномы головного мозга – Европейские рекомендации
- Алгоритм лечения каверномы головного мозга – Европейские рекомендации
- Причины и классификация дуральных артериовенозных фистул (ДАВФ)
- Алгоритм диагностики и лечения дуральной артериовенозной фистулы – Европейские рекомендации
- Алгоритм диагностики сужения сосуда головного мозга и его окклюзии – Европейские рекомендации
- Алгоритм лечения сужения сосуда головного мозга и его окклюзии – Европейские рекомендации
- Алгоритм лечения заболеваний сосудов головного мозга – Европейские рекомендации
Источник
Артериовенозная мальформация (АВМ) — врожденная аномалия развития сосудистой системы головного мозга, которая представляет собой различной формы и величины клубки, образованные беспорядочным переплетением патологических сосудов. Функционально артериовенозная мальформация представляет собой прямое артерио-венозное шунтирование без промежуточных капилляров.
Основные механизмы патологического влияния артерио-венозной мальформации на головной мозг:
- Разрыв патологически изменённых сосудов клубка или аневризм артерий, питающих АВМ.
- Хроническая недостаточность кровообращения, вызванная артериовенозным шунтированием.
- Синдром прорыва нормального перфузионного давления.
Клинические проявления мальформаций:
- Внутримозговые, субарахноидальные и внутрижелудочковые кровоизлияния. Это наиболее частое проявление, встречается в 50% – 70% случаев. Возрастной пик 20 – 40 лет. В среднем ежегодный риск кровоизлияния составляет около 3%. В течение первого года после первого эпизода, риск повторного кровоизлияния составляет 6%. Наличие небольшого узла, единственной дренажной вены, наличие аневризм на питающих сосудах, наличие варикозного расширения на дренажной вене или, наоборот, сужение её, глубокая локализация мальформации – увеличивают риск кровоизлияния.
- Судорожные припадки примерно в 30% – 40% случаев.
- Прогрессирующий неврологический дефицит в связи с давлением на окружающие структуры или в связи с ишемическими нарушениями из-за синдрома “ обкрадывания“.
- Головная боль
Всё более широкое применение КТ и МРТ сканирования приводит к увеличению случаев обнаружения асимптоматичных АВМ.
Лечение артерио-венозных мальформаций
Основной задачей любого вида вмешательства является полная облитерация сосудистой сети мальформации. В настоящее время применяются следующие методы: хирургическое вмешательство, эндоваскулярная эмболизация, радиохирургия – по отдельности или в комбинации.
Хирургическое вмешательство – радикальная экстирпация АВМ с приемлемым риском неврологических осложнений поверхностных АВМ вне функционально значимых зон головного мозга. Удаление АВМ градации 4 – 5 по шкале Spetzler-Martin сопряжено с большими техническими сложностями, очень высоким риском глубокой инвалидизации и летального исхода. АВМ, расположенные в глубинных отделах, стволе мозга – недоступны.
Радиохирургия – возможна полная облитерация АВМ диаметром менее 3 см у 85% больных (на протяжении 2 лет). На протяжении этого периода сохраняется риск кровоизлияния.
Эндоваскулярные операции (эмболизации) – малоинвазивные; величина и локализация АВМ не влияют на риск процедуры.
Технологический прогресс в последние годы привёл к тому, что эндоваскулярный метод стал методом выбора при лечении АВМ
Риск осложнений – менее 3%, что меньше, чем годовой риск кровоизлияния.
Процедура проводится под общим наркозом. Производится прокол бедренной артерии, мягкий катетер вводится в сосуды, кровоснабжающие головной мозг. Микрокатетер проводится по питающему сосуду в сосуды узла АВМ. Под радиологическим контролем производится иньекция эмболизирующего материала. После заполнения узла АВМ, микрокатетер удаляется, и производится контрольная ангиография.
При сложном строении АВМ – большая, состоящая из нескольких узлов – процедура может быть разбита на 2 – 3 этапа.
В настоящее время существует возможность выполнения данной операции бесплатно, по федеральной квоте. Можно получить квоту на высокотехнологичное лечение как по месту жительства, так и через комиссию при нашей клинике. Главным основанием для получения квоты является наличие выполненной в течение последнего года ангиографии, или 64-срезовой МСКТ (мультиспиральной компьютерной томографии) артерий с контрастом, на которой выявлены значимые поражения. Далее полученную информацию на CD- или DVD-диске пациент пересылает в нашу клинику и хирурги принимают решение о возможности выполнения операции. Затем пациент собирает необходимый пакет документов и ждет получения квоты. Для более полной информации – звоните по тел.:
Ординаторская: 8 (495) 441-92-11
Зав. отделением: 8 (985) 146-06-96 Шелеско Андрей Анатольевич
Источник
