Матки сосудов и сердца печени
Чистая кровь – здоровые сердце и сосуды
Шлаки и токсины, циркулирующие в крови, – результат нарушения фильтрующей функции нашей печени. Дело в том, что в нашу кровь постоянно попадают огромные количества шлаков и токсинов, которые печень призвана отфильтровать. Однако, токсическая нагрузка на печень современного человека непомерно высока. В результате в ней накапливаются ядовитые вещества. Защищаясь от отравления, каждая клетка печени стремится заключить их в жировой «саркофаг».
Поскольку зашлакованные, забитые жиром клетки печени больше не могут нормально фильтровать кровь, токсины и шлаки отравляют каждый наш орган, каждую клетку нашего организма. Например, каждую секунду повреждаются миллионы клеток нашего сердца, которые и образуют ткань сердечной мышцы – миокард. Прямое токсическое повреждение клеток миокарда является одной из причин, лежащих в основе стенокардии (боли в сердце). Во-вторых, поврежденные клетки сердца утрачивают способность адекватно потреблять кислород из крови. От этого возникает кислородное голодание миокарда, лежащее в основе ишемической болезни сердца.
Другим мощным фактором, вызывающим ишемическую болезнь сердца, является атеросклероз коронарных артерий сердца. Что же лежит в основе атеросклеротического процесса во всех (!) наших сосудах? Современный взгляд многих врачей на эту проблему следующий. Шлаки и токсины, постоянно циркулирующие в нашей крови, как химически, так и просто механически повреждают внутреннюю поверхность наших сосудов. На случай таких повреждений природа предусмотрела специальный защитный механизм. Один из его элементов – это холестерин. Холестерин – это жир, который синтезируется печенью и является нужным и важным для нашего организма веществом. Одна из его функций в нашем организме заключается в том, что он наподобие шт.укатурки налипает изнутри к повреждениям в сосудах, чтобы их залатать. Единственное, чего не смогла предусмотреть мудрая природа, так это огромное количество шлаков и токсинов в крови современного человека. Вот и получается, что ежесекундно необходимо ставить сотни тысяч заплаток изнутри на стенки наших сосудов. К сожалению, новые и новые порции токсинов продолжают повреждать наши сосуды даже поверх уже поставленных «заплаток». Так и образуются атеросклеротические бляшки. По мере роста бляшка полностью либо частично перекрывает просвет сосуда и вызывает острую или медленно нарастающую недостаточность кровоснабжения органа, который данный сосуд питает. Если закупорился сосуд сердца (коронарная артерия), возникает ишемическая болезнь сердца. Она нередко приводит к полному отмиранию участка сердечной мышцы – инфаркту миокарда. Если бляшки перекрывают сосуд в головном мозге, возникает ишемия головного мозга, логическим продолжением которой является мозговой инсульт.
Атеросклероз – коварное заболевание. Обычно пока бляшка не перекроет 70% просвета того или иного сосуда, болезнь никак себя не проявляет. Поэтому современная медицина пересмотрела свое отношение к атеросклерозу как к болезни «пожилых». Как выяснили ученые, атеросклеротический процесс уже активно протекает в сосудах молодых людей (25-30 лет), и в наибольшей степени ему подвержены жители индустриально развитых стран. Как известно, сердечно-сосудистые заболевания стоят на 1-м месте среди причин смертности населения России, а в США они уступают пальму первенства лишь онкологическим заболеваниям. Ранее считалось, что для развития атеросклероза и его страшных последствий должен быть повышен общий холестерин крови. Однако оказалось, что у многих людей активный атеросклеротический процесс развивается и при нормальных цифрах общего холестерина. Это служит лишь еще одним подтверждением тому, что одна из основных причин развития атеросклероза – это повреждение стенок сосудов токсинами и шлаками крови. Следует отметить, повышенный общий холестерин обусловливает лишь более быстрое развитие атеросклеротического процесса.
Как известно, атеросклероз одновременно поражает многие артерии нашего организма, питающие различные органы. Помимо атеросклероза сосудов мозга и сердца многие люди имеют протекающий скрыто атеросклеротический процесс в сосудах нижних конечностей. Особенно ему подвержены курильщики. Это заболевание называется «облитерирующий атеросклероз нижних конечностей» или «синдром перемежающейся хромоты». Сначала человек замечает, что у него постоянно мерзнут ноги, даже в теплом помещении. Затем появляются боли при ходьбе, а позже и в состоянии покоя. Дальнейшее развитие нарушения кровообращения может привести к отмиранию ткани (гангрене) и необходимости ампутации конечности.
Поскольку атеросклероз вызывает множественное поражение наших сосудов, его лечение крайне затруднительно. Даже оперативное лечение, например, стентирование коронарной артерии или аорто-коронарное шунтирование, не способено защитить человека от нарастания атеросклеротических бляшек в других сосудах сердца, мозга, конечностей, кишечника, почек и других органов. К тому же, множественное сужение просвета сосудов является одной из основных причин артериальной гипертонии. Ведь для того, чтобы прокачивать кровь по суженным бляшками сосудам сердцу необходимо выбрасывать кровь с повышенной силой. Очевидно, что чем меньше просвет наших сосудов, тем выше цифры артериального давления.
Обращаем ваше внимание! Эта статья не является призывом к самолечению. Она написана и опубликована для повышения уровня знаний читателя о своём здоровье и понимания схемы лечения, прописанной врачом. Если вы обнаружили у себя схожие симптомы, обязательно обратитесь за помощью к доктору. Помните: самолечение может вам навредить.
Источник
Кровоснабжение печени и ее сегменты
Печень обладает двойным кровоснабжением: приблизительно 70% крови поступает из воротной вены, остальная часть — из печеночной артерии. По ветвям печеночной вены кровь отводится в нижнюю полую вену. На сложном взаимодействии этих сосудов основано функционирование печени.
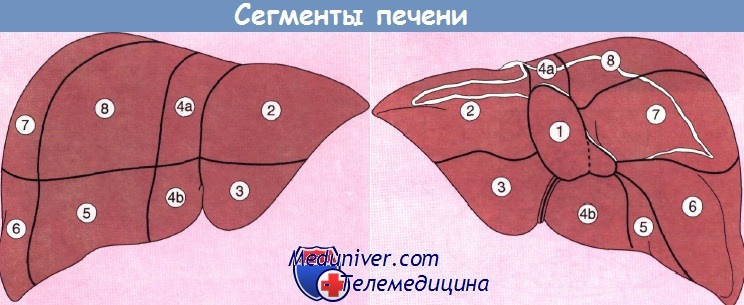
В зависимости от хода сосудов печень делится на восемь сегментов, что с хирургической точки зрения имеет большое значение, поскольку при выборе типа оперативного вмешательства предпочтение зачастую отдают сегментэктомии, а не лобэктомии.
Сегмент 1 (каудальная доля) автономен, поскольку снабжается кровью как от левой и правой ветвей воротной вены, так и от печеночной артерии, в то время как венозный отток от данного сегмента осуществляется непосредственно в нижнюю полую вену. При синдроме Бадда—Киари тромбоз главной печеночной вены приводит к тому, что отток крови от печени происходит полностью через хвостатую долю, которая при этом значительно гипертрофируется.
Печень хорошо видна на обзорной рентгенограмме брюшной полости. Часто обнаруживают придаток правой доли, направленный к области правой подвздошной ямки — так называемую долю Риделя.

Вид печени спереди и снизу, показывающий деление на 8 сегментов. Сегмент 1 — хвостатая доля.

Компьютерная томография печени. Изображение в аксиальной проекции через верхний свод печени позволяет увидеть разделение печеночной паренхимы на сегменты.
Задний сегмент правой доли редко просматривают на этом уровне, поскольку основной объём данного сегмента лежит ниже переднего сегмента правой доли:
1 — медиальный сегмент левой доли печени; 2 — левая печеночная вена; 3 — латеральный сегмент левой доли печени;
4 — срединная печеночная вена; 5 — передний сегмент правой доли печени; 6 — задний сегмент правой доли печени;
7 — правая печеночная вена; 8 — аорта; 9 — пищевод;
10 — желудок; 11 — селезенка.

Синдром Бадда-Киари: сниженное всасывание коллоида в печени в хвостатой доле печени и повышенное всасывание — в костях и селезенке.
Сцинтиграфия с использованием технеция.
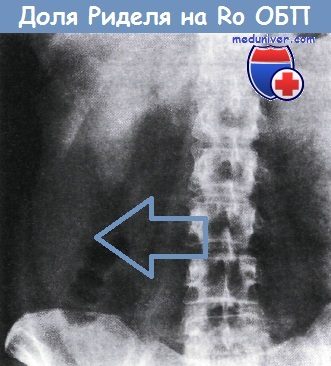
Нормальная рентгенограмма брюшной полости, в правом подреберье видна доля Риделя
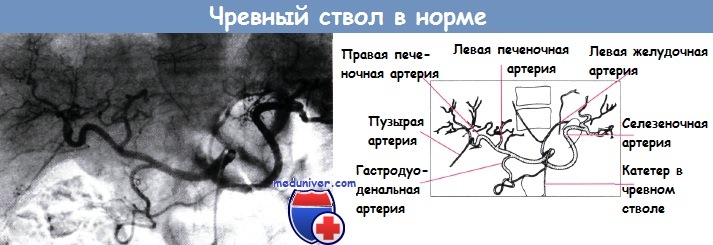
Печеночная артерия, воротная вена и общий печеночный проток в воротах печени располагаются рядом. Печеночная артерия в норме представляет собой ветвь чревного ствола, тогда как желчный пузырь снабжается кровью от пузырной артерии; нередко встречают анатомические особенности строения этих сосудов.
Существует несколько способов контрастирования воротной вены, формирующейся при слиянии селезеночной и верхней брыжеечной вен позади головки поджелудочной железы.
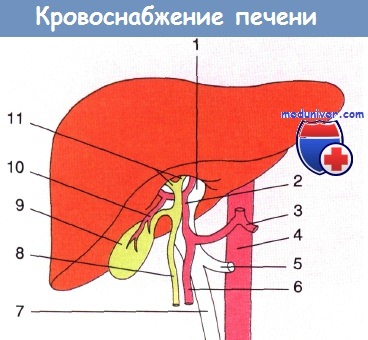
Кровоснабжение печени:
1 — воротная вена; 2 — печеночная артерия; 3 — чревный ствол;
4 — аорта; 5 — селезеночная вена; 6 — гастродуоденальная артерия;
7 — верхняя брыжеечная вена; 8 — общий желчный проток; 9 — желчный пузырь;
10 — пузырная артерия; 11 —печеночные протоки
Метод прямой чрескожной инъекции в селезеночную пульпу (спленовенография) раньше был широко распространен, но в настоящее время его используют редко даже при увеличении селезенки и признаках портальной гипертензии. У младенцев при открытой пупочной вене возможна прямая катетеризация с контрастированием системы левой воротной вены. В настоящее время чаще используют селективную ангиографию, когда воротную систему визуализируют при катетеризации селезеночной артерии и последующем наблюдении фазы венозного возврата после прохождения контраста через селезенку.
У пациентов с портальной гипертензией качество изображения может быть плохим вследствие гемодилюции и снижения концентрации контрастного вещества, что можно скорректировать методом цифровой субтракционной ангиографии. Сразу после прохождения катетера через правое предсердие и желудочек его можно ввести в печеночные вены. При этом легко оценить рентгеновское изображение и измерить венозное давление, для чего сначала фиксируют величину свободного печеночного венозного давления в просвете сосуда, затем катетер аккуратно погружают в печеночную паренхиму.
Наконечник баллона расширяется, и измеряемая величина (фиксированное печеночное венозное давление) практически соответствует давлению в воротной вене, что позволяет рассчитать градиент указанного параметра. Наиболее легко провести катетер через правую внутреннюю яремную вену, поскольку в этом случае обеспечивается практически прямолинейный доступ. Аналогичную технику доступа применяют при трансвенозной биопсии печени.
С помощью УЗИ нормальной печени оценивают ее размер и консистенцию, дефекты наполнения, анатомию системы желчных протоков и воротной вены. Печеночную паренхиму и окружающие ткани также можно исследовать с помощью компьютерной томографии.
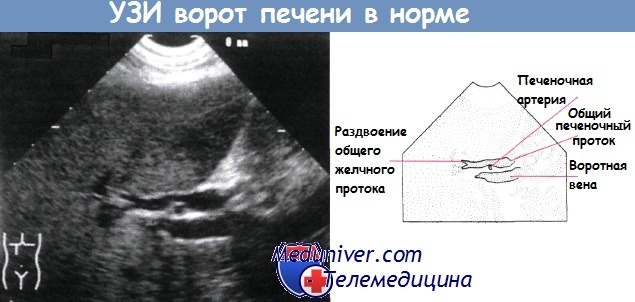
Ультразвуковое исследование анатомических структур в воротах печени.
Печеночная артерия расположена между расширенным общим печеночным протоком и воротной веной.
При магнитно-резонансной холангиопанкреатографии применяют Т1 и Т2 время релаксации среды. Сигнал от жидкостной среды имеет очень низкую плотность (обеспечивает темный цвет) на Т,-изображениях и высокую плотность (с получением светлого оттенка) на Т2-изображениях. При данном методе исследования Т2-изображения используют для получения холангиограмм и панкреатограмм. Чувствительность и специфичность методики различаются в зависимости от техники и показаний.
Если подозрение на патологию небольшое, лучше провести магнитно-резонансную холангио- и панкреатографию, а при высокой вероятности оперативного вмешательства предпочесть эндоскопическую ретроградную холангиографию. Кроме того, периампуллярные образования зачастую остаются незамеченными из-за артефактов, обусловленных скоплением воздуха в двенадцатиперстной кишке. К сожалению, магнитно-резонансный метод исследования недостаточно чувствителен при ранней диагностике патологии желчных протоков, например в случае с едва различимыми повреждениями, часто встречающимися при первичном склерозирующем холангите. Метод сканирования TESLA для визуализации желчных протоков применяют редко.
Компьютерная или МРТ — лучшие методы для исследования патологии печени. Благодаря контрастированию и получению изображений в артериальной и венозной фазе возможна диагностика как доброкачественных, так и злокачественных образований. 3D-компьютерная и МРТ позволяют получать изображение сосудов. При дополнительном использовании MRC либо TESLA-изображений можно диагностировать рак желчных путей.
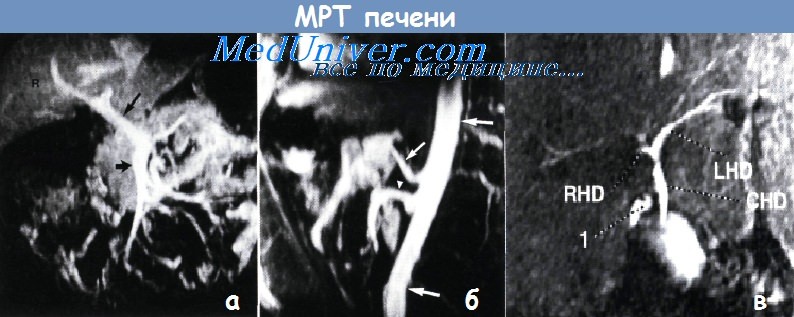
а – Магнитно-резонансная томограмма, демонстрирующая систему воротной вены в норме. Видны верхняя брыжеечная вена (показана короткой стрелкой) и ее основные ветви.
Воротная вена (длинная стрелка) проходит далее внутрь печени. Правая доля печени (R) идентифицирована.
б,в – На магнитно-резонансной томограмме (б) в средней сагиттальной проекции определяются аорта (показана длинной стрелкой), чревный ствол (короткая стрелка) и корень верхней брыжеечной артерии (кончик стрелки).
Материал предоставил д-р Drew Torigian. TESLA-сканирование (в) также служит неинвазивным методом исследования анатомии желчных путей:
RHD — правый печеночный проток; LHD — левый печеночный проток; CHD — общий печеночный проток; 1 — «cystic duct» — пузырный проток.
Компьютерную либо МРТ можно использовать в качестве единственных методов исследования для обнаружения опухолей, описания анатомии сосудов и определения степени поражения желчных путей.

Изотопное сканирование печени и селезенки с использованием 99mТс (а). HIDA-сканирование, показывающее нормальное всасывание и экскрецию соединения в желчный проток (б).
Исследование можно проводить совместно со стимуляцией холецистокинином для оценки дисфункции желчного пузыря или сфинктера Одди.
1 — поверхностные маркеры грудной клетки; 2 — печень; 3 — селезенка
Радиоизотопный метод исследования печени в настоящее время используют значительно реже. Данным способом исследования определяют концентрацию технеция в ретикулоэндотелиоцитах (клетки Купфера), введенного внутривенно.
Лапароскопический метод достаточно редко применяют для непосредственного визуального исследования печени, однако он позволяет проводить биопсию под визуальным контролем, поскольку в этом случае достаточно четко просматривается нижняя поверхность органа.
Учебное видео сегментарное строение печени на схеме
Скачать данное видео и просмотреть с другого видеохостинга можно на странице: Здесь.
– Также рекомендуем “Желчевыводящие пути в норме и ее варианты”
Оглавление темы “Болезни желудочно-кишечного тракта”:
- Псевдокисты поджелудочной железы – диагностика
- Кисты поджелудочной железы – диагностика
- Рак поджелудочной железы – диагностика
- Эндокринные опухоли поджелудочной железы – диагностика
- Периампулярный рак – диагностика
- Муковисцидоз – диагностика
- Печень – анатомия, топография
- Кровоснабжение печени и ее сегменты
- Желчевыводящие пути в норме и ее варианты
- Гистология печени и ее функциональная анатомия
Источник
Эмболизация — малоинвазивная процедура, которая может дополнять хирургическое лечение или использоваться самостоятельно. Хирург через прокол в бедренной артерии проводит специальный катетер в артерии, непосредственно питающие опухоль и через него закрывает их специальными частицами — эмболами, которые перекрывают кровоток. В ряде случаев используют эмболы, способные выделять химиопрепарат в ткань опухоли — такое вмешательство называется химиоэмболизация.
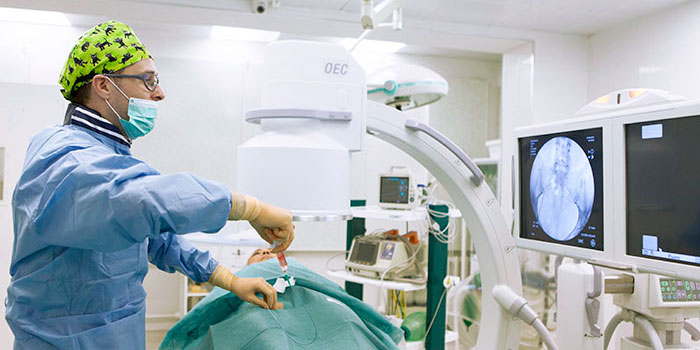
Эмболизация применяется для лечения многих заболеваний. С начала XXI века эта процедура получает все более широкое применение и в онкологии, в первую очередь из-за своей эффективности и малоинвазивности — эмболизации безболезненны, не требуют наркоза, инструмент вводится через пункцию артерии, т. е. нет никакой операционной раны.
Эмболизация у онкологических пациентов
Эмболизация артерий для лечения опухолей и их метастазов помогает решить следующие задачи:
- в качестве самостоятельного метода лечения — эмболизация (чаще всего в варианте химиоэмболизации) может приводить к ишемии ткани опухоли и ее гибели. Для некоторых заболеваний, например, ряд опухолей печени, этот лечения может приводить к полной ремиссии без хирургического лечения.
- в сочетании с хирургическим лечением эмболизация используется как вспомогательная технология — чаще всего для уменьшения кровотечения во время операции за счет деваскуляризации (обескровливания) новообразования;
- в ряде случаев эмболизация, выполненная перед операцией, дает возможность проведения более радикальной операции за счет предварительного уменьшения опухоли;
- эмболизация также может применяться для борьбы с симптомами и осложнениями онкологических заболеваний — это в первую очередь остановка опасных кровотечений, которые угрожают жизни пациента, кроме того — облегчение боли, вызванной злокачественным новообразованием; еще одним эффектом является уменьшение объема и замедление роста опухоли.
Виды эмболизации артерий у онкологических больных:
- предоперационная — выполняется в качестве первого этапа хирургического вмешательства;
- в качестве самостоятельного метода лечения — чаще всего при опухолях печени, почек и ряде других опухолей
- в качестве паллиативного метода лечения — для остановки кровотечений, уменьшения болевого синдрома, уменьшения объемов и темпа роста опухоли.
Как проводится эмболизация артерий?
Эмболизация выполняется врачами-рентгенохирургами в специально оборудованной ангиографической операционной. Перед эмболизацией всегда проводят ангиографию. В сосуды вводят рентгенконтрастное вещество, в ходе чего записывают рентгеновское изображение в цифровом видеоформате. Это помогает врачу оценить расположение и анатомию сосудов, определить, из каких артерий осуществляется кровоснабжение опухоли.
Чаще всего эмболизацию выполняют под местной анестезией. В редких случаях приходится использовать общую анестезию (наркоз). За 4–5 часов до процедуры пациента просят ограничить прием пищи, иногда дают успокоительные препараты.
В большинстве случаев доступ к нужному сосуду получают через бедренную артерию, это самый типичный доступ для всех ангиографических исследований и вмешательств, но могут использовать и другие артерии в других местах (лучевую на запястье, плечевую в области локтевого сгиба и т. п.). Врач обрабатывает кожу антисептиком и делает небольшой прокол, вводит в артерию специальный катетер размером не более 1,5 мм и продвигает его до тех пор, пока не достигнет нужного сосуда. Через катетер в сосуд вводят эмболы, которые перекрывают его просвет.
Существуют разные виды эмболов:
- Поливинилалкоголь (PVA) представляет собой частицы размером от 50 до 1000 мкм. Это относительно недорогой и простой в применении препарат, однако, в настоящее время он считается устаревшим. Сейчас чаще всего применяют сферические эмболы, например, Bead Block и Embozene.
- Спирали из платины и нержавеющей стали. После установки в просвете сосуда на них быстро образуется тромб, который перекрывает кровоток. Иногда такие спирали применяют вместе с желатиновыми губками: сначала устанавливают спираль, а затем через катетер вводят губку — ее частички оседают между витками. Их применяют только для остановки кровотечений, обусловленных опухолями.
- Химиоэмболизация — введение в просвет сосуда эмболов, содержащих химиопрепарат. Таким образом, с одной стороны происходит закупорка сосудов, кровоснабжающих опухоль, а с другой химиопрепарат поступает непосредственно в ткань опухоли и не оказывает побочные эффекты, которые возникают при его введении в вену. При этом в самой опухоли создаются очень высокие концентрации препарата, невозможные при обычном введении. Мы применяем самые современные препараты для химиоэмболизации: DC Beads (Terumo, Япония) и Hepaspheres (Merit Medical, США)., которые высвобождают химиопрепарат в течение длительного времени, в стабильной дозировке.
- Радиоэмболизация — введение эмболов, содержащих радиоактивные изотопы. Эта процедура еще называется внутренней лучевой терапией, так как в опухоль изнутри вводят дозу радиации, разрушающей ее клетки. Для этого обычно используют изотоп Иттрий-90.
Эмболизация артерий в онкологии
К эмболизации артерий наиболее часто прибегают при следующих онкологических заболеваниях:
- В качестве самостоятельного метода лечения: Первичные и метастатические опухоли печени, почек, легких и других локализаций.
- В комбинации с хирургическими методами: Первичные и метастатические опухоли печени, почек, легких, костей, позвоночника, матки, простаты, мочевого пузыря и т. д.
- Для остановки кровотечений при опухолях: малого таза, легких, прямой кишки, толстой кишки, печени, матки, простаты, опухолях головы и шеи. Т. е. практически при любой локализации с целью прекращения кровотечения.
Эмболизация также широко применяется для лечения заболеваний, не связанных с онкологией:
- Миома матки. Эмболизация маточных артерий — наименее травматичный способ лечения миомы матки, обладающий высокой эффективностью — около 98,5% женщин, перенесших эту процедуру, не нуждаются в дополнительном лечении.
- Аденома простаты. Эмболизация – эффективный, малоинвазивный способ лечения аденомы предстательной железы, который сегодня становится все более распространен в развитых странах.
- Варикоцеле — наименее инвазивная альтернатива хирургическому лечению, выполняется амбулаторно за 20–30 минут.
- Сосудистые мальформации различной локализации.
- Аневризмы — в первую очередь аневризмы головного мозга, способные вызвать геморрагический инсульт.
Насколько безопасна эмболизация?
Цель эмболизации в онкологии — не только прекратить приток крови к патологическому очагу, но и сохранить при этом кровообращение в соседних здоровых тканях. Современная техника эмболизации с использованием микрокатетеров позволяет обеспечить необходимую точность эмболизации.
Для того чтобы обеспечить точность в ходе эмболизации всегда проводят ангиографию. Врач внимательно изучает сосудистую сеть, кровоснабжение опухоли и определяет, в какой сосуд должны быть введены эмболы. Эмболы вводятся только после детального изучения сосудистой анатомии опухоли в ходе вмешательства. Перед эмболизацией вам также могут назначить УЗИ, КТ, МРТ и другие исследования.
Существует ряд противопоказаний к проведению эмболизации, но все они являются относительными, то есть процедура, как правило, все же может быть проведена при соблюдении некоторых условий. Например, у пациента с нарушением функции почек должно быть нормализовано артериальное давление, водно-солевой баланс, а во время ангиографии нужно использовать минимальное количество контрастного вещества.
В Европейской клинике с каждым пациентом работают индивидуально. Врач оценивает общее состояние больного, учитывает сопутствующие заболевания, размеры и расположение опухоли, особенности ее кровоснабжения.
Врачи-специалисты Европейской клиники имеют огромный опыт проведения эмболизации артерий при различных видах опухолей. Мы используем значительный собственный и опыт коллег из ведущих зарубежных клиник. Некоторые процедуры, которые мы предлагаем пациентам в Европейской клинике (например, эмболизация при аденоме простаты), даже в Европе, США и Израиле являются прерогативой крупных университетских клиник из-за необходимости иметь хирургов самого высокого уровня.
Нашими врачами были выполнены первые в России эмболизации миомы матки, артерий простаты, мы первыми стали работать с самыми современными препаратами для эмболизации — Bead Block, Embozene, DC Bead и др.
Источник
