Механизмы повреждения стенки сосудов
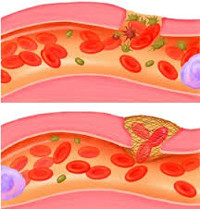
Повреждение сосудов – нарушение целостности артерий и вен в результате травматического воздействия. Может наблюдаться как при открытой, так и при закрытой травме, сопровождается наружным или внутренним кровотечением, возможно нарушение кровоснабжения нижележащего сегмента. Повреждение крупных сосудов является тяжелой травмой и представляет опасность для жизни пациента. Диагноз выставляется на основании клинических признаков, к числу которых относится наличие раны или закрытого повреждения, кровотечение или гематома, ослабление или отсутствие пульса на периферических артериях. Лечение хирургическое.
Общие сведения
Повреждение сосудов – достаточно распространенная травма, как в военное, так и в мирное время. Наибольшее количество повреждений приходится на сосуды нижних конечностей. Второе место по распространенности занимают повреждения сосудов верхних конечностей, третье – сосудов шеи. В последние десятилетия специалисты в области травматологии отмечают изменение характера таких травм за счет увеличения количества высокоэнергетических травматических воздействий. В связи с этим ранения и закрытые повреждения сосудов чаще выявляются в составе множественной и сочетанной травмы, что усложняет лечение и утяжеляет прогноз.
Открытые и закрытые повреждения сосудов могут сочетаться с переломами костей туловища и конечностей, тупой травмой живота, повреждениями почек, ЧМТ и повреждениями грудной клетки. Наряду с этим нередко наблюдаются изолированные травмы с тяжелыми разрушениями конечностей: многооскольчатыми переломами, раздавливанием и размозжением мягких тканей, обширными рваными ранами и т. д. И, хотя возможности современной реконструктивной ангиохирургии во многих случаях позволяют восстановить целостность сосудов даже при тяжелых повреждениях, тактика лечения и прогноз в таких случаях зависят не только от возможности восстановления артерий и вен, но и от жизнеспособности тканей травмированной конечности.

Повреждение сосудов
Открытые повреждения
Открытые повреждения сосудов отличаются большим разнообразием и обычно возникают в результате огнестрельных ранений, резаных, колото-резаных и колотых ран. Реже причиной становятся рваные и рвано-ушибленные раны. С учетом вида травмированного сосуда выделяют ранения артерий и вен, с учетом характера повреждения – полные поперечные и неполные поперечные разрывы, одиночные сквозные, боковые (касательные) и фенестрирующие повреждения. Фенестрирующие повреждения возникают в результате ранения дробью или мелкими осколками и характеризуются наличием «окна» или «дырки» в стенке сосуда при сохранении кровотока.
Как правило, открытые повреждения сосудов сопровождаются наружным кровотечением. Однако иногда дефект в стенке поврежденной артерии или вены «закупоривается» тромбом или сдавливается окружающими тканями, поэтому кровотечение может отсутствовать. Возможно также излитие крови не наружу, а в мягкие ткани с формированием напряженной гематомы. При ранении крупных сосудов в большинстве случаев наблюдаются кровопотеря и гиповолемический шок.
Местные симптомы ранений сосудов зависят от диаметра травмированной артерии или вены, характера повреждения сосудистой стенки, анатомических особенностей зоны травмы, объема разрушения мягких тканей, сопутствующего повреждения костей и нервов, общего состояния пациента и т. д. При повреждении вен кровь темно-вишневая, изливается ровной струей, при нарушении целостности крупных стволов возможна пульсация в такт дыханию. Возможно образование нарастающей не пульсирующей гематомы в окружающих мягких тканях. Пульс на периферических артериях сохранен, цвет кожи в дистальных отделах не изменен, нарушения функции конечности обусловлены характером и тяжестью травмы.
К числу признаков, позволяющих заподозрить повреждение артерии, относятся рана в проекции сосуда, наружное кровотечение алой пульсирующей струей или нарастающая пульсирующая гематома, ослабление или отсутствие пульсации на артериях ниже уровня повреждения. Важнейшим симптомом повреждения магистральных артерий является нарастающая ишемия дистальных отделов конечности. О недостаточности местного кровообращения свидетельствуют парестезии, побледнение, а в последующем – синюшность и мраморность кожных покровов, похолодание и ишемические боли, которые не уменьшаются при иммобилизации и не усиливаются при пальпации. Перечисленные проявления сопровождаются нарастающей ригидностью мышц. Затрудняются сначала активные, а затем и пассивные движения, при глубоких расстройствах кровообращения возникают мышечные контрактуры.
Закрытые повреждения
Закрытые повреждения сосудов могут возникать вследствие окклюзирующих или контузионных повреждений. Окклюзирующие повреждения обычно выявляются при вывихах и переломах костей, их причиной становится сдавление или ушиб артерий сместившейся костью или костным фрагментом. При этом нередко наблюдается мгновенное удлинение (насильственное чрезмерное растяжение) сосуда, способствующее усугублению травмы. В первую очередь страдает нежная интима – внутренняя оболочка сосуда. Если воздействие достаточно интенсивное, нарушается целостность средней оболочки артерии. При этом наружная оболочка благодаря своей высокой прочности может остаться неповрежденной. Разрывы внутренней и средней оболочки сосудов называются контузией.
Выделяют три степени контузионных повреждений сосудов. Первая – в интиме есть отдельные трещины. Вторая – имеются циркулярные повреждения интимы. Третья – повреждена не только внутренняя, но и средняя оболочка артерии. При повреждениях второй и третьей степени из-за тока крови интима отслаивается и закупоривает просвет сосуда, вызывая внутрисосудистый тромбоз. При повреждении всех оболочек артерии формируется пульсирующая гематома, из которой в последующем, как правило, образуется травматическая аневризма.
В случаях одновременного разрыва артерии и вены возникает артериовенозный свищ – кровь из артерии сразу сбрасывается в вену, что может приводить не только к нарушению кровоснабжения дистальных отделов конечности, но и к развитию общих расстройств кровообращения. Фактором, способствующим усугублению ишемии нижележащих отделов конечности, является кровопотеря и сопутствующие повреждения окружающих мягких тканей. При отсутствии неповрежденных коллатеральных артерий в течение 3-4 часов развиваются необратимые нарушения жизнедеятельности тканей, возникает так называемая гемодинамическая ампутация конечности.
Клиническими признаками закрытого повреждения сосудов являются нарушения движений и чувствительности дистальных отделов конечности, а также резкая боль, которая не уменьшается после вправления отломков, иммобилизации и использования анальгетиков. Кроме того, наблюдается отсутствие периферической пульсации и цианоз или резкая бледность кожных покровов. При нарушении целостности всех слоев сосудистой стенки в проекции травмы образуется обширная гематома.
Диагностика и лечение
Диагноз выставляется на основании внешних признаков, при необходимости выполняется ангиография. Тактика лечения зависит от состояния дистальных отделов конечности, поэтому большое внимание уделяется оценке жизнеспособности тканей. Мягкость мышц и сохранение пассивных движений свидетельствуют о том, что конечность еще жизнеспособна, в таких случаях целесообразно предпринять попытку восстановления кровотока. Окоченение мышц и тугоподвижность суставов являются признаком гибели тканей и могут рассматриваться, как показания к ампутации.
Часть мышечных волокон при глубокой ишемии остается жизнеспособной, поэтому в некоторых случаях врачи отказываются от ампутации и пытаются восстановить кровоснабжение конечности. Однако вероятность благополучного исхода при таких повреждениях сомнительна и, даже если конечность удается сохранить, она остается неполноценной, то есть, превращается в аналог биологического протеза.
В процессе лечения перед травматологом или сосудистым хирургом стоят три задачи, которые следует решать в определенной последовательности. Приоритетом является спасение жизни пациента, то есть, остановка кровотечения и борьба с последствиями кровопотери. С этой целью проводятся противошоковые мероприятия, осуществляются переливания крови и кровезамещающей жидкости. Второй задачей является сохранение жизнеспособности конечности и третьей – восстановление ее функций.
Противошоковые мероприятия способствуют улучшению гемодинамики, следовательно, помогают сохранить жизнеспособность тканей. Наряду с этим, обязательным условием сохранения конечности является реконструктивная операция. В зависимости от характера повреждения сосуда возможен либо обычный сосудистый шов, либо восстановление сосуда с использованием специального протеза. В послеоперационном периоде проводятся мероприятия по нормализации деятельности всех органов и систем, назначаются антибиотики, обезболивающие препараты, ЛФК и физиотерапия.
Прогноз при открытых и закрытых повреждениях артерий и вен зависит от общего состояния пострадавшего, наличия или отсутствия других травм, локализации пораженного сосуда, особенностей коллатерального кровообращения, степени разрушения окружающих мягких тканей и других факторов. Важнейшее значение имеет временной фактор. Хирургические вмешательства, проведенные в течение первых 10 часов после травмы, как правило, дают возможность сохранить конечность. В последующем вероятность неблагополучного исхода резко возрастает.
Источник
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке “Файлы работы” в формате PDF
Несмотря на значительные успехи в изучении артериальной гипертонии (АГ) – самого распространенного заболевания, входящего в сердечно-сосудистый континуум, проблема повреждения тканевых и клеточных структур при хроническом воздействии повышенного артериального давления остается не вполне выясненной. Инициальными механизмами поражения главного органа-мишени при АГ – артериального сосудистого русла – признаются эндогенное воспаление [1] и апоптоз [2], приводящие к развитию эндотелиальной дисфункции (ЭД)[3]. Большое количество исследований посвящены ее функциональной составляющей, в меньшей степени изучены патоморфологические особенности, в частности количественное и качественное состояние эндотелиоцитов интимы сосудистой стенки. При ее поражении в первую очередь изменяется секреторная функция зндотелиальных клеток, зависящая от синтеза вазодилатирующих и вазоконстриктивных факторов, развивается вазотонический биоэффекторный дисбаланс [4]. По сути этот механизм отражает поражение на клеточном, субклеточном и молекулярном уровнях функционирования сердечно- сосудистой системы.
Патогенетические механизмы формирования ЭД многочисленны и наиболее важными из них являются морфо-функциональные изменения эндотелиоцитов сосудистой стенки. развёртывающихся на фоне активации тканевой РААС (ангиотензина II) [5], а также индуцирующих эндогенное воспаление и апоптоз.
Повреждения сосудистой стенки выражаются повреждением интимы, появлением или увеличением числа циркулирующих в кровотоке эндотелиоцитов.
Приведенные аргументы обосновывают необходимость исследования отмеченных механизмов повреждения эндотелиальной клетки.
Эндотелиоциты образуют внутренний слой сосудистой стенки и помимо защитной функции обладают выраженной эндо-, пара-, и аутокринной активностями, благодаря которым регулируется артериальный сосудистый тонус при секреции вазоактивных веществ и метаболический гомеостаз. Главными биоэффекторами эндотелиоцитов считаются оксид азота и эндотелин-I, интенсивность синтеза которых зависит от индивидуальных генетических, эпигенетических, возрастных, метаболических, гормональных и ферментативных особенностей организма. Постоянное и особенно длительное влияние повышенного артериального давления модифицирует функционирование и структуру сосудистой стенки. Вследствие воспалительного процесса, повреждаются мембраны эндотелиоцитов, развивается дисбаланс секреторной функции оксида азота и эндотелина-I, что обуславливает нарушение функционального ответа сосудистой стенки, увеличивая наклонность к вазоспастическим реакциям, а в тяжелых случаях – и вазоконстрикции. В настоящее время артериальную гипертонию рассматривают с позиций субклинического воспалительного процесса, вызванного провоспалительными цитокинами, среди которых наиболее часто исследуются молекулы клеточной адгезии, ИЛ 1, ИЛ 6, а также специфический маркер эндогенного воспаления – высокочувствительный С-протеин. Для его образования гепатоцитами достаточно возрастания ИЛ 1, ИЛ 6 или ФНО-α в 2-3 раза. Даже небольшое повышение уровня СРБ может отражать субклинический воспалительный процесс в сосудистой стенке. При низком уровне сосудистых осложнений концентрация С-протеина мала ниже 1 мг/л. При показателях С-протеина 1-3 мг/л риск сосудистых осложнений оценивается как средний, при концентрации С-протеина больше 4мг/л как высокий, что наблюдалось в настоящем исследовании. Эндогенное воспаление усиливается ангиотензином II, а посредником его влияния выступает ФНО -α.
Другим важным повреждающим эндотелиоциты механизмом признается апоптоз. Апоптоз отличается от других форм клеточной гибели, которая встречается в ответ на токсины, физические стимулы, ишемию, трансформацию макрофагов в пенистые клетки и т. д. Эта форма клеточного разрушения обозначена как «запрограммированная клеточная смерть» [6].
Ключевой феномен апоптотической клеточной смерти – активация каспаз (caspases), расщепление каспаз-связанных протеинов и фрагментация внутриядерных белков клетки. Активация каспаз может быть связана с гибелью рецепторного комплекса на цитоплазматической мембране или нарушения целостности митохондрий. Описаны 10 каспаз, из которых каспазы 8 и 3 занимают центральное место в апоптотическом пути. Активация каспазы 8 происходит в ответ на воздействие экстрацеллюлярных апоптоз-индуцирующих лигандов и является активатором комплекса процессов, связанных с внутриклеточной гибелью структур, ответственных за экспрессию многих клеточных рецепторов. Каспаза 3 выступает в комплексе с каспазами 8 и 9, реализуя окончательную передачу команды к распаду клетки.
Процесс апоптоза регулируется сигналами, генерируемыми в тот момент, когда цитокины связываются с их рецепторами. Основной путь инициации апоптоза реализуется через систему мембранно-связанных белков семейства туморнекротических (tumour necrosis factor, TNF) рецепторов, к которым относится Apo-1/Fas.
Гибель эндотелиоцитов, происходит при разрушении клеточных ядер с повреждением ДНК и цитозольных органелл, что приводит к сокращению эндотелиального клеточного плацдарма в функциональном и количественном отношении. Нарушение целостности эндотелиальной выстилки обнажает базальную мембрану сосудистой стенки, увеличивая её проницаемость для клеток крови, активных вазоэффекторов, регулирующих различные функции средних и адвентициальных слоёв сосудистой стенки. Отмеченные механизмы составляют основу для формирования атеросклеротических, фибротических процессов и ремоделирования сосудистого русла.
Целью настоящего исследования стало определение роли субклинического воспаления и апоптотического процесса в развитии повреждений сосудистого эндотелия при АГ у женщин пожилого возраста.
Материалы и методы исследования. В исследовании приняли участие 42 пожилые женщины, страдающие АГ II стадии, 1-2 степени, средний возраст – 67,1±4,4 года и 27 женщин аналогичного возраста без сердечно-сосудистых заболеваний с нормальным уровнем артериального давления. Критерии исключения из исследования: вторичные гипертензии, сахарный диабет, заболевания щитовидной железы, внутренних органов в стадии обострения, системные заболевания соединительной ткани, анемии, злокачественные новообразования, тяжелые нарушения сердечного ритма.
У всех обследуемых определялось количество циркулирующих эндотелиоцитов в крови методом Hladovec (1973 г.). С помощью наборов для иммуноферментного анализа (ИФА) оценивались активности апоптотических ферментов: каспазы-8 и 3, человеческого высокочувствительного ФНО-α, высокочувствительного С-реактивного белка (ВЧ СРБ), человеческого s-APO-1/Fas. Для определения ФНО-α, С-реактивного белка и sAPO-1/Fas использовались наборы компании Bender MedSystems (Австрия), для определения каспазы-8 – компании eBioscence (США).
Статистический анализ полученных результатов проведен с помощью методов описательной статистики в программах Microsoft Excel, BIO, istica 6.0; достоверность результатов определялась по критерию Стьюдента и считалась значимой при р<0,05.
Результаты исследования.
Проведенное исследование показало, что хроническая АГ продолжительностью более 11 лет вследствие гипоксии, механических повреждений стенки сосудов и повышения активности ангиотензина-II, сопровождалась гибелью эндотелиоцитов, активацией про- и апоптотических механизмов и субклинического воспаления.
В таблице представлены значения изученных параметров.
Таблица. Показатели про- и апоптотической активности, субклинического воспаления у пожилых женщин с АГ
Показатели | Эндотелио-цитемия, ×109 клеток/л | ВЧ СРБ, мг/л | ФНО-альфа, пг/мл | sAPO-1/Fas, пг/мл | Каспаза-8, нг/мл | Каспаза-3 нг/мл |
Основная группа, n=42 | 1,78±0,05 | 4,7±0,05 | 2,4±0,2 | 154,8±27,2 | 0,36±0,05 | 11,50,8 |
Группа сравнения, n=24 | 1,2±0,02 | 0,5±0,03 | 2,1±0,2 | 41,8±1,5 | 0,15±0,04 | 5,4±0,8 |
p< | 0,001 | 0,001 | н/д | 0,01 | 0,01 | р<0,01 |
Полученные результаты показали, что у женщин, страдающих АГ, отмечался высокий уровень эндотелиоцитемии, что способствовало появлению участков интимы, лишенных эндотелия, с последующей возможностью формирования на этом участке атеросклеротических бляшек. Активация РААС инициировала воспаление в подлежащих слоях сосудистой стенки, вследствие высокой адгезии и проницаемости для макрофагов, нейтрофилов и инициации воспаления что подтверждено тенденцией к активации таких цитокинов, как ФНО-альфа и значительным повышением активности ВЧ СРБ до 4,7±0,05 мг/л, что свидетельствует о развитии субклинического воспаления. Считается, что повышение уровня цитокинов характеризует не только выраженность эндогенного воспалительного процесса в сосудистой стенке, но и интенсивность апоптоза [7].
Кроме воспалительных изменений сосудистой стенки у женщин с АГ наблюдалось повышение про- и апоптотической активности, также способствующих развитию эндотелиоцитемии – результата преждевременной гибели эндотелиоцитов, происходящей вследствие вышеописанных гормональных, иммунологических, гипоксических и метаболических изменений. Уровень sAPO-1/Fas характеризовал состояние клеточных рецепторов, активация которых запускала ферментативный (каспазный) апоптотический каскад с последующим распадом клеточного ядра. Как свидетельствуют полученные результаты, у обследованных женщин, страдающих АГ II ст., апоптотические механизмы повреждения эндотелиоцитов сочетались с воспалительными, что способствовало потере количества эндотелиоцитов и нарушениям их функции.
Таким образом, активацию апоптоза и десквамации эндотелия сосудистой стенки на фоне интенсификации эндогенного воспалительного процесса у женщин пожилого возраста, страдающих АГ, можно считать причинами и механизмами развития и прогрессирования повреждений сосудистой стенки, развития эндотелиальной дисфункции как одного из ведущих патологических процессов при артериальной гипертонии.
Литература:
Горшунова, Н.К., Украинцева, Д.Н. С-реактивный белок как один из факторов эндогенного воспаления при поражении органов-мимшеней у пожилых пациентов с артериальной гипекртонией //Тезисы докладов международного когресса по гериатрической кардиологии и неинвазивной визуализации сердца совместно с XVI ежегодной научно-практической конференцией «Актуальные вопросы кардиологии№.-Тюмень,2009.-С.59-60
Владимирская, Т.Э. Морфологические изменения и апоптоз эндотелиальных клеток коронарных артерий при атеросклерозе /Т.Э.Влладимирская, И.А. Швед, С.Г. Криворот//Кардиология.-2014.-Т.54.-№12. С.44-46
С-реактивный белок и интерллейкин-6 при поражении органов-мишеней на ранних стадиях у больных гипертонической болезнью /В.А. Дмитриев, Е.В. Ощепкова, В.Н.Титов [и др.] //Кардиологический вестник.-2007.-Т.2,№2.-С.55-61
Горшунова, Н.К., Мауэр, С.С. Коррекция биоэффекторного дисбаланса при эндотелиальной дисфункции у больных артериальной гипертонией пожилого возраста//Фундаментальные исследования.-2013.-№7 (ч.2).С296-360
Srinivas Sriramula/Involvement of Tumor Necrjsis Factor – in Angiotensin II -ted Effects on Salt Appetite. Hypertension. and Cardiac Hypertrophy// Srinivas Sriramula. Masudul Haque. Dewan A.A. Majid. Joseph Francis/ Hupertension. 2008; 51:1345 -1351
Белушкина Н.Н. Молекулярные основы патологии апоптоза/Н.Н.Белушкина, С.Е.Северин// Архив патологии.-2001.-№1.-С.51-60
Рюмшин М.А. Механизмы апоптоза и субклинического воспаления в патогенезе повреждений эндотелия сосудистой стенки при артериальной гипертонии у женщин пожилого возраста //Иатериалы XVII международной научно-практической конференции студентов и молодых ученых в 2частях. Витебск, -2017.-ч.1, С.460-462
Источник
