Механизмы регуляции сосудов мозга
Регуляция мозгового кровообращения осуществляется сложной системой, включающей интра- и экстрацеребральные механизмы. Эта система способна к саморегуляции (т.е. может поддерживать кровоснабжение головного мозга в соответствии с его функциональной и метаболической потребностью и тем самым сохранять постоянство внутренней среды), что осуществляется путем изменения просвета мозговых артерий. Эти гомеостатические механизмы, развившиеся в процессе эволюции, весьма совершенны и надежны. Среди них выделяют следующие основные механизмы саморегуляции.
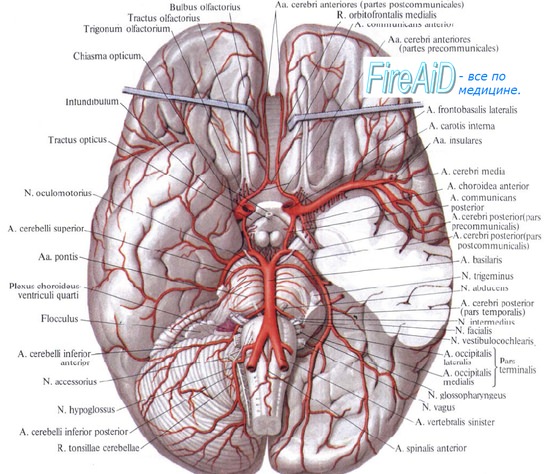
Нервный механизм передает информацию о состоянии объекта регулирования посредством специализированных рецепторов, расположенных в стенках сосудов и в тканях. К ним, в частности, относятся механорецепторы, локализующиеся в кровеносной системе, сообщающие об изменениях внутрисосудистого давления (баро- и прессорецепторы), в том числе прессорецепторы каротидного синуса, при их раздражении расширяются мозговые сосуды; механорецепторы вен и мозговых оболочек, которые сигнализируют о степени их растяжения при увеличении кровенаполнения или объема мозга; хеморецепторы каротидного синуса (при их раздражении суживаются мозговые сосуды) и самой ткани мозга, откуда идет информация о содержании кислорода, углекислоты, о колебаниях рН и о других химических сдвигах в среде при накоплении продуктов метаболизма или биологически активных веществ, а также рецепторы вестибулярного аппарата, аортальной рефлексогенной зоны, рефлексогенные зоны сердца и коронарных сосудов, ряд проприорецепторов. Особенно велика роль синокаротидной зоны. Она оказывает влияние на мозговое кровообращение не только опосредовано (через общее АД), как это представлялось ранее, но и непосредственно. Денервация и новокаинизация этой зоны в эксперименте, устраняя сосудосуживающие влияния, ведет к расширению мозговых сосудов, к усилению кровоснабжения головного мозга, к повышению в нем напряжения кислорода.
Гуморальный механизм заключается в прямом воздействии на стенки сосудов-эффекторов гуморальных факторов (кислорода, углекислоты, кислых продуктов метаболизма, ионов К и др.) путем диффузии физиологически активных веществ в стенку сосудов. Так, мозговое кровообращение усиливается при уменьшении содержания кислорода и (или) увеличении содержания углекислого газа в крови и, наоборот, ослабляется, когда содержание газов в крови меняется в противоположном направлении. При этом происходит рефлекторная дилятация или констрикция сосудов в результате раздражения хеморецепторов соответствующих артерий мозга при изменении содержания в крови кислорода и углекислоты. Возможен и механизм аксонрефлекса.
Миогенный механизм реализуется на уровне сосудов-эффекторов. При их растяжении тонус гладких мышц возрастает, а при сокращении наоборот снижается. Миогенные реакции могут способствовать изменениям сосудистого тонуса в определенном направлении.
Разные механизмы регуляции действуют не изолировано, а в различных сочетаниях друг с другом. Система регулирования поддерживает постоянный кровоток в мозге на достаточном уровне и быстро изменяет его при воздействии различных «возмущающих» факторов.
Таким образом, понятие «сосудистые механизмы» включает структурные и функциональные особенности соответствующих артерий или их сегментов (локализацию в микроциркуляторной системе, калибр, строение стенок, реакции на различные воздействия), а также их функциональное поведение – специфическое участие в тех либо иных видах регуляции периферического кровообращения и микроциркуляции.
Выяснение структурно-функциональной организации сосудистой системы головного мозга позволило сформулировать концепцию о внутренних (автономных) механизмах регуляции мозгового кровообращения при различных возмущающих воздействиях. Согласно этой концепции, в частности, были выделены: «замыкательный механизм» магистральных артерий, механизм пиальных артерий, механизм регуляции оттока крови из венозных синусов мозга, механизм внутримозговых артерий. Суть их функционирования заключается в следующем.
«Замыкательный» механизм магистральных артерий поддерживает в мозге постоянство кровотока при изменениях уровня общего артериального давления. Это осуществляется путем активных изменений просвета мозговых сосудов – их сужения, увеличивающего сопротивление кровотоку при повышении общего АД и, наоборот, расширения, снижающего цереброваскулярное сопротивление при падении общего АД. Как констрикторные, так и дилятаторные реакции возникают рефлекторно с экстракраниальных прессорецепторов, либо с рецепторов самого мозга. Основными эффекторами в таких случаях являются внутренние сонные и позвоночные артерии. Благодаря активным изменениям тонуса магистральных артерий гасятся дыхательные колебания общего артериального давления, а также волны Траубе – Геринга, и тогда кровоток в сосудах мозга остается равномерным. Если же изменения общего АД очень значительны или механизм магистральных артерий несовершенен, вследствие чего нарушается адекватное кровоснабжение головного мозга, то наступает второй этап саморегуляции – включается механизм пиальных артерий, реагирующий аналогично механизму магистральных артерий. Весь этот процесс многозвеньевой. Основную роль в нем играет нейрогенный механизм, однако определенное значение имеют и особенности функционирования гладкомышечной оболочки артерии (миогенный механизм), а также чувствительность последней к различным биологически активным веществам (гуморальный механизм).
При венозном застое, обусловленном окклюзией крупных шейных вен, избыточное кровенаполнение сосудов головного мозга устраняется путем ослабления притока крови в его сосудистую систему вследствие констрикции всей системы магистральных артерий. В таких случаях регуляция происходит также рефлекторно. Рефлексы посылаются с механорецепторов венозной системы, мелких артерий и оболочек мозга (вено-вазальный рефлекс).
Система внутримозговых артерий представляет собой рефлексогенную зону, которая в условиях патологии дублирует роль синокаротидной рефлексогенной зоны.
Таким образом, согласно разработанной концепции, существуют механизмы, ограничивающие влияние общего АД на мозговой кровоток, корреляция между которыми во многом зависит от вмешательства саморегулирующихся механизмов, поддерживающих постоянство сопротивления мозговых сосудов (табл. 1). Однако саморегуляция возможна лишь в определенных пределах, ограниченных критическими величинами факторов, являющихся ее пусковыми механизмами (уровень системного АД, напряжения кислорода, углекислоты, а также рH вещества мозга и др.). В клинических условиях важно определить роль исходного уровня АД, его диапазона, в рамках которого мозговой кровоток сохраняет стабильность. Отношение диапазона этих изменений к исходному уровню давления (показатель саморегуляции мозгового кровотока) в известной мере определяет потенциальные возможности саморегуляции (высокий или низкий уровень саморгеуляции).
Нарушения саморегуляции мозгового кровообращения возникают в следующих случаях.
1. При резком снижении общего АД, когда градиент давления в кровеносной системе мозга уменьшается настолько, что не может обеспечить достаточный кровоток в мозге (при уровне систолического давления ниже 80 мм рт. ст.). Минимальный критический уровень системного АД равен 60 мм рт. ст. (при исходном – 120 мм рт. ст.). При его падении мозговой кровоток пассивно следует за изменением общего АД.
2. При остром значительном подъеме системного давления (выше 180 мм рт. ст.), когда нарушается миогенная регуляция, так как мышечный аппарат артерий мозга утрачивает способность противостоять повышению внутрисосудистого давления, в результате чего расширяются артерии, усиливается мозговой кровоток, что чревато «мобилизацией» тромбов и эмболией. Впоследствии изменяются стенки сосудов, а это ведет к отеку мозга и резкому ослаблению мозгового кровотока, несмотря на то, что системное давление продолжает оставаться на высоком уровне.
3. При недостаточном метаболическом контроле мозгового кровотока. Так, иногда после восстановления кровотока в ишемизированном участке мозга концентрация углекислоты снижается, но рН сохраняется на низком уровне вследствие метаболического ацидоза. В результате сосуды остаются расширенными, а мозговой кровоток – высоким; кислород утилизируется не в полной мере и оттекающая венозная кровь имеет красный цвет (синдром избыточной перфузии).
4. При значительном снижении интенсивности насыщения крови кислородом или увеличении напряжения углекислоты в мозге. При этом активность мозгового кровотока также меняется вслед за изменением системного АД.
При срывах механизмов саморегуляции артерии мозга утрачивают способность к сужению в ответ на повышение внутрисосудистого давления, пассивно расширяются, вследствие чего избыточное количество крови под высоким давлением направляется в мелкие артерии, капилляры, вены. В результате повышается проницаемость стенок сосудов, начинается выход белков, развивается гипоксия, возникает отек мозга.
Таким образом, нарушения мозгового кровообращения компенсируются до определенных пределов за счет местных регуляторных механизмов. Впоследствии в процесс вовлекается и общая гемодинамика. Однако даже при терминальных состояниях в течение нескольких минут за счет автономности мозгового кровообращения в мозге поддерживается кровоток, а напряжение кислорода падает медленнее, чем в других органах, так как нервные клетки способны поглощать кислород при таком низком парциальном давлении его в крови, при котором другие органы и ткани поглощать его не могут. По мере развития и углубления процесса все более нарушаются взаимоотношения между мозговым кровотоком и системной циркуляцией, иссякает резерв ауторегулирующих механизмов, и кровоток в мозге все больше начинает зависеть от уровня общего АД.
Таким образом, компенсация нарушений мозгового кровообращения осуществляется при помощи тех же, функционирующих в нормальных условиях, регуляторных механизмов, но более напряженных.
Для механизмов компенсации характерна двойственность: компенсация одних нарушений вызывает другие циркуляторные расстройства, например, при восстановлении кровотока в ткани, испытавшей дефицит кровоснабжения, в ней может развиться постишемическая гиперемия в виде избыточной перфузии, способствующей развитию постишемического отека мозга.
Конечной функциональной задачей системы мозгового кровообращения являются адекватное метаболическое обеспечение деятельности клеточных элементов мозга и своевременное удаление продуктов их обмена, т.е. процессы, протекающие в пространстве микрососуд – клетка. Все реакции мозговых сосудов подчинены этим главным задачам. Микроциркуляция в головном мозге имеет важную особенность: в соответствии со спецификой его функционирования активность отдельных областей ткани меняется почти независимо от других областей ее, поэтому микроциркуляция также меняется мозаично – в зависимости от характера функционирования мозга в тот или иной момент. Благодаря ауторегуляции перфузионное давление микроциркуляторных систем любых частей мозга менее зависит от центрального кровообращения в других органах. В мозге микроциркуляция усиливается при повышении уровня метаболизма и, наоборот. Те же механизмы функционируют и в условиях патологии, когда имеет место неадекватность кровоснабжения ткани. При физиологических и патологических условиях интенсивность кровотока в микроциркуляторной системе зависит от величины просвета сосудов и от реологических свойств крови. Однако регулирование микроциркуляции осуществляется в основном путем активных изменений ширины сосудов, в то же время при патологии важную роль играют также изменения текучести крови в микрососудах.
Источник
Оглавление темы “Сосудистый тонус. Эндотелий сосудов. Кровоснабжение головного мозга. Кровоснабжение сердца ( миокарда ).”:
1. Регионарное кровообращение. Сосудистый тонус. Эффект Остроумова—Бейлисса.
2. Ауторегуляция кровотока. Теории механизма ауторегуляции кровотока. Миогенная, нейрогенная теория. Теория тканевого давления. Обменная теория.
3. Базальный тонус сосудов. Растяжимость сосудов. Трансмуральное давление. Мобилизация крови из вен.
4. Депонирование крови. Причина головокружения ( обморока ) при вставании. Рабочая ( или функциональная ) гиперемия.
5. Реактивная ( постокклюзионная ) гиперемия. Ауторегуляторная реакция. Функциональная гиперемия органов.
6. Нервная регуляция тонуса сосудов. Парасимпатические воздействия на сосуды. Влияние симпатической нервной системы на сосуды.
7. Влияние простогландинов на сосуды. Воздействие кининов на стенку сосуда.
8. Эндотелий сосудов. Роль ( значение ) эндотелия в регуляции просвета сосудов.
9. Кровоснабжение головного мозга. Интенсивность кровотока в сосудах мозга. Миогенная, гуморальная регуляция мозгового кровотока.
10. Кровоснабжение сердца ( миокарда ). Интенсивность кровотока в сосудах сердца ( миокарда ). Миогенная, гуморальная регуляция коронарного кровотока.
Кровоснабжение головного мозга. Интенсивность кровотока в сосудах мозга. Миогенная, гуморальная регуляция мозгового кровотока.
Интенсивность кровотока в сосудах мозга высока и составляет в состоянии покоя человека 55—60 мл/100 г/мин, т. е. около 15 % сердечного выброса. При относительно небольшой массе (2 % от массы тела) мозг потребляет до 20 % всего кислорода и 17 % глюкозы, которые поступают в организм человека. Интенсивность потребления кислорода мозгом составляет в среднем 3—4 мл/100 г/мин. В отличие от других органов мозг практически не располагает запасами кислорода.
При относительном постоянстве общего мозгового кровотока локальный кровоток в различных отделах мозга не постоянен и зависит от интенсивности их функционирования. Так, при напряженной умственной работе локальный кровоток в коре головного мозга человека может возрастать в 2—3 раза по сравнению с состоянием покоя.
В условиях герметичности и жесткости черепа общее сопротивление сосудистой системы головного мозга мало зависит от изменений давления в его артериях. Так, при повышении АД происходит расширение мозговых артерий, что ведет к повышению давления ликвора, сжатию вен мозга и оттоку ликвора в спинальную полость. При этом сопротивление артерий падает, а вен — возрастает, так что общее сопротивление сосудистой системы мозга в целом практически не меняется.
Миогенная регуляция мозгового кровотока осуществляется за счет реакции гладких мышц артериальных сосудов мозга на изменение давления в них. Повышение АД приводит к возрастанию тонуса миоцитов и сужению артерий, снижение АД — к снижению тонуса и расширению артерий. Миогенная регуляция мозгового кровообращения считается центральным звеном системы ауторегуляции кровообращения в мозге.
Гуморальная регуляция. Мощным регулятором мозгового кровотока является уровень напряжения углекислого газа в артериальной крови и связанный с этим уровень рН спинномозговой жидкости. На каждый миллиметр изменения напряжения С02 величина мозгового кровотока изменяется примерно на 6 %. Возрастание напряжения С02 в крови (гипер-капния) сопровождается расширением мозговых сосудов, а гипокапния — их сужением, столь значительным, что достигается порог кислородной недостаточности мозга (одышка, судороги, потеря сознания). Увеличение мозгового кровотока при гиперкапнии обеспечивает быстрое «вымывание» углекислоты и возвращение уровня напряжения С02 и концентрации водородных ионов к исходной величине.
Метаболическая реакция клеток мозга играет существенную роль при локальных перераспределениях крови между областями мозга, имеющими разный уровень функциональной активности в каждой конкретной ситуации. Локальное повышение функциональной активности нервных клеток приводит к росту в межклеточной среде концентрации аденозина и ионов калия, что ведет к местному расширению сосудов и усилению в них кровотока.
Поскольку уровень концентрации ионов калия в межклеточной среде головного мозга может меняться в течение долей секунды от момента усиления функциональной активности нейронов, описанный механизм считается быстрым контуром регуляции. Более медленный контур регуляции мозгового кровотока связан с повышением напряжения С02 в мозговом веществе вследствие активного потребления кислорода работающими клетками. Это вызывает локальное снижение рН в межклеточной среде и приводит к расширению сосудов активно функционирующей области мозга.
Биологически активные вещества и гормоны могут оказывать как прямое, так и опосредованное влияние на сосуды мозга. К внутрисосудистым вазоконстрикторам относятся: вазопрессин, ангиотензин, простагландины группы F, катехоламины. Сосудорасширяющий эффект оказывают: аце-тилхолин, гистамин (средние и крупные артерии), брадикинин (мелкие артерии).
Нейрогенная регуляция сосудов головного мозга менее эффективна, чем метаболическая. Основной зоной приложения нейрогенных влияний являются мелкие артериальные мозговые сосуды диаметром до 25—30 мкм. Доказано существование адренергических, холинергических, серотонинергических и пептидергических нервных волокон, обеспечивающих регуляцию тонуса мозговых сосудов, Нервные влияния на стенку сосудов головного мозга опосредуются через а- и (B-адренорецепторы (норад-реналин), М-холинорецепторы (ацетилхолин, вазоинтестинальный пептид), D-рецепторы (серотонин).
Основной источник нервных влияний на сосуды мозга — постганглио-нарные симпатические волокна, начинающиеся в верхних шейных ганглиях. Существование парасимпатических влияний на мозговые сосуды не доказано.
Нейрогенные влияния на кровоснабжение мозга во многом зависят от выраженности ауторегуляции, исходного тонуса сосудов, напряжения СO2, O2, состава и концентрации ионов, присутствия биологически активных веществ в спинномозговой жидкости и тканях мозга. Именно поэтому конечный эффект нейрогенных влияний на мозговой кровоток не однозначен.
– Также рекомендуем “Кровоснабжение сердца ( миокарда ). Интенсивность кровотока в сосудах сердца ( миокарда ). Миогенная, гуморальная регуляция коронарного кровотока.”
Источник
Ауторегуляция мозгового кровообращения. Нервная и гуморальная регуляция сосудов головного мозгаАуторегуляция мозгового кровообращения – это способность поддерживать постоянство объемного мозгового кровотока в условиях изменения перфузионного давления в основном за счет колебаний артериального давления (Мчедлишвили Г.И., 1968; Ганнушкина И.В., 1975; Москаленко Ю.Е., 1984; Москаленко Ю.Е. и соавт., 1988; Fog, 1938; Lassen, 1964; Harper, 1966; Ekstrom-Jodal et al., 1971; Berne et al., 1981; Paulson et al., 1989). При повышении артериального давления (АД) резистивные сосуды суживаются и ограничивают приток крови к мозгу, а при снижении – расширяются и увеличивают приток крови к мозгу, в результате мозговая перфузия остается неизменной при колебании системного АД (Зеликсон Б.Б., 1973; Wahl, Schilling, 1993). В основе ауторегуляции мозгового кровообращения лежат три взаимосвязанных механизма, нейрогенный, гуморально-метаболический и миогенный (Aaslid, 1992; Wahl, Schilling, 1993). Заметим, что мозговая ауторегуляция не является каким-то особенным и обособленным видом регуляции церебральной гемодинамики. Этот достаточно сложный механизм базируется на известных для любого сосудистого региона видах регуляции сосудистого тонуса, имея при этом некоторые особенности. В связи с этим ниже представляем краткую характеристику основных вариантов регуляции мозгового кровообращения. Нервная система, безусловно, участвует в регуляции мозговой гемодинамики. При этом мозговой кровоток крайне мало снижается {всего на 5-10%) при максимальной стимуляции симпатических нервов (Фолков Б., Нил Э., 1976; Лассен Н.А., 1982). Этот факт позволил сделать вывод о малой функциональной роли нервных влияний в регуляции мозгового кровотока. Роль нервной системы ограничивается модулирующими влияниями на другие контуры регуляции мозговой гемодинамики (Москаленко Ю.Е., 1984), как уже упоминалось выше.
Гуморальная регуляция мозгового кровообращения в основном связана с функционированием ренин-ангиотензиновой и калликреин-кининовой систем. Ангиотензин II обладает констрикторным действием на мозговые сосуды (Enoch et al., 1978; Reynier-Rebuffel etal., 1983; Das, Ghosh, 1997). В некоторых случаях гуморальные стимулы избирательно изменяют резистентность крупных мозговых артерий, правда без изменений кровотока вследствие реакций мелких мозговых сосудов (Faraci et al., 1988), т.е. некоторые гуморальные факторы производят противоположные сосудистые эффекты в крупных и мелких артериях, что выражается в незначительных изменениях суммарного кровотока. Согласно сформулированной более 100 лет назад метаболической концепции Roy и Sherrington, метаболическая регуляция мозговой гемодинамики в виде усиления локального мозгового кровотока является следствием увеличения концентрации в нейронах конечных продуктов метаболизма (Н+, К+, аденозина), в связи с повышением нейрональной активности (Шахнович А.Р., Шахнович В.А., 1996; Aaslid, 1987; Klingelhofer et al., 1996; Sandor, 1999). Наиболее изученной является реакция тонуса мозговых сосудов на изменение напряжения С02 в артериальной крови, о чем уже говорилось выше. В основе миогенной регуляции мозгового кровообращения лежит способность сосудистой стенки реагировать сокращением на повышение и расслаблением на снижение внутрисосудистого давления. Этот феномен был впервые описан Остроумовым В.И., а затем подтвержден в опытах Бейлисса (Конради Г.П., 1973). Эндотелийзависимая регуляция тонуса кровеносных сосудов осуществляется благодаря выработке эндотелиальными клетками биологически активных субстанций вазодилататорного и вазоконстрикторного действия. Важнейшими дилататорами являются оксид азота, эндотелиальный фактор гиперполяризации (EDHF), простациклин, натрийуретический пептид С-типа и адреномедуллин (Kukreja et al., 1993; Katusic et al., 1989)- Кроме того, в сосудистой стенке синтезируется важнейший дилататор – брадикинин. Изменение соотношения продукции эндотелием дилататоров и констрикторов, про- и антитромбогенных факторов и связанная с этим дизрегуляция сосудистого тонуса и реологии крови обозначается как дисфункция эндотелия (Luscher et al.,1993; Vanhoutte, 1997; Sobrevia, Mann, 1997). – Также рекомендуем “Артериальное давление сосудов головного мозга. Особенности мозговой гемодинамики” Оглавление темы “Допплерография мозговых сосудов”: |
Источник
