Молекула ударяется о стенку сосуда
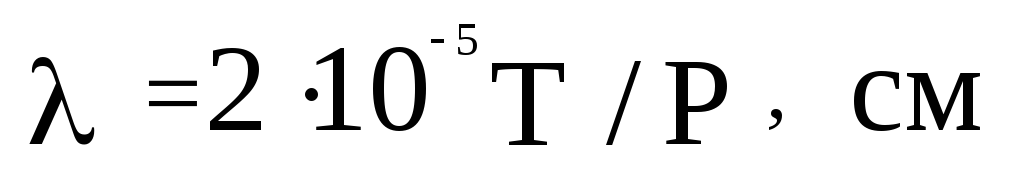
Молекулы ударяются о стенки сосуда, создавая тем самым давление. Его мерой является сила ударов движущихся молекул о поверхность в 1 в 1 с. С повышением температуры скорость движения молекул увеличивается, вместе с тем увеличивается и число ударов молекул о стенки сосуда, т. е. растет давление газа. [c.21]
Кинетическая теория дает простое объяснение закону Бойля. Молекула при ударе о стенку сосуда, в котором находится газ, отражается от стенки, передавая ей импульс (количество движения) таким образом, удары молекул газа о стенку создают давление газа, которое уравновешивается внешним давлением, оказываемым на газ. Если объем уменьшается вдвое, то каждая молекула ударяется о стенку сосуда вдвое чаще, а следовательно, давление увеличивается в два раза. Закон Шарля и Гей-Люссака имеет столь же простое объяснение. Если абсолютная температура увеличивает- ся вдвое, то скорость молекул возрастает в ]/ 2 раза. Это приводит к уве- I личению числа ударов молекул о стенку в ]/2 раза большему, чем прежде, причем сила каждого удара возрастает в]/ 2 раза, и, таким образом, само давление удваивается (У 2 X ]/”2 = 2) при увеличении вдвое абсолютной температуры. На основании того, что средняя кинетическая энергия молекул газа одинакова для всех газов при данной температуре, можно объяснить также и закон Авогадро. [c.290]
Далее, Ван-дер-Ваальс учел, что молекула газа, испытывающая притяжение со стороны других молекул, ударяется о стенку сосуда с меньщей силой, чем если бы такое притяжение отсутствовало. Когда молекула приближается к стенке сосуда, между ними остается меньще молекул, чем в газе, находящемся позади молекулы (рис. 3-18). Число столкновений со стенкой за произвольный промежуток времени пропорционально плотности газа, а каждое столкновение смягчается вследствие больщего притяжения остающимися в толще газа молекулами, которое также пропорционально их плотности. Таким образом, поправка к измеряемому давлению Р должна быть пропорциональна квадрату плотности газа, т.е. обратно пропорциональна квадрату его объема Р = Р + а/У , где постоянная а определяется притяжением между молекулами. Окончательный вид уравнения Ван-дер-Ваальса таков [c.153]
Молекула, ударяя о стенку, приносит количество движения- -ms,., а отлетая от нее (ввиду полной упругости) -ms . Приращение количества движения равно + msx – ( = -f 2т . [c.147]
Давление газа обусловлено ударами молекул о стенки сосуда, заключающего газ. Если молекула ударяется о стенку сосуда с силой /, которая действует некоторое время Д то импульс этой силы равен ft. При обычных условиях за 1 сек о стенки сосуда ударяется очень много молекул. Каждая молекула при ударе сообщает стенке импульс определенной величины. Все молекулы, ударяющиеся о стенки сосуда, сообщают им сумму импульсов [c.13]
Кроме того, учитывая, что в среднем молекула ударится о стенку тем большее число раз и тем лучше приспособится, чем глубже она проникнет в пору, можно ожидать, что стенка поры тем более уязвима, чем глубже она расположена ). Поэтому кажется естественным, что горение углубляет первоначальные неровности поверхности углерода. Тот факт, что коэффициент шероховатости становится тем больше, чем менее активен газовый реагент, как мы это вскоре увидим (25 при использовании Оз 40 при НгО 100 при СОг), согласуется с этим объяснением. [c.151]
Если газ находится в закрытом сосуде, то, обладая способностью неограниченно расширяться, он целиком заполняет весь объем и оказывает на внутренние стенки сосуда равномерное давление. В результате хаотического движения молекулы газа не только сталкиваются друг с другом, но и беспрерывно бомбардируют стенки сосуда. Каждая молекула, ударяясь о стенку, воздействует на нее в течение очень малого времени с определенной силой. Сумма этих беспорядочных уда [c.8]
Молекула, ударяя о стенку, приносит количество движения 4-а отлетая от нее (ввиду полной упругости)-тИх- Приращение количества движе НИН равно – – ти – ( – ин -) = 2ти .. [c.126]
Чем больше концентрация газа в сосуде, тем большей плотности масса газа стоит позади каждой молекулы и тем чаще молекула соударяется от этой массы и тем чаще она отталкиваясь от них ударяет о стенку сосуда. Но при этом каждая молекула еще и отталкивает соответственно большее количество молекул назад от стенки. Поэтому хотя каждая отдельная молекула гораздо чаще ударяется о стенку но мере роста концентрации, но общее количество ударов молекул о стенку увеличивается не в процессе количества молекул умноженное на количество ударов каждой молекулы, а увеличивается просто в пропорции к количеству молекул, потому, что, чем чаще каждая молекула ударяется о стенку, тем большее количество молекул она отталкивает назад, которые могли бы удариться об эту стенку. [c.205]
Давление газа на стенки сосуда создается за счет более частого отталкивания молекул друг от друга и соударения со стенками сосуда. Чем больше концентрация молекул, тем короче путь каждой молекулы к стенке после отскока, тем чаще каждая молекула ударяется о стенку, создавая большее давление. [c.220]
Ну а если % доля реакциоппоспособных молекул увеличивается в 10 раз и во столько же раз уменьшается концентрация молекул. Всего было 100 молекул, из них 1 реакционноспособная. Количественная доля последних возросла в 10 раз и стало 10 реакциоппоспособных молекул. Но общая концентрация молекул уменьшается в 10 раз и тогда осталась опять 1 реакционноспособная молекула. Но если % доля реакциоппоспособных молекул растет быстрее, чем уменьшается их количество, то тогда другое дело. В этом случае количество реакционноспособных молекул остается в микропоре больше, чем опи удаляются. Этот случай возможен когда % доля реакционноспособных молекул очень низка, а возрастание частоты соударения каждой молекулы при уменьшении диаметра пор происходит всегда с одинаковой скоростью. Чем меньше доля реакционноспособных молекул тем быстрее эта доля способна возрастать. Было 100 молекул из них 1 реакционноспособная, или было 100 молекул из них 10 реакционноспособных. Каждая молекула ударилась о стенку в 10 раз чаще Чтобы в микропоре всегда происходило опережение скорости роста новых минералов над скоростью растворения минералов исходной породы, падо, чтобы частота соударения каждой молекулы о стенку микропоры возрастала быстрее, чем скорость [c.296]
А что если сосуд сделать с гибкой стенкой, а фронт растворенных молекул ударившись о стенку создаст на нее давление и прогнет эту стенку. Но все дело в том, что скорость давления, создаваемого молекулами настолько быстрая, а расстояние прогиба (менее одного среднего расстояния между молекулами) настолько маленькое, что никакой материал не способен испытать прогиб. [c.402]
Молекулы растворенного вещества у стенки в процессе диффузионного движения в первое мгновение создают давление на стенки сосуда, соударяясь с ними. Но каждая молекула, создав давление, отскакивает обратно и сразу же оттягивает от стенки часть массы растворителя. Поэтому удар молекул о стенку сразу же нейтрализуется нротивоноложно направленной силой оттягивания молекул воды от стенки и поэтому растворенные молекулы никакого давления на стенку не создают. Хотя каждая молекула растворенного вещества чаще соударяется со стенкой, чем молекула растворителя, но поскольку каждый удар молекулы означает, что здесь не ударилась молекула растворителя, поскольку плотность жидкости здесь такова, что чтобы о стенку ударилась какая-либо молекула, она должна оттеснить от стенки другую молекулу и чем чаще растворенные молекулы ударяются о стенку, тем чаще они отталкивают от стенки молекулы растворителя, которые, следовательно, уже не соударяются о стенку. Иными словами давление на стенку молекулы жидкости не создают, т.к. жидкость имеет постоянный объем и всякое стремление молекул расширится тут же нейтрализуется притяжением молекул назад в жидкость. [c.393]
В общем то, конечно, чем больше молекул, тем больше ударов о стенку они создают, тем больше давление, но это не непосредственная причина, а просто в целом общее представление. Непосредственной же причиной является то, что каждая молекула, ударившись о стенку, имеет возможность снова к ней вернуться, оттолкнувшись от себе подобных молекул. Именно возможность каждой молекулы вернуться назад после отталкивания и является главным фактором создаваемого давления. Если нет этого отталкивания, то не и давления. Непосредственно у самой стенки каждая молекула находясь близко от стенки имеет возможность очень часто [c.424]
Микронородиффузия отсасывает молекулы растворителя из интерстиций между коллоидными частицами поскольку опи являются гибкими, пластичными, позволяя отсасывать весь раствор из иптерстиций между коллоидными частицами. Молекулы, ударяясь о стенки щели, стремятся как бы выровнять ее конфигурацию. [c.176]
Разуплотненность молекул в поверхностном слое создается за счет более быстрого их удаления из этого слоя. В целом они на стенки сосуда создают такое же большое количество ударов, как и друг с другом в глубине жидкости, но общее количество одновременно присутствующих здесь молекул меньше, чем в глубине газа, т.к. здесь молекулы, ударившись о стенку, быстро удаляются от нее, не задерживаясь здесь в этом объеме пространства. [c.519]
Приходящие из глубины молекулы ударяют о стенку с такой же частотой, как и друг с другом, но уходят они от стенки гораздо быстрее, чем приходят, поэтому у стенки создается разуплотпепие молекул вследствие различия в скорости прихода и скорости ухода от стенкп. Поэтому здесь количество одновременно присутствующих молекул меньше, чем в объеме пространства п этим создается разуплотненный поверхностный слой. Но в первое мгновение встречи молекул со стенкой они создают избыточное давление на нее – это и есть давление разунлотнения. [c.519]
Но если молекула ударяется о стенку сосуда, то она никакого фактического давления на нее не способна оказать, т.к. давление на стенки создается за счет ударов молекул. Но молекулы имеют одинаковую кинетическую энергию и их количество у стенки согласно закону Авогадро одинаково, независимо от количества растворенного вещества. Значит, все они создают удары на стенку с одинаковой энергией и чем чаще, нанример, молекула растворенного вещества ударяет о стенку, тем соответственно реже ударяют о стенку молекулы растворителя. Причем независимо от того, чаще эта растворенная молекул ударяет, потому что больше концентрация вещества, или она чаще подходит к стенке вследствие действия решетчато-пружинпого механизма. Здесь нет никакого преимущества для обоих сортов молекул. Поэтому хотя давление и существует, но фактически оно в этом случае не проявляется. [c.567]
Вообще существует ли сила притяжения какой-либо твердой плоскости к поверхности воды Кога вода в новообразующихся трещин касается ее стенок в острие трещин, то она в это первое мгновение плотно прижимается к ней своими глубинными слоями. Но потом скачущие молекулы ударяются о стенки и зеркально отражаясь создают прострел в массе воды создавая этим разуплотнение. [c.625]
Курс физической химии Том 2 Издание 2 (1973) — [ c.102 ]
Источник
Получим формулу для вычисления числа ударов молекул в единицу времени о единичную площадь стенки сосуда, в котором находится газ.
Возьмем на стенке сосуда, бесконечно малую площадку dS, перпендикулярную оси Z системы координат XYZ ( рис. 8).
На этой площадке , как на основании, построим бесконечно узкий цилиндр с осью, имеющей направление, определяемое сферическими углами j и J,идлина которой равна vdt, где v – скорость молекулы, dt – промежуток времени. Объем этого цилиндра
, (1.4.1)
а число молекул в нем dn=ndV, где n – концентрация молекул в сосуде. Из-за хаотичности движения не все dn молекул достигнут площадки dS за время dt. Ее достигнут только те из молекул, которые, во-первых, движутся в направлении к площадке dS и, во-вторых, имеют скорости, близкие к u, при этом за время dt они проходят расстояние udt, равное длине образующей цилиндра, и достигают площадки dS. Найдем число таких молекул в объеме dV цилиндра.
И если к моменту времени t эти молекулы находились в объеме dV цилиндра, тогда время от t до t+dt все они достигнут площадки dS.
Р и с. 8
Обозначим через dnu число молекул в единице объема газа, которые имеют скорости, заключенные в интервале (u, u+du). Пусть среди этих молекул молекул в единице объема имеют направления движения, определяемые сферическими углами, взятыми из интервалов (j,j+dj) и (J,J+dJ). Согласно формуле (1.3.5), количество таких молекул в единице объема газа равно
(1.4.2)
Число же указанных молекул в объеме dV рассматриваемого цилиндра
dnu,J,j=dnu,J,j × dV (1.4.3)
С учетом формул (1.4.1) и (1.4.2) выражение (1.4.3) примет вид
(1.4.4) Таким образом, среди всех молекул, находящихся в объеме dV цилиндра, dnu,J,j молекул имеют близкие к u скорости, и их направления движения определяются углами, близкими к углам J и j. Однако из объема V, занимаемого газом, к площадке dS подлетают молекулы с других направлений и с иными скоростями. Чтобы учесть эти молекулы, необходимо проинтегрировать выражение (1.4.4) по всем возможным углам j и J и скоростям u:
(1.4.5)
Сферический угол J в общем случае изменяется от 0 до p. В выражении (1.4.5) интегрирование по J произведено от 0 до p/2, так как при интегрировании по J в пределах от p/2 до p рассматриваемые молекулы, как легко видеть из рис.8, будут иметь направление движения, соответствующее их удалению от площадки.
Разделив обе части соотношения (1.4.5) на dtdS, получим
(1.4.6)
Таким образом, выражение (1.4.6) определяет число ударов молекул газа в единицу времени о единичную площадку стенки сосуда.
Для выяснения смысла величины интеграла в выражении (1.4.6) умножим и разделим его на концентрацию молекул n=N/V.
(1.4.7)
Если обозначить через dNu число молекул в объеме V, которые имеют скорость от u до u + du, то dnu=dNu /V будет определять число таких молекул в единице объема газа. Величина же
(1.4.8)
при больших N представляет собой вероятность того, что случайно “взятая” в газе молекула будет иметь скорость, заключенную в интервале (u,u+du). Эта вероятность связана с функцией распределения (плотностью вероятности) следующим соотношением (см. А.23):
(1.4.9)
Функция распределения молекул по скоростям F(u) является важнейшей характеристикой равновесного состояния газа. Ее явный вид будет получен в последующих параграфах из весьма общих предпосылок.
С учетом формул (1.4.8) и (1.4.9), выражение (1.4.7) примет вид
(1.4.10)
Интеграл, стоящий в соотношении (1.4.10), представляет среднее значение скорости (см. формулу (А.25) Приложения А):
(1.4.11)
Поэтому
(1.4.12)
Как видно из выражения (1.4.12), число ударов молекул газа в единицу времени о единичную площадку пропорционально концентрации и средней скорости их движения, что находится в полном согласии с нашей интуицией.
Пример
1. В космическом корабле находится воздух объема V с концентрацией n0, поддерживаемый при постоянной температуре. За бортом корабля вакуум. Найти зависимость концентрации молекул воздуха в корабле от времени, если в тонкой части его стенки образовалось малое отверстие площади S?

Решение. Пусть через время t после образования отверстия концентрация воздуха в корабле стала равной n(t). Тогда число молекул воздуха, влетающих в отверстие площади S за время dt (от момента t до t+dt), согласно формуле (1.4.5)
dn= n(t)<u>Sdt (1.4.13)
Эти молекулы покидают кабину корабля. С другой стороны, это число молекул можно выразить иначе.
Изменение концентрации воздуха в корабле за время dt (от t до t+dt)
Откуда находим
dn = -Vdn (1.4.14)
Сравнивая выражения (1.36) и (1.37), получаем
(1.4.15)
Проинтегрируем равенство (1.4.15).
Откуда находим искомую зависимость концентрации от времени
(1.4.16)
Источник
При решении ряда задач, встречающихся в вакуумной технике, часто требуется знать среднее число молекул газа n , ударяющихся о единицу поверхности стенки за единицу времени. Для числа ударов  кинетическая теория дает выражение
кинетическая теория дает выражение
 (2.16)
(2.16)
Подставив в уравнение (2.16) значение n из (2.15) и  из (2.6), получим
из (2.6), получим
 (2.17)
(2.17)
Следовательно, при постоянной температуре число ударов молекул о стенку пропорционально давлению газа. Заменяя в уравнении (2.17) массу молекулы m молекулярной массой М, имеем
(2.18)
если Р выражено в мм рт.ст., Т в Кельвинах, М в граммах.
2.6.Направление скоростей молекул после удара о стенку
Многочисленные опыты показывают, что молекулы газа после удара о стенку отлетают от нее в направлениях, совершенно не связанных с углом их падения, и подчиняются “закону косинуса”:
 (2.19)
(2.19)
где n – число молекул, отлетающих в единицу времени по нормали к поверхности и заключенных в единице телесного угла;  – число молекул, отлетающих под каким-либо другим углом
– число молекул, отлетающих под каким-либо другим углом  по отношению к нормали.
по отношению к нормали.
Этот механизм вытекает из механизма соударения, согласно которому молекулы, ударяясь о стенку, не отрекаются, как упругие шары, а удерживаются на ней силами сцепления в течение некоторого времени. Затем под влиянием теплового движения в твердом теле они покидают стенку, подчиняясь вероятностным законам испарения.
2.7.Число взаимных столкновений молекул газа.
Находясь в хаотическом движении, молекулы газа не только ударяются о стенки сосуда, но и непрерывно сталкиваются между собой. Вследствие этого каждая молекула движется по сложной пространственной ломаной траектории, прямолинейные участки которой соответствуют ее свободному перемещению без столкновений. Для подсчета числа столкновений молекулы газа рассматриваются как твердые шары радиуса r, а их соударения считают упругими. При этих допущениях столкновения двух молекул могут иметь место тогда, когда расстояние между их центрами меньше 2r (рис.2.2). Предположив, что все молекулы неподвижны, за исключением одной

Рис.2.2. К вычислению средней длины свободного пробега молекул газа
(меченой), движущейся со скоростью U, найдем, что число столкновений  одной молекулы за единицу, времени будет равно количеству молекул, которые встретятся на пути меченой молекулы, и центры которых находятся в объеме цилиндра с радиусом
одной молекулы за единицу, времени будет равно количеству молекул, которые встретятся на пути меченой молекулы, и центры которых находятся в объеме цилиндра с радиусом  и высотой, численно равной скорости U, т.е.
и высотой, численно равной скорости U, т.е.
 (2.20)
(2.20)
где n – число молекул газа в единице объема.
В действительности же все молекулы газа участвуют в тепловом движении, и их скорости распределены согласно закону Максвелла – Больцмана. Учет этого обстоятельства позволяет уточнить формулу (2.20):
 , (2.21)
, (2.21)
где  – средняя арифметическая скорость молекул газа.
– средняя арифметическая скорость молекул газа.
Так как все n молекул движутся друг относительно друга, то полное число соударений Z, имеющих место в единице объема за единицу времени, можно получить умножением выражения (2.21) на n/2, потому что теперь каждое соударение учитывается дважды. Тогда окончательно имеем
 , (2.22)
, (2.22)
или с учетом уравнения (2.6)
 , (2.23)
, (2.23)
2.8.Средняя длина свободного пробега молекул газа
Вследствие хаотичности теплового движения прямолинейные участки молекул газа между двумя столкновениями не могут быть одинаковыми. Однако из-за наличия определенного закона распределения длин свободных пробегов можно, аналогично понятию средней скорости теплового движения, говорить о средней длине прямолинейных участков между двумя столкновениями. Эта величина также является вполне определенной и называется средней длиной свободного пути или средней длиной свободного пробега  . Ее можно определить, разделив средний путь, проходимый одной молекулой за единицу времени
. Ее можно определить, разделив средний путь, проходимый одной молекулой за единицу времени  , на число свободных пробегов (число соударений)
, на число свободных пробегов (число соударений) :
:
 , (2.24)
, (2.24)
Отсюда видно, что средняя длина свободного пробега в однородном газе обратно пропорциональна концентрации молекул, а, следовательно, в соответствии с уравнением (2.14) зависит от давления газа
 , (2.25)
, (2.25)
Подставив в уравнение (2.25) значение константы Больцмана и выразив Т в кельвинах, Р в мм рт.ст.,  в сантиметрах, получим
в сантиметрах, получим
 (2.26)
(2.26)
В приближенных расчетах для легких газов ( ,
, 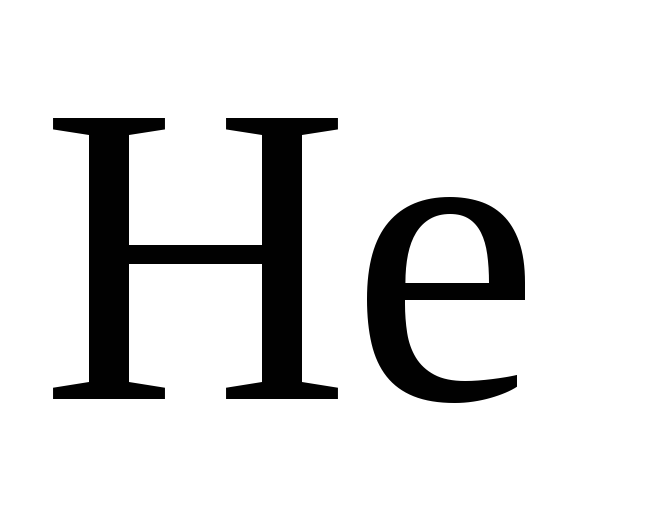 ,
, 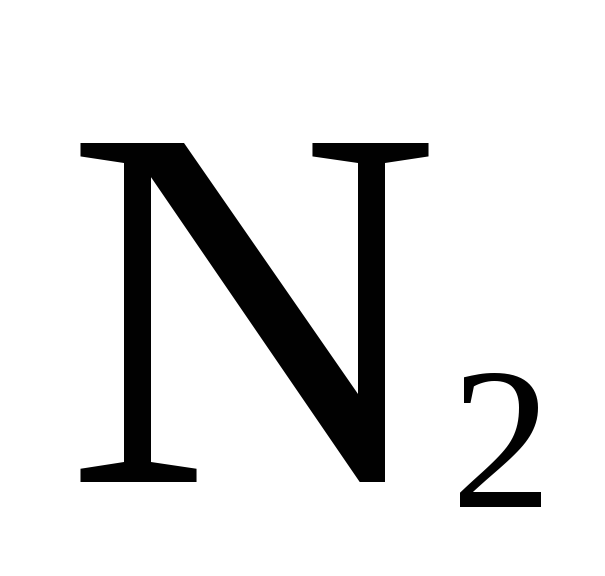 ,
,  , воздух и
, воздух и  ) обычно пользуются величиной
) обычно пользуются величиной  . Тогда формула (2.26) упрощается до вида
. Тогда формула (2.26) упрощается до вида
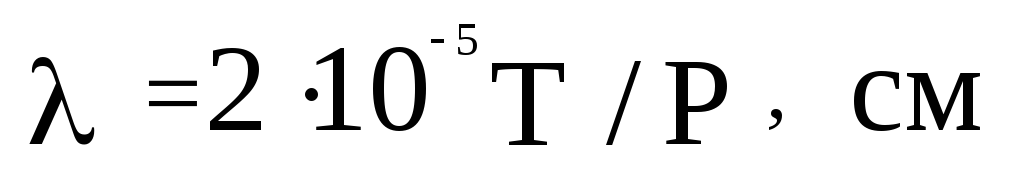 . (2.27)
. (2.27)
Принятое выше допущение, что молекулы газа в процессе соударения взаимодействуют чисто механически как твердые упругие шары, приводит к независимости средней длины свободного пробега от температуры. Однако, из опыта хорошо известно, что с понижением температуры средняя длина свободного пробега уменьшается. Более точный расчет, проведенный с учетом зависимости газокинетического эффективного радиуса молекулы от скорости, также дает зависимость средней длины свободного пробега молекул от температуры газа
 , (2.28)
, (2.28)
где  – средняя длина свободного пробега при температуре Т; С – постоянная Сезерленда, т.е. температура, при которой газокинетический поперечник молекулы удваивается. Для воздуха С= 113.
– средняя длина свободного пробега при температуре Т; С – постоянная Сезерленда, т.е. температура, при которой газокинетический поперечник молекулы удваивается. Для воздуха С= 113.
Для оценки длин свободного пробега молекул воздуха при любых давлениях и комнатной температуре можно пользоваться приближенным выражением
 . (2.29)
. (2.29)
Соседние файлы в папке старые
- #
- #
- #
- #
- #
- #
Источник
