Норма скорости кровотоков сосудов головного мозга
Показатели функционирования головного мозга в норме. Потребление кислорода, мозговой кровоток
Целью анестезиологического пособия в хирургии аневризм головного мозга является:
1. Защита организма пациента от хирургического стресса.
2. Защита непосредственно головного мозга с целью минимизации операционной травмы, риска периоперационного разрыва аневризмы и развития церебральной ишемии.
3. Создание благоприятных условий для проведения операции.
Успешное лечение нейрохирургических больных невозможно без адекватного анестезиологического пособия. Неадекватная анестезия и недостаточная миорелаксация, сопровождающиеся артериальной гипертензией или гипотонией, гипоксией и гипер-капнией, кашлем, часто приводят к нарушению кровоснабжения головного мозга. С помощью тщательного мониторинга и поддержания в пределах физиологической нормы параметров гомеостаза головного мозга можно достигнуть лучших результатов, чем при использовании сложных методик защиты мозга.
А. Потребление мозгом кислорода (ПМО2) колеблется в пределах 3—3,8 мл/100 г (вещества мозга)/мин. Уровень метаболизма клеток головного мозга очень высок, а запасов энергетических субстратов в нем мало. Несмотря на то, что масса мозга составляет около 2% от массы тела, на его долю приходится около 20% общей потребности в кислороде всего организма. Это обстоятельство предопределяет высокую степень чувствительности нейронов к гипоксии и ишемии.
Б. Мозговой кровоток (МК) в норме составляет 45—65 мл/100 г/мин. Это соответствует 15% сердечного выброса.
1. СО2-реактивность. При повышении парциального давления углекислого газа в артериальной крови наблюдается дилатация сосудов и возрастание мозгового кровотока, и, наоборот, снижение РаСО2 приводит к вазоконстрикции и редукции МК. Повышение РаСО2 вдвое с 40 до 80 мм рт. ст. — удваивает МК, а снижение, наоборот, во столько же раз его уменьшает.
Гипервентиляция за счет резкого снижения мозгового кровотока может приводить к снижению ВЧД, в среднем на 50% в течение 2-30 минут. Нарушение СО2-реактивности может наблюдаться при различной патологии ЦНС, в том числе, и при церебральной ишемии.
2. Гипоксия. Гипероксия в нормальных условиях мало влияет на мозговой кровоток. Однако гипоксия (снижение парциального давления кислорода ниже 50 мм рт. ст.) вызывает резкое повышение мозгового кровотока, что объясняется аккумуляцией кислых метаболических продуктов, прежде всего, молочной кислоты.
3. Ауторегуляция мозгового кровотока. Очень важная особенность мозгового кровотока — феномен его ауторегуляции, существенным элементом которой является миогенный механизм. Повышение давления внутри сосуда приводит к повышению тонуса его гладких мышц и сосудистому спазму, и наоборот, снижение давления внутри сосуда — к релаксации сосудов и увеличению их диаметра. Этот механизм эффективен в пределах среднего артериального давления (АДср) от 50 до 150 мм рт. ст.
Повышение АДср выше 150 мм рт. ст. ведет к расширению сосудов мозга, нарушению гематоэнцефалического барьера (ГЭБ), отеку и ишемии головного мозга, а снижение Адср ниже 50 мм рт. ст. — к максимальному расширению сосудов мозга и пассивному кровотоку.
В. Внутричерепное давление (ВЧД). Определяется в полости черепа тремя основными объемами: объем вещества мозга (80—85% от общего объема), кровь (4-8%) и ЦСЖ (10-12%). Согласно известной доктрине Монро-Келли, между тремя составляющими в полости черепа должно соблюдаться динамическое равновесие.
Г. Церебральное перфузионное давление (ЦПД). ЦПД в норме мало отличается от среднего АД (АДср = АД сист + 2АД диаст/3), но у больных с внутричерепной гипертензией ЦПД = Адср – ВЧД. Так, например, если во время анестезии и операции отмечается рост ВЧД, то следует не допускать снижения Адср и быстро проводить его коррекцию посредством инфузионной терапии или своевременным назначением катехоламинов.
– Также рекомендуем “Механизмы развития ишемии мозга. Патогенез”
Оглавление темы “Гидроцефалия. Защита мозга”:
- Диагностика гидроцефалии. Вентрикулокраниальный индекс (ВКИ)
- Риски развития гидроцефалии после субарахноидального кровоизлияния. Прогнозирование
- Методы лечения гидроцефалии. Шунтирующие системы
- Техника вентрикулоперитонеального шунтирования гидроцефалии. Этапы операции
- Результаты шунтирования гидроцефалии. Последствия
- Показатели функционирования головного мозга в норме. Потребление кислорода, мозговой кровоток
- Механизмы развития ишемии мозга. Патогенез
- Защита мозга. Гипотермия
- Фармакологическая защита мозга. Препараты
- Техника анестезии при аневризме мозга. Предоперационное обследование и индукция
Источник
УЗИ сканер HS70
Точная и уверенная диагностика. Многофункциональная ультразвуковая система для проведения исследований с экспертной диагностической точностью.
Уже более 20 лет допплерография используется для оценки мозгового кровотока у новорожденных детей. Хорошо изучены подходы для визуализации внутричерепных артерий и вен, разработаны стандартные показатели, снимаемые с допплеровской кривой. Но интерпретация полученных результатов по-прежнему затруднена. Допплерография является, с одной стороны, очень тонким методом, позволяющим регистрировать малейшие изменения регионального кровоснабжения, а с другой стороны, относительно грубым в силу зависимости от большого количества “внемозговых” факторов. К такому самому весомому фактору относится состояние сердечной гемодинамики. В литературе часто встречаются сообщения о так называемых кардиоцеребральном синдроме, транзиторной дисфункции миокарда у новорожденных, перенесших гипоксию [1, 2], однако изменения в сердце и головном мозге в этих исследованиях рассматриваются изолированно. Поэтому в нашей работе мы попытались одновременно оценить состояние центральной и церебральной гемодинамики у новорожденных детей с целью выявления возможной связи между ними.
Материалы и методы
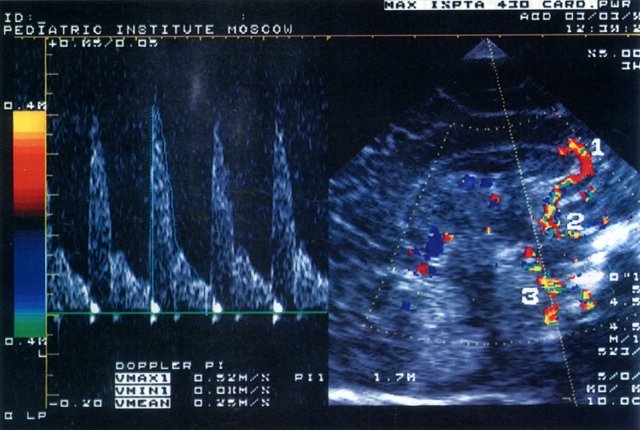
Было обследовано 103 ребенка (I группа – 58 детей, родившихся недоношенными со сроком гестации 27-36 недель и массой при рождении от 910 до 1910 г, II группа – 45 детей, родившихся доношенными с массой от 2070 до 4400 г) в возрасте от 4 дней до 6 месяцев. Исследования проводились в динамике через 7-10 дней во время пребывания ребенка в стационаре на втором этапе выхаживания, а затем при явке его для наблюдения в поликлинику Научного центра здоровья детей РАМН (НЦЗД). Состояние всех детей в момент обследования было стабильным, а в клинической картине ведущей была неврологическая симптоматика различной степени тяжести. Всем пациентам проводили ультразвуковое исследование мозга и цветную допплерографию внутричерепных сосудов – передней мозговой, внутренней сонной и базиллярной артерий (рис. 1). Учитывали максимальную систолическую скорость (Vmax), среднюю скорость кровотока за время сердечного цикла (Vmean), минимальную диастолическую скорость (Vmin) и индекс резистентности RI=(Vmax-Vmin)/Vmin. Параллельно проводили ЭХО-кардиографическое исследование, определяя общий ударный объем (УО), вычисляемый как разница между диастолическим и систолическим объемами левого желудочка; эффективный ударный объем (УО эфф); минутный объем кровообращения (МО); фракцию изгнания (ФИ). Все ультразвуковые обследования проводили в одно и то же время – через 1 час после кормления детей в состоянии покоя. Регулярно оценивали пациентам соматический и неврологический статус и проводили общеклинические лабораторные исследования.

Рис. 1. Эхограмма головного мозга новорожденного (сагиттальный срез через большой родничок) и допплерограмма кровотока по базиллярной артерии.
1 – передняя мозговая артерия; 2 – внутренняя сонная артерия; 3 – базиллярная артерия.
Результаты
Для вычисления описательных характеристик показателей центральной и церебральной гемодинамики обследованные были разделены на подгруппы по возрасту и периоду перинатальной энцефалопатии: первые 28 дней – острый период, старше 28 дней – восстановительный период.
Значения скоростей мозгового кровотока во всех трех обследованных сосудах были выше у доношенных детей по сравнению с недоношенными и в восстановительном периоде по сравнению с острым периодом (табл. 1). Другими словами, абсолютные скорости кровотока в крупных мозговых артериях повышались с увеличением массы тела, гестационного и постнатального возраста ребенка, что подтвердил корреляционный анализ. Наиболее выраженной была зависимость скоростей кровотока от массы тела (табл. 2). Индексы резистентности мозговых артерий были выше в группе детей, родившихся недоношенными (в остром периоде разница была высокодостоверной с р<0,001, в восстановительном периоде тенденция к повышению сохранялась, но разница была значительно менее выражена) – см. табл. 1.
Таблица 1. Допплерографические показатели церебральной гемодинамики.
| Показатель | Доношенные | Недоношенные | ||
|---|---|---|---|---|
| Острый период | Восстановительный период | Острый период | Восстановительный период | |
| V max ПМА, м/сек | 0,33±0,12 | 0,49±0,14 | 0,32±0,12 | 0,48±0,18 |
| V min ПМА, м/сек | 0,09±0,04 | 0,13±0,05 | 0,07±0,04 | 0,12±0,08 |
| V mean ПМА, м/сек | 0,20±0,08 | 0,30±0,09 | 0,19±0,07 | 0,29±0,12 |
| RI ПМА | 0,72±0,08 | 0,74±0,08 | 0,77±0,09 | 0,76±0,11 |
| V max ВСА, м/сек | 0,48±0,13 | 0,71±0,11 | 0,46±0,13 | 0,58±0,15 |
| V min ВСА, м/сек | 0,12±0,05 | 0,16±0,07 | 0,09±0,06 | 0,14±0,08 |
| V mean ВСА, м/сек | 0,29±0,09 | 0,41±0,07 | 0,26±0,09 | 0,35±0,12 |
| RI ВСА | 0,75±0,07 | 0,78±0,10 | 0,81±0,09 | 0,77±0,09 |
| V max БА, м/сек | 0,46±0,14 | 0,59±0,13 | 0,40±0,12 | 0,53±0,16 |
| V min БА, м/сек | 0,11±0,05 | 0,13±0,05 | 0,07±0,04 | 0,12±0,08 |
| V mean БА, м/сек | 0,27±0,09 | 0,34±0,08 | 0,22±0,07 | 0,32±0,11 |
| RI БА | 0,75±0,08 | 0,77±0,08 | 0,81±0,09 | 0,78±0,10 |
ПМА – передняя мозговая артерия.
ВСА – внутренняя сонная артерия.
БА – базиллярная артерия.
Vmax – максимальная систолическая скорость.
Vmin – минимальная диастолическая скорость.
Vmean – средняя скорость кровотока за время сердечного цикла.
RI – индекс резистентности.
Абсолютные показатели сердечного выброса – общий ударный объем, эффективный сердечный выброс и минутный объем кровообращения были выше в группе доношенных детей как в остром, так и в восстановительном периодах (табл. 3). Так же, как и скорости мозгового кровотока, значения сердечного выброса увеличивались с увеличением массы тела у всех обследованных детей (табл. 2). Относительные показатели (сердечные индексы) – УО/кг, УО эфф/кг и МО/кг – были выше у недоношенных, что можно объяснить более высокими темпами роста, большей потребностью в кислороде и напряженностью метаболических процессов у таких детей по сравнению с доношенными.
Таблица 2. Коэффициенты корреляции между массой тела при обследовании и показателями центральной и церебральной гемодинамики (р<0,01).
| Дети | УО эфф | УО эфф/кос | МО | МО/кг | УО | УО/кг |
|---|---|---|---|---|---|---|
| Доношенные | 0,42 | -0,47 | 0,37 | -0,44 | 0,43 | -0,48 |
| Недоношенные | 0,69 | -0,31 | 0,60 | -0,36 | 0,57 | -0,42 |
| Дети | Vmax ПМА | Vmin ПМА | Vmean ПМА | RI ПМА | Vmax ВСА | Vmin ВСА |
| Доношенные | 0,27 | 0,28 | 0,30 | – | 0,35 | 0,30 |
| Недоношенные | 0,51 | 0,57 | 0,55 | -0,27 | 0,36 | 0,37 |
| Дети | Vmean ВСА | RI ВСА | Vmax ВСА | Vmin ВСА | Vmean ВСА | RI ВСА |
| Доношенные | 0,34 | – | 0,43 | 0,40 | 0,46 | – |
| Недоношенные | 0,37 | -0,23 | 0,42 | 0,54 | 0,50 | -0,34 |
ПМА – передняя мозговая артерия.
ВСА – внутренняя сонная артерия.
УО – общий ударный обьем.
УО эфф – эффективный ударный обьем.
МО – минутный объем кровообращения.
Vmax – максимальная систолическая скорость.
Vmin – минимальная диастолическая скорость.
Vmean – средняя скорость кровотока за время сердечного цикла.
RI – индекс резистентности.
Один из основных параметров сократимости миокарда – фракция изгнания – в обеих группах был одинаковым и соответствовал норме.
Таблица 3. Показатели центральной гемодинамики у обследованных детей.
| Показатель | Доношенные | Недоношенные | ||||
|---|---|---|---|---|---|---|
| Острый период | Восстановительный период | Острый период | P1 | Восстановительный период | P2 | |
| УО, мл | 6,35±1,61 | 6,70±2,04 | 4,84±0,99 | <0,001 | 5,78±1,81 | <0,01 |
| УО/кг, мл/кг | 2,08±0,60 | 1,78±0,48 | 2,27±0,58 | <0,05 | 2,14±0,56 | <0,01 |
| УО эфф, мл | 6,14±1,55 | 6,85±2,16 | 4,58±1,20 | <0,001 | 5,90±2,22 | <0,05 |
| УО эфф/кг, мл/кг | 2,01±0,54 | 1,71±0,55 | 2,16±0,67 | >0,05 | 2,09±0,58 | <0,01 |
| МО, л/мин | 0,91±0,26 | 1,04±0,31 | 0,70±0,19 | <0,001 | 0,92±0,33 | <0,05 |
| МО/кг, л/мин/кг | 0,30±0,09 | 0,26±0,09 | 0,33±0,11 | <0,05 | 0,33±0,10 | <0,001 |
| ФИ | 0,69±0,04 | 0,69±0,04 | 0,69±0,03 | – | 0,69±0,05 | – |
УО – общий ударный обьем.
УО эфф – эффективный ударный обьем.
МО – минутный объем кровообращения.
ФИ – фракция изгнания.
P1 – коэффициент достоверности по отношению к подгруппе доношенных детей в остром периоде.
Р2 – по отношению к подгруппе доношенных детей в восстановительном периоде.
Корреляционный анализ, проведенный между показателями сердечного выброса и мозгового кровотока, выявил различия между группами доношенных и недоношенных детей. У детей, рожденных раньше срока, была обнаружена достоверная (р<0,05) положительная связь между скоростями кровотока в передней мозговой и базиллярной артериях и величиной сердечного выброса. В группе доношенных детей такой зависимости отмечено не было. При подробном анализе результатов обследования мы обнаружили, что связь между мозговым кровотоком и сердечным выбросом на протяжении первых месяцев жизни имелась не у всех недоношенных детей, а у детей с гестационным возрастом менее 34 недель. У более зрелых недоношенных скорости мозгового кровотока не зависели от изменений сердечного выброса, так же, как и у доношенных.
Между сердечными индексами и скоростями мозгового кровотока связь была обратной в обеих группах детей.
Зависимости между показателями мозгового кровотока, в том числе и индексами резистентности, и частотой сердечных сокращений в нашем исследовании не выявлено.
У всех обследованных детей обнаружена достоверная (р<0,05) обратная связь между скоростями мозгового кровотока и гематокритом (рис. 2), причем менее всего эта связь была выражена в отношении минимальной скорости. Таким образом, диастолическая скорость и тесно связанный с ней индекс резистентности являются наиболее независимыми показателями состояния сосудистого русла мозга.
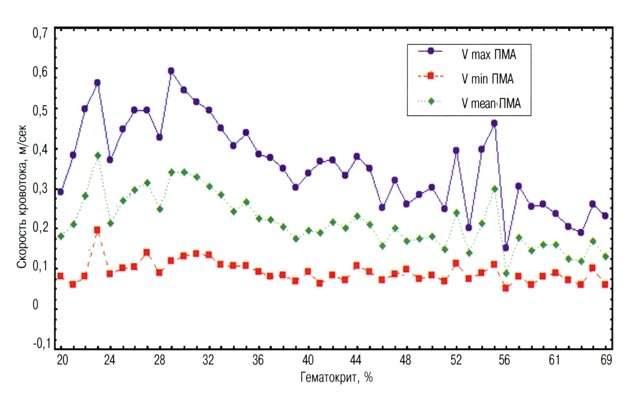
Рис. 2. Зависимость скоростей кровотока в передней мозговой артерии от величины гематокрита.
Обсуждение
Результаты наших исследований показали, что у новорожденных детей с перинатальным гипоксическитравматическим поражением головного мозга после выхода их из критического состояния основными факторами, влияющими на показатели мозгового кровотока, были масса тела, гестационный и постнатальный возраст – так же, как и у здоровых новорожденных [3]. Это говорит о том, что нарушения мозгового кровотока без тяжелых органических изменений в головном мозге носят преходящий характер и быстро компенсируются.
Абсолютные скорости кровотока в крупных мозговых артериях растут с увеличением возраста и, в большей степени, массы тела ребенка. Индексы резистентности снижаются с увеличением гестационного возраста, т.е. у недоношенных детей, резистентность сосудов мозга в норме выше, чем у доношенных.
Сердечный выброс в обеих группах обследованных детей увеличивался с возрастанием массы тела, что также согласуется с литературными данными в отношении здоровых новорожденных [4, 5].
Обнаруженную нами положительную связь между сердечным выбросом и скоростями кровотока в передней мозговой и базиллярной артериях у недоношенных детей, на первый взгляд, можно объяснить влиянием на эти показатели массы тела. Известно, что связь между двумя физиологическими параметрами может быть не прямой, а опосредованной через третий показатель. Такое объяснение применимо к обнаруженной нами обратной связи между сердечными индексами и скоростями кровотока в мозговых артериях – с возрастанием массы происходит увеличение скоростей, но в меньшей степени, чем снижение значений сердечного выброса на килограмм веса, причем такое соотношение соблюдается в обеих группах обследованных детей.
У недоношенных детей имеется достоверная прямая зависимость абсолютных значений сердечного выброса и скоростей мозгового кровотока от массы тела. Однако такая же зависимость выявлена и у доношенных детей, но между собой показатели сердечного выброса и мозгового кровотока в этой группе не были связаны. Это означает, что зрелые новорожденные в стабильном состоянии уже со второй недели жизни обладают способностью поддерживать постоянство кровоснабжения мозга независимо от изменений центральной гемодинамики.
Н.С. Lou et al [6], обследуя доношенных и недоношенных новорожденных, находившихся в критическом состоянии (перенесших тяжелую асфиксию или имевших тяжелый синдром дыхательных расстройств), методом оценки клиренса радиоактивного ксенона, обнаружили у них прямую связь между мозговым кровотоком и изменениями артериального давления. Авторы назвали этот феномен нарушением ауторегуляции. Позже, с помощью допплерографического метода наличие такой же связи было установлено у глубоконедоношенных детей (с гестационным возрастом менее 31 недели и весом при рождении менее 1501 г) [7]. Из-за отсутствия регуляции мозговой кровоток пассивно следовал за изменениями артериального давления, увеличивая риск развития ишемических поражений при гипотензии и кровоизлияний при повышении артериального давления.
В нашем исследовании мы измеряли не артериальное давление, а непосредственно сердечный выброс у доношенных и недоношенных детей, находившихся в стабильном состоянии. Все обследованные дети живы и, более того, ни у одного ребенка с момента начала наблюдения не появилось новых патологических очагов ишемического или геморрагического генеза в головном мозге.
Мы полагаем, что выявленная нами зависимость мозгового кровотока от сердечного выброса у детей, родившихся ранее 34-й недели гестации, говорит не о тяжести состояния ребенка, а отражает морфологические особенности сосудистой системы мозга на этом этапе развития. К ним можно отнести значительную незрелость в количественном и качественном отношениях всех трех слоев стенок внутримозговых сосудов, а также наличие широких анастомозов между ветвями отдельных артерий и их связь с венами. После 30-32-й недель внутриутробного развития начинается регрессия артериальных анастомозов, бурный рост капиллярной сети, дифференцировка и созревание нервных окончаний и гладко-мышечных компонентов сосудистой стенки. Причем формирование внутримозговой ангиоархитектоники продолжается и у доношенных детей длительное время после рождения [8].
Результаты наших исследований еще раз подчеркивают необходимость максимально щадящей тактики выхаживания детей, родившихся недоношенными. Такое выхаживание должно включать в себя: придание удобного положения, поддержание стабильного уровня температуры тела (в кювезе или кроватке с подогревом), кормление через зонд (поскольку для незрелого ребенка даже акт сосания является серьезной физической нагрузкой), ограничение различных манипуляций, особенно связанных с болевыми ощущениями.
При обследовании новорожденных с перинатальным поражением головного мозга мы рекомендуем пользоваться не абсолютными значениями скоростей артериального кровотока ввиду их значительной вариабельности и зависимости от большого количества внешних факторов, а индексами резистентности, учитывая поправку на гестационный возраст. У недоношенных детей, особенно родившихся ранее 34-й недели гестации, также необходимо регулярно оценивать морфометрические и функциональные показатели сердца для раннего выявления отклонений, которые могут усугубить церебральную патологию.
Литература
- Walther F.J., Siassi В., Ramadan N.A., Wu P.Y.K. Cardiac output in newborn infants with transient myocardial dysfunction. J.Pediatr. – 1985. – 107, 781-785.
- Попова Н.В. Клинико-эхокардиографическая характеристика состояния сердца у новорожденных детей при перинатальной энцефалопатии/Автореф.дисс. к.м.н. – М.: – 1991. – 21 с.
- Van Bel F. (1997). Cerebral blood flow velocity waveform characteristics (Doppler ultrasound). In: Govaert P. and De Vries L.S. An atlas of neonatal brain sonography. – 1997. – 341-363. (Mac Keith Press)
- Walther F.J., Siassi В., Ramadan N.A., Wu P.Y.K. (1985). Pulsed Doppler determinations of cardiac output in neonates: normal standarts for clinical use. J.Pediatr. – 1985. – 76, 829-833.
- Гаврюшов В.В., Миленин О.Б., Ефимов М.С., Аксерольд В.Г. Определение сердечного выброса у новорожденных методом допплерографии/Педиатрия. – 1988. – N2, С. 71-76.
- Lou H.C., Lassen N.A., Friis-Hansen В. Impaired autoregulation of cerebral blood flow in the distressed newborn infant. J.Pediatr. – 1979. – 94, 118-121.
- Jorch G., Jorch N. Failure of autoregulation of cerebral blood flow in neonates studied by pulsed Doppler ultrasound of the internal carotid artery. Eur.J.Pediatr. – 1987. – 146, 486-472.
- Жукова Т.П. Морфологические изменения сосудистой системы мозга в перинатальном периоде. – Обзор/Под ред. Жуковой Т.П. Мозговое кровообращение у новорожденных детей в норме и патологии. 5-22. – М.: 1983, ВНИИМИ.

УЗИ сканер HS70
Точная и уверенная диагностика. Многофункциональная ультразвуковая система для проведения исследований с экспертной диагностической точностью.
Источник
