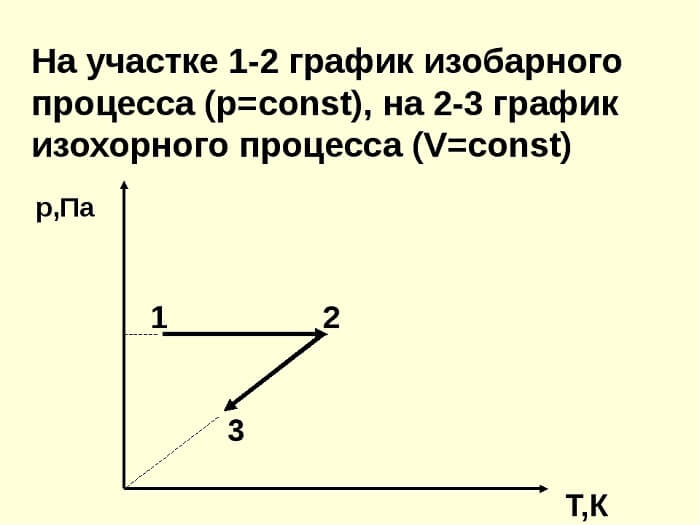
Объем сосуда при изохорном процессе
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: изопроцессы — изотермический, изохорный, изобарный процессы.
На протяжении этого листка мы будем придерживаться следующего предположения: масса и химический состав газа остаются неизменными. Иными словами, мы считаем, что:
• , то есть нет утечки газа из сосуда или, наоборот, притока газа в сосуд;
• , то есть частицы газа не испытывают каких-либо изменений (скажем, отсутствует диссоциация — распад молекул на атомы).
Эти два условия выполняются в очень многих физически интересных ситуациях (например, в простых моделях тепловых двигателей) и потому вполне заслуживают отдельного рассмотрения.
Если масса газа и его молярная масса фиксированы, то состояние газа определяется тремя макроскопическими параметрами: давлением, объёмом и температурой. Эти параметры связаны друг с другом уравнением состояния (уравнением Менделеева — Клапейрона).
Термодинамический процесс (или просто процесс) — это изменение состояния газа с течением времени. В ходе термодинамического процесса меняются значения макроскопических параметров — давления, объёма и температуры.
Особый интерес представляют изопроцессы — термодинамические процессы, в которых значение одного из макроскопических параметров остаётся неизменным. Поочерёдно фиксируя каждый из трёх параметров, мы получим три вида изопроцессов.
1. Изотермический процесс идёт при постоянной температуре газа: .
2. Изобарный процесс идёт при постоянном давлении газа: .
3. Изохорный процесс идёт при постоянном объёме газа: .
Изопроцессы описываются очень простыми законами Бойля — Мариотта, Гей-Люссака и Шарля. Давайте перейдём к их изучению.
Изотермический процесс
Пусть идеальный газ совершает изотермический процесс при температуре . В ходе процесса меняются только давление газа и его объём.
Рассмотрим два произвольных состояния газа: в одном из них значения макроскопических параметров равны , а во втором — . Эти значения связаны уравнением Менделеева-Клапейрона:
Как мы сказали с самого начала,масса и молярная масса предполагаются неизменными.
Поэтому правые части выписанных уравнений равны. Следовательно, равны и левые части:
(1)
Поскольку два состояния газа были выбраны произвольно, мы можем заключить, что в ходе изотермического процесса произведение давления газа на его объём остаётся постоянным:
(2)
Данное утверждение называется законом Бойля — Мариотта.
Записав закон Бойля — Мариотта в виде
(3)
можно дать и такую формулировку: в изотермическом процессе давление газа обратно пропорционально его объёму. Если, например, при изотермическом расширении газа его объём увеличивается в три раза, то давление газа при этом в три раза уменьшается.
Как объяснить обратную зависимость давления от объёма с физической точки зрения? При постоянной температуре остаётся неизменной средняя кинетическая энергия молекул газа, то есть, попросту говоря, не меняется сила ударов молекул о стенки сосуда. При увеличении объёма концентрация молекул уменьшается, и соответственно уменьшается число ударов молекул в единицу времени на единицу площади стенки — давление газа падает. Наоборот, при уменьшении объёма концентрация молекул возрастает, их удары сыпятся чаще и давление газа увеличивается.
Графики изотермического процесса
Вообще, графики термодинамических процессов принято изображать в следующих системах координат:
• -диаграмма: ось абсцисс , ось ординат ;
• -диаграмма: ось абсцисс , ось ординат ;
• -диаграмма: ось абсцисс , ось ординат .
График изотермического процесса называется изотермой.
Изотерма на -диаграмме — это график обратно пропорциональной зависимости .
Такой график является гиперболой (вспомните алгебру — график функции ). Изотерма-гипербола изображена на рис. 1.

Рис. 1. Изотерма на -диаграмме
Каждая изотерма отвечает определённому фиксированному значению температуры. Оказывается, что чем выше температура, тем выше лежит соответствующая изотерма на –диаграмме.
В самом деле, рассмотрим два изотермических процесса, совершаемых одним и тем же газом (рис. 2). Первый процесс идёт при температуре , второй — при температуре .

Рис. 2. Чем выше температура, тем выше изотерма
Фиксируем некоторое значение объёма . На первой изотерме ему отвечает давление , на второй — . Но при фиксированном объёме давление тем больше, чем выше температура (молекулы начинают сильнее бить по стенкам). Значит, .
В оставшихся двух системах координат изотерма выглядит очень просто: это прямая, перпендикулярная оси (рис. 3):

Рис. 3. Изотермы на и -диаграммах
Изобарный процесс
Напомним ещё раз, что изобарный процесс — это процесс, проходящий при постоянном давлении. В ходе изобарного процесса меняются лишь объём газа и его температура.
Типичный пример изобарного процесса: газ находится под массивным поршнем, который может свободно перемещаться. Если масса поршня и поперечное сечение поршня , то давление газа всё время постоянно и равно
где — атмосферное давление.
Пусть идеальный газ совершает изобарный процесс при давлении . Снова рассмотрим два произвольных состояния газа; на этот раз значения макроскопических параметров будут равны и .
Выпишем уравнения состояния:
Поделив их друг на друга, получим:
В принципе, уже и этого могло бы быть достаточно, но мы пойдём немного дальше. Перепишем полученное соотношение так, чтобы в одной части фигурировали только параметры первого состояния, а в другой части — только параметры второго состояния (иными словами, «разнесём индексы» по разным частям):
(4)
А отсюда теперь — ввиду произвольности выбора состояний! — получаем закон Гей-Люссака:
(5)
Иными словами, при постоянном давлении газа его объём прямо пропорционален температуре:
(6)
Почему объём растёт с ростом температуры? При повышении температуры молекулы начинают бить сильнее и приподнимают поршень. При этом концентрация молекул падает, удары становятся реже, так что в итоге давление сохраняет прежнее значение.
Графики изобарного процесса
График изобарного процесса называется изобарой. На -диаграмме изобара является прямой линией (рис. 4):

Рис. 4. Изобара на -диаграмме
Пунктирный участок графика означает, что в случае реального газа при достаточно низких температурах модель идеального газа (а вместе с ней и закон Гей-Люссака) перестаёт работать. В самом деле, при снижении температуры частицы газа двигаются всё медленнее, и силы межмолекулярного взаимодействия оказывают всё более существенное влияние на их движение (аналогия: медленный мяч легче поймать, чем быстрый). Ну а при совсем уж низких температурах газы и вовсе превращаются в жидкости.
Разберёмся теперь, как меняется положение изобары при изменении давления. Оказывается, что чем больше давление, тем ниже идёт изобара на –диаграмме.
Чтобы убедиться в этом, рассмотрим две изобары с давлениями и (рис. 5):

Рис. 5. Чем ниже изобара, тем больше давление
Зафиксируем некоторое значение температуры . Мы видим, что . Но при фиксированной температуре объём тем меньше, чем больше давление (закон Бойля — Мариотта!).
Стало быть, .
В оставшихся двух системах координат изобара является прямой линией, перпендикулярной оси (рис. 6):

Рис. 6. Изобары на и -диаграммах
Изохорный процесс
Изохорный процесс, напомним, — это процесс, проходящий при постоянном объёме. При изохорном процессе меняются только давление газа и его температура.
Изохорный процесс представить себе очень просто: это процесс, идущий в жёстком сосуде фиксированного объёма (или в цилиндре под поршнем, когда поршень закреплён).
Пусть идеальный газ совершает изохорный процесс в сосуде объёмом . Опять-таки рассмотрим два произвольных состояния газа с параметрами и . Имеем:
Делим эти уравнения друг на друга:
Как и при выводе закона Гей-Люссака, «разносим» индексы в разные части:
(7)
Ввиду произвольности выбора состояний мы приходим к закону Шарля:
(8)
Иными словами, при постоянном объёме газа его давление прямо пропорционально температуре:
(9)
Увеличение давления газа фиксированного объёма при его нагревании — вещь совершенно очевидная с физической точки зрения. Вы сами легко это объясните.
Графики изохорного процесса
График изохорного процесса называется изохорой. На -диаграмме изохора является прямой линией (рис. 7):

Рис. 7. Изохора на -диаграмме
Смысл пунктирного участка тот же: неадекватность модели идеального газа при низких температурах.
Далее, чем больше объём, тем ниже идёт изохора на –диаграмме (рис. 8):

Рис. 8. Чем ниже изохора, тем больше объём
Доказательство аналогично предыдущему. Фиксируем температуру и видим, что . Но при фиксированной температуре давление тем меньше, чем больше объём (снова закон Бойля — Мариотта). Стало быть, .
В оставшихся двух системах координат изохора является прямой линией, перпендикулярной оси (рис. 9):

Рис. 9. Изохоры на и -диаграммах
Законы Бойля — Мариотта, Гей-Люссака и Шарля называются также газовыми законами.
Мы вывели газовые законы из уравнения Менделеева — Клапейрона. Но исторически всё было наоборот: газовые законы были установлены экспериментально, и намного раньше. Уравнение состояния появилось впоследствии как их обобщение.
Источник
Какой процесс называется изохорным, условия протекания
Определение
Изохорным процессом называют термодинамический процесс, протекающий при условии постоянного объема.
Изохорный процесс можно наблюдать опытным путем. Для этого необходимо повышать или понижать температуру вещества в газообразном или жидком состоянии, находящегося в сосуде и сохраняющего стабильность объема. В случае, когда манипуляции производят с идеальным газом, его давление и температура будут изменяться прямо пропорционально, согласно закону Шарля. Для реальных газов данная закономерность не применима.
История возникновения теории, кто открыл, формула
Изучение изохорного процесса связывают с Гийомом Амонтоном. Работа ученого под названием «Парижские мемуары», написанная в 1702 году, посвящена исследованию характеристик газообразного вещества, помещенного в фиксированный объем, который составляет часть «воздушного термометра». Равновесие жидкости в данных условиях объясняется воздействием на нее давления газа, находящегося в сосуде, и атмосферного давления. Если температура среды повышается, показатели давления в резервуаре возрастают. При этом определенный объем жидкости вытесняется в выступающую трубку. Зависимость между такими характеристиками процесса, как температура и давление, представлена на рисунке.

Источник: infourok.ru
В 1801 году были опубликованы два эссе исследователя Джона Дальтона с описанием эксперимента, результаты которого демонстрируют одинаковое расширение всех газов и паров при постоянном давлении и изменении температуры, когда начальная и конечная температура одинакова. В итоге был сформулирован закон Гей-Люссака. Ученый, в честь которого явление получило название, экспериментальным путем подтвердил одинаковое расширение различных газообразных веществ и вывел коэффициент, практически равный коэффициенту, полученному Дальтоном. Благодаря объединению данной закономерности с законом Бойля-Мариотта, был описан изохорный процесс.
График изохорного процесса в идеальном газе
Зависимость характеристик при изохорном процессе можно представить схематично. График на диаграмме в системе координат будет иметь следующий вид:

Источник: prezentacii.org
В случае идеального газа графически изохорные процессы будут изображены следующим образом:

Источник: wi-ki.ru/wiki
Первый закон термодинамики для изохорного процесса
В условиях термодинамического процесса формула элементарной работы имеет следующий вид:
(delta A=PdV)
Преобразование данного выражения позволит рассчитать величину полной работы процесса:
(A=int_{V_{1}}^{V_{1}}{PdV})
В случае, когда объем сохраняет стабильность, то есть (dV=0), значение интеграла будет нулевым. Исходя из этого, в изохорном процессе работа газа не наблюдается:
(A=0)
Изменение внутренней энергии для идеального газа рассчитывается по формуле:
(Delta U=frac{i}{2}nu RDelta T)
где i представляет собой количество степеней свободы, зависящее от числа атомов, которыми обладает молекула газа. В качестве примера можно рассмотреть такие вещества:
- одноатомная молекула неона обладает тремя степенями;
- пять степеней характерно для двухатомной молекулы кислорода;
- в молекуле с тремя и более атомами, как у водяного пара, насчитывается 6 степеней.
Формула внутренней энергии выходит из понятия и уравнения теплоемкости, представляет собой следующее отношение:
(Delta U=nu c_{upsilon }^{mu }Delta T)
где (c_{upsilon }^{mu }) является молярной теплоемкостью в условиях постоянного объема.
Расчет количества теплоты выполняют с помощью первого начала термодинамики в условиях термодинамического процесса:
(Q=Delta U+A)
Следует учитывать, что в условиях изохорного процесса газообразное вещество не выполняет работу. Исходя из этого, можно вывести формулу:
(Q=Delta U=nu c_{upsilon }^{mu }Delta T)
Согласно уравнению, газ получает теплоту. Она полностью расходуется, чтобы изменять внутреннюю энергию газообразного вещества.
Изменения термодинамических параметров в изохорном процессе
В условиях изохорного процесса наблюдается теплообмен с внешней средой. Данное явление называют изменением энтропии. Из его понятия следует уравнение:
(dS=frac{delta Q}{T})
где (delta Q) является элементарным количеством теплоты.
Преобразуя уравнение для расчета количества теплоты в дифференциальный вид, получают следующую формулу:
(delta Q=nu c^{mu }_{upsilon }dT)
где (nu) является количеством вещества, а (nu c^{mu }_{upsilon }) обозначает молярную теплоемкость в условиях постоянного объема.
Формула микроскопического изменения энтропии в условиях протекания изохорного процесса имеет вид:
(dS=frac{nu c^{mu }_{upsilon }dT}{T}dy/dx dy/dx)
Если проинтегрировать последнюю формулу, то расчет полного изменения энтропии выполняют таким образом:
(int_{S_{1}}^{S_{2}}{dS}=nu int_{T_{1}}^{T_{2}}frac{c^{mu }_{upsilon }dT}{T}Rightarrow Delta S=nu int_{T_{1}}^{T_{2}}frac{c^{mu }_{upsilon }dT}{T})
В этой ситуации не представляется возможным вынести определение молярной теплоемкости в условиях стабильного объема за интеграл, так как оно представлено в виде функции, зависящей от температуры.
Применение эффекта изохорного процесса
Идеальный цикл Отто приближенно воспроизведен в конструкции мотора внутреннего сгорания, работающего на бензине. Такты 2-3 и 4-1 при его функционировании представляют собой изохорные процессы. На выходе двигателя совершается работа. Она рассчитывается, как разность работ. К одной из них относят работу, производимую газообразным веществом над поршнем в процессе третьего такта или рабочего хода, к другой – работу, затраченную поршнем во время сжатия газа при втором такте. Таким образом, на примере двигателя, функционирующего, согласно принципу Отто, в системе принудительного сжигания смеси, газообразное вещество сжимается до 7-12 раз.

Источник: mashintop.ru
На рисунке изображен классический двигатель Стирлинга с конструкцией бета-типа, для которой характерно расположение рабочего и вытеснительного поршня в одном цилиндре.
Динамику цикла Отто можно представить в следующем виде:

Источник: wi-ki.ru
Цикл Стирлинга также характеризуется наличием двух изохорных тактов. Процесс протекает при дооснащении конструкции двигателя Стирлинга регенератором. Во время прохождения газообразного вещества в одном направлении через наполнитель осуществляется передача тепла от рабочего тела к регенератору. Если газ проходит в обратную сторону, то тепловая энергия передается на рабочее тело. Идеальный цикл Стирлинга достигает обратимости и характеризуется теми же параметрами КПД, что и цикл Карно.
Источник
Определение 1
Изохорический или изохорный процесс — один из основных термодинамических процессов, который происходит исключительно при постоянном объёме.
Рисунок 1. Изохорный процесс. Автор24 — интернет-биржа студенческих работ
Для осуществления изохорного процесса в идеальном газе или жидкости достаточно постепенно нагревать или охлаждать действующее вещество в сосуде, который не изменяет своего изначального объёма и находится в замкнутом пространстве.
При изохорическом процессе общее давление идеального газа будет всегда прямо пропорционально его начальной температуре. Графики, которые изображают указанное физическое явление линиями, называются изохоры.
Для идеального газа они являются прямыми и стабильными во всех диаграммах, которые связывают такие основные параметры:
- $T$ (температура рабочего тела);
- $V$ (объем исследуемого вещества);
- $P$ (внутреннее давление).
История возникновения теории изохорного процесса
Наиболее часто первые научные исследования изохорного процесса связывают с физиком-теоретиком Гийомом Амонтоном . В своей первой работе «Парижские мемуары», которая была выпущена в 1702 году, изобретатель детально описал поведение идеального газа в фиксированном объёме внутри так называемого «воздушного стабильного термометра». Жидкость в нём находится всегда в равновесии под влиянием атмосферного давления и энергии исследуемого элемента в резервуаре. При постепенном нагревании давление и объем в замкнутом пространстве увеличивается, и жидкость вытесняется в следующий, выступающий столб.
В начале 1801 года физик Джон Дальтон в двух своих известных эссе опубликовал новый эксперимент, в котором определил, что все пары и газы, исследованные при неизменном давлении, одинакового расширяются и уменьшаются при изменении температуры, если соответствующий начальный и конечный показатель были одинаковы. Данный закон получил в науке название закона Гей-Люссака, так как именно этот исследователь вскоре смог провести самостоятельные опыты и подтвердил одинаковое распределение различных газов, получив в итоге практически тот самый коэффициент, что и Дальтон. Впоследствии ученый объединил свою теорию с законом Бойля — Мариотта, что позволило более понятно описывать в том числе и сам изохорный процесс.
Первый закон термодинамики для изохорного процесса
Рисунок 2. Закон Шарля. Автор24 — интернет-биржа студенческих работ
Простая формулировка первого термодинамического закона может звучать приблизительно так: изменение внутренней энергии той или иной концепции возможно только при наличии внешнего воздействия.
То есть иными словами, чтобы в системе произошли любые изменения необходимо приложить усилия извне. Именно первый закон термодинамики устанавливает, почему все многочисленные попытки исследователей потерпели неудачу, ведь ученые так и не смогли изобрести «вечный двигатель», существование которого считается абсолютно невозможным согласно этому самому закону.
Замечание 1
Формула первого закона термодинамики записывается таким образом: $Q = ΔU + A$, где $Q$ –количество теплоты, $ΔU$ – сумма изменения внутренней энергии и $A$ – работа системы.
Изохорным процессом в термодинамике называют физическим процесс, происходящий при постоянном, равномерном объеме. То есть, если в газе или жидкости нагреть определенное вещество в сосуде, произойдет изучаемое явление, так как объем элементов в такой системе останется неизменным. Это условие имеет существенное влияние и на первый термодинамический закон термодинамики, проходящий в основном при изохорном процессе.
В изохорном процессе объем рабочих тел $V$ является постоянной константой, следовательно, газ работы не совершает $A = 0$.
Из этого возможно вывести следующую формулу: $Q = ΔU = U (T_2) – U (T_1)$. Здесь $U (T_1)$ и $U (T_2)$ – внутренние энергии идеального газа, которые были зафиксированы в начальном и конечном положениях. Внутренняя энергия исследуемого элемента напрямую зависит только от первостепенной температуры (закон Джоуля).
При изохорном систематическим нагревании все тепло материального тела поглощается газом $(Q > 0)$, и его внутренняя энергия постепенно увеличивается. При охлаждении тепло будет отдаваться внешним элементам $(Q $
Метод исследования данного процесса заключается в следующем:
- изначально выводится уравнение физического явления (взаимосвязь между начальными и конечными показателями рабочего тела);
- вычисляется дальнейшая работа изменения объема газа;
- устанавливается точное количество теплоты, отведенное или подведенной к исследуемому объекту;
- определяется изменение внутренней энергии и энтропии концепции в процессе.
Поскольку внутренняя энергия является главной функцией состояния материального тела, то формулы изохорного процесса справедливы для любого термодинамического процесса идеального газа.
Применение эффекта изохорного процесса
Рисунок 3. Уравнение состояния. Автор24 — интернет-биржа студенческих работ
Изохорный процесс зачастую осуществляется в жидкостях и газах, расположенных в замкнутом сосуде с постоянным объемом. При этом явлении система не выполняет работы, и подведённая теплота $Q$ полностью расходуется на изменение тепловой энергии: $dU = Dq$.
Замечание 2
Следовательно, теплоёмкость при неизменном объёме будет всегда значительно меньше аналогичного параметра при постоянном давлении.
В идеальном газе в ходе изохорного процесса давление прямо пропорционально температуре – закон Шарля. Для неидеального газа закон Шарля невозможно применить, так как часть сообщённой газу теплоты идет строго на увеличение энергетического потенциала взаимодействия элементарных частиц.
При идеальном цикле Отто, который максимально приближённо внедрен в бензиновый двигатель внутреннего сгорания, такты 2—3 и 4—1 считаются изохорными процессами. Совершаемая на выходе мотора работа равна разности основных работ, которую производит газ над конкретным поршнем во время третьего такта и рабочего хода, включающий поршень на сжатие действующего вещества во время второго такта. Так как в указанном цикле используются принципы принудительного зажигания смеси, то происходит увеличение сжатия газа в 7—12 раз.
В другом цикле, под названием Стирлинг, также присутствуют два главных изохорных такта. Для его осуществления в устройстве добавлен мощный регенератор. Газ, проходя через наполнитель в одну сторону, отдаёт тепловую энергию от рабочего тела к регенератору, а при обратном движении возвращает его рабочей системе. Идеальный цикл Стирлинга достигает стопроцентной обратимости, а затем и тех же величин, что и цикл Карно.
Источник
