Образование новых сосудов сердца

Васкуляризация тканей. Формирование и рост новых кровеносных сосудовОсновным механизмом долговременной регуляции местного кровотока является изменение количества кровеносных сосудов в тканях. Так, длительная активизация метаболических процессов в данной ткани вызывает усиленную васкуляризацию ткани; если же уровень метаболизма снижается, количество кровеносных сосудов в ткани уменьшается. Так происходит изменение васкуляризации тканей в зависимости от их метаболических потребностей. Эта реконструкция сосудистой системы развивается быстро (через несколько дней) у очень молодых животных, а также в быстрорастущих тканях зрелого организма (например, в рубцовой ткани или в растущей опухоли). И наоборот, в зрелых, высокодифференцированных тканях подобный процесс протекает медленно. Таким образом, на долговременную регуляцию кровотока требуется всего несколько дней у новорожденных, и более месяца — у лиц старшего возраста. Кроме того, результат перестройки сосудистого русла оказывается гораздо лучшим в молодых тканях. Так, у новорожденных сосудистая сеть способна практически полностью удовлетворять возросшие потребности тканей, в то время как в зрелых тканях васкуляризация зачастую намного отстает от потребностей ткани. Роль кислорода в долговременной регуляции. Кислород имеет большое значение не только в быстрой краткосрочной регуляции местного кровотока, но и в долговременной регуляции. Одним из примеров является усиленная васкуляризация тканей у животных, обитающих на больших высотах, где содержание кислорода в атмосфере низкое. Другим примером может быть наблюдение за куриными зародышами, развивающимися в условиях гипоксии, у которых число кровеносных сосудов в 2 раза превышает нормальную плотность сосудов в тканях. Подобный эффект может иметь самые неблагоприятные последствия у недоношенных детей, помещенных в кислородную палатку с лечебными целями. Избыток кислорода немедленно прекращает рост сосудов сетчатки глаза у недоношенного ребенка и даже вызывает дегенерацию уже имеющихся сосудов. Затем, когда ребенка извлекают из кислородной палатки, начинается бурный рост сосудов в тканях глазного яблока, и кровеносные сосуды прорастают в стекловидное тело глаза, что приводит к слепоте. Такое явление называют ретроленталъной фиброплазией.
Формирование и рост новых кровеносных сосудовОбнаружены более 10 факторов, которые усиливают рост новых кровеносных сосудов. Почти все они являются короткими пептидами, из них 3 фактора изучены лучше других: сосудистый эндотелиальный фактор роста, фактор роста фибробластов и ангиогенин. Каждый из них был выделен из тканей с неадекватно низким кровоснабжением. По-видимому, дефицит кислорода или питательных веществ (или и того, и другого) приводит к образованию сосудистых факторов роста (так называемых ангиогенных факторов). В сущности, все ангиогенные факторы вызывают рост новых сосудов одинаковым способом: они способствуют появлению новых сосудов путем разрастания и ветвления старых сосудов. Первым этапом этого процесса является растворение базальной мембраны эндотелия в точке ветвления. Затем начинается быстрое образование новых эндотелиальных клеток, которые мигрируют через сосудистую стенку, образуя сосудистый росток, направленный к источнику ангиогенных факторов. Клетки продолжают быстро делиться и свертываются в трубку. Трубка соединяется с другой такой же, формирующейся от другого сосуда (артериолы или венулы), — и появляется капиллярная петля, в которой начинается кровоток. Если кровоток достаточно велик, в стенку нового сосуда переселяются гладкомышечные клетки, сосуд становится артериолой или венулой, а иногда и более крупным сосудом. Так, ангиогенез объясняет механизм, с помощью которого метаболические факторы тканей способствуют росту новых сосудов. Ряд других веществ, таких как некоторые стероидные гормоны, оказывают на мелкие кровеносные сосуды противоположное действие. При этом происходит разрушение сосудистых клеток и исчезновение сосудов. Следовательно, количество кровеносных сосудов может уменьшаться, когда необходимость в них отпадает. Васкуляризация зависит от максимальной потребности тканей в кровоснабжении, а не от среднего уровня кровоснабжения. Исключительно важной характеристикой долговременной регуляции кровоснабжения является то, что васкуляризация тканей обусловлена главным образом максимальным уровнем кровотока, необходимого тканям, а не средним уровнем их потребностей. Необходимость в таком максимальном кровотоке может возникать не более чем на несколько минут в день. Тем не менее, даже такой кратковременной предельной нагрузки достаточно для выделения эндотелиальных факторов роста в мышечной ткани, чтобы усилить ее васкуляризацию. Если этого не происходит, каждый раз, когда человеку приходится выполнять тяжелую физическую нагрузку, его мышцы не могут развить необходимую силу сокращения, т.к. они не получают достаточного количества кислорода и питательных веществ. Однако если избыточная васкуляризация произошла, большая часть кровеносных сосудов обычно пребывает в состоянии сужения. Они открываются только под действием местных факторов, таких как недостаток кислорода, влияние сосудорасширяющих нервов и других факторов, свидетельствующих о необходимости резко увеличить кровоток. – Также рекомендуем “Коллатеральное кровообращение. Гуморальная регуляция кровообращения” Оглавление темы “Регуляция кровоснабжения”: |
Источник
Человеческое сердце представляет собой биологический насос, производительность которого в среднем за сутки составляет до 10 тысяч литров перекачиваемой в организм крови. Зная средний показатель числа сокращений сердечной мышцы или так называемого пульса у здорового человека — 70 ударов в минуту, несложно посчитать, что количество ударов за сутки составляет порядка 100 тысяч раз. Сокращаясь каждый раз, сердце выталкивает в аорту кровь насыщенную кислородом для дальнейшего поступления во все остальные кровеносные сосуды тела.
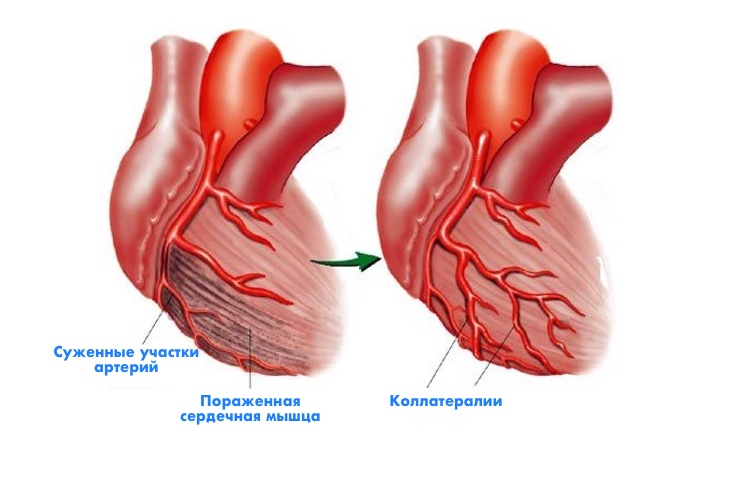
Примерно 5% объем этой крови проходит через две коронарные артерии с последующим разветвлением на сеть мелких сосудов для обеспечивая жизненно важными элементами, включая кислород, клетки сердечной мышцы. Оказывается, что организм имеет запасные пути поступления крови в клетки сердца в случае затруднения кровотока через коронарные пути. Такие резервные кровеносные пути имеют название коллатерали, активизирующиеся в случае возникновения недостаточного поступления крови через коронарные пути.
- Причина образования коллатералей
- Процедура возникновения коллатералей
- Рост коллатералей при физических упражнениях
- Белковая, генная и терапия стволовыми клетками для активации роста коллатералей
- Перспективная методика стимулирующая рост коллатералий

Причина образования коллатералей
Кровь может перестать поступать в достаточном объеме через коронарные сосуды по причине возникновения кровяных сгустков или отложения холестерина на стенках сосудов, вследствие чего клетки сердца перестают получать в должном объеме кислород и жизненно важные питательные элементы. Если вовремя не оказать медицинскую помощь, через непродолжительное время происходит отмирание сердечной мышцы чаще всего приводящее к инфаркту.
Нестабильная работа сердца резко сказывается на общем состоянии организма. Вследствие кислородного голодания сердечной мышцы происходит постепенное отмирание ее клеток. Если время не упущено и пациент своевременно попадает в больницу, современная кардиохирургия сможет обеспечить восстановление кровотока в коронарные артерии с помощью шунтирования или установки дополнительных сосудов, обводящие проблемный участок.
Подобно иммунной системе, сердце человека имеет резервные каналы под названием коллатерали, по которым кровь после затруднений прохождения через коронарные артерии достигает своей цели доставляя кислород в сердечные клетки. Коллотералии человеческое сердце получает с рождения, но в здоровом организме они совершенно не задействованы. Активация резервных коллатералей происходит в случае явных нарушений кровообращения. Каналы имеют тенденцию роста в течении месяца.
Интересен тот факт, что количество коллатералей в различных организмах может существенно отличаться. Встречаются уникальные организмы, в которых коллатерали могут обеспечить кровоток даже при полностью перекрытых коронарных артериях.
Но у большинства людей сеть коллатералий развита слабо и для их роста нужно время. Как правило, у пациентов с патологией сердца, дополнительные каналы коллатералий не способны обеспечить должный поток крови к поврежденным участкам сердца. Многие ученые сегодня пытаются разгадать способы стимуляции роста коллатералей и помочь кардио медицине в лечении пациентов с патологией сердца. К сожалению достичь весомого результата медицине пока не удалось. Но определенные сдвиги в этом направление однозначно есть.
Испытания под руководством врача генной терапии Габора Рубани сегодня проходят активную фазу клинических испытаний. Уже точно известно, что методика позволит существенно уменьшить болевой синдром возникающий у людей под воздействием физических нагрузок. В чем заключаются новые методы кардиотерапии?
Процедура возникновения коллатералей
Для того, чтобы разработать методы стимулирования возникновения новых и роста существующих коллатералей необходимо понять природу их естественного образования в сердце. Для образования их роста до средних размеров диаметра артерий необходимо обеспечить условия роста проходимости через них крови и отсутствие недостаточного поступления кислорода в пораженный участок сердечной мышцы.
Соответственно, оба условия возникают каждый раз при уменьшении кровотока через суженые участки коронарной артерии. Недостаток кислорода активирует рост новых коллатералей, а увеличение потока крови в резервных коллатеральных каналах ведет к укреплению стенок существующих и их росту в диаметре для увеличения обмывания испытывающих кислородное голодание участков.
Пока остается невыясненным тот факт, почему у 70-80% пациентов, страдающих кардиологическими заболеваниями сеть коллотералий развита плохо, и лишь у 20% эта сеть развита и способная обеспечить резервный кровоток.
Предполагают, что вероятными причинами такого показателя может быть либо высокий показатель холестерола, либо поврежденная сеть мелких сосудов при сахарном диабете.
Вопрос регенеративного процесса коллатералей сегодня способен снизить планку смертности от инфаркта. В случае, если сеть коллатералей сможет обеспечить 25% общего объема крови, проходимого через коронарные сосуды, то вероятность смерти от инфаркта в ближайшие годы снизится на 65%. Эти цифры подтверждает обследование 845 больных с серьезными сердечно-сосудистыми заболеваниями, проведенное в Швейцарии Кристианом Зейлером.
Рост коллатералей при физических упражнениях
Долгие годы поиска методов роста коллатералей позволили найти всего лишь один способ их активации — это интенсивные физические упражнения. В 2016 году в Германии был приведен эксперимент с пациентами у которых были нарушены коронарные артерии. Участникам обследования были предложены физические нагрузки под пристальным наблюдением врачей и спортивных тренеров. Оказывается, что кровоток через сеть коллатералей увеличился в среднем на 40% при 10 часах высокой физической нагрузки в неделю и 15 часах средней. Никто из участников обследования так и не смог перешагнуть порог в 40%.
Таким образом, ученые сделали вывод, что кровоток через сеть коллатералей способен обеспечить максимум третью часть объема крови, проходящего через коронарные артерии.
Причина активации роста коллатералей под влиянием физических нагрузок может быть избыточное давление, которое возникает в коронарных артериях и перенаправляемое в сеть коллотералий. Факт активации роста дополнительных сосудов при физических нагрузках очевиден, но является ли это стимулом к росту новых пока не совсем ясно.
Белковая, генная и терапия стволовыми клетками для активации роста коллатералей
Предложенный выше метод интенсивных физических нагрузок не подходит к пациентам с сердечно-сосудистой патологией ввиду высокого риска ухудшения состояния их здоровья. Такой группе пациентов вводили специальные белки (FGF, VEGF), стимулирующие рост коллатералей. Проведенные эксперименты с различной дозировкой дали определенный рост при высоких дозировках в локальные участки коллотералий, остальная же часть в других областях сердца оставалась неизменной. Параллельно с этим недостатком был выявлен факт снижения артериального давления, что являлось причиной прекращения применения данного способа.
Последующий шаг состоял в использовании генной терапии. Непосредственно в сердечную мышцу вводилась инъекция генов, кодированные вышеперечисленными белками. Перед введением гены были интегрированы в инактивированные вирусные частички, которыми были инфицированы сердечные клетки. Рост дополнительных каналов наблюдался в тех местах, где это локально было необходимо при условии успешной имплантировании генов. Действие имплантируемого вируса носило эффективный характер только при экспериментах с животными, у которых соответственно и наблюдался рост коллатералей до их зрелого состояния.
Еще одним прогрессивным способом для стимулирования роста и образования новых коллатералей — применение собственных стволовых клеток крови больного. В ходе экспериментов была зафиксирована тенденция активации факторов роста новых сосудов, но к сожалению не столь значительная. Лишь на считанные минуты дольше удалось выдержать физические нагрузки без появления боли в груди пациентам из этой группы перед теми больными, которые не участвовали в имплантировании стволовых клеток.
Перспективная методика стимулирующая рост коллатералий
Вызвать регенеративный процесс по восстановлению новых резервных каналов коллатералий и тем самым обеспечить дополнительный кровоток к пораженным участкам сердца позволит метод введения терапевтических генов.
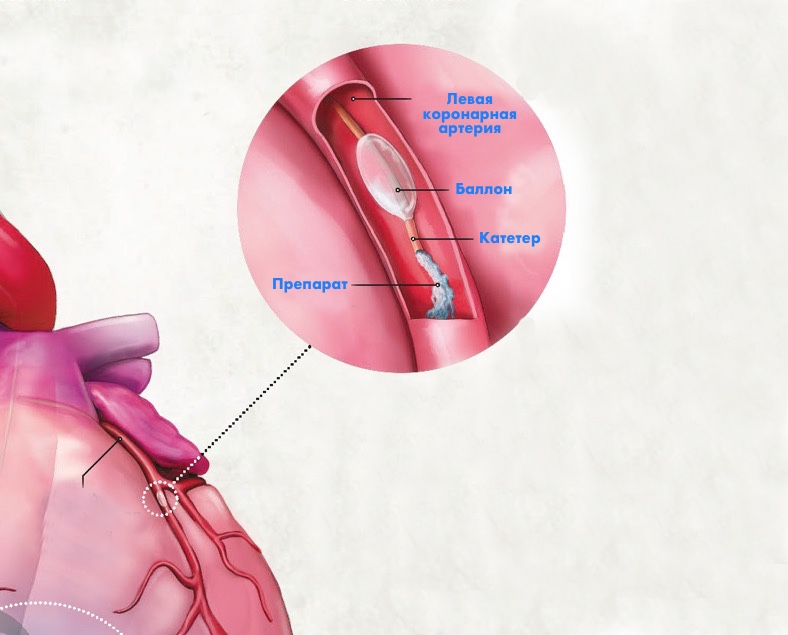
Рассмотрим работу методики на примере иллюстрации, на которой изображено нарушения кровотока в правом коронарном сосуде вследствие его сужения из-за образования внутри него атеросклеротической бляшки.
Разделим процесс на следующие этапы:
- Вводят катетер в бедренную артерию.
- Перед вводом препарата через катетер, поток крови на короткое время перекрывается расширительным баллоном, одетым сверху на трубку катетера. Это позволяет препарату максимально быстро попасть в сердечную мышцу.
- Инъекция, содержащая в себе кодированный геном, в первую очередь способствует рождению новых коллатералей, а также росту уже существующих, тем самым обеспечивая доставку обогащаемой кислородом крови в места пораженной части сердечной мышцы.
В исследовании искусственных способов развития дополнительных сосудов существует проблема отбора пациентов, а именно определение степени развития уже существующей их собственной сети коллатералий. Ведь у многих пациентов в момент поступления в исследовательский центр эта сеть может быть уже развита, и тогда в ходе лечения будет сложно заметить какой-либо эффект. Для правильного отбора пациентов необходимо создать экспресс-методы для определения уровня развития коллатералий. Не менее важным моментом является сегодня выработать методику введения препаратов. В выше представленном методе инъекцию вводят непосредственно в коронарную артерию, предварительно на короткое время перекрыв кровоток специальным баллоном.
Видео: Коллатеральное кровообращение. НаучФильм СССР.
Если в ближайшем будущем ученым удастся найти эффективные способы стимулирования роста коллатералий, то это будет колоссальным шагом вперед в лечении пациентов с сердечно-сосудистыми заболеваниями. Напомним еще раз тот факт, что экспериментальным путем доказано, что ничего не мешает здоровым людям уже сегодня уделять внимание физической культуре. Начиная с малого и плавно добавляя физические нагрузки каждому подвластно выйти на уровень интенсивных физических нагрузок, которые помогут активировать сеть коллатералий и вывести ее практически на максимальный уровень, достигающий 40%.
Загрузка…
Источник
Кардиогенез :: Образование кровеносных сосудов и сердца. (Бодемер Ч.…

(Бодемер Ч. Современная эмбриология 1971)
с.321-327, Образование кровеносных сосудов и сердца.
Глава XVI Внезародышевые оболочки и кровеносная система
Образование кровеносных сосудов и сердца
Одним из самых значительных процессов в развитии является образование сердца. На ранних стадиях обрастания желтка бластодермой в висцеральном листке боковой пластинки дифференцируются кровяные островки. Составляющие их мезодермальные клетки образуют как кровь, так и выстилку кровеносных сосудов. Клетки, расположенные внутри кровяных островков, дифференцируются в клетки крови, тогда как клетки наружного слоя образуют эндотелиальные мешочки.
Множество таких мешочков сливается, и в результате роста и удлинения они превращаются в кровеносные сосуды.
Этот процесс приводит к образованию сложной сети сосудов в области, которая окружает зародыш; её называют сосудистым полем (area vasculosa).
В течение первого дня развития в бластодерме у переднего конца первичной полоски по обе стороны от неё образуются два мезодермальных скопления. Экспериментально показано, что это два мезодермальных зачатка сердца, которые возникают из клеток эпибласта, прошедших через первичную полоску и собравшихся в слое мезодермы по обе стороны гензеновского узелка.
В течение первых 24 час до появления каких-либо видимых признаков развития сердца презумптивный миокард (см. ниже) приобретает специфические биохимические свойства и способность к самодифференцировке.

Расположенные с обеих сторон области мезодермы, способные дифференцироваться в сократимую сердечную мышцу при пересадке их в индифферентное окружение, больше истинного зачатка сердца и, таким образом, представляют собой типичные эмбриональные поля.
Образование складок эктодермы и энтодермы в процессе образования передней кишки зародыша приводит к объединению двух зачатков сердца по средней линии и образованию одной срединной трубки с двойными стенками. Эндокард (фиг. 195), состоящий из типичного эндотелия, образует выстилку сердца.
Из висцерального листка боковой пластинки, лежащей над эндотелием, возникает эпимиокард; он образует толстый мышечный слой — миокард и тонкий немышечный покровный слой — эпикард. На фиг. 196 изображено сердце и приведена схема кровообращения на ранней стадии развития.
Фиг. 195. Образование сердца путем слияния двух зачатков.
A. Два зачатка эндокарда представляют собой тонкостенные сосуды—эндокардиальные пузырьки. Два утолщения в висцеральном листке образуют будущую сердечную мышцу.
B. Эндокардиальные пузырьки сближаются, а зачатки эпимиокарда окружают эндокард и смыкаются над его верхней и нижней поверхностями. В. Эпимиокард образует оболочку вокруг эндокарда и дорзально соединяется с париетальным листком боковой пластинки. В результате сердце оказывается подвешенным на спинной брыжейке. Эндокард соединяется с желточными венами. 1 — париетальный листок боковой пластинки; 2 — хорда; 3 — нервная трубка; 4 — спинная мезодерма; 5 — эктодермальный эпителий; 6 — висцеральный листок боковой пластинки; 7 — передняя кишка; 8 —эндокардиальные пузырьки; 9 —энтодерма; 10 — эпимиокард; 11 — спинная брыжейка; 12 — спинная аорта; 13 — эндокард.

Фиг. 196. Строение кровеносной системы сразу после начала кровообращения по замкнутому кругу.
Желточные вены соединились с эндокардом сердца. Дуги аорты связывают сердце со спинной аортой. Желточные артерии соединяются со спинной аортой. Очень сложная сеть сосудов. возникающая в сосудистой зоне, связывает желточные артерии с желточными венами. Направление тока крови показано стрелками. 1 — дуга аорты; 2 — спинная аорта; 3 — сердце; 1 — желточная вена; 5 — желточная артерия; 6 — сосудистое поле.
Мезодермальный зачаток сердца имеет вид плотных скоплений клеток, сохраняющих свою индивидуальность в процессе образования сердца. Перемещение этих клеток является внутренне присущим и необходимым свойством развивающегося сердца. На фиг. 197, иллюстрирующей перемещение клеток, мезодермальный зачаток сердца показан только с одной стороны. Вскоре после того, как напротив гензеновского узелка образуются большие скопления мезодермы, клетки этих скоплений начинают перемещаться, по-видимому с помощью псевдоподий, вперед и по средней линии, образуя серп. Этот кардиальный серп по мере образования передних кишечных ворот образует внизу складку, и мезодермальные клетки в его боковых частях перемещаются вперед, сближаются и включаются в зачатки сердца.

Фиг. 197. Куриные зародыши на стадиях 5—12 (вид с брюшной стороны).
Показаны границы мезодермального зачатка сердца. Черный полусерп представляет собой мезодерму, из которой всегда образуется сердце. Точками отмечены области мезодермы, которые участвуют в образовании сердца у некоторых, но не у всех зародышей. Мезодермальный зачаток сердца показан только с одной стороны; таким образом, в действительности он имеет форму серпа на рисунках Л — Г. На рисунках Б — Ж показано положение клеток, из которых образуется сердце, на промежуточных стадиях (6—11). К стадии 12 (3) из большей части зачатка образовались ткани правой половины конуса (зачернены), петли желудочка (со спинной стороны не видны) и области синуса и предсердия (зачернены). Сетка с левой стороны на рисунке А представляет собой цифровой ключ для прослеживания судьбы маркированных участков в этих опытах.
С самых ранних стадий развитие сердца тесно связано с развитием головной энтодермы, и нормальное образование сердца также зависит от энтодермы. Так, удаление энтодермы на ранних стадиях развития амфибий приводит к развитию зародышей, лишенных сердца. Нарушение нормальных связей между энтодермой и мезодермальный зачатком сердца приводит к образованию у куриных зародышей двойного сердца. Энтодерму можно отделить от мезодермы, обрабатывая куриные зародыши лимоннокислым натрием; при этом нарушение связей на стадии первичной полоски приводит к тому, что сердечная мезодерма не перемещается, как обычно, но в ней дифференцируются пузырьки сократимой ткани. О ведущей роли энтодермы в перемещении мезодермы свидетельствует также отсутствие у куриных зародышей, лишенных энтодермы, каких-либо трубчатых структур. На стадии первичной полоски перемещение мезодер-мальных клеток, образующих сердце, по-видимому, случайно, а после образования серпа энтодерма, вероятно, направляет движение клеток. Даже в культуре энтодерма нужна для того, чтобы мезодермальные клетки совершали свойственное им перемещение. Таким образом, миграция клеток зачатка сердца и образование энтодермальной складки представляют собой самостоятельные процессы, однако после установления связи между мезодермой и энтодермой на стадии серпа мезодерма становится зависимой от энтодермы; при нарушении этой связи сердце развивается ненормально. Напомним (гл. XIV), что именно на этой стадии мезодермальный зачаток сердца, вероятно, действует на энтодерму в области кишечных ворот, индуцируя образование печени.

Фиг. 198. Слияние зачатков сердца куриного зародыша (вид с брюшной стороны).
Зачатки сердца представляют собой две трубки, которые сливаются, образуя единое трубчатое сердце. Это слияние начинается на уровне желудочков (стадия 8 сомитов) и продолжается в заднем направлении (А). На стадии 10 сомитов (Б) начинают сливаться парные зачатки предсердий и к стадии 14 сомитов образуется единое предсердие (В). На этой стадии венозный синус все еще сохраняется в виде двух зачатков. 1 — брюшные аорты; 2 — желудочек; 3 — предсердие; 4 — венозный синус.
Слияние зачатков сердца начинается у переднего края будущего сердца и затем постепенно распространяется назад (фиг. 198). У зародыша на стадии 7 сомитов (стадия 9) слияние происходит в области будущего желудочка, а предсердие в это время все еще представлено двумя отдельными трубками. К стадии 10 сомитов (стадия 10) парные зачатки желудочка уже соединились и начинается образование единого предсердия. Наконец, на стадии 14 сомитов (стадия 11) предсердие и желудочки четко обособлены, а два зачатка венозного синуса еще не соединились. На стадии 21 сомита (стадия 14; фиг. 199) процесс слияния зачатков сердца завершен.

Фиг. 199. Изменения формы сердца куриного зародыша (вид со спины).
На стадии 21 сомита парные зачатки венозного синуса сливаются и желудочек изгибается, образуя петлю. На последующих стадиях развития дальнейшее изгибание желудочка у зародыша приводит к тому, что он располагается сбоку от предсердия, а у 72-часового зародыша — позади предсердия. 1 —предсердие; 2 —желудочек; 3 —желточная вена; 4 —венозный синус; 5 —артериальная луковица; 6 —брюшная аорта; 7 —артериальный ствол; 8 — петля желудочка.
Еще до полного слияния зачатков сердца их форма изменяется, так что сердечная трубка приобретает S-образную форму (фиг. 199). Сначала сердце изгибается в правую сторону (стадии 13 и 13+); затем одна часть сердца, состоящая из желудочка и артериальной луковицы, образует складку над правой стороной другого плеча, состоящего из предсердия и части желудочка. Таким образом, у зародыша в возрасте 48 час (стадия 13) желудочек образует петлю. Наконец, в возрасте 72 час (стадия 19) предсердие занимает переднее положение, около брюшной аорты, тогда как петля желудочка простирается за венозный синус.
Зачаток сердца может начать сокращаться еще на стадии 7 сомитов (стадия 9), во время образования сердца и задолго до установления полного круга кровообращения. Сокращения начинаются в небольшом участке вдоль правого края зачатка, из которого образуются артериальная луковица и желудочек. Сокращающийся участок позже распространяется латерально, захватывая левую сторону сердца, и к стадии 11 сомитов (стадия 10+) левая сторона начинает сокращаться синхронно с правой. Возникновение на этой стадии сокращений сердца в области желудочка подтверждается тем, что перевязка или перерезка каудального отдела желудочка не прерывает сокращений. Предсердие начинает сокращаться на стадии 13 сомитов (стадия 11), и затем сокращение сердца приобретает характер волны сокращений; эта волна распространяется в задне-переднем направлении от предсердия к артериальной луковице. К стадии 16 сомитов (стадия 12) эта волна уже достаточно сильна, чтобы обеспечить циркуляцию кровяных клеток (фиг. 194 и 196). В период между стадиями 20 и 25 сомитов (стадия 14+) образуется венозный синус, который начинает регулировать ритм сердца. Становится очевидным, что сокращение развивающегося сердца начинается в его каудальном отделе. Центр инициации сокращений сердца сначала расположен в бульбовентрикулярной области (области луковицы аорты и желудочка), затем в предсердии и, наконец, в венозном синусе. Каждому из этих элементов присуща своя частота сокращений, причем эта частота у каждого последующего отдела выше, чем у предыдущего, т. е. она возрастает последовательно по мере распространения волны сокращений. В конце концов в стенку предсердия включается венозный синус и образующийся сикоаурикулярный узел — небольшое скопление специализированной мышечной ткани — становится пейсмекером (водителем ритма сердца).
Льюис давно показал, что отдельные клетки миокарда способны к автономным сокращениям. О независимой сократимости всего сердца говорит тот факт, что in vitro сердце зародыша ритмично сокращается. Последовательное функциональное доминирование различных элементов сердца особенно четко выявляется в опытах с удалением и рекомбинацией этих элементов. Если изолировать части эмбрионального сердца, то каждая из них сокращается с характерным для неё ритмом: бульбовентрикулярная область медленнее всего, предсердие с промежуточной скоростью, а венозный синус быстрее всего. Если сердце зародыша на стадии 16 сомитов (стадия 12) перерезать в месте соединения предсердия с желудочком и оставить обе части наложенными друг на друга, то рана вскоре зарастает новой тканью и целостность сердца восстанавливается. Пока обе части отделены друг от друга, каждая из них сокращается с присущей ей частотой, но при восстановлении целостности сердечной ткани частота сокращений бульбовентрикулярной области возрастает, достигая уровня, характерного для области предсердия и синуса. Доминирование этой последней еще более четко выявляется в следующем опыте. Область предсердия и венозного синуса после двух дней развития пересаживали к противоположному концу сердца, в бульбовентрикулярную область. В новом положении она не только продолжала сокращаться с характерной для неё, частотой, но волна сокращений распространялась в направлении, противоположном обычному, т.е. от артериального к венозному концу сердца.
Принято считать, что вначале волна сокращений в сердце передается от клетки к клетке и только позднее развивается определенная система передачи, которая служит основным механизмом, координирующим сокращение сердца. Возбуждающий импульс возникает в синоаурикулярном узле, находящемся в стенке правого предсердия, и этот стимул, определяющий частоту сокращения, передается группой специализированных мышечных волокон (волокон Пуркинье) мышцам предсердия. Эти последние передают импульс атриовентрикулярному узлу, расположенному в перегородке между предсердиями; отсюда возбуждающий импульс передается по волокнам атриовен-трикулярного пучка, находящимся в межжелудочковой перегородке, мышцам желудочка, которые активируются в направлении от эндокарда к эпикарду небольшими ответвлениями атриовентрикулярного пучка. Сроки дифференцировки этой проводящей системы в сердце зародыша пока еще не известны. Сердце куриного зародыша, очевидно, приобретает иннервацию к концу 3-го дня инкубации. Однако атриовентрикулярный пучок появляется не раньше 5-го дня, и поэтому можно предположить, что по крайней мере до этой стадии волна сокращений в сердце передается от клетки к клетке. Развитие и функциональная интеграция этой проводящей системы требуют дальнейших обширных исследований.

Источник